一种克里本类芽孢杆菌代谢物及其在生防上的应用的制作方法
本发明属于生物防治技术领域,更具体地,涉及一种克里本类芽孢杆菌代谢物及其在生防上的应用。
背景技术:
联合国粮农组织(fao)调查统计称,每年世界粮食因杂草危害损失达11%、因鼠类危害损失达20%、因害虫危害损失达14%、因病害危害损失达10%。化学农药是解决粮食生产过程中病、虫、草、鼠害的主要措施,但随着化学农药的过量使用,对环境生态、土壤结构和微生物多样性等产生了不利的影响,另外,植物病原菌对不少品种已产生了严重的抗性,化学农药的使用越来越受限制。目前,我国正在推广植物生产过程中“减肥减药”的技术,这是当前植物保护领域的热门方向。“减药”主要指的就是减少化学农药的使用,因此,生物农药由于具有环保、高效、低毒、低残留以及与环境相容性好等特点,越来越受到重视,迫切需要开发具有不同作用机理的、安全、有效、环保的生防制剂。
植物病害生物防治的概念最早于1965由英国植物病理学家garrat提出,是指通过除人以外的一种或多种生物来降低病原物数量或减弱病原的致病活力,从而减少病原物所致病害的发生。寄主植物周围不仅存在病原菌,而且还存在着大量的非病原菌,其中有的是病原菌的拮抗微生物。这些拮抗微生物可通过与病原菌的抗生作用、竞争作用、重寄生作用及诱导植物产生系统抗性等机理来抑制病原菌,达到防治植物病害的目的。此外,拮抗微生物对环境安全,不会像化学农药那样造成环境污染以及对人畜产生毒害,同时拮抗微生物不易使病原菌产生耐药性,有些还具有促进植物生长的作用,且实际生产工艺简单,因此,利用拮抗微生物防治病害的研究正越来越受到国内外科研机构的重视。目前,人们已经分离到多种对不同植物病害有不同程度防治效果的拮抗微生物,其中有些已经进入实际应用阶段,产生了巨大的社会效益和环境效益。拮抗微生物(真菌、细菌、放线菌等)的生防机制主要有竞争、抗生、重寄生、交叉保护和诱导植物抗性等方面。一种微生物作用机制可以有多种,不同微生物作用机制可能有所不同,它们的相对重要性随生防因子的种类及根际理化条件和生物条件而异。
而拮抗微生物的抗生作用主要是抗菌代谢产物的杀菌作用,抗菌代谢产物在目前的植病生防菌的筛选中是第一位的重要指标,产生抗菌代谢产物与否及其产量大小往往决定着一个生防菌株的命运,代谢产物包括抗生素、细菌素、几丁质酶、葡聚糖酶等。木霉菌作为拮抗真菌的代表在产生抗菌物质方面具有优势,就其种类而言,仅抗真菌的代谢产物至少在70种以上。细菌产生抗菌物质的属主要集中在假单胞菌属(pseudomonas)、芽孢杆菌属(bacillus)中。据统计由枯草芽孢杆菌产生的抗菌物质达20多种,主要为多肽类物质,部分为具有特殊结构的蛋白类物质,如结合有多糖、磷脂蛋白。
类芽孢杆菌属是1994年从芽孢杆菌中分出的一个新属,模式菌为多粘类芽孢杆菌(paenibacilluspolymyxa)。多粘类芽孢杆菌自在日本发现以后得到了广泛的研究,其中有些菌株可以产生多粘菌素,其主要成分为a、b、c、d、e五种成分,b、e两种成分已在医药领域得到广泛的应用,为人类健康做出了重要的贡献。而目前,对于类芽孢杆菌属的研究主要集中在优良菌株的选育和通过发酵或基因工程的手段提高活性物质的产量,对于克里本类芽孢杆菌(paenibacilluskribbensis)代谢物的活性物质的纯化、鉴定和在防治植物真菌病害中的应用尚未见报道,仍具有很大的不足和研究空间。
技术实现要素:
本发明要解决的技术问题是克服现有应用化学农药防治植物真菌病害的缺陷和不足,从克里本类芽孢杆菌代谢物中纯化鉴定得到一种具有广谱抑真菌活性的化合物,在防治植物真菌病害方面具有很好的应用前景。
本发明目的是提供一种从克里本类芽孢杆菌代谢物中分离纯化的抑菌化合物。
本发明另一目的是提供一种生防制剂。
为了实现上述目的,本发明是通过以下方案予以实现的:
一种抑菌化合物,其分子式为c12h10n4o2,分子量为242.96,结构式如下式(i)所示:
该化合物对水稻纹枯病菌、玉米大斑病菌、玉米小斑病菌等植物真菌病害均具有很好的抑菌活性,因此,所述化合物在抑制植物真菌病原或防治植物真菌病害方面的应用,以及在制备植物真菌病原抑菌剂或植物真菌病害生防制剂方面的应用,均应在本发明的保护范围之内。
具体优选地,所述植物真菌为水稻纹枯病菌、玉米小斑病菌、玉米大斑病菌、水稻稻瘟病菌、香蕉枯萎病菌、辣椒炭疽菌或灰葡萄孢菌等。
所述植物真菌病害包括水稻纹枯病、玉米小斑病和玉米大斑病等。
一种包含所述抑菌化合物的植物真菌病害生防制剂,也应在本发明的保护范围之内。
另外,本发明还提供了一种制备所述抑菌化合物的方法:是以组成为蔗糖、nano3和k2hpo4的基础培养基对克里本类芽孢杆菌进行培养,从培养代谢产物中分离鉴定得到抑菌活性高的单体化合物。
优选地,所述基础培养基的配方为:2~4%蔗糖、0.1~0.2%nano3、0.05~0.15%k2hpo4。
更优选地,所述基础培养基的配方为:3%蔗糖、0.15%nano3、0.1%k2hpo4。
优选地,所述克里本类芽孢杆菌的分类命名为:克里本类芽孢杆菌paenibacilluskribbensis,菌株为:trcc82001,该菌株于2013年8月13日保藏于中国微生物菌种保藏管理委员会普通微生物中心,其保藏编号为:cgmccno.7996,保藏地址为:北京市朝阳区北辰西路1号院3号。
优选地,克里本类芽孢杆菌的培养条件为:初始ph7~8,温度28~32℃,转速150~220r/min,80~120ml/1000ml(v/v)摇瓶发酵培养72~96h。
更优选地,克里本类芽孢杆菌的培养条件为:初始ph7~8,温度30℃,转速180r/min,100ml/1000ml(v/v)摇瓶发酵培养84h。
最后,克里本类芽孢杆菌的培养产物使用乙醇沉淀多糖,使多糖析出,然后再离心除去菌体及胞外多糖,再依次经过大孔吸附树脂层析、硅胶柱层析、反相c-18柱层析,分离得到具有抑菌活性单点馏分,鉴定得到所述抑菌化合物。
另外具体地,作为一种可选择的实施方案,所述抑菌化合物的制备方法包括以下步骤:
(1)克里本类芽孢杆菌的培养
以上述基础培养基对克里本类芽孢杆菌进行培养,并调节培养基的ph为7~8,置于温度为30℃,转速为180r/min的培养条件下,进行100ml/1000ml(v/v)摇瓶发酵培养84h;
(2)培养产物的预处理
发酵结束后,使用乙醇沉淀多糖,使多糖析出,然后再离心除去菌体及胞外多糖;
(3)克里本类芽孢杆菌代谢物的分离
先用大孔吸附树脂层析,再用硅胶柱层析,最后用反相c-18柱层析,分离得到单点馏分,利用tcl生物自显影法测定馏分的抑菌活性,对克里本类芽孢杆菌代谢物进一步的鉴定。
更具体地,步骤(2)的具体步骤为:发酵结束后,加入等体积的乙醇,剧烈震荡使乙醇与发酵液充分接触,并静置一夜使菌体分泌的多糖充分析出,低温冷冻离心除去析出的多糖,得到清亮的发酵液;再利用旋转蒸发仪进行减压蒸馏浓缩,除去多余的水分;当发酵液比较黏稠时,再加入等体积的乙醇,再除一次多糖,重复3~5次,最后浓缩得到多糖含量较少的发酵粗提物。
步骤(3)的具体步骤为:
1)先用大孔吸附树脂层析,通过梯度洗脱,采用tlc-生物自显影跟踪检测代谢物活性,具有活性的洗脱液在60℃水浴中真空减压浓缩至干,待下一步继续分离纯化;
2)再用硅胶柱进行层析,通过梯度洗脱,采用tlc-生物自显影跟踪检测活性,具有活性的洗脱液在60℃水浴中真空减压浓缩至干,待下一步继续分离纯化;
3)再用反相c-18柱进行层析,先用纯水洗脱,然后逐渐增加甲醇比例进行梯度洗脱,最终分离得到一个单一的点,用于进一步鉴定。
对以上沉淀富集的单点馏分进行结构研究,得到一个具有较强抑菌活性的化合物,该化合物为淡黄色晶体,极性高,能溶于水和dmso,微溶于甲醇,分子式为c12h10n4o2,分子量为242.96。
与现有技术相比,本发明具有以下有益效果:
本发明从克里本类芽孢杆菌trcc82001中分离、鉴定出了一种具有较强抑菌活性代谢物,明确了该代谢物的化学结构和分子式,同时发现该代谢物对植物病原真菌具有较强的抑菌作用,对水稻纹枯病、玉米小斑病和玉米大斑病等的防治效果显著,为生防制剂的开发应用提供了良好的依据。
附图说明
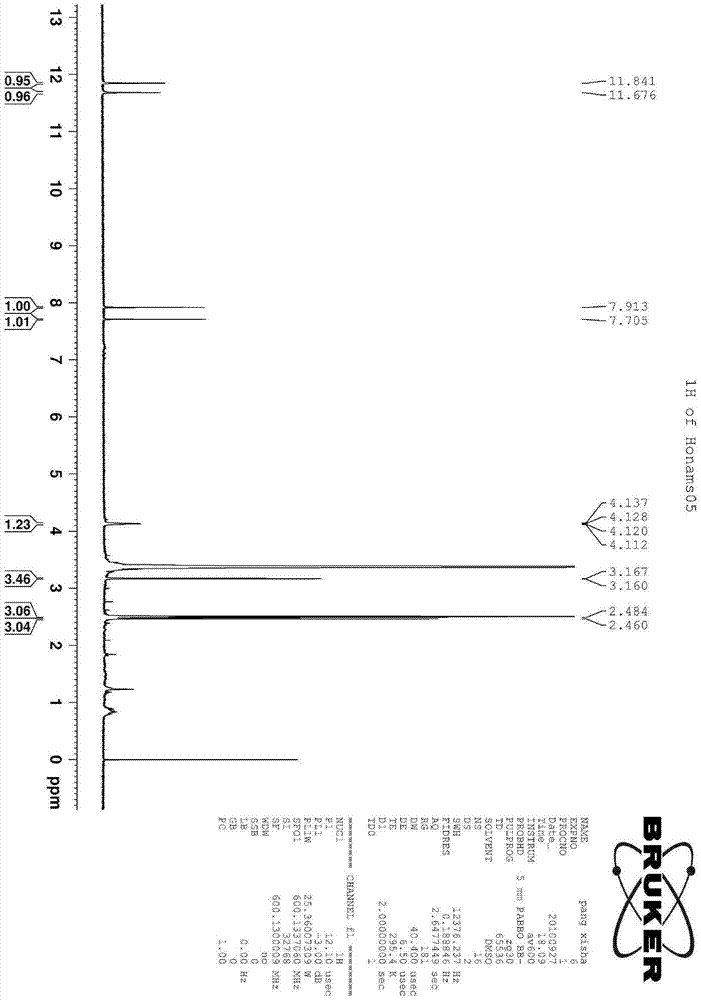
图1为抑菌化合物的1h-nmr分析的结果。
图2为抑菌化合物的13c-nmr分析的结果。
图3为抑菌化合物的质谱(dept)分析的结果。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备;以下实施例所用试剂和材料均为市购。
实施例1克里本类芽孢杆菌trcc82001培养基的优化筛选
1.以蔗糖为主要糖源,以nano3为主要氮源,采用正交试验法对克里本类芽孢杆菌代谢物的培养基进行优化筛选,以菌株生长量(细菌培养液的浓度,od600)和对水稻纹枯病的抑菌率为指标进行测定。
2.结果如表1所示,综合蔗糖、nano3、k2hpo4这3个因素不同水平对发酵的影响,最终确定最适合该菌株生长的培养基各组成的配比为3%蔗糖、0.15%nano3、0.1%k2hpo4,最大抑菌率可达到85%以上。
表1培养基各组分配比优化的正交试验设计及统计结果
实施例2克里本类芽孢杆菌trcc82001代谢物的制备
1.克里本类芽孢杆菌代谢物的培养
以上述优化筛选的基础培养基对克里本类芽孢杆菌代谢物进行培养,并调节培养基的ph为7~8,置于温度为30℃,转速为180r/min的培养条件下,100ml/1000ml(v/v)摇瓶发酵培养84h。
2.克里本类芽孢杆菌代谢物的预处理
在上述摇瓶发酵得到发酵液之后,加入等体积的乙醇,剧烈震荡使乙醇与发酵液充分接触,并静置一夜使菌体分泌的多糖充分析出。通过低温冷冻离心除去析出的多糖,得到清亮的发酵液,再利用旋转蒸发仪进行减压蒸馏浓缩,除去多余的水分;当发酵液比较黏稠时,再加入等体积的乙醇,再除一次多糖,重复3~5次,最后浓缩得到多糖含量较少的发酵粗提物。
3.克里本类芽孢杆菌代谢物的分离
(1)大孔吸附树脂层析:
将上述发酵粗提物用水溶解,沿层析柱壁缓缓倒入大孔吸附柱中,倒完后放置一夜,让大孔吸附树脂(d101树脂)充分吸附样品,采用水:甲醇的比例设置100:0、75:25、50:50、0:100共4个梯度洗脱,流速5.0ml/min,洗脱液要现用现配,手动收集样品,每250ml收集一个馏分,一个梯度合并到一起.
通过大孔吸附树脂层析后,蒸馏水洗脱下来的物质(dh100)呈淡黄色,浓缩后静置一段时间分为三层,最下层为沉淀,颜色最深,中间层为黏稠的液体,上层为泡沫状物质。三层均能溶于水中,完全蒸干后为粘稠的糊状,25%甲醇洗脱下来的物质(dm25)呈黄褐色,也能溶于水中,粘度较大;50%甲醇洗脱下来的物质(dm50)能溶于60℃的水中,粘度也较大;100%甲醇洗脱下来的物质(dm100)为黄色沉淀,在水中的溶解度较低,在甲醇中有一定的溶解度;100%丙酮洗脱下来的物质(da100)呈橙黄色,极性较低,可溶于甲醇,tlc显示为两个点。
利用tlc生物自显影法测定馏分的生物活性:利用薄层板将混合物在薄层板上展开后,将薄层板与接种了病原微生物的培养基相接触,通过一定条件的培养,非活性部位会被生长出的病原微生物所盖而呈现背景色,活性部位因抑制了病原微生物的生长而呈现抑制斑点,这样就可从混合物中筛选出活性成分,进行活性跟踪,指导化合物的分离。
抑菌结果如表2所示,dh100、da100两个馏分对水稻纹枯病菌(rhizoctoniasolani)、玉米大斑病菌(exserohilumturcicum)、玉米小斑病菌(bipolarismaydis)均没有抑菌活性;而dm100馏分在500μg/ml的浓度下对供试菌的抑制率在30%~80%之间。因此,dm100馏分可以进一步分离纯化直到得到单体活性化合物。
表2大孔吸附树脂层析各馏分的抑菌活性(500μg/ml)
注:菌落直径是三次重复的平均值±se,同列数字后随相同字母表示在0.05水平差异不显著(dmrt)。
(2)dm100馏分进行硅胶柱层析:
经过大孔吸附树脂层析得到的dm100馏分,加入适量硅胶使硅胶恰好将溶剂吸附,继续烘干,间断搅拌,使硅胶成为均匀吸附样品的粉末;待装好的硅胶柱上层只有1cm左右高度溶剂时开始上样,将干燥的吸附了样品的硅胶粉末均匀的撒在层析柱上层,加完后再加一层棉花,然后再加一层石英砂作为缓冲层,采用氯仿:甲醇的比例设置100:0、95:5、90:10、80:20、70:30、50:50、30:70、10:90共8个梯度洗脱,流速5.0ml/min,每个梯度100ml,洗脱液要现用现配,手动收集样品,每100ml收集一个馏分。采用tlc-生物自显影跟踪检测活性,具有活性的洗脱液在60℃水浴中真空减压浓缩干燥,待下一步继续分离纯化。
(3)反相c-18柱层析:
将硅胶柱层析后的样品用甲醇充分溶解,滤纸抽滤除去不溶沉淀;然后将样品置于60℃水浴锅上浓缩甲醇至干;再加入少量水,使样品溶解或均匀悬浮;当柱中液面刚好与ods填料平齐时用滴管缓缓加入样品悬液,打开阀门,当液面再次与填料平齐时开始加入洗脱液;先用纯水洗脱,然后逐渐增加水:甲醇的比例设置90:10、70:30、50:50、40:60、20:80共5个梯度进行洗脱,最后用甲醇冲色谱柱,在自动收集仪上,试管分管定量收集。
经洗脱得到15个馏分,经tlc确定,将馏分1~2、3~4、5~7、8~9、10~13、14~15分别合并,f1~2呈橙黄色,f3~4呈黄绿色,f5~7、f8~9、f10~13呈黄褐色,f14~15呈粉红色。
同样利用tcl生物自显影法测定馏分的抑菌活性。结果如表3所示,可知f1~2、f3~4、f5~7、f8~9、f10~13、f14~15各馏分在500μg/ml的浓度下对供试菌都具有一定的抑制率,因此,该dm100各馏分进一步分离纯化可得到单体活性化合物,f3~4经沉淀富集得到一个单点,确定为化合物ps04-1。
表3dm100各馏分的抑菌活性(500μg/ml)
注:菌落直径是三次重复的平均值±se,同列数字后随相同字母表示在0.05水平差异不显著(dmrt)。
(4)馏分f3~4是单一的点,对该物质进行结构研究,初步推断化合物类型,测定分子式,计算不饱和度,然后确定分子中含有的官能团或结构片断,或基本骨架,再推断并确定分子的主体结构,最后推断并确定分子的平面结构。
具体程序如下:
1)首先对化合物进行元素分析和质谱分析,在此基础上确定化合物的分子式,并计算不饱和度;
2)化合物的红外光谱检测,根据红外光谱数据推测分子中的存在的特征性官能团。
测定化合物的1h-nmr,13c-nmr和dept;根据1h-nmr推测分子中的结构单元(根据偶合情况及化学位移),根据13c-nmr、dept确认碳的类型(ch3、ch2、ch、c)和种类(如饱和碳、双键碳或三键碳);
3)根据谱学数据推测出来的单元结构连接成各种可能的结构。对于谱学方法难以区分的异构体,可以考虑培养结晶,利用x衍射分析最后的结构。nmr测定:样品溶解于氖代试剂(约0.5ml)中,测定1h-nmr在600mhz条件下操作,测定13c-nmr、dept在75mhz条件下操作,tms(tetramethylsilane)作为内标。
1h-nmr,13c-nmr分析的结果如图1和图2所示,质谱(dept)分析的结果如图3所示。
根据以上对该化合物结构的研究,得到一个具有较强抑菌活性的化合物ps04-1,该化合物为淡黄色晶体,极性高,能溶于水和dmso,微溶于甲醇,分子式为c12h10n4o2,分子量为242.96,结构式如下式(i)所示:
该化合物对水稻纹枯病菌、玉米大斑病菌、玉米小斑病菌、水稻稻瘟病菌、香蕉枯萎病菌、辣椒炭疽菌、灰葡萄孢菌等均具有很好的抑菌活性,抑菌率可达74%以上。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!