薯蓣皂苷元衍生物、其药物组合物及其应用的制作方法
本发明涉及医药
技术领域:
,特别涉及药物化学合成领域,具体是指一种薯蓣皂苷元衍生物、其药物组合物及其应用。
背景技术:
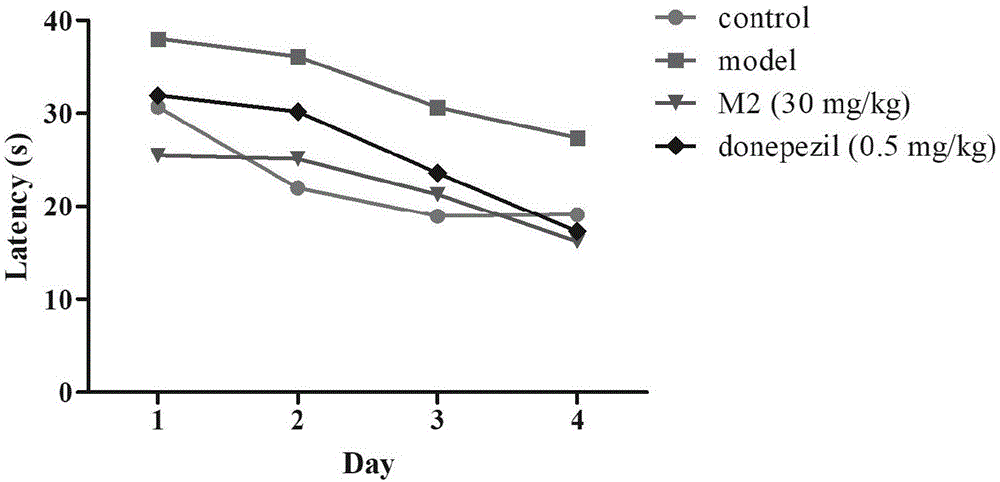
:随着老龄化加剧,神经退行性疾病患病率也节节攀升。神经退行性疾病是一类大脑和脊髓的神经元细胞丧失的疾病状态,神经元细胞一般不会再生,过度的损害可能是毁灭性的,不可逆转的。神经退行性疾病会随着时间的推移而恶化,最终导致功能障碍,阿尔茨海默病和帕金森病是患病率最高的两种疾病,为病人和家属带来极大痛苦。现在普遍认为阿尔茨海默病(ad)的发生主要和aβ的沉积有关,而在帕金森病(pd)患者中,ad的病理改变同样很普遍。有研究认为神经元纤维缠结(nft)和β淀粉样老年斑(sp)病理改变或上述两种病理改变同时出现合并皮质路易小体(clbs)、边缘系统路易小体(lbs)就组成了pd神经病理学的主要构成,并且是pd认知障碍的主要原因。另外有两项研究发现在路易小体痴呆(dlb)中不断增多的皮质aβ聚集量与ad相似,这就说明dlb皮质aβ积存造成了该病的认知损伤。与前面研究相同,还有研究发现在pd、dlb中的β淀粉样蛋白负荷量会不断上调。从上述发现我们可以看到,aβ在神经退行性病变中认知功能的影响起到关键作用,而aβ是通过何种共同机制损伤神经突触、诱导神经细胞死亡,最终导致认知损害一直是人们关注的焦点。而另一方面,神经退行性疾病的发病机制目前不清楚,这类疾病的脑病理改变主要有两种形式:一种是由细胞凋亡引起的大量神经元丢失;另一种则是神经系统没有明显细胞体数量减少,但神经细胞出现结构和功能的进行性、退行性变性。大量的研究资料表明,在衰老、ad、pd、als和hd等神经退行性疾病中,特定脑区的神经细胞受到ros攻击,使细胞发生凋亡,进而恶化直至神经元网络功能紊乱,最终发生神经退行性疾病。ros-氧化应激在神经退行性疾病细胞凋亡的发生发展中起着重要作用。例如,已知的帕金森症——相关基因的突变,包括par7、pink1、park2、snca(α-synuclein)、和lrrk2,可以直接或间接地损害线粒体功能和导致ros水平升高(diasetal.,2013)同样,编码超氧化物歧化酶1(sod1,是细胞中一种重要的抗氧化酶)的基因突变,占家族性肌萎缩性脊髓侧索硬化症病例的20%(barberandshaw,2010)。氧化应激可通过产生破坏dna、蛋白质和脂类的过氧化物和自由基来发挥细胞毒性作用。目前,天然产物来源的抗氧化剂取得了较大的进展,包括茶多酚、黄酮、生物碱、甾体化合物等等。特别是甾体化合物,近年多有报道其有很好的抗炎抗氧化作用,多用于心血管及神经退行性疾病。薯蓣皂苷元是甾体化合物中的一种,在自然界中含量丰富,药理学研究证明它有很好的抗炎抗氧化作用,同时,它的衍生物caprospinol被证明能保护神经元细胞免受aβ寡聚物诱导的细胞损伤作用。本发明基于特定作用机制的薯蓣皂苷元结构修饰,一方面可以通过合理的药物设计针对性的提高其对神经元保护的作用,另一方面,由于其在自然界中含量高、易得,所以对于新药的开发更有意义。技术实现要素:本发明的目的是为了克服上述现有技术中的缺失,提供可用于制备治疗抗神经退行性疾病药物的薯蓣皂苷元衍生物、其药物组合及其应用。为了实现上述目的,本发明一方面提供了一种薯蓣皂苷元衍生物,其中所述的薯蓣皂苷元衍生物的结构式如通式(1)所示,其中,所述的x为o或nh,当所述的x=o时,r1为下列基团中的任意一种:其中r2、r3各自独立地为、取代或未取代的c1-8的直链或支链的烷基、取代或未取代的c3-7的环烷基、取代或未取代的苄基、取代或未取代的芳基中的一种;r4为h、取代或未取代的c1-8的直链或支链的烷基、取代或未取代的苄基、取代或未取代的芳基、中的一种,当所述x为nh时,r1为以下基团中的任意一种:其中r7、r8各自独立的为h、取代或未取代的c1-8的直链或支链的烷基、取代或未取代的c3-7的环烷基、取代或未取代的苄基、取代或未取代的芳基中的一种。较佳地,当r2、r3、r4为取代的c1-8的直链或支链的烷基,所述的c1-8的直链或支链的烷基的取代基为胺基、取代或未取代的芳基、氰基中的一种;当r2、r3、r4为取代的c3-7的环烷基,所述的c3-7的环烷基的取代基为胺基、取代或未取代的芳基、氰基中的一种;当r2、r3、r4为取代的芳基时,所述的取代的芳基的取代基为卤素、胺基、烷基、硝基、羟基或烷氧基中的一种或多种;当r2、r3、r4为取代的苄基时,所述的取代的苄基的取代基为卤素、胺基、烷基、烷氧基、羟基或硝基中的一种或多种。较佳地,所述的r5、r6为取代或未取代的c1-8的直链或支链的烷基,取代或未取代的c3-7的环烷基,取代或未取代的芳基中的一种。较佳地,所述的薯蓣皂苷元衍生物为以下化合物中的一种,本发明中的“一个”或“一种”或“一类”意指最少一个/种/类或一个/种/类或一个/种/类以上。本发明中的“烷基”意指各种饱和的直链的、带侧链的或环状的碳氢基团,特包括含有十个或十个碳以下的小烷基。本发明中的“芳基”为环状共轭芳香系统并可在环中含有一个或一个以上的非碳原子(除碳以外的其他杂原子如氮),如苯基、吡啶基、吡嗪基。特别进一步说明,上述所定义的各种取代基还包括它们被进一步取代而构成的基团,其中这些新的取代基也可含有其他基团。例如烷基和芳基上的氢原子被氨基、卤素或其他基团取代即成为属于上述各定义中的基团。本发明还提供了一种药物组合物,所述的药物组合物包含所述的薯蓣皂苷元衍生物或其药学上可接受的盐,以及任选的药学上可接受的载体。本发明提供了一种所述的药物组合物在制备治疗神经退行性疾病药物中的应用。较佳地,所述的神经退行性疾病包括阿尔茨海默病、血管性痴呆、混合性痴呆和帕金森综合征。采用本发明的薯蓣皂苷元衍生物、其药物组合及其应用,首次对该先导化合物进行了系统性的针对3位和5/6位双键进行结构修饰,合成了一系列新化合物,这些新化合物通过相关靶点的活性测试,很多显示出优于先导化合物的活性,对于治疗神经退行性疾病十分有价值。弥补了现有技术中薯蓣皂苷元衍生物的不足,十分有意义。附图说明图1为本发明的薯蓣皂苷衍生物化合物m2对颈动脉结扎大鼠的空间探索实验结果图。图2为本发明的薯蓣皂苷衍生物化合物m2对颈动脉结扎大鼠的工作记忆实验结果图。图3为本发明的薯蓣皂苷衍生物化合物m2对app小鼠水迷宫实验结果图。图4为本发明的薯蓣皂苷衍生物化合物m2对app小鼠新物体识别实验结果图。图5为本发明的薯蓣皂苷衍生物化合物m2对app小鼠筑巢实验结果图。具体实施方式为了能够更清楚地理解本发明的技术内容,下面对本发明的具体实施方法作进一步说明。实施例1薯蓣皂苷元氨基甲酸酯类衍生物m1~m17的制备中间体s1的制备在氩气保护下,将薯蓣皂苷元dio(4.14g,10mmol)和吡啶(0.5ml)溶于15ml的二氯甲烷中,冰浴条件下缓慢加入对硝基苯基氯甲酸酯(15mmol),然后升至室温继续反应4小时。反应完毕后,用100ml水淬灭,二氯甲烷萃取(3*100ml),合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(乙酸乙酯/石油醚=1:20)得到化合物s1为5.804g(95%)。化合物m1~m17的制备在氩气保护下,将s1(306mg,0.5mmol)和三乙胺(0.1ml)溶于5ml二氯甲烷中,冰浴下缓慢加入相应的胺(1.5mmol)然后升温至室温继续反应3小时。反应完毕后,用30ml水淬灭,二氯甲烷萃取(3*30ml),合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(乙酸乙酯/石油醚=1:15)得到化合物m1-m17(50%-85%)。化合物m1,白色固体。1hnmr(400mhz,cdcl3)δ5.37(1h,d,j=3.1hz),4.42(3h,m),δ3.79(1h,m),3.47(1h,dd,j=10.0,3.0hz,),3.38(1h,t,j=10.9hz),1.14(6h,d,j=6.5hz),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc31h49no4:500.3740;found:500.3742。化合物m2,白色固体。1hnmr(400mhz,cdcl3)δ7.31(5h,m),5.38(1h,d,j=5.1hz),4.91(1h,s),4.54(1h,m),4.42(1h,m),4.36(2h,d,j=5.6hz),3.47(1h,dd,j=9.9,3.8hz),3.38(1h,t,j=10.9hz),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc35h49no4:548.3740;found:548.3743。化合物m3,白色固体。1hnmr(400mhz,cdcl3)δ7.30(2h,d,j=8.4hz),7.22(2h,d,j=8.2hz),5.38(1h,d,j=5.1hz),4.93(1h,s),4.53(1h,m),4.41(1h,dd,j=15.0,7.5hz),4.32(2h,d,j=5.8hz),3.47(1h,dd,j=9.7,4.1hz),3.38(1h,t,j=10.9hz),2.38(1h,dd,j=12.6,3.7hz),2.28(1h,t,j=13.1hz),1.02(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc35h48clno4:582.3350;found:582.3353。化合物m4,白色固体。1hnmr(400mhz,cdcl3)δ7.21(2h,d,j=8.3hz),6.86(2h,d,j=8.6hz),5.38(1h,d,j=3.3hz),4.86(1h,s),4.52(1h,m),4.41(1h,dd,j=15.0,7.4hz),4.29(2h,d,j=5.6hz),3.80(3h,s),3.48(1h,dd,j=10.7,3.6hz),3.38(1h,t,j=10.9hz),1.02(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc36h51no5:578.3845;found:578.3847。化合物m5,白色固体。1hnmr(400mhz,cdcl3)δ5.37(1h,d,j=5.1hz),4.43(3h,m),3.47(2h,dd,j=10.3,2.6hz),3.37(1h,t,j=10.9hz),1.03(3h,s),0.97(4h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc34h53no4:540.4053;found:540.4057。化合物m6,白色固体。1hnmr(400mhz,cdcl3)δ5.37(1h,d,j=5.0hz),4.52(1h,m),4.41(1h,dd,j=14.1,6.8hz),3.48(1h,dd,j=10.9,4.7hz),3.35(5h,m),1.04(2h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc32h49no4:512.3740;found:512.3743。化合物m7,白色固体。1hnmr(400mhz,cdcl3)δ7.21(2h,d,j=7.2hz),7.16(2h,d,j=7.2hz),5.38(1h,d,j=5.1hz),4.91(1h,s),4.54(1h,m),4.42(1h,m),4.36(2h,d,j=5.6hz),3.47(1h,dd,j=9.9,3.8hz),3.38(1h,t,j=10.9hz),2.37(3h,s),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc36h51no4:562.3896;found:562.3899。化合物m8,白色固体。1hnmr(400mhz,cdcl3)δ7.31(5h,m),5.38(1h,d,j=5.1hz),4.91(1h,s),4.54(1h,m),4.42(4h,m),4.36(2h,d,j=5.6hz),3.47(1h,dd,j=9.9,3.8hz),3.38(1h,t,j=10.9hz),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc36h51no4:562.3896;found:562.3899。化合物m9,白色固体。1hnmr(400mhz,cdcl3)δ5.37(1h,d,j=5.1hz),4.43(3h,m),4.41(3h,m),3.47(2h,dd,j=10.3,2.6hz),3.37(1h,t,j=10.9hz),1.03(3h,s),0.97(4h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc35h55no4:554.4209;found:554.4213。化合物m10,白色固体。1hnmr(400mhz,cdcl3)δ5.37(1h,d,j=5.1hz),4.53(m,1h),4.41(3h,m),4.39(dd,j=13.3,6.0hz,1h),3.48(dd,j=10.4,3.8hz,1h),3.38(t,j=10.9hz,1h),2.99(t,j=6.3hz,1h),0.96(d,j=6.9hz,6h),0.94(s,3h),0.90(d,j=6.7hz,3h),0.79(d,j=6.3hz,3h),0.75(s,3h).hrms(esi):m/z[m+h]+calcdforc33h53no4:528.4053;found:528.4055。化合物m11,白色固体。1hnmr(400mhz,cdcl3)δ7.17(2h,dd,j=12.6,7.2hz),6.86(2h,d,j=8.6hz),5.39(1h,d,j=5.0hz),4.56(1h,s),4.41(3h,m),3.80(2h,s),3.48(1h,dd,j=10.1,4.5hz),3.38(1h,t,j=10.9hz),2.82(3h,d,j=16.2hz),1.04(3h,s),0.97(3h,d,j=6.9hz),δ0.79(3h,s),δ0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc37h53no5:592.4002;found:592.4005。化合物m12,白色固体。1hnmr(400mhz,cdcl3)δ7.30(2h,d,j=8.2hz),7.17(2h,dd,j=17.6,7.6hz),5.39(1h,d,j=2.6hz),4.56(1h,s),4.41(3h,m),3.48(1h,dd,j=10.1,4.7hz),3.38(1h,t,j=10.9hz),2.84(3h,d,j=21.8hz),1.03(3h,d,j=7.5hz),0.97(3h,d,j=6.9hz),δ0.79(3h,s),δ0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc36h50clno4:596.3507;found:596.3510。化合物m13,白色固体。1hnmr(400mhz,cdcl3)δ5.37(1h,d,j=5.2hz),4.50(1h,m),4.41(1h,dd,j=15.0,7.5hz),3.48(1h,dd,j=9.3,4.1hz),3.39(5h,m),1.04(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc33h51no4:526.3896;found:526.3898。化合物m14,白色固体。1hnmr(400mhz,cdcl3)δ5.38(1h,d,j=4.7hz),4.51(1h,tt,j=9.7,4.6hz),4.41(1h,dd,j=15.1,7.3hz),3.47(5h,m),3.38(1h,t,j=10.9hz),2.39(4h,m),1.04(3h,s),0.97(3h,d,j=6.9),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc33h52n2o4:541.4005;found:541.4009。化合物m15,白色固体。1hnmr(400mhz,cdcl3)δ8.54(2h,dd,j=6.7,2.6hz),7.64(1h,d,j=7.6hz),7.27(2h,m),5.38(1h,d,j=3.2hz),5.00(1h,s),4.53(1h,m),4.40(3h,m),3.47(1h,dd,j=11.3,3.3hz),3.37(1h,t,j=10.9hz),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc34h48n2o4:549.3692;found:549.3696。化合物m16,白色固体。1hnmr(400mhz,cdcl3)δ8.56(2h,d,j=5.5hz),7.21(2h,d,j=5.5hz),5.39(1h,d,j=3.6hz),5.10(1h,s),4.54(1h,m),4.40(3h,m),3.47(1h,dd,j=9.5,3.8hz),3.37(1h,t,j=10.9hz),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc34h48n2o4:549.3692;found:549.3696。化合物m17,白色固体。1hnmr(400mhz,cdcl3)δ8.62(1h,s),8.51(2h,d,j=6.8hz),5.53(1h,s),5.38(1h,d,j=4.8hz),4.54(3h,d,j=5.2hz),4.41(1h,dd,j=15.0,7.4hz),3.47(1h,dd,j=10.1,3.3hz),3.37(1h,t,j=10.9hz),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc33h47n3o4:550.3645;found:550.3648。实施例2薯蓣皂苷元m18~m21的制备在氩气保护下,将薯蓣皂苷元dio(207mg,0.5mmol)和吡啶(0.5ml)溶于15ml的无水二氯甲烷中,室温下缓慢加入三光气(2mmol)反应3小时后,加入相对应的芳香胺,继续反应3小时,停止反应,用30ml水淬灭,依次用10%的hcl溶液(3*30ml),饱和食盐水(3*30ml)洗涤,合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(乙酸乙酯/石油醚=1:20)得到化合物m18-m21(40%-70%)。化合物m18,白色固体。1hnmr(400mhz,cdcl3)δ7.29(2h,d,j=9.0hz),6.85(2h,d,j=9.0hz),6.40(1h,s),5.40(1h,d,j=5.1hz),4.59(1h,m),4.42(1h,dd,j=14.9,7.6hz),3.77(3h,d,j=15.0hz),2.43(1h,m),2.33(1h,t,j=12.3hz),1.05(3h,s),0.98(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc35h49no5:564.3689;found:564.3693。化合物m19,白色固体。1hnmr(400mhz,cdcl3)δ7.33(d,j=26.3hz,4h),7.05(s,1h),6.55(s,1h),5.40(s,1h),4.60(1h,m),4.42(s,1h),3.48(d,j=11.8hz,1h),3.38(t,j=11.0hz,1h),2.39(dd,j=30.1,7.5hz,2h),1.05(3h,s),0.98(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc34h47no4:534.3583;found:534.3586。化合物m20,白色固体。1hnmr(400mhz,cdcl3)δ7.23(d,j=7.4hz,2h),7.18(d,j=7.4hz,2h),5.40(s,1h),4.60(s,1h),4.42(s,1h),3.48(d,j=11.8hz,1h),3.38(t,j=11.0hz,1h),2.36(s,3h),1.05(3h,s),0.98(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc35h49no4:548.3740;found:548.3743。化合物m21,白色固体。1hnmr(400mhz,cdcl3)δ7.33(d,j=8.3hz,2h),7.32(d,j=8.3hz,2h),5.40(s,1h),4.60(s,1h),4.42(s,1h),3.48(d,j=11.8hz,1h),3.38(t,j=11.0hz,1h),2.39(dd,j=30.1,7.5hz,2h),1.05(3h,s),0.98(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc34h46clno4:568.3194;found:568.3198。实施例3薯蓣皂苷元m22~m28的制备m22~m28由薯蓣皂苷元出发经过三步反应得到,前两步是氨基甲酸酯的制备得到s3,第三步是由化合物s3和不同的羧酸经过脱水缩合制得。第三步:在氩气保护下,将s3(263mg,0.5mmol)和相应的羧酸(1.2eq),edcl(1.5eq),dmap(0.02eq)溶于5ml二氯甲烷中,室温反应3小时。反应完毕后,用20ml水淬灭,二氯甲烷萃取(3*20ml),合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(乙酸乙酯/石油醚=1:15)得到化合物m22-m28(65%-85%)。化合物m22,白色固体。1hnmr(400mhz,cdcl3)δ7.41(2h,d,j=8.5hz),7.36(2h,d,j=8.5hz),5.38(1h,d,j=4.9hz),4.53(1h,m),4.41(1h,dd,j=15.0,7.5hz),3.43(10h,m),1.04(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc39h53cln2o5:665.3721;found:665.3725。化合物m23,白色固体。1hnmr(400mhz,cdcl3)δ7.39(2h,d,j=8.7hz),6.92(2h,d,j=8.7hz),5.38(1h,d,j=4.9hz),4.53(1h,m),4.41(1h,dd,j=14.9,7.4hz),3.84(3h,s),3.45(10h,m),1.04(3h,s),0.97(4h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc40h56n2o6:661.4217;found:661.4219。化合物m24,白色固体。1hnmr(400mhz,cdcl3)δ8.31(2h,d,j=8.6hz),7.58(2h,d,j=8.7hz),5.38(1h,d,j=4.8hz),4.54(1h,m),4.41(1h,dd,j=14.9,7.3hz),3.49(10h,m),1.04(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc39h53n3o7:676.3962;found:676.3965。化合物m25,白色固体。1hnmr(400mhz,cdcl3)δ8.09(1h,s),5.38(1h,d,j=5.0hz),4.54(1h,m),4.41(1h,dd,j=15.0,7.5hz),3.45(10h,m),1.04(2h,s),0.97(2h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc33h50n2o5:555.3798;found:555.3795。化合物m26,白色固体。1hnmr(400mhz,cdcl3)δ5.38(1h,d,j=5.0hz),4.53(1h,m),4.41(1h,dd,j=15.0,7.5hz),3.61(2h,m),3.39(8h,m),1.16(3h,t,j=7.4hz),1.04(2h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc35h54n2o5:583.4111;found:583.4115。化合物m27,白色固体。1hnmr(400mhz,cdcl3)δ7.23(2h,d,j=8.0hz),7.14(2h,d,j=7.9hz),5.31(1h,d,j=5.0hz),4.46(1h,m),4.34(1h,m),3.40(10h,m),2.31(3h,s),0.97(3h,s),0.90(4h,d,j=6.9hz),0.72(3h,s),0.72(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc40h56n2o5:645.4267;found:645.4269。化合物m28,白色固体。1hnmr(400mhz,cdcl3)δ7.42(5h,m),5.38(1h,d,j=4.1hz),4.53(1h,m),4.41(1h,dd,j=14.6,7.3hz),3.48(10h,m),1.04(3h,s),0.97(3h,d,j=6.8hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc39h54n2o5:631.4111;found:631.4114。实施例4薯蓣皂苷元m29~m32的制备m29~m32由薯蓣皂苷元出发经过三步反应得到,前两步是氨基甲酸酯的制备得到s3,第三步是由化合物s3和不同的磺酰氯反应制得。第三步:在氩气保护下,将s3(263mg,0.5mmol)和三乙胺(0.1ml)溶于10ml的二氯甲烷中,在0℃冰浴下缓慢加入相应的磺酰氯(1.2eq),然后升至室温反应3小时。反应完毕后,用20ml水淬灭,二氯甲烷萃取(3*20ml),合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(乙酸乙酯/石油醚=1:15)得到化合物m29-m32(70%-85%)。化合物m29,白色固体。1hnmr(400mhz,cdcl3)δ7.37(5h,m),5.34(1h,d,j=5.0hz),4.43(2h,m),3.55(4h,m),3.47(1h,dd,j=10.4,2.9hz),3.37(1h,t,j=10.9hz),2.96(4h,s),1.01(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc38h54n2o6s:667.3781;found:667.3785。化合物m30,白色固体。1hnmr(400mhz,cdcl3)δ7.63(2h,d,j=8.2hz),7.34(2h,d,j=8.2hz),5.34(1h,d,j=5.0hz),4.43(2h,m),3.55(4h,m),3.47(1h,dd,j=10.4,2.9hz),3.37(1h,t,j=10.9hz),2.96(4h,s),2.44(3h,s),1.01(3h,s),0.97(3h,d,j=6.9hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc39h56n2o6s:681.3937;found:681.3941。化合物m31,白色固体。1hnmr(400mhz,cdcl3)δ5.38(1h,d,j=4.8hz),4.53(1h,m),4.41(1h,dd,j=15.0,7.4hz),3.55(4h,m),3.48(1h,dd,j=10.5,3.3hz),3.37(1h,t,j=10.9hz),3.27(4h,m),2.96(2h,q,j=7.4hz),1.38(3h,t,j=7.4hz),1.04(3h,s),0.96(3h,s),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc34h54n2o6s:619.3781;found:619.3785。化合物m32,白色固体。1hnmr(400mhz,cdcl3)δ7.77(2h,dd,j=8.1,5.0hz),7.23(2h,t,j=8.4hz),5.34(1h,d,j=2.9hz),4.42(2h,m),3.57(4h,m),3.47(1h,dd,j=10.2,2.1hz),3.37(1h,t,j=10.8hz),2.98(4h,m),1.01(3h,s),0.97(3h,d,j=6.8hz),0.79(3h,s),0.79(3h,d,j=4.3hz).hrms(esi):m/z[m+h]+calcdforc38h53fn2o6s:685.3687;found:685.3689。实施例5薯蓣皂苷元m33~m38的制备m33~m38由薯蓣皂苷元出发经过三步反应得到,前两步是氨基甲酸酯的制备得到s3,第三步是由化合物s3和不同的醛反应制得。第三步:在氩气保护下,将s3(263mg,0.5mmol)和相应的醛(1.5eq)溶于10ml的二氯甲烷中,加入三乙酰氧基硼氢化钠(1.5eq),5min后加入三乙胺(0.1mmol)室温反应过夜。反应完毕后,用20ml水淬灭,二氯甲烷萃取(3*20ml),合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(乙酸乙酯/石油醚=1:15)得到化合物m33-m38(60%-80%)。化合物m33,白色固体。1hnmr(400mhz,cdcl3)δ7.31(5h,m),5.37(1h,d,j=3.3hz),4.50(1h,m),4.41(1h,dd,j=14.9,7.5hz),3.51(2h,s),3.47(4h,m),3.37(1h,t,j=10.9hz),2.40(4h,m),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(6h,m).hrms(esi):m/z[m+h]+calcdforc39h56n2o4:617.4318;found:617.4321。化合物m34,白色固体。1hnmr(400mhz,cdcl3)δ7.22(2h,d,j=8.6hz),6.86(2h,d,j=8.6hz),5.37(1h,d,j=5.2hz),4.50(1h,m),4.41(1h,dd,j=15.0,7.5hz),3.80(3h,s),3.45(6h,m),3.37(1h,t,j=10.9hz),2.40(4h,m),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(6h,m).hrms(esi):m/z[m+h]+calcdforc40h58n2o5:647.4424;found:647.4428。化合物m35,白色固体。1hnmr(400mhz,cdcl3)δ7,32(2h,m),7.13(2h,d,j=8.3hz),5.37(1h,d,j=5.2hz),4.50(1h,m),4.41(1h,dd,j=14.9,7.5hz),3.46-3.49(6h,m),3.37(1h,t,j=10.9hz),2.41(4h,m),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(6h,m).hrms(esi):m/z[m+h]+calcdforc39h55cln2o4:651.3929;found:651.3933。化合物m36,白色固体。1hnmr(400mhz,cdcl3)δ6.85-6.89(2h,m),6.80(1h,d,j=8.0hz),5.58(1h,s,ar-oh),5.37(1h,d,j=5.2hz),4.50(1h,m),4.41(1h,dd,j=14.9,7.5hz),3.92(3h,s),3.46-3.50(6h,m),3.37(1h,t,j=10.9hz),2.41(4h,m),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(6h,m).hrms(esi):m/z[m+h]+calcdforc40h58n2o6:663.4373;found:663.4375。化合物m37,白色固体。1hnmr(400mhz,cdcl3)δ7.23(2h,d,j=7.4hz),7.18(2h,d,j=7.4hz),5.37(1h,d,j=5.2hz),5.03(1h,s),4.50(1h,m),4.41(1h,dd,j=14.9,7.5hz),3.44-3.48(6h,m),3.37(1h,t,j=10.9hz),2.41(4h,s),2.36(3h,s),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(6h,m).hrms(esi):m/z[m+h]+calcdforc40h58n2o4:631.4475;found:631.4478。化合物m38,白色固体。1hnmr(400mhz,cdcl3)δ7.16(2h,d,j=8.2hz),6.77(2h,d,j=8.2hz),5.37(1h,d,j=5.2hz),4.50(1h,m),4.41(1h,dd,j=14.9,7.5hz),3.53–3.38(6h,m),3.37(1h,t,j=10.9hz),2.39(4h,m),1.03(3h,s),0.97(3h,d,j=6.9hz),0.79(6h,m).hrms(esi):m/z[m+h]+calcdforc39h56n2o5:633.4267;found:633.4270。实施例6化合物m39~m46的制备第一步:将薯蓣皂苷元dio(16.56g,40mmol),异丙醇铝(2eq),30ml环己酮溶于100ml甲苯中,100℃下搅拌6h,直至反应完全。反应完全后,旋干甲苯,二氯甲烷抽滤,得到滤液,旋干,用石油醚/乙酸乙酯重结晶,得到s5。第二步:将s5溶于30ml的甲醇中,加入5%pd/c做催化,氢气60℃还原氢化4h,直至反应完全后,旋干甲醇,二氯甲烷溶解,过滤除去pd/c,得到s6。第三步:将得到的s6溶于20ml四氢呋喃中,加入硼氢化钠(1.5eq),直至反应完全后,用20ml水淬灭,旋干四氢呋喃,二氯甲烷萃取(3*20ml),合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(乙酸乙酯/石油醚=1:15)得到化合物sm1和sm2。中间体s7的制备在氩气保护下,将sm1(4.14g,10mmol)和吡啶(0.5ml)溶于15ml的二氯甲烷中,冰浴条件下缓慢加入对硝基苯基氯甲酸酯(15mmol),然后升至室温继续反应4小时。反应完毕后,用100ml水淬灭,二氯甲烷萃取(3*100ml),合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(乙酸乙酯/石油醚=1:20)得到化合物s7为5.804g(95%)。化合物m39~m46的制备在氩气保护下,将s7(306mg,0.5mmol)和三乙胺(0.1ml)溶于5ml二氯甲烷中,冰浴下缓慢加入相应的胺(1.5mmol)然后升温至室温继续反应3小时。反应完毕后,用30ml水淬灭,二氯甲烷萃取(3*30ml),合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(乙酸乙酯/石油醚=1:15)得到化合物m39~m46(50%-85%)。化合物m39,白色固体。1hnmr(400mhz,cdcl3)δ7.21(d,j=8.4hz,2h),6.86(d,j=8.6hz,2h),4.88(s,1h),4.74–4.52(m,1h),4.39(dd,j=14.6,7.4hz,1h),4.28(d,j=5.6hz,2h),3.79(s,3h),3.47(dd,j=10.3,3.3hz,1h),3.37(t,j=10.9hz,1h),0.96(d,j=7.0hz,3h),0.94(s,3h),0.79(d,j=6.3hz,3h),0.75(s,3h).hrms(esi):m/z[m+h]+calcdforc36h53no5:580.4002;found:580.4007。化合物m40,白色固体。1hnmr(400mhz,cdcl3)δ4.71–4.53(m,1h),4.39(dd,j=13.3,6.0hz,1h),3.48(dd,j=10.4,3.8hz,1h),3.38(t,j=10.9hz,1h),2.99(t,j=6.3hz,1h),0.96(d,j=6.9hz,6h),0.94(s,3h),0.90(d,j=6.7hz,3h),0.79(d,j=6.3hz,3h),0.75(s,3h).hrms(esi):m/z[m+h]+calcdforc32h53no4:516.4053;found:516.4058。化合物m41,白色固体。1hnmr(400mhz,cdcl3)δ7.32(m,5h),4.93(s,1h),4.65(td,j=10.9,5.4hz,1h),4.47–4.30(m,4h),3.47(dd,j=9.9,2.6hz,1h),3.37(t,j=10.9hz,1h),0.96(d,j=7.0hz,4h),0.94(s,4h),0.79(d,j=6.2hz,4h),0.75(s,3h).hrms(esi):m/z[m+h]+calcdforc35h51no4:550.3896;found:550.3899。化合物m42,白色固体。1hnmr(400mhz,cdcl3)δ7.23(2h,d,j=8.0hz),7.14(2h,d,j=7.9hz),4.93(s,1h),4.65(td,j=10.9,5.4hz,1h),4.47–4.30(m,4h),3.47(dd,j=9.9,2.6hz,1h),3.37(t,j=10.9hz,1h),0.96(d,j=7.0hz,4h),0.94(s,4h),0.79(d,j=6.2hz,4h),0.75(s,3h).hrms(esi):m/z[m+h]+calcdforc36h53no4:564.4053;found:564.4056。化合物m43,白色固体。1hnmr(400mhz,cdcl3)δ4.59(s,1h),4.50(d,j=5.2hz,1h),4.40(dd,j=14.4,7.4hz,1h),3.54–3.43(m,2h),3.38(t,j=10.9hz,1h),0.96(d,j=6.9hz,3h),0.94(s,3h),0.79(d,j=6.2hz,3h),0.75(s,3h).hrms(esi):m/z[m+h]+calcdforc34h55no4:542.4029;found:542.4033。化合物m44,白色固体。1hnmr(400mhz,cdcl3)δ4.62(ddd,j=15.8,11.1,4.5hz,1h),4.40(dd,j=15.0,6.8hz,1h),3.48(dd,j=10.3,3.3hz,1h),3.44–3.28(m,5h),0.97(d,j=6.9hz,3h),0.94(s,3h),0.79(d,j=6.3hz,3h),0.76(s,3h).hrms(esi):m/z[m+h]+calcdforc32h51no4:514.3896;found:514.3899。化合物m45,白色固体。1hnmr(400mhz,cdcl3)δ4.68–4.55(m,1h),4.40(dd,j=14.0,7.7hz,1h),3.48(dd,j=9.9,3.6hz,1h),3.39(dt,j=16.1,8.1hz,5h),0.97(d,j=6.8hz,3h),0.94(s,3h),0.79(d,j=6.3hz,3h),0.76(s,3h).hrms(esi):m/z[m+h]+calcdforc33h53no4:528.4053;found:528.4056。化合物m46,白色固体。1hnmr(400mhz,cdcl3)δ7.30(d,j=8.3hz,2h),7.22(d,j=8.3hz,2h),4.95(s,1h),4.70–4.57(m,1h),4.40(dd,j=14.7,7.5hz,1h),4.32(d,j=5.7hz,2h),3.48(dd,j=10.4,3.2hz,1h),3.37(t,j=10.9hz,1h),0.96(d,j=7.0hz,4h),0.94(s,3h),0.79(d,j=6.3hz,3h),0.75(s,3h).hrms(esi):m/z[m+h]+calcdforc35h50clno4:584.3507;found:584.3509。实施例7化合物m47~m48的制备m55~m56由sm1出发经过三步反应得到,前两步是氨基甲酸酯的制备得到s8,第三步是由化合物s8和不同的醛反应制得。第三步:在氩气保护下,将s8(263mg,0.5mmol)和相应的醛(1.5eq)溶于10ml的二氯甲烷中,加入三乙酰氧基硼氢化钠(1.5eq),5min后加入三乙胺(0.1mmol)室温反应过夜。反应完毕后,用20ml水淬灭,二氯甲烷萃取(3*20ml),合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(乙酸乙酯/石油醚=1:15)得到化合物m47~m48(60%-80%)。化合物m47,白色固体。1hnmr(400mhz,cdcl3)δ7.36–7.28(m,5h),4.61(tt,j=11.1,5.7hz,1h),4.39(dd,j=14.1,7.7hz,1h),3.48(dd,j=13.5,8.2hz,6h),3.37(t,j=10.9hz,1h),2.40(d,j=4.5hz,4h),0.96(d,j=6.9hz,3h),0.94(s,3h),0.79(d,j=6.3hz,3h),0.75(s,3h).hrms(esi):m/z[m+h]+calcdforc39h58n2o4:619.4475;found:619.4479。化合物m48,白色固体。1hnmr(400mhz,cdcl3)δ7.22(d,j=8.4hz,2h),6.86(d,j=8.5hz,2h),4.69–4.48(m,1h),4.39(dd,j=13.9,7.3hz,1h),3.80(s,3h),3.46(s,6h),3.37(t,j=10.9hz,1h),2.38(s,4h),0.96(d,j=6.9hz,3h),0.94(s,3h),0.79(d,j=6.2hz,3h),0.75(s,3h).hrms(esi):m/z[m+h]+calcdforc40h60n2o5:649.4580;found:649.4583。实施例8化合物m49~m55的制备第一步:在氩气保护下,将sm2(4.16g,10mmol)和三苯基膦(1.5eq),邻苯二甲酰亚胺(1.5eq)溶于20ml的四氢呋喃中低温搅拌30min,缓慢加入偶氮二甲酸二异丙酯(1.5eq),反应3h。反应完毕后用20ml水淬灭,二氯甲烷萃取(3*20ml),合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(乙酸乙酯/石油醚=1:45)得到化合物s9。第二步:将上述得到的化合物s9溶于甲醇中,加入水合肼55℃搅拌脱保护直至反应完全。反应完全后用20ml水淬灭,旋干甲醇,二氯甲烷萃取(3*20ml),合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(甲醇/二氯甲烷=1:10)得到化合物s10。第三步:在氩气保护下,将s9(208mg,0.5mmol)和相应的羧酸(1.2eq),edcl(1.5eq),dmap(0.02eq)溶于5ml二氯甲烷中,室温反应3小时。反应完毕后,用20ml水淬灭,二氯甲烷萃取(3*20ml),合并有机相,经无水硫酸钠干燥,减压浓缩后经层析柱(乙酸乙酯/石油醚=1:15)得到化合物m49~m55(65%~85%)。化合物m49,白色固体。1hnmr(400mhz,cdcl3)δ7.76(d,j=8.8hz,2h),6.89(d,j=8.8hz,2h),6.21(d,j=8.0hz,1h),4.38(dd,j=15.0,7.4hz,1h),4.04–3.89(m,1h),3.83(s,3h),3.47(dd,j=10.2,3.2hz,1h),3.37(t,j=10.9hz,1h),0.96(d,j=8.5hz,6h),0.79(d,j=6.3hz,3h),0.75(s,3h).hrms(esi):m/z[m+h]+calcdforc35h51no4:550.3896;found:550.3898。化合物m50,白色固体。1hnmr(400mhz,cdcl3)δ7.76(d,j=7.9hz,2h),7.51–7.45(m,1h),7.42(t,j=7.2hz,2h),6.02(d,j=7.7hz,1h),4.40(dd,j=14.7,7.2hz,1h),3.99(d,j=10.3hz,1h),3.48(dd,j=9.3,2.7hz,1h),3.38(t,j=10.8hz,1h),0.97(d,j=6.9hz,6h),0.79(d,j=6.2hz,3h),0.76(s,3h).hrms(esi):m/z[m+h]+calcdforc34h49no3:520.7657;found:520.7659。化合物m51,白色固体。1hnmr(400mhz,cdcl3)δ8.28(d,j=8.7hz,2h),7.92(d,j=8.7hz,2h),6.03(d,j=7.7hz,1h),4.83(s,3h),4.40(dd,j=14.9,7.4hz,1h),4.01(d,j=7.2hz,1h),3.48(dd,j=10.7,3.7hz,1h),3.38(t,j=10.9hz,1h),0.99(s,3h),0.97(d,j=6.9hz,3h),0.79(d,j=6.3hz,3h),0.77(s,3h).hrms(esi):m/z[m+h]+calcdforc34h48n2o5:565.3641;found:565.3644。化合物m52,白色固体。1hnmr(400mhz,cdcl3)δ7.65(d,j=8.1hz,2h),7.22(d,j=8.0hz,2h),5.92(d,j=7.8hz,1h),4.40(dd,j=14.4,7.8hz,1h),4.00(s,1h),3.48(dd,j=12.2,4.3hz,1h),3.38(t,j=10.9hz,1h),2.39(s,3h),0.97(d,j=7.0hz,6h),0.79(d,j=6.4hz,3h),0.77(s,3h).hrms(esi):m/z[m+h]+calcdforc35h51no3:534.3947;found:534.3949。化合物m53,白色固体。1hnmr(400mhz,cdcl3)δ7.70(d,j=8.5hz,2h),7.39(d,j=8.5hz,2h),5.99(s,1h),4.40(dd,j=14.9,7.5hz,1h),4.04–3.89(m,1h),3.48(dd,j=10.4,3.0hz,1h),3.38(t,j=10.9hz,1h),0.97(d,j=6.8hz,6h),0.79(d,j=6.3hz,3h),0.76(s,3h).hrms(esi):m/z[m+h]+calcdforc34h48clno3:554.3401;found:554.3405。化合物m54,白色固体。1hnmr(400mhz,cdcl3)δ5.32(d,j=7.5hz,1h),4.39(dd,j=14.9,7.5hz,1h),3.78(s,1h),3.48(d,j=7.8hz,1h),3.38(t,j=10.8hz,1h),1.95(s,3h),1.00–0.92(m,6h),0.79(d,j=6.1hz,3h),0.75(s,3h).hrms(esi):m/z[m+h]+calcdforc29h47no3:458.3634;found:458.3638。化合物m55,白色固体。1hnmr(400mhz,cdcl3)δ5.28(d,j=7.8hz,1h),4.39(dd,j=14.8,7.5hz,1h),3.76(dt,j=10.9,8.9hz,1h),3.48(dd,j=10.7,2.7hz,1h),3.38(t,j=10.9hz,1h),1.14(d,j=6.9hz,6h),0.99–0.93(m,6h),0.79(d,j=6.3hz,3h),0.76(s,3h).hrms(esi):m/z[m+h]+calcdforc31h51no3:486.3947;found:486.3949。实施例9薯蓣皂苷元衍生物对h2o2诱导损伤的pc12细胞活性的影响(1)试剂材料pc12鼠肾上腺髓质嗜铬细胞购于americantypeculturecollection;dmem培养基、胎牛血清fbs、青霉素/链霉素、胰酶购于gibco;30%过氧化氢购于国药试剂。(2)实验仪器移液器购于thermoscientific荧光显微镜购于nikonti-s,nikon;二氧化碳培养箱购于thermoscientific;96孔板购于jetbiofil电热恒温鼓风干燥箱购于上海一恒科学仪器仪表有限公司。(3)mtt法检测细胞存活率鼠肾上腺髓质嗜铬pc12细胞,培养基为含有10%胎牛血清、100iu/ml青霉素和100ug/ml链霉素的dmem培养基。pc12细胞培养于6cm培养皿中,置于细胞培养箱内37℃、5%co2、饱和湿度条件下培养。细胞长至对数生长期时以1×105个/ml接种于96孔板中,每孔100ul。设置调零孔,空白对照、损伤组和药物实验组。h2o2损伤模型:将pc12细胞以1×105浓度,每孔100ul,铺于96孔板,每组设3个副孔。24小时后,用无血清的培养基将化合物由的10mm母液稀释至10um,替换原来的培养基。在培养箱中孵育2h后加入浓度为2mm的h2o2,每孔加入11ul,使最终浓度为200um。放入培养箱孵育24小时后,每孔加入11ulmtt,4小时后,吸掉所有液体,每孔加入150uldmso溶解,用酶标仪测定在490nm处的od值。保护率=(a实验组-a阴性对照组)/(a空白组-a阴性对照组)×100%(4)实验结果化合物保护率%(10um)化合物保护率%(10um)化合物保护率%(10um)nac1mm:37.1±2.5m203.1±0.4m3917.9±1.5m156.1±4.1m217.4±0.6m409.2±1.1m2121.1±5.3m222.1±0.2m413.5±0.5m378.9±5.6m232.8±0.4m4229.2±3.1m470.1±1.2m245.9±0.9m4317.9±0.6m552.0±6.0m25116.9±9.9m447.6±0.8m689.8±3.3m2654.2±5.7m457.1±0.6m749.6±5.0m2727.0±1.6m4645.5±2.1m866.7±6.3m2882.3±3.0m4736.9±3.5m93.4±0.5m299.7±1.0m484.8±0.2m1037.7±0.4m309.1±0.8m492.3±0.3m1139.3±2.5m313.5±0.5m5013.1±0.9m1266.3±4.0m327.2±0.9m5166.1±4.1m1356.6±0.5m3317.9±1.3m5234.8±2.0m144.7±0.4m342.7±0.4m5324.8±1.5m1520.4±1.7m353.1±0.4m5412.9±1.1m1665.7±5.1m3620.7±2.1m5510.4±1.3m1749.3±3.8m377.3±1.1m182.9±0.3m3813.7±1.3m196.1±0.7nac:氨基胍实施例10薯蓣皂苷元衍生物对lps诱导损伤的raw264.7细胞no抑制活性的影响(1)试剂材料raw264.7细胞株(中国科学院上海细胞生物学研究所);dmem培养基(含有10%胎牛血清、100iu/ml青霉素和100ug/ml链霉素);griess试剂(含1%的对氨基苯磺酰胺、0.1%的n-1-萘乙二胺盐酸盐、2.5%磷酸),其他试剂同上。诱导物为脂多糖(lps)阳性对照为氨基胍(2)实验方法mtt法检测细胞存活率:将生长至融合状态的raw264.7细胞,以每孔2x104个细胞的数量铺于96孔板。过夜后,用无血清培养基将化合物由10mm的母液稀释至10μm,替换原来的培养基,每组设三副孔。于培养箱中孵育24小时后,向每孔中加入10μl终浓度为5mg/ml的mtt溶液。37℃下孵育4小时后,移出96孔板中的液体并加入130μl的dmso,震荡均匀后,用酶标仪测定490nm处的od值。该实验重复三次。no测试:小鼠巨噬细胞raw264.7于dmem培养基中在37℃,5%co2环境下的培养箱培养。试验时将100ul浓度为1×106/ml的细胞悬液接种到96孔板上,继续培养5-6小时。然后将相应浓度的阳性对照药品、制备好的化合物分别加到悬液中。实验分为三组空白对照组、lps组、实验组。半小时后,将10ul的lps加入到lps组和实验组,使lps的终浓度为1ug/ml。培养20小时后,用griess法通过测定细胞上清液中亚硝酸盐的含量间接反映no的生成量;取50ul细胞培养液,加入等量的griess试剂,于540nm波长处测吸光度,以亚硝酸盐标准溶液绘制标准曲线,计算亚硝酸盐的浓度。抑制率=(阴性对照组no产生量-实验组no产生量)/阴性对照组no产生量×100%(3)实验结果化合物no抑制率%(10um)化合物no抑制率%(10um)化合物no抑制率%(10um)m125.1±0.1m208.1±0.9m399.2±0.8m222.7±2.2m2110.7±1.1m4017.7±2.0m37.0±0.2m2214.4±2.3m4114.2±1.7m418.6±1.7m2313.7±1.7m426.8±0.8m511.6±1.9m2422.9±0.5m435.6±0.7m616.5±2.1m2523.7±2.3m443.2±0.3m78.0±0.8m2614.1±1.3m4513.0±1.7m820.8±2.3m2718.5±1.8m4617.6±1.5m910.9±0.3m2814.9±1.9m4718.3±1.4m104.8±0.6m293.6±0.5m4815.5±1.4m1112.4±2.0m3011.4±2.9m4920.1±2.5m1212.5±1.3m3123.4±1.6m5019.8±1.8m1312.0±0.1m327.8±0.4m5127.2±2.3m1418.2±1.9m3311.7±1.7m5218.3±1.5m1511.8±2.3m3414.2±1.3m5317.9±1.1m1611.8±1.3m352.7±0.3m5432.7±3.8m1722.9±1.2m3616.1±1.2m5526.5±2.0m187.8±1.3m3712.3±1.1m1913.1±1.7m3815.7±1.7实施例11薯蓣皂苷元衍生物对sh-sy5y细胞氧糖缺乏的保护作用(1)试剂材料(2)实验方法将生长至融合状态的sh-sy5y细胞,以每孔1x105个细胞的数量铺于96孔板。过夜后,用高糖无血清培养基将化合物由10mm的母液稀释至10μm,替换原来的培养基,每组设三副孔。于培养箱中孵育24小时后,用预温pbs轻柔洗涤培养板1次,用去氧无糖无血清dmem将化合物由10mm的母液稀释至10μm,替换原来的培养基,100μl/孔,每组三副孔。置于三气培养箱(37℃、94%n2、5%co2、1%o2)进行ogd培养5.5h。向每孔中加入10μl终浓度为5mg/ml的mtt溶液。37℃下孵育4小时后,移出96孔板中的液体并加入150μl的dmso,震荡均匀后,用酶标仪测定490nm处的od值。保护率=(a实验组-a阴性对照组)/(a空白组-a阴性对照组)×100%(3)实验结果化合物保护率%(10um)化合物保护率%(10um)化合物保护率%(10um)m118.7±1.9m209.3±1.1m3925.8±3.1m240.9±3.7m213.6±0.5m4030.2±0.9m326.9±2.4m223.8±0.5m411.5±0.2m418.9±1.6m230.9±0.1m4214.0±1.6m55.8±0.7m241.5±0.2m433.3±0.4m624.5±2.1m250.7±0.3m446.7±0.9m725.1±2.3m261.6±0.1m450.8±0.1m818.3±1.4m271.9±0.3m4621.7±0.6m92.3±0.2m2821.1±1.8m4751.6±4.9m1029.7±1.3m291.3±0.2m4824.0±2.1m111.5±0.3m302.1±0.3m494.6±0.3m123.7±0.4m311.8±0.2m503.3±0.3m1323.9±2.1m321.1±0.3m515.6±0.4m1419.3±1.1m3317.2±1.5m527.9±0.9m1517.0±1.3m347.1±0.5m537.7±0.6m1615.6±0.9m355.3±0.4m543.9±0.5m172.4±0.5m3626.1±2.4m5521.7±2.2m1819.9±2.3m377.9±0.8m191.2±0.2m3815.6±1.1实施例12化合物m2对大鼠脑缺血模型的活性评价(1)实验动物spf级sd雄性大鼠,8周龄,220克左右。(2)实验方法动物分为controlgroup(shamoperation),modelgroup(2vo),m2组。造模前,动物禁食12h,不禁水。双侧颈总动脉结扎手术步骤:a.用10%水合氯醛麻醉大鼠,麻醉剂量为体重(kg)*0.4,例如0.3*4=1.2mlb.麻醉生效后,仰卧位平放聚苯乙烯泡沫板上,固定四肢,颈部去毛、消毒、铺巾。c.用手术刀于颈部正中线剪开,开口大约3cm以充分暴露手术视野。d.钝性分离胸骨舌骨肌,分别找到左右两侧颈总动脉后,用玻璃分针分离动脉旁迷走神经,上下结扎颈总动脉后,剪断血管。e.缝合伤口后,滴加双抗于伤口表面。f.置于32度环境保温。(3)实验结果实验结果如图1~2所示,根据水迷宫实验的第1至4天隐蔽平台试验的潜伏期数据(图1),模型组与正常对照组相比,潜伏期变长,大鼠的学习记忆能力下降;m2组、多奈哌齐组与模型组相比,潜伏期变短,大鼠记忆能力有所改善。根据第5天空间探索实验的数据(图2)可知,与对照组相比,模型组的大鼠在目标象限的停留时间显著减少(p<0.01),说明脑缺血模型成功,模型组大鼠的空间记忆能力下降。与模型组相比,给予化合物m2(30mg/kg)的大鼠在目标象限停留的时间显著增加(p<0.01),且与对照组接近,说明化合物m2一定程度上改善了双侧颈总动脉结扎所致的记忆能力损伤。与模型组相比,给予阳性药多奈哌齐(0.5mg/kg)的大鼠,在目标象限停留的时间显著增加(p<0.05),说明多奈哌齐也改善了双侧颈总动脉结扎所致的记忆能力损伤。实施例13实验目的:探究m2对app转基因小鼠的药效作用实验材料:(1)实验动物:m2:app鼠18只,wt鼠6只。(2)实验设备:①新物体识别场地:底面40×40cm的正方形,四周壁高45cm,底面为白色,四周为黑色。识别物体:橙色正方体(3×3×3),紫色三棱锥(3×3×3.5)②水迷宫直径大约1.5m,高60cm的圆形水池,直径10cm的逃生平台。③筑巢实验筑巢棉片,饲养笼实验方法:给药:m2低剂量:6mg/kg;高剂量:30mg/kg喜得镇(阳性对照):1mg/kg给药12周行为学:(1)水迷宫a、实验第一天为熟悉阶段,逃生平台高于水面2厘米,平台中央插一面旗子,小鼠以面朝池壁的方式入水自由泳动,以熟悉环境和适应水温。如果小鼠能够成功找到平台,要保证小鼠在平台停留10-15s。如果小鼠没有找到平台,将引导它爬上平台,并在平台上停留15-20s。b、实验第二天为正式训练阶段,每天训练两次,总共持续6天,每天的训练时间段固定为13:00-15:00。将平台上面的旗子拔掉,分别在s/w两个方向入水。同样,如果小鼠能够在一分钟之内找到平台并在平台上停留5s后自动停止计时,此为小鼠找到平台的潜伏期。如果小鼠一分钟之内没有找到平台,则将其引导上平台,并在平台上面停留15-20s,使其记录周围的环境。c、实验第七天为测试阶段,撤掉平台,时间只设置一分钟,测试小鼠进入平台区域的次数、目标象限停留时间等一系列参数。实验中采用安来(anlilab)软件科技有限公司的视频跟踪和采集系统进行数据的采集和轨迹分析。(2)新物体识别a、在进行训练和测试前3天,每天抚摸实验大鼠1min,避免刺激小鼠,使其消除与测试者的陌生感。b、在训练前3天,每天将动物放在测试的房间内,适应测试环境。c、训练阶段,将a,b两个物体放在一侧壁的左右两端,小鼠背朝两物体放入场地内,并且小鼠鼻尖距离两物的长度要一致。小鼠放入10min,放入后立即开启录像设备,实验者立即离开测试房间,记录小鼠与这两个物体接触的情况,包括鼻子或嘴巴触及物体的次数和距离物体2-3cm范围内探究的时间(前爪搭在物体上、鼻子嗅物体、舔物体等均属探究物体,摆个架势或爬到物体上不动不能算是对新物体的探究)。d、10min结束后,立即将小鼠放回原来饲养的鼠盒内,待小鼠休息3小时后再进行测试(此期间小鼠仍呆在测试房间内)。e、待小鼠休息3小时后开始测试,此时将场地内的b物体换成c物体,仍将小鼠背向两物体,鼻尖距离两物的长度要一致,观察10min,用录像设备录像,观察者离开测试房间,观察指标同第四步。主要观察小鼠对c物体的探究情况。(3)筑巢实验a、将各组小鼠分成单笼,让其适应单笼环境24h后,在每笼中换入厚度1cm的垫料。b、夜节律前2h均匀平铺放入一块筑巢棉片。c、18h后,进行筑巢评分。实验结果:(1)水迷宫中的目标象限停留时间结果如图3所示。(2)新物体识别中的识别指数如图4所示。(3)筑巢实验中的筑巢得分如图5所示。实验结果分析与问题讨论:对于化合物m2,在水迷宫中,app模型组小鼠与正常wt对照组小鼠目标象限停留时间有显著性差异p=0.02,说明模型组小鼠有痴呆症状。与模型组相比,化合物m2(30mg/kg)给药组小鼠,目标象限停留时间显著延长(p<0.05),这表明m2一定程度上改善了app小鼠的空间记忆能力。阳性药喜得镇(1mg/kg)给药组和化合物m2(6mg/kg)给药组目标象限停留时间也比模型组长,但没有显著性差异,预测可能存在一定程度的保护作用。在新物体识别实验中,正常wt对照组小鼠和给药组小鼠识别指数均大于50%,说明对新物体有更好的探索,而app模型鼠识别指数小于50%,且与正常wt对照组(p<0.05),阳性药喜得镇(1mg/kg)给药组(p<0.005),m2(30mg/kg)给药组(p<0.05)有显著性差异。在筑巢实验中,正常wt对照组小鼠筑巢评分接近满分,app模型组小鼠与正常wt对照组小鼠筑巢评筑分有显著性差异p=0.001。化合物m2(30mg/kg)给药组小鼠和阳性药喜得镇(1mg/kg)给药组,筑巢评分显著增加(p<0.05),这表明m2和阳性药一定程度上改善了app小鼠的痴呆。采用本发明的薯蓣皂苷元衍生物、其药物组合及其应用,首次对该先导化合物进行了系统性的针对3位和5/6位双键进行结构修饰,合成了一系列新化合物,这些新化合物通过相关靶点的活性测试,很多显示出优于先导化合物的活性,对于治疗神经退行性疾病十分有价值。弥补了现有技术中薯蓣皂苷元衍生物的不足,十分有意义。在此说明书中,本发明已参照其特定的实施例作了描述。但是,很显然仍可以做出各种修改和变换而不背离本发明的精神和范围。因此,说明书和附图应被认为是说明性的而非限制性的。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1