一种诱导型启动子及其用途的制作方法
本发明属于生物工程技术领域,尤其涉及一种诱导型启动子及其用途。
背景技术:
甾体激素类药物是目前仅次于抗生素的第二大类药物,在临床上具有极其重要的医药价值,在维持生命、调节生理功能、免疫功能、机体生长、皮肤病治疗及生育控制等方面具有良好的作用。化学合成在甾体化合物的研究和生产过程中仍具有举足轻重的地位,而在甾体激素药物的生产中,微生物转化技术已成为许多甾体化合物或其中间体合成路线中不可缺少的关键技术。大量事实表明,甾体化合物工业是将化学合成技术和生物技术相结合应用于工业生产的一个典范。
微生物对甾体化合物的转化反应多种多样,比较典型的微生物转化反应主要有羟基化、脱氢、边链降解等。其中,甾体化合物生物催化羟基化尤为重要。目前,甾体化合物的生物催化羟基化因其高效性,已广泛应用到抗炎药、免疫抑制剂、促孕剂、利尿剂、同化剂以及避孕药的生产中。
细菌和真菌都可以催化甾体的羟基化反应,但目前成功应用于工业生产的大多为丝状真菌如曲霉和青霉等。在甾体化合物生物催化过程中,菌体自身的催化活性直接影响产物的转化效率。随着分子生物学的发展,构建具有高转化能力的基因工程菌株以提高甾体转化效率成为近年来的研究热点。丝状真菌中催化羟基化反应的羟基化酶属于p450酶系,但目前对于参与反应的羟化酶研究相对较少,国内外相关羟化酶启动子也未见报道,其表达调控机制更不明确。
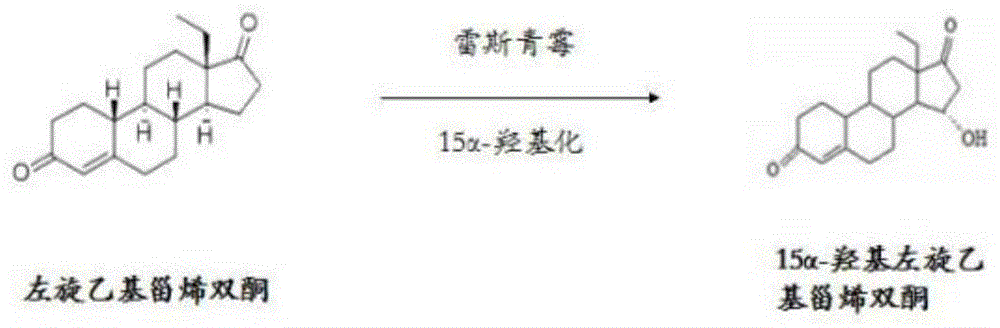
采用雷斯青霉催化甾体化合物左旋乙基甾烯双酮的c15α位羟基化反应,合成孕二烯酮的重要中间体—15α-羟基左旋乙基甾烯双酮(如图1)。与化学合成方法相比,其反应条件较温和,产物较单一,具有很高的区域选择性,立体选择性和化学选择性,易于纯化,且转化率高,生产成本低,对环境友好。研究证明,penicilliumraistrickii(atcc10490)是羟化效果最佳的菌株。已有的研究证实丝状真菌的甾体c15α-羟化酶在转录水平上受甾体底物诱导(jialonggang,dongjianzhang,wangruijie,etal.identificationandcharacterizationofthesteroid15α-hydroxylasegenefrompenicilliumraistrickii,appliedmicrobiologyandbiotechnology,2017,101(16):6409~6418),但有关羟化酶的诱导机制及其相关基因尚未见文献报道。
因此,对于来源于p450羟化酶基因启动子的研究,将为阐述羟化酶的生物催化反应分子机制奠定良好基础,同时也为构建下一代高效工程菌提供了关键的基因资源,对于甾体药物生物催化羟基化的高效生产具有重要的意义。
技术实现要素:
本发明的目的是针对目前工业上甾体生物转化羟化反应转化效率偏低的问题,提供一种诱导型启动子p800,该启动子能够诱导p450羟化酶基因(prh)的表达,为构建高效催化甾体化合物羟化反应的基因工程菌株奠定坚实的基础,对于提高甾体化合物的生物转化效率具有重要的意义。
本发明所述诱导型启动子p800的核苷酸序列如seqidno:1所示。
本发明所述诱导型启动子p800来源于雷斯青霉(penicilliumraistrickii)atcc10490。
本发明所述诱导型启动子p800也可以是能与seqidno:1所示序列杂交并且具有启动子功能的核苷酸序列。
含有本发明所述诱导型启动子p800的表达盒、表达载体、重组载体或宿主细胞也属于本发明的保护范围。
基因扩增含有本发明所述诱导型启动子p800dna全长或部分片段的引物序列也属于本发明的保护范围。
本发明所述诱导型启动子p800,可用于甾体化合物羟化酶基因的诱导表达。
本发明所述诱导型启动子p800,可用于丝状真菌中甾体化合物羟化酶基因的诱导表达。
本发明所述的诱导型启动子p800,可用于包括但不限于甾体15α-羟化酶、11α-羟化酶、16α-羟化酶、7α-羟化酶、14α-羟化酶、9α-羟化酶或11β-羟化酶基因的诱导表达。所述基因表达的羟化酶可以催化包括但不限于甾体化合物c15α、c11α、c16α、c7α、c14α、c9α或c11β的羟基化反应。
本发明所述的诱导型启动子p800,可用于构建诱导表达羟化酶的基因工程重组菌。所述基因工程重组菌可以是丝状真菌。
有益效果:
本发明实例考察了增加雷斯青霉atcc10490c15α-羟化酶基因prh的拷贝数对转化左旋乙基甾烯双酮效率的影响。通过构建prh诱导型表达载体,并运用同源重组的方法获得了相应含两个拷贝prh基因的重组菌株。甾体转化实验表明雷斯青霉重组菌株的转化率显著高于现有生产菌种,同时极大缩短了转化时间,本发明的研究成果具有重要的商业应用价值。
附图说明:
图1:左旋乙基甾烯双酮的15α羟基化生物催化反应。
图2:启动子p800产物验证电泳图;m:marker;p800:启动子p800。
图3a:诱导型启动子表达载体ppzp-l-hyg-p800-prh-tt-r的构建示意图。
图3b:重组表达载体ppzp-l-hyg-p800-prh-tt-r酶切验证图;m:10kbdnaladder;1:酶切产物。
图4:农杆菌agl-1ppzp-l-hyg-p800-prh-tt-r转化子菌落pcr验证电泳图;m:10kbdnaladder,w:农杆菌agl-1野生型,1-10:电转农杆菌转化子。
图5:15α-羟化酶prh基因表达盒定点整合和基因重组菌验证;m:10kbdnaladder;1、2:过表达菌株(p800)转化子。
图6:雷斯青霉重组菌与野生型菌株的prh基因拷贝数比较。
图7:不同发酵时间段雷斯青霉菌株的底物转化率。
图8a:诱导型启动子表达载体ppzp-l-hyg-p800-aoh-tt-r的构建示意图。
图8b:重组表达载体ppzp-l-hyg-p800-aoh-tt-r酶切验证图;m:10kbdnaladder;2:酶切产物。
具体实施方式:
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
涉及菌株:雷斯青霉(penicilliumraistrickii)atcc10490,赭曲霉(aspergillusochraceus)tccc41060,根癌农杆菌agl-1(也可以使用根癌农杆菌lba4404实现介导,具有同样效果),天津科技大学微生物菌种保藏中心。
所用的酶及试剂:
限制性内切酶ecori、noti、saci、hindiii、kpni、solutioni连接试剂盒及pyrobestdna聚合酶购买自takara公司。甲醇、乙腈、乙酸乙酯及石油醚购买自天津化学试剂六厂。其他常规试剂为进口分装或国产分析纯。引物的合成及序列的测定由北京华大公司完成。
所用培养基:
pda培养基(g/l):土豆200,葡萄糖20,115℃灭菌15min。
lb培养基(g/l):蛋白胨10,nacl10,酵母粉5,121℃灭菌20min。
ypd培养基(g/l):蛋白胨20,酵母粉10,葡萄糖20,115℃灭菌20min。
20×absalt:mgso4·7h2o6g,nh4cl20g,cacl20.2g,kcl3g,feso4·7h2o50mg溶于900ml蒸馏水中,终体积定容到1l。
im培养基:20×absalt50ml,na3po42mmol,mes(2-吗啉乙磺酸)50mmol,葡萄糖5g,溶于900ml蒸馏水中,终体积定容到1l,加入琼脂15g,121℃灭菌20min。
实施例1启动子序列的发现与获得
通过转录组测序和酿酒酵母异源表达鉴定左旋乙基双酮15α-羟化酶基因cdna。利用pcr扩增和dna测序获得15α-羟化酶基因的基因序列(genbank:ky451031.1)。进一步以雷斯青霉的核基因组为模板,以获得的15α-羟化酶基因的基因序列设计引物,上游:5’-ctagactacgtagtatcttga-3’,下游:5’-aattcggtcaaggatagaagg-3’,通过反向pcr(inverse-pcr)扩增,获得一段长约780bp的产物片段(如图2所示),将pcr产物连接t载体,设计通用引物进行dna测序,获得诱导型启动子p800的核苷酸序列如seqidno:1所示。
实施例2启动子p800表达载体的构建
本实施例中所用重组载体为pblue-hyg,表达载体为ppzp-hyg。
构建过程所涉及引物如下:
8-l-f:ggtaccttcactttgcttggattgagcg
8-l-r:aagcttacttgagattactgaggatgatgg
prh-tt-f:aagcttatggctgtcctcaccgaattg
prh-tt-r:gaattcttgtgcggtctggagttcatg
p800-prh-tt-f:tctagagagactcaaggcgtagctccag
p800-prh-tt-r:gaattcttgtgcggtctggagttcatg
用引物(prh-tt-f/r)和引物(p800-prh-tt-f/r)通过pcr分别扩增得到prh-tt和p800-prh-tt,构建重组质粒:pblue-l-hyg-p800-prh-tt-r。
采取dna体外重组的方法构建雷斯青霉甾体15α-羟化酶的表达载体ppzp-l-hyg-p800-prh-tt-r。
构建的表达载体如图3a所示,将重组质粒分别进行酶切分析。载体ppzp大小为6.7kb,其中hyg抗性基因及其启动子大小为2.2kb,p800+prh+tt的片段是3.3kb,trpc+prh+tt的片段是2.8kb。经xhoi/xbai双酶切后,琼脂糖凝胶电泳结果(图3b)显示约10kb的载体片段和3.3kb的目的基因片段,证实表达载体构建成功,命名为ppzp-l-hyg-p800-prh-tt-r。
实施例3农杆菌的转化与培养
将构建好的表达载体(ppzp-l-hyg-p800-prh-tt-r)通过电击转化的方法转入农杆菌agl-1感受态细胞中,将验证成功的阳性单克隆转化子在lb(含卡那霉素50ug/ml)平板上划线,28℃培养72h后,放于4℃备用。
因为表达载体在农杆菌agl-1中的拷贝数较低,因此无法通过质粒提取的方法验证载体是否成功转化至农杆菌。需通过菌落pcr的方法验证载体是否成功转化至农杆菌agl-1。pcr引物为hyg-f/hyg-r。pcr结果如图4所示。
hyg-f:gtacctgtgcattctgggtaaacg
hyg-r:tgtttatcggcactttgcatcggc
实施例4农杆菌转化雷斯青霉
利用上述成功携带载体的农杆菌介导雷斯青霉(优选atcc10490)转化,将15α-羟化酶基因prh表达盒转入雷斯青霉中,通过同源重组定点整合的方式增加雷斯青霉prh基因的拷贝数,获得诱导型p800重组菌株。基因重组菌株验证见图5。
具体实验流程为:将农杆菌接种于5mllb液体培养基中,于28℃摇床200rpm培养约24h后,转接于装有50mllb液体培养基的250ml的摇瓶中,于28℃摇床200rpm培养至od600值为0.8。菌液5000rpm离心10min,弃上清。使用im培养基重悬菌体,于28℃摇床200rpm诱导培养5h。将诱导好的农杆菌与雷斯青霉孢子悬液按体积比1:1均匀混合,涂布于im平板上,25℃共培养48h。用1ml生理盐水将菌丝洗下,并用涂布器打碎涂布于cm平板上。
实施例5基因工程菌的筛选验证及其对甾体化合物转化效率的检测
随机挑选雷斯青霉阳性转化子,提取其基因组dna,用引物hyg-f/hyg-r对转化子的基因组dna进行扩增。并以雷斯青霉出发菌株(野生型)基因组作为对照。
利用实时定量pcr检测野生型、诱导型p800重组菌株的prh基因拷贝数,内参基因选用tublin基因。基因组dna定量pcr扩增结果显示:如果将野生型菌株prh基因的相对拷贝数定量为1,p800重组菌株的prh基因相对拷贝数为2.04。说明重组菌的prh基因相对拷贝数是野生菌的2倍以上,说明该启动子确实能够诱导羟化酶基因的表达(图6)。
实施例6基因工程菌对甾体化合物转化效率的检测
为了考察重组雷斯青霉菌株的左旋乙基甾烯双酮15α-羟基化活性,比较了上述野生型菌株、诱导型启动子p800基因重组菌在底物投样量为2g/l时左旋乙基甾烯双酮转化情况。
将雷斯青霉菌培养好后,首先将甾体底物左旋乙基甾烯双酮通过球磨机研磨后,使其颗粒直径在10~15μm。将甾体底物左旋乙基甾烯双酮与n,n-二甲基酰胺(dmf)以1:10体积比例充分混合加热使底物溶解,加入雷斯青霉发酵液中,摇晃均匀后放入摇床(28℃,转速180r/min)继续培养,适时取样测定转化率。
结果如图7所示。在整个发酵时间段,重组菌株所表现出的转化率都明显高于野生菌。诱导型启动子p800基因重组菌在48h左右转化率达到85%,而野生型菌株在60h左右转化率才达到75%。以上结果表明诱导型启动子p800基因重组菌株与野生型菌株相比,催化甾体化合物羟化反应转化率提高约13%,同时转化时间缩短了12h。
实施例7赭曲霉基因工程菌的构建及对甾体化合物的生物转化效果
利用本发明的启动子p800构建高效表达赭曲霉11α-羟化酶基因的工程菌株,改进提高赭曲霉生产菌(优选tccc41060)对甾体化合物环氧黄体酮、左旋乙基甾烯双酮以及雄烯二酮的生物转化效率。
诱导型启动子表达载体的构建过程如图8a所示,将重组质粒分别进行酶切分析。载体ppzp大小为6.7kb,其中hyg抗性基因及其启动子大小为2.2kb,p800+aoh+tt的片段是2.6kb。经xhoi/xbai双酶切后,琼脂糖凝胶电泳结果如图8b显示约10kb的载体片段和2.6kb的目的基因片段,证实表达载体构建成功,命名为ppzp-l-hyg-p800-aoh-tt-r。
将构建好的表达载体(ppzp-l-hyg-p800-aoh-tt-r)通过电击转化的方法转入农杆菌agl-1感受态细胞中,将验证成功的阳性单克隆转化子在lb(含卡那霉素50ug/ml)平板上划线,28℃培养72h后,放于4℃备用。
将农杆菌接种于5mllb液体培养基中,于28℃摇床200rpm培养约24h后,转接于装有50mllb液体培养基的250ml的摇瓶中,于28℃摇床200rpm培养至od600值为0.8。菌液5000rpm离心10min,弃上清。使用im培养基重悬菌体,于28℃摇床200rpm诱导培养5h。将诱导好的农杆菌与赭曲霉孢子悬液按体积比1:1均匀混合,涂布于im平板上,25℃共培养48h。用1ml生理盐水将菌丝洗下,并用涂布器打碎涂布于cm平板上。
随机挑选赭曲霉阳性转化子,菌株培养好后,首先将甾体底物左旋乙基甾烯双酮、雄烯二酮或环氧黄体酮通过球磨机研磨后,使其颗粒直径在10~15μm。将甾体底物左旋乙基甾烯双酮、雄烯二酮或环氧黄体酮分别与n,n-二甲基酰胺(dmf)以1:10体积比例充分混合加热使底物溶解,分别加入每瓶赭曲霉发酵液中,摇晃均匀后放入摇床(28℃,转速180r/min)继续培养,取样测定转化率。在投料浓度为0.2%,转化时间及转化率结果如表1所示:
表1:出发菌株与基因工程菌株在不同时间下对不同甾体底物的转化率
虽然上述已公开了本发明较佳的实施方式,但其并非用以限定本发明,任何本领域技术人员,在不脱离本发明的精神和范围内,都可做各种的改动和修饰,因此本发明的保护范围应该以权利要求书所限定的为准。
序列表
<110>天津科技大学
<120>一种诱导型启动子及其用途
<141>2018-09-28
<160>1
<170>siposequencelisting1.0
<210>1
<211>781
<212>dna
<213>人工合成()
<400>1
ctagactacgtagtatcttgacgaggttagaattaaagctcggaactatgatatccgggg60
cccacccgatttgaaattgttatcaccttattcctcgggaattattataagcatccgtta120
atatcagatcatgggccttcgatatgtcgtctactcttaccgatgtttgtattggaagcc180
ttgtcctagcccatacaatgtagaccattgatcctactattgtgagattatagccttgcg240
ctggctgaagattttcccagtagttaggtactgctaaactttggtttggtacttttcttt300
gtagtaagtactccgtacaaccttgggctttgggccacttgcattgccattggcaatgca360
tttacccttgaacgctgtctgcaagatgcaagtggatcctagacggaacaaaaactttca420
gataatttcctgttaaggtaatgatcgctgattttggctctcgttctcgcattgctcgca480
tttctcgcataatttggaccacggccattaccttccggagcttgagggttccggttaaag540
gatctggttaacttacacatagacgggtggctttctttggtcttcaattcggcttgaggc600
catccggcggtagcgcgggcccccctgattccatctccagtcgaagaaggttccgtgaat660
aaaaaatacaatcagcctgactggttaatggcttagatttcttataaatagtcggtttct720
cgaaatcccactccaaatgtggggttttatctttgcttttccttctatccttgaccgaat780
t781
- 还没有人留言评论。精彩留言会获得点赞!