肝细胞增殖相关circ_137的筛选、检测、应用和抑制肝细胞的调节物及其应用的制作方法
本发明属于生物医药技术领域,具体涉及一种与肝细胞增殖相关circ_137的筛选、检测、应用和抑制肝细胞的调节物及其应用。
背景技术:
肝脏是人体的最大内脏器官,参与蛋白质合成和许多生理活动,包括代谢、解毒和防御,并在体内稳态中起极其关键的作用。病毒、药物和毒物等因素均可损害肝脏。然而,肝脏具有其他器官无法比拟的自我修复和再生能力。因此,解码肝脏的自我修复和再生能力及机制有重要意义。
环状rna(circrna)是一类广泛存在于哺乳动物细胞中的内源性rna分子,它们首尾相接形成闭合的环状rna分子,不易被rna外切酶降解。
本申请人通过研究发现,circ_137表达水平与肝细胞增殖密切相关,而抑制其表达对肝细胞增殖具有显著影响,因此,其在与肝病治疗中具有重要的应用。
技术实现要素:
有鉴于此,发明的目的是提供一种肝细胞增殖相关circ_137的筛选、检测、应用和抑制肝细胞的调节物及其应用,解决了现有技术中存在的不足。
发明的目的是通过以下技术方案来实现:
本发明的一个目的为提供一种与肝再生相关circrna的筛选方法,该筛选方法即为本发明的一个发明点。所述circ-rna为circ_137,其序列如seqidno.1所示,该circrna的筛选方法为:构建大鼠肝再生模型,从肝再生模型中提取总rna,然后通过筛选得到如seqidno.1(即序列表中的第一个序列)所示的circrna。
进一步地,所述筛选为筛选出再生肝中与细胞增殖相关circrna,筛选满足以下4个条件的circrna,(1)根据差异表达基因分析结果中的差异倍数(fold-change)值和p值,筛选出p<0.05和差异倍数在2倍以上的circrna;(2)优先选择发挥mirna海绵作用的外显子类circrna;(3)circrna表达量的显著性,以可代表circrna表达量的fpkm值为依据,筛选出fpkm值大于1的circrna;(4)circrna序列中的mirna结合位点数目分布情况,结合位点数目为1~3个,优选2个。
本发明的另一个目的为提供一种所述circ_137的检测方法,该检测方法尤其是引物序列的使用为本发明的另一个发明点。所述检测方法为采用实时荧光定量pcr检测,实时荧光定量pcr中的引物包括circ_137上游引物和circ_137下游引物,所述circ_137上游引物和circ_137下游引物分别为seqidno.2和seqidno.3。优选地,所述实时荧光定量pcr中还包括内参上游引物和内参下游引物,所述内参上游引物和内参下游引物分别如seqidno.4和seqidno.5所示。
本发明的又一个目的为提供一种能够调节肝细胞增殖的作用靶点,该调节肝细胞增殖的作用靶点的确定为本发明的又一个发明点。所述靶点为所述的circrna,该circrna的碱基序列如seqidno.1所示。
进一步地,所述circrna的干涉分子为抑制rna,抑制rna能够通过干涉circrna的表达儿抑制肝细胞的增值,该抑制rna的碱基序列如seqidno.7或seqidno.8所示。
本发明的再一个目的为提供一种能够抑制肝细胞增殖的调节物,该调节物的选择为本发明的再一个发明点。所述调节物包括能够与circrna相互作用并通过干涉circrna表达实现抑制肝细胞增殖的抑制rna;该circrna为如权利要求1所述的circ_137,该抑制rna的碱基序列如seqidno.7或seqidno.8所示。
优选地,抑制rna的碱基序列优选如seqidno.8所示的序列。
本发明还有一个目的为提供一种抑制肝细胞增殖的方法,所述方法为通过加入上述的抑制rna来干涉circ_137,最终实现抑制肝细胞增殖的目的;该方法也是本发明的一个发明点。
本发明最后一个目的为提供一种肝细胞的调节物在制备治疗抗肿瘤药物中的应用,将所述抑制rna与所述circrna作用并以此实现抑制肝细胞增值,从而实现获得抗肿瘤的药物为本发明的最后一个发明点。所述调节物包括上述的能够与所述的circrna进行作用并抑制circrna表达水平;所述抑制rna能够抑制细胞增殖从而能够作为抑制肿瘤的增长或转移的抗癌药物;所述肿瘤包括肝脏肿瘤。
发明提供了一种肝细胞增殖相关circ_137的筛选、检测、应用和抑制肝细胞的调节物及其应用,其至少具有以下有益效果:
本发明通过特定的方法成功筛选出再生肝的细胞增殖相关circrna分子,其可作为调节肝细胞增殖的靶点;本发明还研究设计出能够与所述circrna作用并抑制其表达的rna干涉分子,即抑制rna,该抑制rna具有较强的特异性,其基本只对circ_137起作用,不影响肝脏细胞中其它分子的正常运作,该与circ_137相互作用的rna干涉分子能够作为抑制肝细胞增殖的药物,并能进一步制成抑制肝癌的药物,该抑制rna与circrna相互作用后,能够有效抑制肝细胞的增殖情况,意义重大。总之,发明内容中所记载的内容为本申请的主要发明点。上述的调节物可应用于肝癌的临床早期诊断、预后判断或靶向治疗,并有利于进一步阐明肝再生及肝癌发生发展机理、信号通路等,有利于为开发相关药物提供高效的、大通量的筛选和评价平台及手段,将大大促进circrna在肿瘤预防、诊断和治疗中的应用。
附图说明
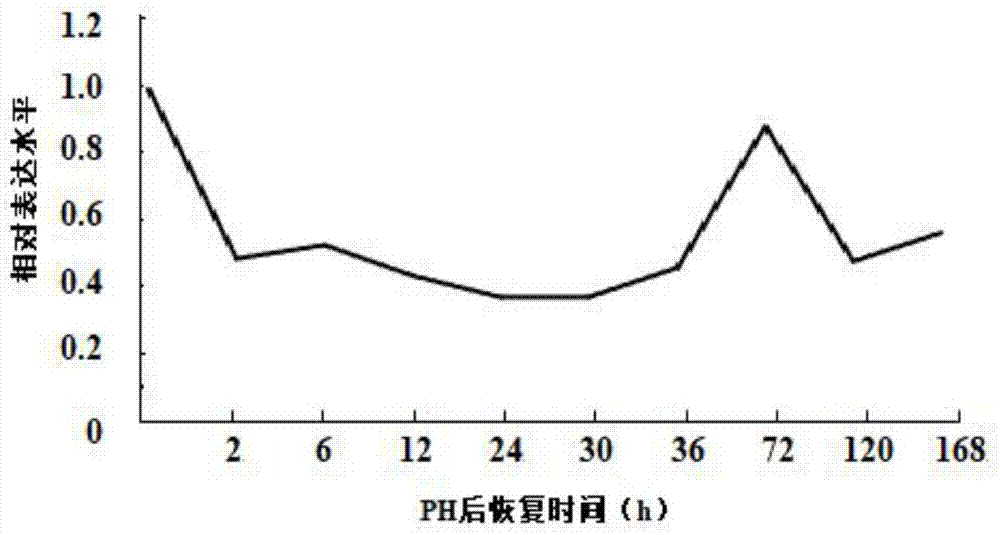
图1为用qrt-pcr技术检测的circ_137在大鼠肝再生中的表达情况;
图2为用qrt-pcr技术检测的circ_137的干涉分子在brl-3a细胞中的抑制效率;
图3为用mtt法检测的circ_137的干涉分子对brl-3a细胞活性的影响;
图4为用流式细胞术检测的对照组中对brl-3a细胞周期的影响;
图5为用流式细胞术检测的circ_137的干涉分子对brl-3a细胞周期的影响;
图6为细胞周期分布统计分析结果。
具体实施方式
下面对发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是发明一部分实施例,而不是全部的实施例。以下提供的发明的实施例的详细描述并非旨在限制要求保护的发明的范围,而是仅仅表示发明的选定实施例。基于发明中的实施例,本领域普通方法人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于发明保护的范围。
实施例1:大鼠肝再生模型制备与取材
实验用大鼠为成年健康雄性sprague-dawley(sd)大鼠,体重230±20g,由河南师范大学实验动物中心提供。取60只成年健康雄性sd大鼠,随机分为10组,每组6只。其中1组用作正常对照,其余9组用于2/3肝切除手术(paritalhepatectomy,ph)。根据higgins等建立的方法制备肝再生模型。具体操作方法为:用乙醚麻醉大鼠,用75%酒精对其腹部进行消毒处理,无菌条件下,距剑突下方约2cm处沿腹中线剪开腹壁至剑突处,然后挤出肝脏的左叶和中叶(约为肝脏总重的2/3)并切除,用手术线缝合切口,并撒上适量磺胺颗粒以防感染。术后12h内大鼠禁食、禁水。于手术后0、2、6、12、24、30、36、72、120和168h时分别收集肝右叶,用液氮将其速冻,存放在-80℃低温冰箱备用。本实验严格遵循中国《实验动物福利伦理指南》。
实施例2:总rna的提取
取适量实施例1中各个时间段下存于-80℃的大鼠肝组织样本,迅速放到液氮预冷的研钵中,在液氮浴的条件下尽快研磨肝组织成粉末状。然后,将样品粉末转移到含trizol的离心管内,剧烈震荡,彻底裂解组织。接着按trizol试剂盒说明书分别提取各个时间段下大鼠肝组织样本中的总rna,于-80℃保存。
实施例3:rna定量与纯度分析
手术后0、2和6h的肝样品送去上海欧易生物医学科技有限公司,用trizol法提取总rna,用紫外分光光度计检测rna浓度。rna样品的od260/od280值在1.8-2.2之间,od260/od230值在2.0-2.4之间,且变性琼脂糖凝胶电泳未检测到rna降解。circrna的定性和定量分析由上海欧易生物医学科技有限公司进行,用fpkm法计算circrna表达量。
实施例4:大鼠肝再生中关键circrna的筛选
从总rna中筛选目的circrna,即大鼠肝再生中起关键作用的circrna筛选标准如下:(1)根据差异表达基因分析结果中的fold-change值和p值,筛选出p<0.05和差异倍数在2倍以上的circrna;(2)优先选择发挥mirna海绵作用的外显子类circrna;(3)circrna的表达量的显著性,在肝再生中表达量相对较高的circrna可能发挥更重要的生物学功能,因此以可代表circrna表达量的fpkm值为依据,筛选出fpkm值大于1的circrna;(4)circrna序列中的mirna结合位点分布情况,通常筛选含有1-3个的结合位点数目,优选2个。综合这4条标准,筛选出了在大鼠肝再生中起关键作用的circrna(表1)。
表1大鼠肝再生的4种关键circrna
实施例5:实时荧光定量pcr(qrt-pcr)检测
为验证circ_137测序结果的可靠性,用qrt-pcr检测circ-137在大鼠肝切除后不同时间点的表达变化。
设计内参引物和特异性circ_137引物,其中,circ_137引物包括circ_137上游引物(如seqidno.2所示)和circ_137下游引物(如seqidno.3所示),内参引物包括gapdh上游引物(如seqidno.4所示)和gapdh下游引物(如seqidno.5所示),具体的碱基序列如表2所示。
表2qrt-pcr引物的碱基序列
用trizol法提取总rna,经紫外、琼脂糖电泳检测rna质量后,根据amv反转录试剂盒操作说明进行反转录,合成cdna链。qrt-pcr体系中模板量为1μl、引物量均为0.5μl、染料sybrgreeni量为1μl。扩增条件为:95℃1min;95℃30s、60℃30s、72℃30s,40个循环。每个样品重复检测三次,所得数据用2-δδct法作相对定量处理。
通过上述定量处理,得到大鼠肝切除后不同时间点的表达变化,即手术后0、2、6、12、24、30、36、72、120和168h时分别收集的肝右叶中circ_137的表达量如图1所示。
实施例6:circ_137抑制分子
研究设计能够抑制circ_137的sirna-1(如下表seqidno.7所示)和sirna-2(如下表seqidno.8所示)。同时设计对照rna序列,如下表seqidno.6所示。sirna-1和sirna-2以circ_137为靶点发挥作用。
上述序列的合成通过常规方法合成便可,合成是由上海吉玛制药技术有限公司合成。具体序列如表3所示。
表3circ_137的抑制分子及对照碱基序列
实施例7:大鼠肝细胞培养
实验用大鼠正常肝细胞brl-3a购自中国科学院上海生命科学研究院细胞资源中心,培养基为含10%胎牛血清(fbs)的dmem高糖培养基,细胞培养于37℃、饱和湿度、5%co2的培养箱里。
实施例8:抑制效率检测
用脂质体
实施例9:mtt法检测肝细胞活性
取对数生长期的brl-3a细胞,用胰酶(0.25%,invitrogen,usa)消化并收集细胞后,按每孔5×103个细胞接种于96孔板中,待细胞汇合度达到50%-60%时,分别加入lipofectaminernaimax转染试剂与对照组(即seqidno.6)或实验组rna(即seqidno.7和seqidno.8)形成的混合体系,最终使转染试剂与rna终浓度分别为7.5μl/孔和25pmol/孔。转染6h后更换具有双抗和血清的新鲜完全培养基,于37℃、5%co2、饱和湿度下继续培养。在转染后48h时,于每孔加10μlmtt溶液(终浓度为0.5mg/ml),继续培养4h,轻轻吸掉96孔板中的上清,于每孔加入100μldmso(geneview,usa),轻轻振荡10min。待紫色结晶物彻底溶解后,置酶标仪于波长490nm处检测吸光度值。对照组和两个实验组各设置5个复孔,重复三次,所得结果与对照组对比,检测结果如图3所示,sirna-1和sirna-2组细胞活性显著低于对照组,说明干涉circ_137可抑制brl-3a细胞增殖(p<0.05),且sirna-2的抑制效率高于sirna-1。
实施例10:流式细胞术检测细胞周期
为检测sirna-2抑制circ_137对brl-3a细胞周期的影响,转染rna后,在37℃、5%co2、饱和湿度条件下培养细胞,转染48h后,进行消化细胞,完成后用完全培养基终止消化,并吹散细胞,1000rpm、4℃、离心10min,收集细胞沉淀;用4℃预冷的pbs洗沉淀,1000rpm、4℃、离心10min,弃上清,重复三次;在沉淀中先加入300μlpbs重悬沉淀,然后再加入700μl无水乙醇,在-20℃固定12h,然后3000rpm、4℃、离心10min,弃上清收集细胞沉淀;将沉淀用500μl预冷pbs再洗一遍,3000rpm、4℃、离心10min,弃上清收集细胞沉淀;向沉淀中加入480μl预冷的pbs和10μlrnasea(0.1mg/ml)溶液,加入10μl的碘化丙啶溶液(50μg/ml)染色液避光孵育15min后,将细胞悬液混匀,用400目筛网过滤,重悬细胞,上机检测。同时设立对照组。其中图4和5分别为对照组和sirna-2处理组流式细胞术检测细胞周期分布,图6为细胞周期分布统计分析结果,由图6可见,circ_137被抑制后,brl-3a的细胞周期进程受到显著影响(p<0.05)。
以上所述仅为发明的优选实施例,并不用于限制发明,对于本领域技术人员而言,发明可以有各种改动和变化。凡在发明的精神和原理之内所作的任何修改、等同替换、改进等,均应包含在发明的保护范围之内。
序列表
<110>河南师范大学
<120>肝细胞增殖相关circ_137的筛选、检测、应用和抑制肝细胞的调节物及其应用
<130>ey01pt011801624
<160>8
<170>siposequencelisting1.0
<210>1
<211>620
<212>dna
<213>humanartificial
<400>1
ctttctcagggaaccagctcactaggaatctacagattaagccatgggaatttagtggac60
acaggaccatgtggcttagatcttacaggataacgttttcctgtttgaccagactaaaaa120
cttacaggtcctcttggaagaaattatacagtacttcacaaacagttgacagcaaggagg180
tcaaaaccttccaggccctggctcactcatggtgggatgagcaagggaagtttgcgcctc240
ttcattctatgaatgacctacgggtgccgttcattagagacaatcttttgaaaacaagta300
ctaatcatgatccaggaaagcctttatctgggatgaagattctcgacgttggctgtggcg360
gtgggttattaactgaacctctagggagactgggagcttcagttgttggaatcgatcctg420
tggctgaaaacattaagatagcacagcaccataaatcatttgatccagtcctggataaga480
ggatacagtaccgagtgtgctccctggaggagaccttgaatgagaatgcagagtgttttg540
atgctgtcgtggcttctgaagttgtcgagcatgtgaacaaccttgaaatgttcatacagt600
gctgctatcaagtattgaaa620
<210>2
<211>20
<212>dna
<213>humanartificial
<400>2
gcgtatggcactggtagaat20
<210>3
<211>16
<212>dna
<213>humanartificial
<400>3
gtgcagggtccgaggt16
<210>4
<211>25
<212>dna
<213>humanartificial
<400>4
cacggcaagttcaacggcacagtca25
<210>5
<211>26
<212>dna
<213>humanartificial
<400>5
gtgaagacgccagtagactccacgac26
<210>6
<211>26
<212>rna
<213>humanartificial
<400>6
uucuccgaacgugucacgutt21
<210>7
<211>21
<212>rna
<213>humanartificial
<400>7
caaguauugaaacuuucuctt21
<210>8
<211>21
<212>rna
<213>humanartificial
<400>8
guauugaaacuuucucaggtt21
- 还没有人留言评论。精彩留言会获得点赞!