一种基于生物条形码的microRNA-7a电化学检测方法及应用与流程
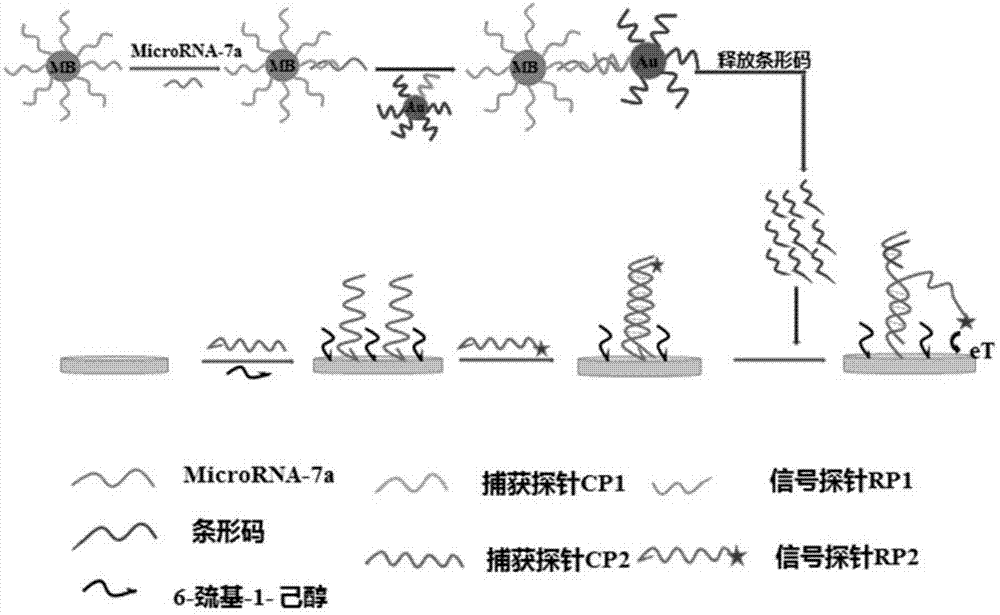
本发明涉及一种基于生物条形码的microrna-7a电化学检测方法及应用,属于分子生物学和核酸化学领域。
背景技术:
microrna(mirna)作为一种非常重要的非编码蛋白的rna,广泛存在于植物、病毒、哺乳动物当中。在细胞增殖、细胞死亡、肿瘤发生和哺乳动物细胞生长中起着重要的调节功能,mirna序列短序列相似性高,含量低,因此发展灵敏选择性好的mirna检测方法十分有必要,也为疾病的早期诊断提供新思路。
生物条形码技术(bca)以纳米颗粒为基础的扩增技术,由于经过多次信号放大,检测灵敏度非常高,其高灵敏度主要来自两个方面:(1)数以万计的条形码dna修饰于金纳米颗粒上,从而使针对每个捕获目标的检测灵敏度放大了2~4个数量级;(2)每个条形码dna均可使用核酸检测方法完成另一个信号放大。因此,随着相关技术的进一步发展,bca技术必将在人类肿瘤或其他疾病的诊断中得到广泛应用。
生物传感器是传感器的一个分支,以生物活性材料(蛋白质、抗体、核酸等)作为敏感元件与目标物分析反应,以电极作为转换装置,输出与目标物浓度相关的电信号作为检测信号,由于其具有高灵敏度和高选择性,被广泛应用到生物分析化学领域中。
技术实现要素:
本发明的目的是提供一种基于生物条形码的mirna-7a电化学检测方法及应用。
具体步骤为:
(1)纳米金合成制备:移取100ml质量百分比浓度为0.01%的氯金酸溶液倒入圆底烧瓶中,将其放置油浴锅中加热煮沸后迅速加入3ml质量百分比浓度为1%的柠檬酸钠溶液作为还原剂,继续加热15分钟,观察溶液的颜色从最初的淡黄色逐渐变成酒红色,最后停止加热冷却至室温,并且全程处于搅拌状态下进行,得浓度为5.8nmol/ml金纳米溶液;通过扫描电子显微镜表征可知纳米金的粒径为16nm。
(2)金标记识别信号探针以及条形码(au-rp1-barcode)的制备:取2.5μl浓度为10μmol/l的信号探针rp1与50μl~275μl浓度为10μmol/l的条形码混合后加入202.5μl含10mmol/l三(2-羧乙基)膦(tcep)浓度为10mmol/lph5.8~7.4的磷酸盐缓冲溶液(pbs)中活化2小时,活化完毕后加入0.5ml步骤(1)所得的浓度为5.8nmol/ml金纳米溶液,立即震荡均匀并迅速裹上锡纸避光孵育16小时;接着加入9.1μl质量百分比浓度为10%的十二烷基硫酸钠(sds)溶液,使最终质量百分比浓度为0.1%;再加入101.6μl浓度为0.1mol/lph7.4pbs溶液,使其最终浓度为10mmol/l;再加入53.5μl浓度为2mol/l的nacl溶液,使其最终浓度为0.1mol/l。在孵育24小时后使用高速离心机离心(10000转/分钟,20分钟),分散至含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液中并重复清洗3次,去掉上清液,最后分散0.5ml至含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液中,震荡均匀,放置在4℃的黑暗环境中得au-rp1-barcode溶液。
所述的信号探针rp1为巯基修饰的dna序列,其碱基序列为:5´-sh-tttttttttttttttttttaactatacaac-3´。
(3)磁珠标记捕获探针(mb-cp1)的制备:量取1mg磁珠置于离心管中,经过磁性分离,弃去上清液,然后用100μlttl缓冲溶液清洗1次,接着分散至200μlttl缓冲溶液中,然后往溶液中加入50μl浓度为10μmol/l捕获探针cp1,在室温下轻微震荡孵育15分钟,以使生物素修饰的捕获探针cp1与链霉亲和素包被的磁珠mb轻缓而充分地结合,最后使用100μltt缓冲溶液清洗2次,磁性分离,弃去上清液,分散至500μl含0.2mol/lnacl浓度为10mmol/lph7.4pbs溶液中得浓度为10mg/ml的mb-cp1溶液。
所述的捕获探针cp1为修饰生物素的dna序列,其碱基序列为:5´-ctactacctcatttttttttttttttttttt-biotin-3´。
所述ttl缓冲溶液包含100mmol/ltris-hcl、ph8.0,体积百分比浓度为的0.1%tween®20以及1mol/llicl。
所述tt缓冲溶液包含250mmol/ltris-hcl、ph8.0,体积百分比浓度为0.1%tween®20。
(4)探针杂交以及条形码释放:移取10μl步骤(2)所得浓度为5.8nmol/mlau-rp1-barcode溶液、10μl步骤(3)所得浓度为10mg/ml的mb-cp1溶液和10μl浓度范围为1fmol/l~1pmol/l的目标物,震荡混匀后置于pcr仪中在30℃下孵育45分钟,磁性分离,用10mmol/lph7.4pbs溶液(含0.1mol/lnacl、0.1%十二烷基硫酸钠)振荡清洗三次后,将收集的磁珠分散至10ul浓度为0.5mol/l的二硫苏糖醇(dtt)溶液中,在50℃下反应15分钟,再在25℃下保持45分钟,最后经过磁性分离,取上清液,得条形码,4℃冷藏备用。
(5)生物传感器的组装以及目标物检测:取4μl浓度为10umol/l捕获探针cp2与72ul浓度为10mmol/lph5.8~7.4pbs溶液混合,然后加入4ul含10mmol/l三(2-羧乙基)膦浓度为10mmol/lph5.8~7.4pbs溶液,振荡均匀,室温下活化2小时;在已经处理好的金电极表面滴加10ul活化后的捕获探针cp2,在室温下孵育反应16小时;用浓度为10mmol/lph5.8pbs溶液对金电极浸洗3次,除去未连接捕获探针cp2,然后用氮气吹干金电极表面,滴加10ul含1mmol/l巯基己醇浓度为10mmol/lph7.4pbs溶液,封闭时间为1小时;用浓度为200mmol/lph7.4pbs溶液对金电极浸洗3次,除去未连接的巯基乙醇,氮气吹干金电极表面;在金电极表面滴加10ul浓度为2.5umol/l的信号探针rp2,杂交时间为6小时;用含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液对金电极进行浸洗3次,用氮气吹干金电极表面;往金电极表面滴加10ul步骤(4)所得条形码,杂交5小时;用含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液对金电极进行浸洗3次,以除去游离的条形码,用氮气吹干金电极表面;利用三电极体系,以含0.1mol/lnacl10mmol/lph7.4pbs溶液为电解质,用差分脉冲伏安法对金电极表面的电活性物质(亚甲基蓝)进行扫描,由此间接得到不同浓度目标物的电化学信号。
所述捕获探针cp2为巯基修饰的dna序列,其碱基序列为:5´-sh-gcgagttagaccgatccccccccttcgtccagtctttt-3´;信号探针rp2为亚甲基蓝mb修饰的dna序列,其碱基序列为:5´-mb-gactggacgcccccccatcggtctaactcgc-3´。
本发明能应用于癌症标记物的检测。
本发明方法的优点如下:
1、生物条形码的引用,间接放大了检测的信号,提高了检测的灵敏度,实现了对目标物mirna-7a的超灵敏检测。
2、利用探针的特异性识别,可实现对目标物的高特异性检测。
3、制备方法比较简单,操作简单,性能稳定。
4、该方法的反应条件温和,环保绿色。
5、本发明在癌症标记物的检测中有着重要的应用价值。
附图说明
图1为本发明的原理图。
图2为本发明施例1实施例纳米金的透射电镜图
图3为本发明施例1生物传感器的组装阻抗图。
图4为本发明施例1金纳米与条形码的数量比例优化图。
图5为本发明施例2活化探针溶液的ph值优化凝胶电泳图。
图6为本发明实施例3目标物电化学响应图和线性曲线图。
具体实施方式
以下将结合说明书附图和具体实施例对本发明做详细说明。
实施例1:
(1)纳米金合成制备:移取100ml质量百分比浓度为0.01%的氯金酸溶液倒入圆底烧瓶中,将其放置油浴锅中加热煮沸后迅速加入3ml质量百分比浓度为1%的柠檬酸钠溶液作为还原剂,继续加热15分钟,观察溶液的颜色从最初的淡黄色逐渐变成酒红色,最后停止加热冷却至室温,并且全程处于搅拌状态下进行,得浓度为5.8nmol/ml金纳米溶液;通过扫描电子显微镜表征可知纳米金的粒径为16nm。
(2)金标记识别信号探针以及条形码(au-rp1-barcode)的制备:取2.5μl浓度为10μmol/l的信号探针rp1与体积分别为50μl、125μl、200μl浓度为10μmol/l的条形码混合后加入202.5μl含10mmol/l三(2-羧乙基)膦(tcep)浓度为10mmol/lph5.8的磷酸盐缓冲溶液(pbs)中活化2小时,活化完毕后加入0.5ml步骤(1)所得的浓度为5.8nmol/ml金纳米溶液,立即震荡均匀并迅速裹上锡纸避光孵育16小时;接着加入9.1μl质量百分比浓度为10%的十二烷基硫酸钠(sds)溶液,使最终质量百分比浓度为0.1%;再加入101.6μl浓度为0.1mol/lph7.4pbs溶液,使其最终浓度为10mmol/l;再加入53.5μl浓度为2mol/l的nacl溶液,使其最终浓度为0.1mol/l。在孵育24小时后使用高速离心机离心(10000转/分钟,20分钟),分散至含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液中并重复清洗3次,去掉上清液,最后分散0.5ml至含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液中,震荡均匀,放置在4℃的黑暗环境中得au-rp1-barcode溶液。
所述的信号探针rp1为巯基修饰的dna序列,其碱基序列为:5´-sh-tttttttttttttttttttaactatacaac-3´。
(3)磁珠标记捕获探针(mb-cp1)的制备:量取1mg磁珠置于离心管中,经过磁性分离,弃去上清液,然后用100μlttl缓冲溶液清洗1次,接着分散至200μlttl缓冲溶液中,然后往溶液中加入50μl浓度为10μmol/l捕获探针cp1,在室温下轻微震荡孵育15分钟,以使生物素修饰的捕获探针cp1与链霉亲和素包被的磁珠mb轻缓而充分地结合,最后使用100μltt缓冲溶液清洗2次,磁性分离,弃去上清液,分散至500μl含0.2mol/lnacl浓度为10mmol/lph7.4pbs溶液中得浓度为10mg/ml的mb-cp1溶液。
所述的捕获探针cp1为修饰生物素的dna序列,其碱基序列为:5´-ctactacctcatttttttttttttttttttt-biotin-3´;ttl缓冲溶液包含100mmol/ltris-hcl、ph8.0,体积百分比浓度为的0.1%tween®20以及1mol/llicl;tt缓冲溶液包含250mmol/ltris-hcl、ph8.0,体积百分比浓度为0.1%tween®20。
(4)探针杂交以及条形码释放:移取10μl步骤(2)中浓度为5.8nmol/mlau-rp1-barcode溶液、10μl步骤(3)中浓度为10mg/ml的mb-cp1溶液、10μl浓度为100fmol/l的目标物,震荡混匀后置于pcr仪中在30℃下孵育45分钟,磁性分离,用10mmol/lph7.4pbs溶液(含0.1mol/lnacl、0.1%sds)振荡清洗三次后,将收集的磁珠分散至10ul浓度为0.5mol/l的二硫苏糖醇(dtt)溶液中,在50℃下反应15分钟,再在25℃下保持45分钟,最后经过磁性分离,取上清液得到10ul的条形码溶液,4℃冷藏备用。
(5)生物传感器的组装以及目标物检测:取4ul浓度为10umol/l捕获探针cp2与72ul浓度为10mmol/lph5.8pbs溶液混合,然后加入4ul含10mmol/l三(2-羧乙基)膦浓度为10mmol/lph5.8pbs溶液,振荡均匀,室温下活化2小时;在已经处理好的金电极表面滴加10ul活化后的捕获探针cp2,在室温下孵育反应16小时;用浓度为10mmol/lph5.8pbs溶液对金电极浸洗3次,除去未连接捕获探针cp2,然后用氮气吹干金电极表面,滴加10ul含1mmol/l巯基己醇浓度为10mmol/lph7.4pbs溶液,封闭时间为1小时;用浓度为200mmol/lph7.4pbs溶液对金电极浸洗3次,除去未连接的巯基乙醇,氮气吹干金电极表面;在金电极表面滴加10ul浓度为2.5umol/l的信号探针rp2,杂交时间为6小时;用含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液对金电极进行浸洗3次,用氮气吹干金电极表面;往金电极表面滴加10ul步骤(4)所得条形码,杂交5小时;用含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液对金电极进行浸洗3次,以除去游离的条形码,用氮气吹干金电极表面;利用三电极体系,以含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液作为电解质,用差分脉冲伏安法对金电极表面的电活性物质(亚甲基蓝)进行扫描,由此间接得到浓度为100fmol/l目标物的电化学信号。
所述捕获探针cp2为巯基修饰的dna序列,其碱基序列为:5´-sh-gcgagttagaccgatccccccccttcgtccagtctttt-3´;信号探针rp2为亚甲基蓝mb修饰的dna序列,其碱基序列为:5´-mb-gactggacgcccccccatcggtctaactcgc-3´。
实施例2:
(1)纳米金合成制备:移取100ml质量百分比浓度为0.01%的氯金酸溶液倒入圆底烧瓶中,将其放置油浴锅中加热煮沸后迅速加入3ml质量百分比浓度为1%的柠檬酸钠溶液作为还原剂,继续加热15分钟,观察溶液的颜色从最初的淡黄色逐渐变成酒红色,最后停止加热冷却至室温,并且全程处于搅拌状态下进行,得浓度为5.8nmol/ml金纳米溶液;通过扫描电子显微镜表征可知纳米金的粒径为16nm。
(2)金标记识别信号探针以及条形码(au-rp1-barcode)的制备:取2.5μl浓度为10μmol/l的信号探针rp1与体积分别为200μl浓度为10μmol/l的条形码混合后加入202.5μl含10mmol/l三(2-羧乙基)膦(tcep)浓度为10mmol/lph为5.8、7.4的磷酸盐缓冲溶液(pbs)中活化2小时,活化完毕后加入0.5ml步骤(1)所得的浓度为5.8nmol/ml金纳米溶液,立即震荡均匀并迅速裹上锡纸避光孵育16小时;接着加入9.1μl质量百分比浓度为10%的十二烷基硫酸钠(sds)溶液,使最终质量百分比浓度为0.1%;再加入101.6μl浓度为0.1mol/lph7.4pbs溶液,使其最终浓度为10mmol/l;再加入53.5μl浓度为2mol/l的nacl溶液,使其最终浓度为0.1mol/l。在孵育24小时后使用高速离心机离心(10000转/分钟,20分钟),分散至含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液中并重复清洗3次,去掉上清液,最后分散0.5ml至含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液中,震荡均匀,放置在4℃的黑暗环境中得au-rp1-barcode溶液。
所述的信号探针rp1为巯基修饰的dna序列,其碱基序列为:5´-sh-tttttttttttttttttttaactatacaac-3´。
(3)磁珠标记捕获探针(mb-cp1)的制备:量取1mg磁珠置于离心管中,经过磁性分离,弃去上清液,然后用100μlttl缓冲溶液清洗1次,接着分散至200μlttl缓冲溶液中,然后往溶液中加入50μl浓度为10μmol/l捕获探针cp1,在室温下轻微震荡孵育15分钟,以使生物素修饰的捕获探针cp1与链霉亲和素包被的磁珠mb轻缓而充分地结合,最后使用100μltt缓冲溶液清洗2次,磁性分离,弃去上清液,分散至500μl含0.2mol/lnacl浓度为10mmol/lph7.4pbs溶液中得浓度为10mg/ml的mb-cp1溶液。
所述的捕获探针cp1为修饰生物素的dna序列,其碱基序列为:5´-ctactacctcatttttttttttttttttttt-biotin-3´;ttl缓冲溶液包含100mmol/ltris-hcl、ph8.0,体积百分比浓度为的0.1%tween®20以及1mol/llicl;tt缓冲溶液包含250mmol/ltris-hcl、ph8.0,体积百分比浓度为0.1%tween®20。
(4)探针杂交以及条形码释放:移取10μl步骤(2)中浓度为5.8nmol/mlau-rp1-barcode溶液、10μl步骤(3)中浓度为10mg/ml的mb-cp1溶液、10μl浓度为100fmol/l的目标物,震荡混匀后置于pcr仪中在30℃下孵育45分钟,磁性分离,用10mmol/lph7.4pbs溶液(含0.1mol/lnacl、0.1%sds)振荡清洗三次后,将收集的磁珠分散至10ul浓度为0.5mol/l的二硫苏糖醇(dtt)溶液中,在50℃下反应15分钟,再在25℃下保持45分钟,最后经过磁性分离,取上清液得到10ul的条形码溶液,4℃冷藏备用。
(5)生物传感器的组装以及目标物检测:取4ul浓度为10umol/l捕获探针cp2与72ul浓度为10mmol/lph5.8pbs溶液混合,然后加入4ul含10mmol/l三(2-羧乙基)膦浓度为10mmol/lph5.8pbs溶液,振荡均匀,室温下活化2小时;在已经处理好的金电极表面滴加10ul活化后的捕获探针cp2,在室温下孵育反应16小时;用浓度为10mmol/lph5.8pbs溶液对金电极浸洗3次,除去未连接捕获探针cp2,然后用氮气吹干金电极表面,滴加10ul含1mmol/l巯基己醇浓度为10mmol/lph7.4pbs溶液,封闭时间为1小时;用浓度为200mmol/lph7.4pbs溶液对金电极浸洗3次,除去未连接的巯基乙醇,氮气吹干金电极表面;在金电极表面滴加10ul浓度为2.5umol/l的信号探针rp2,杂交时间为6小时;用含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液对金电极进行浸洗3次,用氮气吹干金电极表面;往金电极表面滴加10ul步骤(4)所得条形码,杂交5小时;用含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液对金电极进行浸洗3次,以除去游离的条形码,用氮气吹干金电极表面;利用三电极体系,以含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液作为电解质,用差分脉冲伏安法对金电极表面的电活性物质(亚甲基蓝)进行扫描,由此间接得到浓度为100fmol/l目标物的电化学信号。
所述捕获探针cp2为巯基修饰的dna序列,其碱基序列为:5´-sh-gcgagttagaccgatccccccccttcgtccagtctttt-3´;信号探针rp2为亚甲基蓝mb修饰的dna序列,其碱基序列为:5´-mb-gactggacgcccccccatcggtctaactcgc-3´。
实施例3:
(1)纳米金合成制备:移取100ml质量百分比浓度为0.01%的氯金酸溶液倒入圆底烧瓶中,将其放置油浴锅中加热煮沸后迅速加入3ml质量百分比浓度为1%的柠檬酸钠溶液作为还原剂,继续加热15分钟,观察溶液的颜色从最初的淡黄色逐渐变成酒红色,最后停止加热冷却至室温,并且全程处于搅拌状态下进行,得浓度为5.8nmol/ml金纳米溶液;通过扫描电子显微镜表征可知纳米金的粒径为16nm。
(2)金标记识别信号探针以及条形码(au-rp1-barcode)的制备:取2.5μl浓度为10μmol/l的信号探针rp1与200μl浓度为10μmol/l的条形码混合后加入202.5μl含10mmol/l三(2-羧乙基)膦(tcep)浓度为10mmol/lph5.8的磷酸盐缓冲溶液(pbs)中活化2小时,活化完毕后加入0.5ml步骤(1)所得的浓度为5.8nmol/ml金纳米溶液,立即震荡均匀并迅速裹上锡纸避光孵育16小时;接着加入9.1μl质量百分比浓度为10%的十二烷基硫酸钠(sds)溶液,使最终质量百分比浓度为0.1%;再加入101.6μl浓度为0.1mol/lph7.4pbs溶液,使其最终浓度为10mmol/l;再加入53.5μl浓度为2mol/l的nacl溶液,使其最终浓度为0.1mol/l。在孵育24小时后使用高速离心机离心(10000转/分钟,20分钟),分散至含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液中并重复清洗3次,去掉上清液,最后分散0.5ml至含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液中,震荡均匀,放置在4℃的黑暗环境中得au-rp1-barcode溶液。
所述的信号探针rp1为巯基修饰的dna序列,其碱基序列为:5´-sh-tttttttttttttttttttaactatacaac-3´。
(3)磁珠标记捕获探针(mb-cp1)的制备:量取1mg磁珠置于离心管中,经过磁性分离,弃去上清液,然后用100μlttl缓冲溶液清洗1次,接着分散至200μlttl缓冲溶液中,然后往溶液中加入50μl浓度为10μmol/l捕获探针cp1,在室温下轻微震荡孵育15分钟,以使生物素修饰的捕获探针cp1与链霉亲和素包被的磁珠mb轻缓而充分地结合,最后使用100μltt缓冲溶液清洗2次,磁性分离,弃去上清液,分散至500μl含0.2mol/lnacl浓度为10mmol/lph7.4pbs溶液中得浓度为10mg/ml的mb-cp1溶液。
所述的捕获探针cp1为修饰生物素的dna序列,其碱基序列为:5´-ctactacctcatttttttttttttttttttt-biotin-3´;ttl缓冲溶液包含100mmol/ltris-hcl、ph8.0,体积百分比浓度为的0.1%tween®20以及1mol/llicl;tt缓冲溶液包含250mmol/ltris-hcl、ph8.0,体积百分比浓度为0.1%tween®20。
(4)探针杂交以及条形码释放:移取10μl步骤(2)中浓度为5.8nmol/mlau-rp1-barcode溶液、10μl步骤(3)中浓度为10mg/ml的mb-cp1溶液、10μl浓度为1fmol/l、5fmol/l、10fmol/l、50fmol/l、100fmol/l、1pmol/l的目标物,震荡混匀后置于pcr仪中在30℃下孵育45分钟,磁性分离,用10mmol/lph7.4pbs溶液(含0.1mol/lnacl、0.1%sds)振荡清洗三次后,将收集的磁珠分散至10ul浓度为0.5mol/l的二硫苏糖醇(dtt)溶液中,在50℃下反应15分钟,再在25℃下保持45分钟,最后经过磁性分离,取上清液得到10ul的条形码溶液,4℃冷藏备用。
(5)生物传感器的组装以及目标物检测:取4ul浓度为10umol/l捕获探针cp2与72ul浓度为10mmol/lph5.8pbs溶液混合,然后加入4ul含10mmol/l三(2-羧乙基)膦浓度为10mmol/lph5.8pbs溶液,振荡均匀,室温下活化2小时;在已经处理好的金电极表面滴加10ul活化后的捕获探针cp2,在室温下孵育反应16小时;用浓度为10mmol/lph5.8pbs溶液对金电极浸洗3次,除去未连接捕获探针cp2,然后用氮气吹干金电极表面,滴加10ul含1mmol/l巯基己醇浓度为10mmol/lph7.4pbs溶液,封闭时间为1小时;用浓度为200mmol/lph7.4pbs溶液对金电极浸洗3次,除去未连接的巯基乙醇,氮气吹干金电极表面;在金电极表面滴加10ul浓度为2.5umol/l的信号探针rp2,杂交时间为6小时;用含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液对金电极进行浸洗3次,用氮气吹干金电极表面;往金电极表面滴加10ul步骤(4)所得条形码,杂交5小时;用含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液对金电极进行浸洗3次,以除去游离的条形码,用氮气吹干金电极表面;利用三电极体系,以含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液作为电解质,用差分脉冲伏安法对金电极表面的电活性物质(亚甲基蓝)进行扫描,由此间接得到浓度为1fmol/l、5fmol/l、10fmol/l、50fmol/l、100fmol/l、1pfmol/l目标物的电化学信号。
所述捕获探针cp2为巯基修饰的dna序列,其碱基序列为:5´-sh-gcgagttagaccgatccccccccttcgtccagtctttt-3´;信号探针rp2为亚甲基蓝mb修饰的dna序列,其碱基序列为:5´-mb-gactggacgcccccccatcggtctaactcgc-3´。
如图1所示,磁珠标记的捕获探针与金纳米标记的信号探针以及条形码在目标物的存在下,形成“三明治”结构,加入dtt溶液释放金纳米上面的条形码,将条形码作为新的目标物加入组装完毕的传感器中进行杂交,信号探针中修饰亚甲基蓝的一端与金电极接近,产生了信号电流,从而间接定量检测了目标物的浓度。
图2为金纳米的透射电子显微镜,可以从图看出:金纳米颗粒粒径均一,分散性好,粒径大概在16nm左右。
图3为生物传感器的组装阻抗图,可以从图中看出,不同的修饰电极有不同的阻抗曲线,且呈现一定的规律,说明成功组装了生物传感器。
由图4可以看出,最佳的金纳米与条形码最佳比例为1:80。
由图5可以看出,最佳的活化探针的ph值为5.8。
由图6可以看出,峰电流信号与目标物浓度的对数有一个良好线性关系,线性回归方程式为:y=170.762+9.886logc,r2=0.9903,检测浓度的下限值为1fmol/l。
以上仅是本发明的优选实施方案,本发明的保护范围并不仅局限于上述实施例,与本发明构思无实质性差异的各种工艺方案均在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!