一种含冠醚的HBC化合物及其制备和应用的制作方法
本发明属于超分子组装材料及其制备和应用领域,特别涉及一种含冠醚的hbc化合物及其制备和应用。
背景技术:
上世纪80年代超分子化学概念的提出到现在,超分子化学经历了迅猛地发展。其中,以有机单分子组装的具有规则组装形貌的超分子材料成为研究热点,其分子设计和材料开发吸引了大量科学家的兴趣。拥有大的π-共轭结构的六苯并蔻(hexa-peri-hexabenzocoronene,hbc)衍生物受到了青睐,可以通过在芳香核上引入柔性的侧链来赋予hbc衍生物的溶解性和热学性能,对分子合成和后续的功能材料的应用至关重要。hbc衍生物由于具有大的π-共轭体系,易通过本身所拥有的极强的π-π相互堆积作用发生自组装,从而使单分子形成一维的非共价键的超分子结构,二维网状结构和三维纳米结构,这些组装的超分子结构在电化学,物理学,生物学等领域都具有广泛应用。
两亲性的hbc化合物作为一类功能化的hbc化合物由于其潜在应用前景而受到广泛的关注。
现阶段大量的手性组装材料主要通过在分子单元中引入手性中心得到,这种手性中心是不可逆的共价键连接,如日本的yashima教授通过在高分子链中引入大量的不对称手性中心以得到手性螺旋组装体。但是这种通过共价键引入手性中心的策略,需要进行大量的不对称合成和在组装过程中对其手性进行精准的控制,存在着很大的困难,并且大大降低了效率,我们希望通过非共价键实现这一目的。
技术实现要素:
本发明所要解决的技术问题是提供一种含冠醚的hbc化合物及其制备和应用,以克服通过共价键而实现手性材料制备的难题,我们希望通过冠醚基团的非共价键作用来实现手性材料的制备,这种非共价键键能较弱,使得本发明的手性材料还具有可逆性,大大提高了效率。
本发明的一种含冠醚的hbc(六苯并蔻)化合物,其通式为:
所述化合物为:
中的一种,其中n≥1的整数。
所述化合物的冠醚基团与金属、铵盐、氨基酸中的一种或几种络合配位。
所述金属为li、na、k、cs中的一种或几种;铵盐为季铵盐。
所述络合配位后的结构式为:
本发明的一种所述含冠醚的hbc化合物的制备方法,包括:
(1)母体部分以十二烷基溴苯为原料,通过sonogashira偶联反应,炔基氧化以及羟醛缩合反应合成取代的环戊二烯酮中间体,再利用d-a反应得到取代的六苯基苯中间体i;
(2)冠醚取代的亲水性部分通过冠醚单体与双频哪醇合二硼进行miyaura反应合成单体ii;
(3)利用中间体i与单体ii进行suzuki偶联反应得到氧化前驱体,通过三氯化铁对前驱体催化进行scholl氧化关环即可得到含冠醚的hbc化合物。
本发明提供一种所述含冠醚的hbc化合物作为自组装单元分子在功能性材料制备、开发中的应用。
本发明提供一种所述含冠醚的hbc化合物在超分子组装材料中的应用。
所述含冠醚的hbc化合物组装形貌对溶剂具有响应性,用于超分子组装材料形貌研究。
本发明提供一种所述含冠醚的hbc化合物在制备手性超分子组装材料中的应用。
所述通过手性客体分子对组装形貌进行诱导制备手性超分子组装材料。
本发明提供一种所述含冠醚的hbc化合物与金属的配位络合在制备不同功能的复合功能材料中的应用。
有益效果
(1)本发明提供了一系列新型含冠醚的hbc化合物合成方法,具备原料合成方法简单,制备工艺成熟等优点;
(2)本发明可作为优良的自组装单元分子应用到新型功能材料开发中;
(3)本发明可通过自身所含冠醚基团与不同金属离子配位,而呈现不同的荧光光谱,用于探针材料研究;
(4)本发明通过与手性氨基酸的可逆的非共价键相互作用,而对手性氨基酸具有刺激响应性,制备具有不同手性的纳米材料,在得到手性材料后,可以通过透析等手段除去手性小分子,可得到外围包围有冠醚结构的手性纳米组装体,用于手性氨基酸的检测,分离等材料,并可循环利用;
(5)本发明中含冠醚基团的hbc化合物,具有良好的溶解性,分子结构具有大的共轭体系,这类化合物可以通过π-π堆积自组装构筑一维、二维和三维超分子结构,并且可以通过分子中冠醚基团与金属离子、铵基离子、氨基酸等基团的配位络合能力,可以广泛的应用于响应性超分子材料、光电材料、手性记忆材料、探针材料等领域,这类含冠醚的hbc化合物可以作为优良的自组装单元分子应用到新型功能超分子材料开发中。
附图说明
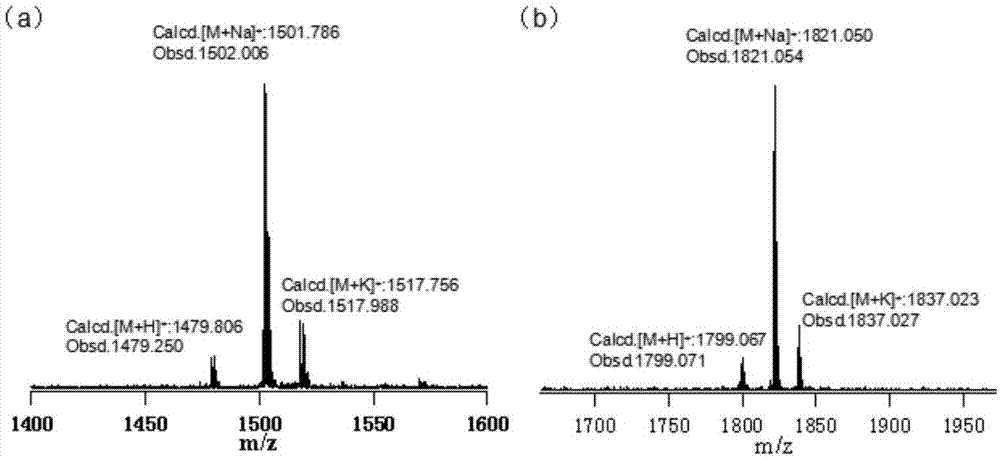
图1为实施例7化合物1和实施例14化合物2的maldi-tofmass图;其中(a)化合物1的maldi–tof–ms图;(b)化合物2的maldi–tof–ms图;
图2为实施例8中化合物1与不同手性氨基酸共组装时的sem(a,c)和tem(b,d)图;其中(a)化合物1与l-氨基酸共组装的高分辨扫描电镜图(四氢呋喃:甲醇=1:1);(b)化合物1与l-氨基酸共组装的高分辨透射电镜图(四氢呋喃:甲醇=1:1);(c)化合物1与d-氨基酸共组装的高分辨扫描电镜图(四氢呋喃:甲醇=1:1);(d)化合物1与d-氨基酸共组装的高分辨透射电镜图(四氢呋喃:甲醇=1:1);
图3为实施例8中化合物1与不同手性氨基酸共组装时的圆二色谱图(a)和圆二色谱随加入不同量氨基酸变化图(b);
图4为实施例14中化合物2组装前后紫外吸收光谱图(a)和组装过程紫外吸收光谱变化图(b)。
具体实施方式:
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
化合物4的合成
向50ml两口瓶瓶中依次加入3(400mg,1.03mmol),双频哪醇合二硼(313mg,1.23mmol),pdcl2(dppf)(75mg,0.103mmol,10%),koac(221mg,2.25mmol,3eq.),ar气保护下抽换气三次,加入无水dmf(冷冻除氧)(20ml),加热至80℃,反应3小时,停止反应。冷至室温后,ch2cl2萃取(50ml×3),合并有机相,蒸馏水洗(50ml×3),无水硫酸镁干燥有机相,过滤除去硫酸镁,旋蒸蒸除溶剂,剩余物用硅胶层析柱提纯(洗脱剂:二氯甲烷:甲醇=20:1),得浅黄色油状物:200.41mg,产率61%。1hnmr(600mhz,cdcl3)δ(ppm)7.08(d,j=7.1hz,2h),6.93(d,j=8.4hz,1h),4.23(d,j=20.9hz,4h),3.98(s,4h),3.81(s,4h),3.75(s,4h),3.72(s,4h),1.27(s,12h).13cnmr(150mhz,cdcl3):δ(ppm)148.99,148.22,134.54,119.72,114.23,113.16,70.83,70.82,70.78,70.75,69.71,69.69,69.23,69.12,29.71.maldi–tof–ms:calcd.forc22h35bo8[m+na]+:m/z=461.23;found:461.38.
实施例2
化合物6的合成
在250ml两口瓶中加入化合物5(5g,15.36mmol),碘化亚铜(0.293g,1.54mmol),pdcl2(pph3)2(0.66g,0.9mmol),ar保护下,抽换气三次,加入dbu(14.24ml),苯(20ml),三甲基乙炔基硅(tmsa,1.1ml)和h2o(60μl),加热至80℃,反应24小时后停止反应冷却至室温。ch2cl2取三次(30ml×3),合并有机相,该有机相用10%hcl洗,再用饱和nacl洗,旋转蒸发掉大部分溶剂,加入适量硅胶干法柱层析分离,(洗脱剂:石油醚),得无色透明液体2.1g,产率65%。1hnmr(600mhz,cdcl3):δ(ppm)7.45(d,j=7.3hz,4h),7.17(d,j=7.2hz,4h),2.62(d,j=6.6hz,4h),1.62(s,4h),1.30(d,j=17.1hz,36h),0.90(d,j=6.5hz,6h)。13cnmr(150mhz,cdcl3):δ(ppm)143.6,131.8,128.8,121.0,89.3,36.3,36.2,31.6,30.0,29.8,29.8,29.7,29.6,23.1,14.5。maldi–tof–ms:calcd.forc38h58[m+h]+:m/z=514.88;found:515.01。
实施例3
化合物7的合成
向500ml两口烧瓶中加入6(2.46g,4.79mmol),ruo2(14mg),按比例加入ch3cn/ccl4/h2o=14ml/14ml/21ml,在25℃下搅拌2.5小时,蒸馏除去溶剂,用ch2cl2萃取(50ml×3),合并有机相,无水硫酸镁干燥有机相,过滤除去硫酸镁,旋蒸蒸除溶剂,剩余物用硅胶层析柱提纯,(洗脱剂:石油醚:二氯甲烷=3:1),得淡黄色固体1.6g,产率85%。1hnmr(600mhz,cdcl3):δ(ppm)7.91(d,j=7.9hz,4h),7.33(d,j=8.0hz,4h),2.70(t,j=7.7hz,4h),1.65(m,4h),1.30(d,j=18.0hz,36h),0.90(t,j=6.6hz,6h)。13cnmr(150mhz,cdcl3):δ(ppm)194.8,151.2,131.2,128.8,129.3,36.5,32.2,31.3,29.9,29.8,29.7,29.6,29.5,23.0,14.4。maldi–tof–ms:calcd.forc38h58o2[m+h]+:m/z=546.88;found:546.98。
实施例4
化合物8的合成
向50ml的圆底烧瓶中加入化合物7(300mg,0.55mmol)和1,3-二苯基丙酮(128mg,0.6mmol),ar保护下,抽换气三次后,加入1,4-二氧六环15ml,回流后加入1.0m四丁基氢氧化铵的甲醇溶液(0.8ml),反应6min后,加水淬灭反应,蒸馏除去溶剂,用ch2cl2萃取(50ml×3),合并有机相,无水硫酸镁干燥有机相,过滤除去硫酸镁,旋蒸蒸除溶剂,剩余物用硅胶层析柱提纯(洗脱剂:石油醚:二氯甲烷=4:1),得红褐色固体260mg,产率66%。1hnmr(600mhz,cdcl3):δ(ppm)7.26-7.20(m,10h),6.97(d,j=8.0hz,4h),6.81(d,j=8.0hz,4h),2.56(t,j=8.0hz,4h),1.61-1.53(m,4h),1.32-1.27(m,36h),0.89(t,j=7.0hz,6h).13cnmr(125mhz,cdcl3):δ(ppm)154.59,143.32,131.00,130.22,130.04,129.26,127.84,127.79,127.14,124.79,35.80,32.00,31.66,31.10,29.79,29.74,29.57,29.45,29.26,22.78,22.74,14.22。maldi–tof–ms:calcd.forc53h68o[m+h]+:m/z=721.11;found:720.00。
实施例5
化合物9的合成
向50ml的schlenk瓶中加入化合物8(300mg,0.42mmol)和二(4-溴苯基)乙炔(140mg,0.42mmol),ar保护下,抽换气三次后,加入二苯醚1.5ml,回流反应16h,冷却后硅胶层析柱提纯,(洗脱剂:石油醚:二氯甲烷=6:1),得白色固体380mg,产率88%。1hnmr(600mhz,cdcl3):δ(ppm)7.00(d,j=8.0hz,4h),6.85-6.84(m,6h),6.77-6.75(m,4h),6.67-6.59(m,12h),2.32(t,j=7.5hz,4h),1.41-1.33(m,4h),1.30-1.18(m,32h),1.06(br.,4h),0.86(t,j=7.0hz,6h).13cnmr(150mhz,cdcl3):δ(ppm)141.1,140.3,140.2,139.4,138.4,137.4,132.9,131.2,131.0,129.9,126.7,126.6,125.2,119.5,35.3,32.0,31.2,29.8,29.7,29.6,29.4,28.9,22.8,14.2。maldi–tof–ms:calcd.forc66h76br2[m+h]+:m/z=1029.12;found:1028.07.
实施例6
化合物10的合成
向100ml两口烧瓶中加入9(100mg,0.097mmol,1eq.),5(128mg,0.292mmol,3eq.),2mk2co3(冷冻除氧)(0.8ml,10eq.),ar气保护下,加入thf(20ml),回流48h,停止反应。旋蒸除去thf,用ch2cl2萃取(50ml×3),合并有机相,蒸馏水洗(50ml×3),无水硫酸镁干燥,过滤除去硫酸镁,旋转蒸蒸除溶剂,剩余物用氧化铝层析柱提纯(洗脱剂:三氯甲烷:甲醇=30:1),得浅黄色固体97mg,产率62%。1hnmr(600mhz,cdcl3,):δ(ppm)7.09(d,j=8.3hz,4h),6.99(d,j=8.3hz,4h),6.91-6.84(m,16h),6.71(d,j=8.1hz,4h),6.66(d,j=8.1hz,4h),4.18-4.12(m,8h),3.94-3.89(m,8h),3.79-3.76(m,8h),3.74-3.72(m,8h),3.69(s,8h),2.37(t,j=7.4hz,4h),1.41(m,4h),1.31-1.22(m,32h),1.12(m,4h),0.90(t,j=7.0hz,6h).13cnmr(150mhz,cdcl3):δ(ppm)149.00,148.28,140.84,140.75,140.45,139.70,139.51,139.33,137.90,136.98,134.35,131.92,131.54,131.26,126.60,125.05,124.78,119.62,114.3,112.9,70.82,70.81,70.75,69.67,69.66,69.19,35.32,31.95,31.18,29.75,29.70,29.69,29.54,29.40,28.81,22.71,14.14。maldi–tof–ms:calcd.forc98h122o12[m+na]+:m/z=1514.89;found:1515.40。
实施例7
化合物1的合成
向250ml两口瓶中加入化合物10(80mg,0.05mmol),抽换气三次后,在ar鼓泡状态下加入新蒸二氯甲烷100ml,10分钟后加入三氯化铁(265mg,1.61mmol)的硝基甲烷溶液(1.5ml),室温下反应1小时后,加入大量甲醇淬灭反应,此时有大量黄色沉淀析出,抽滤除去滤液,沉淀用氧化铝柱层析提纯(洗脱剂:三氯甲烷:甲醇=20:1),得金黄色固体52mg,产率65%。1hnmr(600mhz,cdcl3):δ(ppm)8.30(s,2h),8.17(s,2h),8.00(s,2h),7.90(d,j=8.0hz,2h),7.70(s,4h),7.36(s,2h),7.25-7.15(m,4h),7.07(d,j=8.0hz,2h),4.39(m,8h),4.12(s,8h),3.94(s,8h),3.87(s,8h),3.82(s,8h),2.66(t,j=7.4hz,4h),1.74(t,j=7.4hz,4h),1.48-1.22(m,36h),0.90(t,j=7.0hz,6h).maldi–tof–ms:calcd.forc98h110o12[m+h]+:m/z=1479.81,found:1479.25;calcd.forc98h110o12[m+na]+:m/z=1501.79,found:1502.01;calcd.forc98h110o12[m+k]+:m/z=1517.76;found:1517.99。
实施例8
化合物1和氨基酸络合物的合成
向5ml样品瓶中加入化合物1(0.5mg),加入四氢呋喃1ml,手性氨基酸的甲醇溶液1ml,在40℃下超声2分钟,完全溶解后室温下静置2小时后。取一滴溶液滴在干净硅片上,喷金,利用场发射扫描电镜进行表征;将其溶液滴在超薄碳膜铜网上,利用场发射透射电镜进行表征;圆二色谱仪测试其溶液手性,电镜图上显示组装体为单一手性,圆二色谱图显示溶液为单一手性(图2,3),证明化合物1和手性氨基酸络合体的形成,再通过分子堆积而形成规整的手性组装体。
化合物1对手性氨基酸类化合物具有高度响应性,能够利用化合物1与不同手性的低浓度氨基酸共组装,从而将氨基酸手性放大,通过圆二色谱测试能够准确无误的判断出氨基酸的手性。并且这种手性螺旋组装体结构稳定,通过透析能够除去络合在冠醚上的氨基酸分子,透析后的螺旋组装体还能够对消旋体系的氨基酸进行手性分离,化合物1可运用在氨基酸手性的检测与分离。
实施例9
化合物12的合成
向100ml两口瓶中加入4-溴-4-甲氧基联苯(2.7g,10.12mmol),dbu(9.2g,60.43mmol),双三苯基膦二氯化钯(425mg),碘化亚铜(191mg),氩气保护下,抽换气三次,加入苯40ml,加入三甲基乙炔基硅(0.71ml),水(70ul),避光条件下加热至60℃反应24h。反应结束后,反应液冷却至室温,旋蒸除去溶剂,加入二氯甲烷分散,抽滤,残渣多次水洗,甲醇洗得到棕色粗产物,后用大量甲苯重结晶得到化合物12为白色固体(1.4g,69%)。1hnmr(600mhz,thf-d8):δ7.56(t,j=8.5hz,8h),7.50(d,j=8.5hz,4h),6.93(d,j=8.5hz,4h),3.76(s,6h).maldi-tof-ms:calcd.forc28h22o2[m+h]+:m/z=390.47;found:390.13。
实施例10
化合物14的合成
将化合物13(1.0g,2.18mmol),碳酸钾(336mg,2.4mmol)加入到50ml两口瓶中,氩气保护下抽换气三次,加入四氢呋喃20ml,加热至80℃,缓慢滴加1-氮杂-18-冠-6(574mg,518mmol)的四氢呋喃溶液(10ml),反应24h。反应结束后,将反应液冷却到室温,直接柱层析提纯(洗脱剂:二氯甲烷:甲醇=15:1),得化合物21为淡黄色液体(996mg,83%)。1hnmr(600mhz,cdcl3):δ(ppm)7.78(d,j=8.0hz,2h),7.16(d,j=8.0hz,2h),3.98-3.49(m,30h),3.05(s,6h),2.35(s,3h).13cnmr(150mhz,cdcl3):δ(ppm)143.05,139.49,128.64,126.00,71.09,70.47,70.22,70.15,70.08,69.95,69.68,64.65,55.14,50.34,46.17,43.19,21.31.maldi-tofmass:calcd.forc25h43no10s[m+k]+:m/z=588.67;found:588.89。
实施例11
化合物15的合成
向25mlschlenk管中加入化合物8(0.72g,1mmol)和12(0.39g,1mmol),氩气保护下抽换气三次,加入二苯醚2ml,沙浴回流16h。反应结束后,将反应液冷却到室温,直接柱层析进行提纯(洗脱剂:石油醚:二氯甲烷=3:1),得化合物15为淡黄色固体(0.98g,90%)。1hnmr(600mhz,cdcl3)δ7.39(d,j=7.0hz,4h),7.10(d,j=6.8hz,4h),6.88(d,j=13.4hz,18h),6.71(d,j=6.7hz,4h),6.66(d,j=6.7hz,4h),3.81(s,6h),2.37(t,4h),1.41(t,4h),1.28(m,36h),0.90(t,6h)。maldi-tof-mscalcd.forc80h90o2[m+h]+:m/z=1083.61;found:1083.65。
实施例12
化合物16的合成
向50ml两口瓶中加入化合物15(500mg,0.46mmol),氩气保护下抽换气三次,冰水浴下加入二氯甲烷20ml,加入bbr3(0.48g,1.84mmol),反应液立刻变为黑绿色,避光反应16h。反应结束后,加入饱和氯化钠淬灭反应,ch2cl2萃取三次(50ml×3),合并有机相,无水mgso4干燥,旋转除去溶剂,柱层析分离提纯(洗脱剂:二氯甲烷:乙酸乙酯=1:9),得化合物16为白色固体(445mg,92%)。1hnmr(600mhz,cdcl3)δ7.33(d,j=7.7hz,4h),7.08(d,j=7.6hz,4h),6.88(d,j=7.6hz,18h),6.71(d,j=7.6hz,4h),6.66(d,j=7.6hz,4h),2.36(t,j=7.3hz,4h),1.41(t,4h),1.25(m,36h),0.90(t,j=6.4hz,6h)。13cnmr(150mhz,cdcl3):δ(ppm)154.58,140.75,140.60,140.33,139.64,139.24,139.20,137.80,136.77,133.53,131.82,131.44,131.16,127.84,126.49,126.47,124.91,124.57,115.30,35.37,32.00,31.22,29.80,29.75,29.59,29.45,28.87,22.77,14.20。maldi-tof-mscalcd.forc78h86o2[m+h]+:m/z=1054.66;found:1054.86。
实施例13
化合物17的合成
将化合物14(260mg,0.47mmol),化合物16(200mg,0.19mmol)和碳酸钾(266mg,1.9mmol)加入到50ml两口瓶中,氩气保护下抽换气三次,加入四氢呋喃20ml,加热至80℃,反应24h。反应结束后,将反应液冷却到室温,直接柱层析提纯(洗脱剂:三氯甲烷:甲醇=10:1),得淡黄色油状物,再将油状物用gpc进行分离提纯,得到化合物17为淡黄色油状物(232mg,68%)。1hnmr(600mhz,cdcl3):δ(ppm)7.37(d,j=8.3hz,4h),7.08(d,j=8.3hz,4h),6.92-6.84(m,18h),6.70(d,j=8.3hz,4h),6.65(d,j=8.3hz,4h),4.20(m,4h),3.93(m,4h),3.76(m,4h),3.66-3.57(m,48h),2.72-2.57(m,12h),2.36(t,j=7.4hz,4h),1.43-1.39(m,4h),1.34-1.20(m,32h),1.14-1.08(m,4h),0.90(t,j=6.9hz,6h).13cnmr(150mhz,cdcl3):δ(ppm)157.73,140.89,140.79,140.42,139.68,139.49,139.35,137.83,136.70,133.52,131.93,131.57,131.28,127.72,126,61,126.58,125.01,124.62,114.81,70.00,69.95,69.69,69.26,69.08,68.41,68.30,68.18,67.67,67.31,54.97,52.98,35.31,31.94,31.17,29.74,29.69,29.68,29.53,29.39,28.81,22.70,14.13。maldi-tof-ms:calcd.forc114h156n2o16[m+k]+:m/z=1849.11;found:1849.34。
实施例14
化合物2的合成
将化合物17(93mg,0.052mmol)加入到250ml两口瓶中,氩气鼓泡状态下加入二氯甲烷120ml,15min后加入fecl3(253mg,1.56mmol)的硝基甲烷(3ml)溶液,反应液立刻变为黑色,并伴随有氯化氢气体产生,反应2h。反应结束后,加入甲醇淬灭反应,并伴随有大量黄色沉淀产生,抽滤除去滤液,固体残渣柱层析进行分离提纯(洗脱剂:热四氢呋喃),收集到产物后再通过thf/meoh进行再沉淀得到化合物2为黄色固体(46mg,52%)。1hnmr(600mhz,thf-d8,55℃):δ(ppm)8.30(s,2h),8.19(s,2h),8.02(s,2h),7.93(d,j=7.3hz,2h),7.83(s,2h),7.79(s,2h),7.62(d,j=7.3hz,4h),7.19(s,2h),7.07(d,j=7.3hz,4h),4.25(s,4h),3.93(d,j=4.7hz,4h),3.73(d,j=4.7hz,4h),3.65(d,j=5.0hz,4h),3.59-3.50(m,44h),2.78(m,12h),2.72(t,j=8.0hz,4h),1.76(m,4h),1.34-1.23(m,36h),0.80(t,j=7.0hz,6h).maldi-tof-ms:calcd.forc114h144n2o16[m+h]+:m/z=1799.07,found:1799.24;[m+na]+:m/z=1821.05,found:1821.22;[m+k]+:m/z=1837.02;found:1837.22。
- 还没有人留言评论。精彩留言会获得点赞!