一株吲哚美辛单克隆抗体杂交瘤细胞株及其应用的制作方法
本发明涉及一株吲哚美辛单克隆抗体杂交瘤细胞株及其应用,属于食品安全免疫学检测技术领域。
背景技术:
吲哚美辛(indomethacin)又称消炎痛,是一种作用较强的非皮质激素类的消炎解热和镇痛药,通过抑制环氧酶减少前列腺素(pg)合成,制止炎症组织痛觉神经冲动的形成,抑制炎性反应,包括抑制白细胞的趋化性及溶酶体酶的释放等,从而产生解热、镇痛及消炎作用。吲哚美辛的消炎、解热作用很强,其抗炎作用比保泰松强84倍,比氢化可的松也强,与糖皮质激素、阿司匹林、保泰松联合使用,可减少它们的用量、毒性及副作用,提高疗效;其次是解热作用,为氨基比林的10倍;镇痛作用较弱,只对炎性疼痛有明显镇痛作用,但对炎性疼痛的效果好于保泰松、安乃近和水杨酸类。临床主要用于对水杨酸类药物不易耐受,或疗效不明显的急、慢性风湿性或类风湿性关节炎、强直性脊柱炎、滑囊炎、腱鞘炎、关节囊炎、骨关节炎、急性痛风及癌性疼痛等。近年来研究人员尝试将吲哚美辛用于胆绞痛、痛经、偏头痛、肾小球肾炎、多尿、沙门菌性胃肠炎、体位性低血压、巴特综合症等,均有较好疗效。还可用于治疗眼科色素膜炎、角膜炎、巩膜炎、青光眼以及癌症引起的发热或其他难以控制的发热。皮肤科用于红斑狼疮、白塞综合症、硬皮病、结节性红斑、带状疱疹、关节型银屑病等。外用治疗湿疹、过敏性皮炎、光感性皮炎、局部疼痛。
吲哚美辛的不良反应的发生率相当高,常见的不良反应如下:
①恶心、呕吐、腹痛、腹泻、纳差,严重者可出现溃疡并引起出血和穿孔等。饭后即服可减少发生率。
②常见有头痛、头晕、乏力,偶有惊厥、精神错乱、晕厥等。应注意适时停药。
③皮肤瘙痒、红斑、荨麻疹以及少有的哮喘发作、呼吸困难甚至呼吸、循环的抑制。
④造血系统的抑制如粒细胞减少、再生障碍性贫血、血小板减少等。虽然罕见,但后果较为严重。
目前一方面国内外至今尚未建立吲哚美辛进出口产品质量的检测标准及其测定方法,这给吲哚美辛的生产使用和进出口贸易以及食品卫生监督与监测工作带来很大的阻碍;另一方面食品中吲哚美辛残留量的检测方法也没有国家标准。这给吲哚美辛食品添加剂生产使用和进出口贸易以及食品卫生监测工作带来很大的困难。为了维护广大消费者的利益,有必要建立一种针对吲哚美辛的高效、快速的检测方法,而酶联免疫法(elisa)前处理简单,成本低,可实现大量样品的快速检测,且检测时对样本的纯度要求不高。因此,建立高效的免疫学检测方法很有必要,而建立此方法的一个重要前提即需筛选出针对吲哚美辛的高特异性单克隆单体。
技术实现要素:
本发明的目的是提供一株吲哚美辛单克隆抗体杂交瘤细胞株及其应用,由该细胞株制备的抗体对吲哚美辛具有较好特异性和检测灵敏度,可以用来建立吲哚美辛的免疫学检测方法。
一株吲哚美辛单克隆抗体杂交瘤细胞株ss0712,保藏于中国微生物菌种保藏管理委员会普通微生物中心,简称cgmcc,保藏地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmccno.14690,分类命名为单克隆细胞株,保藏日期为2017年9月5日。
吲哚美辛单克隆抗体,其由所述保藏编号为cgmccno.14690的吲哚美辛单克隆抗体杂交瘤细胞株ss0712分泌产生。
所述吲哚美辛单克隆抗体的应用,将其应用于食品安全检测中吲哚美辛残留的分析检测。
一种试剂盒,其含有所述的吲哚美辛单克隆抗体杂交瘤细胞株ss0712或者所述的吲哚美辛单克隆抗体。
所述试剂盒用于检测吲哚美辛。
本发明提供的吲哚美辛单克隆抗体杂交瘤细胞株ss0712的制备基本步骤为:
(1)半抗原结构:
原药mol.wt:357.79
(2)完全抗原吲哚美辛-bsa的制备:称取3.2mg吲哚美辛,3mgn-羟基琥珀酰亚胺(nhs),溶解于300μln,n-二甲基甲酰胺(dmf)中,室温搅拌反应10min;再称取5.5mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc),用100μldmf充分溶解后,加入到吲哚美辛溶液中,室温搅拌反应6-8h(称为a液)。取10mgbsa(吲哚美辛与牛血清白蛋白(bsa)摩尔比为60:1),用2ml0.01m硼酸盐缓冲溶液(bb,ph=8.6)溶解(称为b液),再逐滴将a液缓慢加入到b液中,室温反应过夜;然后用0.01mpbs溶液透析,除去未反应的小分子半抗原,得到完全抗原吲哚美辛-bsa,并通过紫外吸收扫描方法进行鉴定;
(3)小鼠的免疫:将吲哚美辛完全抗原与等量弗氏佐剂混合乳化后,对balb/c小鼠进行颈背部皮下多点注射免疫(冲刺免疫除外)。首次免疫用完全弗氏佐剂,剂量为100μg/只;多次加强免疫用不完全弗氏佐剂且剂量减半即为50μg/只;冲刺免疫不用佐剂,直接用生理盐水稀释后腹腔注射,剂量再减半即为25μg/只。首次免疫与第二次加强免疫之间间隔一个月,多次加强免疫之间间隔21天,冲刺免疫与最后一次加强免疫之间间隔18-21天。通过间接竞争酶联免疫法(ic-elisa)观测小鼠免疫效果即检测小鼠血清的效价和抑制;
(4)细胞融合与细胞株建立:通过聚乙二醇(peg4000)法将小鼠脾细胞和小鼠骨髓瘤细胞进行融合,采用选择性培养基(hat培养基)筛选出杂交瘤细胞,并用ht培养基进行细胞培养。融合一周后利用ic-elisa法检测阳性细胞孔,并进一步利用ic-elisa法测定阳性细胞孔的抑制效果,通过有限稀释法对抑制较好的阳性细胞孔进行亚克隆,一周后再次检测、挑孔、亚克隆。按上述方法进行三次亚克隆后获得吲哚美辛的高分泌特异抗体的单克隆杂交瘤细胞株ss0712;
(5)杂交瘤细胞株性质的鉴定:通过ic-elisa测定灵敏度和特异性。通过紫外吸收扫描方法进行鉴定。
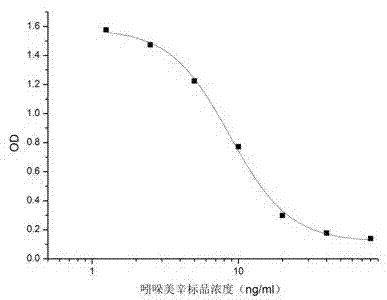
本发明的有益效果:本发明提供的细胞株ss0712分泌的单克隆抗体,对吲哚美辛具有较好的特异性和检测灵敏度(ic50值为8.7ng/ml),可实现对水果、蔬菜中吲哚美辛残留量的检测,为食品中吲哚美辛残留的免疫检测提供了原料,具有实际应用价值。
生物材料样品保藏:一株吲哚美辛单克隆抗体杂交瘤细胞株,已保藏于中国微生物菌种保藏管理委员会普通微生物中心,简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,分类命名单克隆细胞株,保藏日期2017年9月5日,保藏编号为cgmccno.14690。
附图说明
图1ss0712单克隆抗体的抑制标准曲线。
具体实施方式
本发明下面的实施例仅作为本发明内容的进一步说明,不能作为本发明的限定内容或范围。下面通过实施例对本发明作进一步说明。
本发明通过将吲哚美辛完全抗原免疫小鼠,通过细胞融合,hat选择性培养基培养,通过ic-elisa筛选细胞上清,最终得到了针对吲哚美辛具有高分泌特异性抗体的杂交瘤细胞株。
实施例1杂交瘤细胞株ss0712的制备
(1)完全抗原的合成:称取3.2mg吲哚美辛,3mgn-羟基琥珀酰亚胺(nhs),溶解于300μln,n-二甲基甲酰胺(dmf)中,室温搅拌反应10min;再称取5.5mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc),用100μldmf充分溶解后,加入到吲哚美辛溶液中,室温搅拌反应6-8h(称为a液)。取10mgbsa(吲哚美辛与牛血清白蛋白(bsa)摩尔比为60:1),用2ml0.01m硼酸盐缓冲溶液(bb,ph=8.6)溶解(称为b液),再逐滴将a液缓慢加入到b液中,室温反应过夜;然后用0.01mpbs溶液透析,除去未反应的小分子半抗原,得到完全抗原吲哚美辛-bsa,并通过紫外吸收扫描方法进行鉴定;
(2)动物免疫:将吲哚美辛完全抗原与等量弗氏佐剂混合乳化后,对balb/c小鼠进行颈背部皮下多点注射免疫(冲刺免疫除外)。首次免疫用完全弗氏佐剂,剂量为100μg/只;多次加强免疫用不完全弗氏佐剂且剂量减半即为50μg/只;冲刺免疫不用佐剂,直接用生理盐水稀释后腹腔注射,剂量再减半即为25μg/只。首次免疫与第二次加强免疫之间间隔一个月,多次加强免疫之间间隔21天,冲刺免疫与最后一次加强免疫之间间隔18-21天。通过间接竞争酶联免疫法(ic-elisa)观测小鼠免疫效果即检测小鼠血清的效价和抑制;
(3)细胞融合:在冲刺免疫三天后,按照常规peg(聚乙二醇,分子量为4000)方法进行细胞融合,具体步骤如下:
a、小鼠摘眼球取血,颈椎脱臼法处死小鼠后,立即放入75%酒精中消毒,浸泡5min左右,无菌操作取出小鼠的脾脏,用注射器胶头适度研磨并通过200目细胞筛网得到脾细胞悬液,收集,离心(1200rpm,8min),用rpmi-1640培养基洗涤脾细胞三次,最后一次离心后,将脾细胞稀释到一定体积,计数,备用;
b、收集sp2/0细胞:融合前7-10天,将sp2/0瘤细胞用含10%fbs(胎牛血清)rpmi-1640培养基在5%co2培养箱中培养。融合前要求sp2/0瘤细胞数量达到1-4×107,保证融合前sp2/0瘤细胞处于对数生长期。融合时,收集瘤细胞,悬浮于rpmi-1640基础培养液中,进行细胞计数;
c、融合过程7min:第1min,将1ml的peg4000由慢到快滴加到细胞中;第2min,静置。第3min和第4min,在1min内滴加1mlrpmi-1640培养基;第5min和第6min,在1min内滴加2mlrpmi-1640培养基;第7min,每10s滴加1ml的rpmi-1640培养基。然后37℃温浴5min。离心(800rpm,10min),弃上清,细胞轻轻敲散,并向其内加入含20%胎牛血清,2%50×hat的rpmi-1640选择性培养基(hat培养基),按照200μl/孔加到96孔细胞板,置于37℃,5%co2培养箱中培养。
(4)细胞筛选与细胞株建立:在细胞融合后的第3天用hat培养基对融合细胞进行半换液;第5天用含20%胎牛血清,1%的100×ht的rpmi-1640过渡培养液(ht培养基)进行全换液;第7天取细胞上清进行筛选。筛选分两步:第一步先用ic-elisa法筛选出阳性细胞孔,第二步选用吲哚美辛为标准品,用ic-elisa法对阳性细胞进行抑制效果测定。选择对吲哚美辛标准品有较好抑制的细胞孔,采用有限稀释法进行亚克隆,七天后用同样的方法进行检测。按上述方法进行三次亚克隆,最终获得吲哚美辛单克隆抗体细胞株ss0712。
(5)单克隆抗体的制备:取8-10周龄balb/c小鼠,每只小鼠腹腔注射无菌石蜡油1ml;7天后每只小鼠腹腔注射1×106吲哚美辛杂交瘤细胞,从第七天开始收集腹水,将腹水通过辛酸-饱和硫酸铵法进行抗体纯化。在偏酸条件下,正辛酸可以沉淀腹水中除igg免疫球蛋白外的其他杂蛋白,然后离心,弃沉淀;再用等量饱和度的硫酸铵溶液沉淀igg型的单克隆抗体,离心,弃上清,用0.01mpbs溶液(ph7.4)溶解后,透析脱盐,最终得到纯化后的单克隆抗体置于-20℃保存。
(6)单克隆抗体的鉴定:
6.1包被:将包被原吲哚美辛-ova用0.05mph9.6碳酸盐缓冲液从1µg/ml开始3倍比稀释,100μl/孔,37℃反应2h;
6.2洗涤:将板内溶液倾去,并用洗涤液洗涤3次,每次3min;
6.3封闭:拍干后,加入200μl/孔封闭液,37℃反应2h。洗涤后烘干备用;
6.4加样:将抗血清从1:1000开始倍比稀释,并加入到各稀释度的包被孔中,100μl/孔,37℃反应30min;充分洗涤后,加入1:3000稀释的hrp-羊抗鼠igg,100μl/孔,37℃反应30min;
6.5显色:将酶标板取出,充分洗涤后,每孔加入100μl的tmb显色液,37℃避光反应15min;
6.6终止和测定:每孔加入50μl终止液以终止反应,然后用酶标仪测定各孔的od450值。
用ic-elisa测定单克隆抗体吲哚美辛的ic50为:8.7ng/ml,说明对吲哚美辛有很好的灵敏度,可用于吲哚美辛免疫分析检测。
溶液的配置:
碳酸盐缓冲液(cbs):称取na2co31.59g,nahco32.93g,分别溶于少量双蒸水后混合,加双蒸水至约800ml混匀,调ph值至9.6,加双蒸水定容至1000ml,4℃贮存备用;
磷酸盐缓冲液(pbs):8.00gnacl,0.2gkcl,0.2gkh2po4,2.9gna2hpo4·12h2o,溶于800ml纯水中,用naoh或hcl调ph到7.2~7.4,定容至1000ml;
pbst:含0.05%吐温20的pbs;
tmb显色液:a液:na2hpo4.12h2o18.43g,柠檬酸9.33g,纯水定容至1000ml;b液:60mgtmb溶于100ml乙二醇中。a、b液按体积比5:1混合即为tmb显色液,现用现混。
- 还没有人留言评论。精彩留言会获得点赞!