一种双链寡核苷酸核酸探针的结构和用途的制作方法
本发明涉及一种生物检测技术工具,具体是一种双链寡核苷酸核酸探针及其使用方法和它在基因荧光定性、定量分析、医学诊断等生命科学研究中的应用,属于基因检测技术领域。
背景技术:
实时荧光pcr技术于1996年由美国appliedbiosystems公司推出,是指在pcr反应体系中加入荧光基团,利用荧光信号积累实时监测整个pcr进程,最后通过标准曲线对未知模板进行定性定量分析的方法。因其准确、快速、灵敏等特点被国际公认为传染病相关病原微生物实验室确证的最有效手段之一,近年来该技术在sars、甲流等新突发传染病的确证、常规病原体的检测中均发挥了不可替代的作用。
荧光pcr的化学原理可分为3个基本类型:dna结合染料法、淬灭染料引物法和荧光探针法。前2种方法均可检出引物二聚体等非特异反应产物,特异性不强,因此在传染病的临床诊断中应用极少。在传染病的分子诊断中一般建议采用荧光探针法。荧光探针法依赖荧光共振能量迁移(fret,fluorescentresonanceenergytransfer)实现检测,包括taqman探针、分子信标、蝎型(scorpion)探针等。该法仅检测特异性扩增产物,因此特异性强。目前应用最广泛的为taqman探针技术,该技术主要利用了taq酶的5’外切酶活性。首先合成一个能与pcr产物杂交的探针,探针的5’端标记一种荧光分子,3’标记一种相应的荧光淬灭分子,3’端淬灭分子能够吸收5’端荧光分子发出的荧光。正常情况下该探针理论上不发出荧光,但当溶液中有pcr产物时,探针与pcr产物结合,激活taq酶的5’端外切酶活性,将探针切割成单核苷酸,与此同时,标记在探针上的荧光基团游离出来,导致发出荧光,且切割的荧光分子数与pcr产物的数量成正比,因此,根据pcr反应液中荧光信号强度即可计算出初始模板的浓度。taqman探针技术尽管应用广泛,但仍存在以下主要缺点,一是线性探针的长度限制了能量转移效率,淬灭难以彻底,导致本底较高;二是探针的水解依赖taq酶的外切酶活性,定量时受酶性能及质量影响较大,酶活性差异给定量带来了较大的不确定性;三是taqman探针只标记一个荧光分子,灵敏度有待提高。
有鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于针对taqman探针技术存在的不足,提供一种新的双链寡核苷酸核酸探针结构、使用方法及其在基因荧光定性、定量分析,医学诊断和生命科学研究等领域的应用。
本发明提供了一种双链寡核苷酸核酸探针结构,由两条完全或部分碱基互补的寡核苷酸链组成,两条所述寡核苷酸链均由6-50个寡核苷酸组成,每条所述寡核苷酸链的末端连接荧光基团或对应的荧光淬灭基团,两条寡核苷酸探针链均与待测目的dna或者rna核酸序列的部分片段按碱基配对原理杂交结合。
本发明通过提供一种新的双链寡核苷酸核酸探针技术,此技术的双链探针互为彼此的荧光探针和淬灭探针,荧光基团和淬灭基团距离更近,淬灭更彻底,大大降低了荧光本底;不完全依赖外切酶活性;可标记两个或多个荧光分子,两条探针都与模板结合,提高了检测灵敏度,因此该技术在很大程度上克服了现有技术的不足,通过对探针结构的重新设计,扩大了探针本身的应用范围。
优选地,作为进一步可实施的方案,荧光或淬灭基团连接在一条链的5’或者3’末端,当一条链的5’或者3’末端标记荧光基团,与其结合的对应另一条链的3’或者5’则需标记相应的荧光淬灭基团,使淬灭基团能够最大限度的接近荧光基团;或一条链两末端都标记荧光基团,对应的另一条链两末端都标记淬灭基团。
优选地,作为进一步可实施的方案,所述荧光基团为fam、hex、tet、rox、cy3、cy5、vic、joe、sima、alexafluor488、texasred、quasar670的任一种,所述淬灭基团为tamra、dabcyl、bhq-1、bhq-2、bhq-3、mgb、eclipse的任一种。
优选地,作为进一步可实施的方案,每条链连接的荧光基团和淬灭基团的数量均为1个及以上,优选地为1个。
优选地,作为进一步可实施的方案,两条寡核苷酸链的长度相等或不等。
优选地,作为进一步可实施的方案,当两条寡核苷酸链不等长时,相对较短的一条链从相对较长的一条链的5’端、3’端以及中间开始反向互补,相对较短探针与较长探针的反向互补区域都在较长探针区域内,两条寡核苷酸链的非反向互补区域在较长探针的5’端或3’端以外,两条寡核苷酸链反向互补的长度一般为8-35个核苷酸,两条寡核苷酸链上也存在不完全反向互补的突变碱基,突变碱基的数量为1-10个之间。
优选地,作为进一步可实施的方案,当两条寡核苷酸链等长时,两条链上存在不完全反向互补的突变碱基,突变碱基的数量为1-10个之间。
优选地,作为进一步可实施的方案,用于实时荧光pcr、基因芯片以及膜杂交的核酸检测技术,以及应用于制备上述核酸检测技术的临床疾病医学诊断、病原体检测、耐药分析以及实验研究以核酸为基础的诊断与检测试剂中的应用。
本发明还提供了上述双链寡核苷酸核酸探针结构用于实时荧光pcr或者逆转录实时荧光pcr核酸检测技术中的使用方法,包括以下步骤:
根据检测目标dna或rna核酸序列,设计制备双链寡核苷酸核酸探针和对应的上、下游扩增引物;
在离心管中配制pcr扩增反应液,包括引物、双链寡核苷酸核酸探针、模板、pcr缓冲体系、镁离子或锰离子、dntps、taqdna聚合酶;
将含有pcr反应液的离心管置于热循环仪上,进行实时荧光pcr扩增反应,循环数25-50个,每个循环退火或延伸时读取荧光值;
以模板起始浓度的对数值对门槛荧光的循环数做回归分析,制作标准曲线,对待检测dna或rna进行定性或者定量分析。
本发明的基本原理如下:
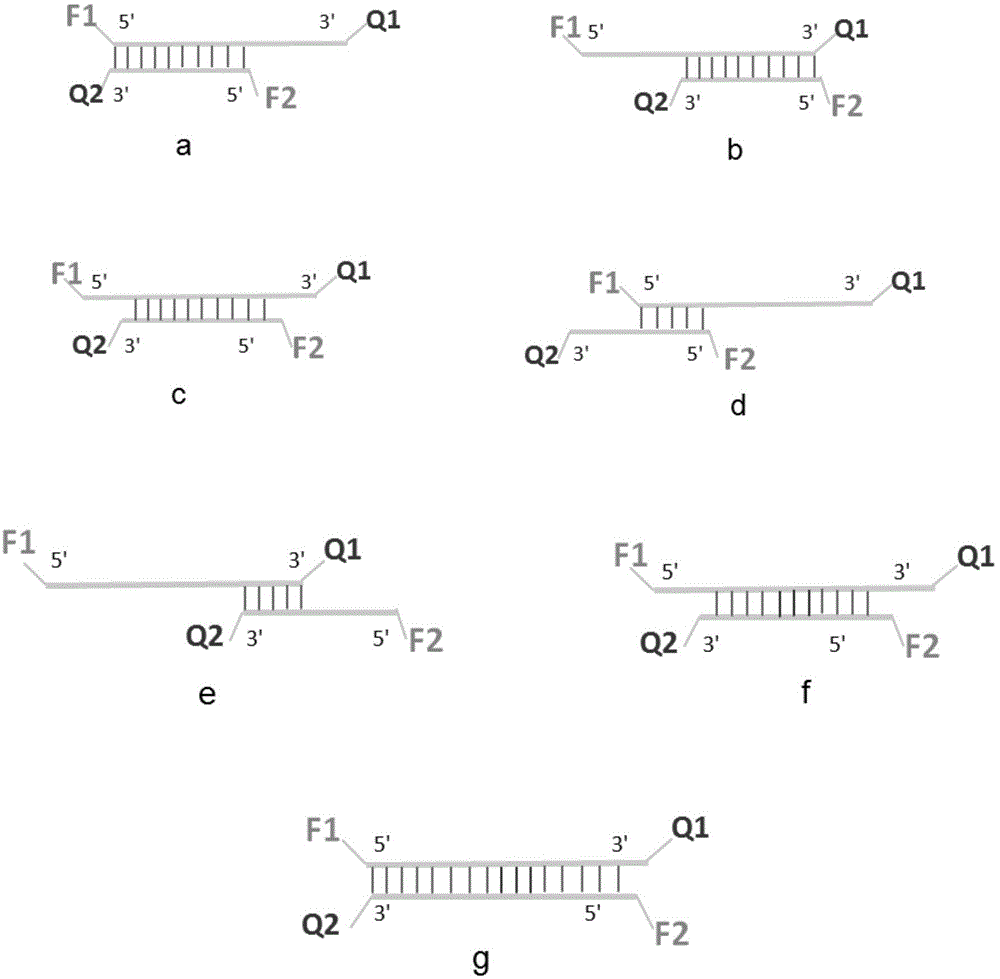
如图1所示,首先合成两条探针,两条探针均在5’端标记荧光基团作为报告分子(f1/f2),两条探针均在3’端标记与5’端相应的荧光淬灭分子(q1/q2),两条探针完全或部分碱基互补。两条探针结合时,探针发出的荧光可同时被同一链及互补链上的淬灭基团吸收,如f1可被q1和q2同时吸收,f2可被q2和q1同时吸收,溶液中没有荧光产生;两条探针分离时,探针与pcr产物结合,taq酶的5’端外切酶活性将探针切割成单核苷酸,f1和f2游离出来,发出荧光。双链探针的优势在于淬灭更彻底,荧光本底更低。基于这一构思,本发明人合成了双链寡核苷酸核酸探针,当pcr扩增体系中没有模板时,两条探针互补结合,溶液中没有荧光产生;当扩增体系中有模板时,在较高温度下两条探针都优先与模板结合,因此两条探针分离,产生荧光,荧光强度与溶液中模板浓度成正比,据此可进行模板的定量测定。
本发明的目的是这样实现的:制备双链寡核苷酸核酸探针,它由两条完全或部分碱基互补的寡核苷酸链组成,其中所述两条探针,每条寡核苷酸链的末端可以连接荧光基团或对应的荧光淬灭基团,两条寡核苷酸探针链均可与待测目的dna或者rna核酸序列的部分片段按碱基配对原理杂交结合。双链探针每条探针都由6-50个寡核苷酸组成,优选的组合中长链探针由25-30个核苷酸组成,短链探针由15-25个核苷酸组成。探针上连接的荧光分子和淬灭分子数可以是1-5个,考虑到成本及合成方便性,一般是1个。荧光基团可以是fam、hex、tet、rox、cy3、cy5、vic、joe、sima、alexafluor488、texasred、quasar670等,该条链对应的另一端连接的淬灭基团可以是tamra、dabcyl、bhq-1、bhq-2、bhq-3、mgb、eclipse等。
本发明公开了双链寡核苷酸核酸探针在基因检测中的使用方法,它包括以下步骤:
(1)制备双链寡核苷酸核酸探针;
(2)根据待检基因序列,设计并合成一对上下游引物,引物tm值应该比长链探针低,引物不与探针发生重叠又邻近探针的两端,距离探针两端1-150个核苷酸;
(3)将模板加入含有探针、引物、pcr缓冲液、镁离子或锰离子、dntps、taqdna聚合酶的反应混合物中进行常规pcr,扩增25-60个循环。作为模板的核酸长度以60-500个碱基为宜,最好是70-150个碱基。在每个循环退火或延伸时记录荧光值;
(4)以模板起始浓度的对数对门槛荧光的循环数作回归分析,制作标准曲线,对待检基因的浓度进行定量分析。门槛荧光是指2倍于本底荧光变异系数的待检基因的荧光强度。
按照上述检测步骤,本发明所述的双链寡核苷酸核酸探针可以广泛地应用于基因荧光定性、定量分析和医学诊断等基因检测领域,尤其在多基因同时检测及分型、基因高灵敏度检测中具有更大的优势。
与现有taqman技术相比,本发明所述的方法中双链探针互为彼此的荧光探针和淬灭探针,荧光基团和淬灭基团距离更近,淬灭更彻底,大大降低了荧光本底;不完全依赖外切酶活性;可标记两个或多个荧光分子,两条探针都与模板结合,提高了检测灵敏度。因此该技术在很大程度上克服了现有技术的不足。综上所述,双链寡核苷酸核酸探针技术具有较大的推广应用价值。
结合附图对本发明的具体实施方式作进一步详细说明。
附图说明
图1双链寡核苷酸核酸探针定性定量分析原理图;
a:两条寡核苷酸链不等长时,相对较短的一条链从相对较长的一条链的5’开始反向互补,相对较短探针与较长探针的反向互补区域都在较长探针区域内;
b:两条寡核苷酸链不等长时,相对较短的一条链从相对较长的一条链的3’开始反向互补,相对较短探针与较长探针的反向互补区域都在较长探针区域内;
c:两条寡核苷酸链不等长时,相对较短的一条链从相对较长的一条链的中间开始反向互补,相对较短探针与较长探针的反向互补区域都在较长探针区域内;
d:两条寡核苷酸链不等长时,相对较短的一条链可以从相对较长的一条链的5’端开始反向互补,两条寡核苷酸链的非反向互补区域在较长探针的5’端以外;
e:两条寡核苷酸链不等长时,相对较短的一条链可以从相对较长的一条链的3’端开始反向互补,两条寡核苷酸链的非反向互补区域在较长探针的3’端以外;
f:两条寡核苷酸链不等长时,两条寡核苷酸链上可以存在不完全反向互补的突变碱基,突变碱基的数量可以是1-10个;
g:两条寡核苷酸链等长时,两条链上可以存在不完全反向互补的突变碱基,突变碱基的数量可以是1-10个;
图2为探针特异性分析图;
双链寡核苷酸核酸探针和taqman探针,分别对105iu/ml乙型肝炎病毒(hbv)、105iu/ml丙型肝炎病毒(hcv)、105iu/ml甲型肝炎病毒(hav)、105pfu/ml人巨细胞病毒(cmv)、105pfu/ml单传疱疹病毒ⅰ型(hsv-1)、105pfu/ml单传疱疹病毒ⅱ型(hsv-2),及阴性对照ddh2o进行检测。“s”型曲线1为双链寡核苷酸核酸探针对105iu/ml乙型肝炎病毒检测的扩增曲线,“s”型曲线2为taqman探针对105iu/ml乙型肝炎病毒检测的扩增曲线;两组探针对105iu/ml丙型肝炎病毒(hcv)、105iu/ml甲型肝炎病毒(hav)、105pfu/ml人巨细胞病毒(cmv)、105pfu/ml单传疱疹病毒ⅰ型(hsv-1)、105pfu/ml单传疱疹病毒ⅱ型(hsv-2),及阴性对照ddh2o均无扩增,为平直线;
图3为探针本底分析图;
图中荧光值在900-1700之间的“1”组平直线为双链寡核苷酸核酸探针扩增荧光信号本底,荧光值在3500-5300之间的“2”组平直线为taqman探针扩增荧光信号本底,taqman探针扩增荧光信号本底是双链寡核苷酸核酸探针的3倍以上;
图4探针检测范围分析图;
图中曲线1-9分别是双链寡核苷酸核酸探针对109iu/ml~10iu/ml的hbv核酸定量检测标准品扩增的曲线图,曲线10-17分别是taqman探针对109iu/ml~102iu/ml的hbv核酸定量检测标准品扩增的曲线图,18为10iu/ml的hbv核酸定量检测标准品,无扩增,为平直线;
图5双链寡核苷酸核酸探针10iu/mlhbv核酸定量检测标准品检测图;
双链寡核苷酸核酸探针(p1/p2)对10iu/ml的hbv核酸定量检测标准品重复检测8次,8次均能够检出,有典型的“s”型曲线;
图6双链寡核苷酸核酸探针10iu/mlhbv核酸定量检测标准品检测图;
双链寡核苷酸核酸探针(p1/p4)对10iu/ml的hbv核酸定量检测标准品重复检测8次,8次均能够检出,有典型的“s”型曲线;
图7taqman探针10iu/mlhbv核酸定量检测标准品检测图。taqman探针对10iu/ml的hbv核酸定量检测标准品重复检测8次,均无扩增,为平直线;
图8双链寡核苷酸核酸探针样本检测图;
双链寡核苷酸核酸探针对18份已定值的hbv临床样本进行检测,18份样本均能够检出,为典型的“s”型曲线。曲线1-2样本浓度为6.31×109、5.30×109,曲线3-4样本浓度为1.65×108、2.60×108,曲线5-6样本浓度为2.77×107、2.38×107,曲线7-8样本浓度为1.50×106、1.12×106,曲线9-10样本浓度为1.50×105、1.80×105,曲线11-12样本浓度为3.17×104、5.56×104,曲线13-14样本浓度为5.26×103、3.16×103,曲线15-16样本浓度为3.14×102、1.95×102,曲线17-18样本浓度为7.10×101、4.90×101;
图9taqman探针样本检测图;
taqman探针对18份已定值的hbv临床样本进行检测,其中14份样本均能够检出,为典型的“s”型曲线。4份样本未能检出,为平直线。曲线1-2样本浓度为6.31×109、5.30×109,曲线3-4样本浓度为1.65×108、2.60×108,曲线5-6样本浓度为2.77×107、2.38×107,曲线7-8样本浓度为1.50×106、1.12×106,曲线9-10样本浓度为1.50×105、1.80×105,曲线11-12样本浓度为3.17×104、5.56×104,曲线13-14样本浓度为5.26×103、3.16×103,曲线15-16样本浓度为3.14×102、1.95×102,曲线17-18样本浓度为7.10×101、4.90×101;
图102c19*2(681g>a)基因突变型a/a样本检测图;
图中,蓝色线代表fam荧光基团标记的突变链探针,绿色线代表hex荧光基团标记的野生链探针;
图112c19*2(681g>a)基因野生型g/g样本检测图;
图中,蓝色线代表fam荧光基团标记的突变链探针,绿色线代表hex荧光基团标记的野生链探针;
图122c19*2(681g>a)基因杂合型g/a样本检测图;
图中,蓝色线代表fam荧光基团标记的突变链探针,绿色线代表hex荧光基团标记的野生链探针。
具体实施方式
为进一步说明双链寡核苷酸核酸探针技术及应用,参照下列实施例进行说明,下列实施例旨在举例说明而不是以任何方式限制本发明。
实施例1乙型肝炎病毒双链寡核苷酸核酸探针检测
1.hbv检测引物探针设计
根据双链寡核苷酸核酸探针定性定量分析原理,依照待测靶分子hbv的dna序列,设计合成引物f、r,长链寡核苷酸探针p1,短链寡核苷酸探针p2,taqman探针p3,含突变碱基寡核苷酸探针p4,引物及探针序列见表1。
表1引物及探针序列
(1)引物
上游引物f,共21个核苷酸,与长链寡核苷酸探针相距17个核苷酸,与短链寡核苷酸探针相距22个核苷酸。
下游引物r,共21个核苷酸,与长链寡核苷酸探针相距27个核苷酸,与短链寡核苷酸探针相距32个核苷酸。
(2)探针
长链寡核苷酸探针p1与靶序列负链互补,由27个核苷酸组成,其中5′端带一荧光素分子,3′端带一淬灭分子;短链寡核苷酸探针p2与靶序列正链互补,由17个核苷酸组成,其中5′端带一荧光素分子,3′端带一淬灭分子,位置上距探针p15个碱基,且较p1短10个碱基;taqman探针p3与靶序列负链互补,由25个核苷酸组成,其中5′端带一荧光素分子,3′端带一淬灭分子;含突变碱基探针p4与靶序列正链存在不完全反向互补的突变碱基;由27个核苷酸组成,其中5′端带一荧光素分子,3′端带一淬灭分子。
2.pcr检测
(1)双链寡核苷酸核酸探针pcr检测
配制pcr反应体系,包括:10×pcr缓冲液4μl,dntps0.2mmol/l,上、下游引物各0.55μmol/l,taqdna聚合酶2.5u,长链寡核苷酸探针0.275μmol/l,短链寡核苷酸探针0.330μmol/l,以及经核酸提取试剂盒提取的hbv模板20μl,总反应体积为40μl;
反应条件:50℃,2min;94℃,2min;94℃,15s,55℃,45s,共45个循环,退火时采集荧光。
(2)双链寡核苷酸核酸不完全反向互补探针荧光pcr检测
配制pcr反应体系,包括:10×pcr缓冲液4μl,dntps0.2mmol/l,上、下游引物各0.55μmol/l,taqdna聚合酶2.5u,长链寡核苷酸探针0.275μmol/l,不完全反向互补寡核苷酸探针0.330μmol/l,以及经核酸提取试剂盒提取的hbv模板20μl,总反应体积为40μl;
反应条件:50℃,2min;94℃,2min;94℃,15s,55℃,45s,共45个循环,退火时采集荧光。
(3)taqman探针荧光pcr检测
配制pcr反应体系包括:10×pcr缓冲液4μl,dntps0.2mmol/l,上、下游引物各0.55μmol/l,taqdna聚合酶2.5u,taqman探针0.275μmol/l,以及经核酸提取试剂盒提取的hbv模板20μl,总反应体系为40μl;
反应条件:50℃,2min;94℃,2min;94℃,15s,55℃,45s,共45个循环,退火时采集荧光。
3.双链寡核苷酸核酸探针的特异性
引物为f与r,探针分别为双链寡核苷酸核酸探针(p1/p2)和taqman探针(p3),模板分别为105iu/ml乙型肝炎病毒(hbv)、105iu/ml丙型肝炎病毒(hcv)、105iu/ml甲型肝炎病毒(hav)、105iu/ml人巨细胞病毒(cmv)、105iu/ml单传疱疹病毒ⅰ型(hsv-1)、单传疱疹病毒ⅱ型(hsv-2),ddh2o为阴性对照,按照步骤2中操作进行pcr检测。
实验结果如图2所示,1-2分别代表双链寡核苷酸核酸探针(p1/p2)与taqman探针检测105iu/mlhbv样本,二者荧光强度均随循环数增加而变化,但hcv、hav、cmv、hsv-1、hsv-2及阴性对照样本,两类探针的荧光强度均未随循环数的增加而变化,结果全部为阴性。由此证明双链寡核苷酸核酸探针与taqman探针都具有良好的特异性。
4.双链寡核苷酸核酸探针淬灭效率
引物为f与r,探针分别为双链寡核苷酸核酸探针(p1/p2)和taqman探针(p3),ddh2o为模板,按照步骤2中操作扩增15个循环,检测双链寡核苷酸核酸探针及taqman探针的淬灭效率。
如图3所示,1-2分别代表一组双链寡核苷酸核酸探针(p1/p2)和一组taqman探针本底信号值检测结果,双链寡核苷酸核酸探针本底信号值均在900-1700之间,taqman探针本底信号均在3500-5300之间,taqman探针扩增荧光信号本底是双链寡核苷酸核酸探针的3倍以上。结果表明,双链寡核苷酸核酸探针淬灭较彻底、本底较低,可以解决本底过高对扩增的影响问题。
5.双链寡核苷酸核酸探针的检测范围与灵敏度
(1)检测范围检测
引物为f与r,探针分别为双链寡核苷酸核酸探针(p1/p2)和taqman探针(p3),模板为:浓度109iu/ml的hbv核酸定量检测标准品,10倍梯度稀释至10iu/ml~109iu/ml,按照步骤2中操作扩增,检测双链寡核苷酸核酸探针及taqman探针的定量范围与灵敏度。
如图4及表2所示,模板浓度在10iu/ml~109iu/ml之间时,随循环数改变,双链寡核苷酸核酸探针组(p1/p2)和taqman探针组可见相应的荧光响应。图中曲线1-9分别是双链寡核苷酸核酸探针对10iu/ml~109iu/ml的hbv核酸定量检测标准品扩增的曲线图,曲线10-17分别是taqman探针对102iu/ml~109iu/ml的hbv核酸定量检测标准品扩增的曲线图,18为10iu/mlhbv核酸定量检测标准品,无扩增,为平直线。其中,双链寡核苷酸核酸探针组荧光响应强度明显高于taqman探针组。
表2探针检测范围分析表
(2)灵敏度检测
引物为f与r,探针分别为双链寡核苷酸核酸探针(p1/p2)、双链寡核苷酸核酸探针(p1/p4)和taqman探针(p3),模板为浓度10iu/ml的hbv核酸定量检测标准品,重复检测8次,按照步骤2中操作扩增,检测双链寡核苷酸核酸探针及taqman探针的最低检测限。
如图5(双链寡核苷酸核酸探针(p1/p2)10iu/mlhbv核酸定量检测标准品检测图)、图6(双链寡核苷酸核酸探针(p1/p4)10iu/mlhbv核酸定量检测标准品检测图)、图7(taqman探针10iu/mlhbv核酸定量检测标准品检测图)及表3、表4所示,模板量为10iu/ml时,双链寡核苷酸核酸探针组(p1/p2)8次重复检测8次有荧光响应,双链寡核苷酸核酸探针组(p1/p4)8次重复检测8次有荧光响应,taqman探针组均无荧光响应。
表3双链寡核苷酸核酸探针(p1/p2)与taqman探针
10iu/ml的hbv核酸定量检测标准品检测结果
表4双链寡核苷酸核酸探针(p1/p4)与taqman探针
10iu/mlhbv核酸定量检测标准品检测结果
由此表明双链寡核苷酸核酸探针可对浓度为10iu/ml~109iu/ml范围内的样本进行准确定量检测,并为浓度为10iu/ml的样本提供检测结果参考。taqman探针可对浓度为102iu/ml~109iu/ml范围内的样本进行准确定量检测,可见本发明实施例的探针检测下限能够达到更低,灵敏度更高。
6、hbv临床样本定量检测分析
引物为f与r,探针分别为双链寡核苷酸核酸探针(p1/p2)和taqman探针(p3),模板为18例已定值的hbvdna阳性血清,按照步骤2中操作进行扩增。
结果如图8(双链寡核苷酸核酸探针样本检测图)、9(taqman探针样本检测图)及表5所示,各浓度范围内,双链寡核苷酸核酸探针均能有效检出,低浓度样本taqman探针检测效果不佳。结果表明,该双链探针能够对hbv临床样本进行有效检测。
表5双链寡核苷酸核酸探针与taqman探针临床样本检测结果表
实施例2双链寡核苷酸探针2c19*2(681g>a)单核甘酸多态性位点的基因型检测
(1)配制pcr反应体系,包括:10×buffer缓冲液2.5μl,上、下游引物各1.2μl(10μm),双链寡核苷酸探针0.6μl(10μm),mg2+2.5μl,50×st酶0.5μl(biori,china),核酸提取试剂盒提取人dna模板3μl,总反应体积为25μl;
反应条件:50℃,2min;95℃,5min;95℃,20s,60℃,45s,共40个循环,退火时采集荧光;
(2)模板:2c19*2基因突变型a/a,野生型g/g,杂合型g/a各12例,ddh2o为阴性对照,按照步骤(1)中操作进行pcr检测;
(3)实验结果如表7及图10-12所示:
双链探针可以检测单核甘酸多态性位点的基因型,准确对2c19*2基因突变型a/a,野生型g/g,杂合型g/a及阴性样本进行检测。突变型样本,标有fam荧光基团的突变链探针随循环数增加荧光信号强度也增加,野生链探针无变化;野生型样本,标有hex荧光基团的野生链探针随循环数增加荧光信号强度也增加,突变链探针无变化;杂合型样本二者均随循环数增加荧光信号也增加,阴性均无变化,引物及探针序列见下表6。
表6引物及探针序列
表7.双链探针检测36份2c19*2突变、野生及杂合型样本结果表
图10突变型a/a样本检测,蓝色线代表fam荧光基团标记的突变链探针,检测突变型位点,除阴性外,荧光信号强度均随循环数增加而增加;绿色线代表hex荧光基团标记的野生链探针,检测野生型位点,均未检测到扩增。
图11野生型g/g样本检测,蓝色线代表fam荧光基团标记的突变链探针,检测突变型位点,未检测到扩增;绿色线代表hex荧光基团标记的野生链探针,检测野生型位点,除阴性外,荧光信号强度均随循环数增加而增加。
图12杂合型g/a样本检测,蓝色线代表fam荧光基团标记的突变链探针,检测突变型位点;绿色线代表hex荧光基团标记的野生链探针,检测野生型位点,除阴性外,两种荧光信号强度均随循环数增加而增加。
sequencelisting
<110>中国人民解放军军事科学院军事医学研究院
<120>一种双链寡核苷酸核酸探针的结构和用途
<160>10
<170>patentinversion3.5
<210>1
<211>21
<212>dna
<213>人工序列
<400>1
gytatcgctggatgtgtctgc21
<210>2
<211>21
<212>dna
<213>人工序列
<400>2
gacaaacgggcaacatacctt21
<210>3
<211>27
<212>dna
<213>人工序列
<400>3
cctctkcatcctgctgctatgcctcat27
<210>4
<211>17
<212>dna
<213>人工序列
<400>4
gcatagcagcaggatgm17
<210>5
<211>25
<212>dna
<213>人工序列
<400>5
catattcctcttcatcctgctgcta25
<210>6
<211>27
<212>dna
<213>人工序列
<400>6
atgaggcataggtcgaggatgmagagg27
<210>7
<211>22
<212>dna
<213>人工序列
<400>7
attattgttttctcttagatat22
<210>8
<211>27
<212>dna
<213>人工序列
<400>8
aagtcccgagggttgttgat20
<210>9
<211>27
<212>dna
<213>人工序列
<400>9
tatttcccaggaaccca17
<210>10
<211>27
<212>dna
<213>人工序列
<400>10
tatgggttcccgggaaataat21
- 还没有人留言评论。精彩留言会获得点赞!