重组Gaussia荧光素酶的制作方法
本发明属于生物学检测领域,主要涉及一种能催化荧光素底物的重组gaussia荧光素酶。
背景技术:
gaussia荧光素酶(gluc)来源于海洋桡脚类生物gaussiaprinceps,是一个分子量约为19.9kda的单体酶,由185个氨基酸组成,具有一个16aa的分泌信号肽,可以被细胞分泌到细胞外。gaussia荧光素酶能够催化荧光素底物(如腔肠素及其衍生物)的酶促氧化反应,并且发出波长在460-480nm之间的荧光(根据底物的不同,光子波长有所不同)。gaussia荧光素酶不同于萤火虫荧光素酶系统,这些基于腔肠素的荧光素酶(gluc)不需要使用atp和辅酶a等高能量分子,反应只需要腔肠素和o2参与,从而极大地简化了它们在众多报告子应用的使用方式。
然而,gluc催化腔肠素的发光反应仍有局限性。在胞内原位标记的应用中,gluc的荧光由于波长较短,穿透力不足,检测灵敏度不足;而在胞外分泌的检测应用中,则因gluc分泌量有限,导致体液环境中的信号分子浓度太低,检测率较低。
技术实现要素:
针对现有技术的不足,本发明的目的是提供一种能提高细胞内外荧光信号分子水平的重组gaussia荧光素酶,其核酸序列如seqidno:5所示。
本发明的有益效果:
本发明重组gaussia荧光素酶利用金黄色葡萄球菌蛋白a(spa)作为前导肽,替换荧光素酶原始的分泌信号肽后,提高了荧光素酶在细胞内的表达量及细胞外的分泌量,提高了可溶性荧光素酶的含量,增大了荧光素酶催化荧光信号分子产生的荧光强度,提高检测灵敏度。
附图说明
图1为重组gaussia荧光素酶与天然荧光素酶的表达菌株在不同诱导因子调控下的生长趋势图。
图2为在不同诱导因子作用下,重组gaussia荧光素酶与天然荧光素酶的荧光信号比较图。
图3为在不同诱导因子作用下,重组gaussia荧光素酶与天然荧光素酶的胞外分泌荧光信号比较图。
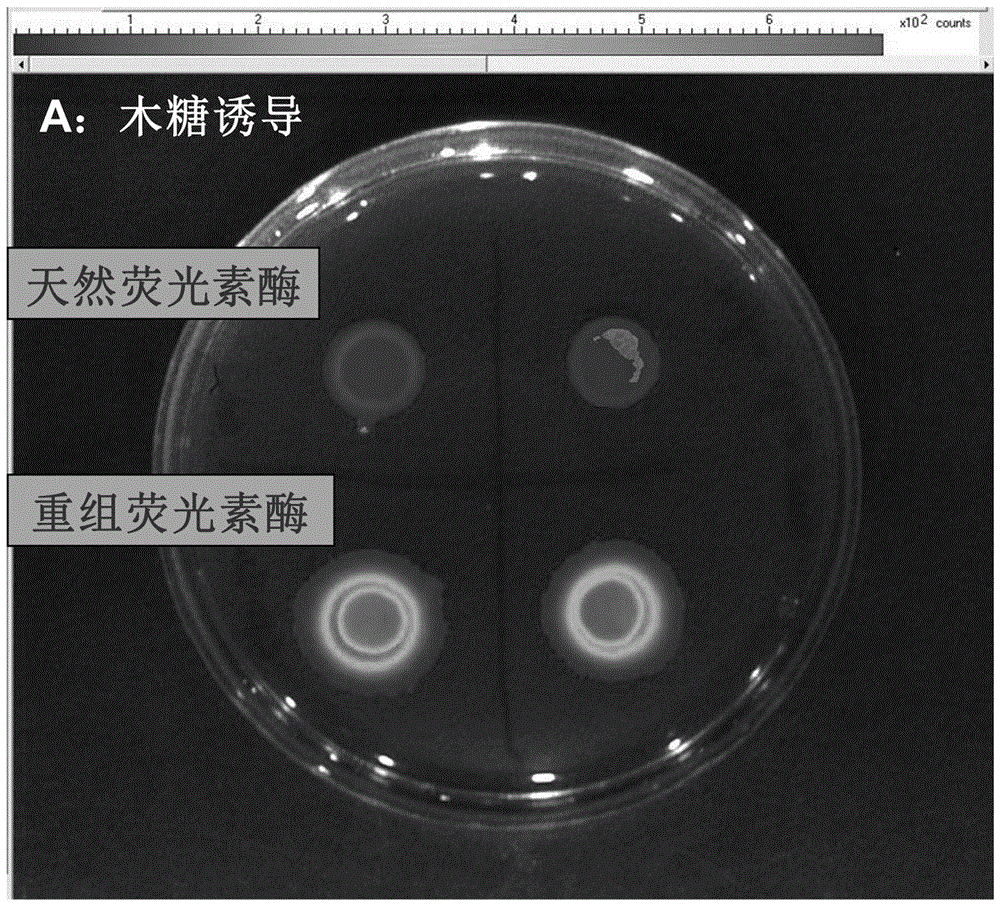
图4a为在木糖诱导因子作用下,琼脂扩散法检测重组gaussia荧光素酶与天然荧光素酶的荧光信号比较图。
图4b为葡萄糖诱导因子作用下,琼脂扩散法检测重组gaussia荧光素酶与天然荧光素酶的荧光信号比较图。
具体实施方式
本发明实施例中所用试剂均来源于市售。
实施例1
本发明利用金黄色葡萄球菌蛋白a(spa)作为前导肽,替换荧光素酶原始的分泌信号肽,可以提高细胞内外的荧光信号分泌量。
gluc蛋白(t.scott,1894)序列来自于美国ncbi数据库genbank:aag54095.1,美国专利:us6232107-b15-may-2001,其氨基酸序列如seqidno:1所示。
金黄色葡萄球菌蛋白a(spa)是金黄色葡萄球菌的膜蛋白(
针对原核生物宿主的蛋白表达,对gluc蛋白反转录的基因序列进行优化,得到如下seqidno:3序列:
atgggtgtaaaagtattatttgctcttatttgtattgctgttgcggaggctaaaccaaccgaaaataatgaggactttaatattgttgccgtcgcttctaattttgctactactgatttggatgcagatcgtgggaaattacctggtaaaaagttgccattagaagsttcttaaggaaatggaagcaaacgcccgtaaagcaggttgcactcgtggatgcttaatttgtttaagtcacattaaatgcacgccaaaaatgaaaaagtttatccctggaagatgtcatacatatgaaggcgataaggaatctgcacaaggaggaatcggtgaagctattgttgatattccagagattccaggttttaaggacttagaaccaatggaacaatttattgctcaagttgacttatgcgttgactgcacgactggttgtctaaaaggtctagctaatgttcaatgtagcgatttattgaagaaatggttgcctcaacgatgtgcaacttttgcaagtaaaatccaaggtcaagtcgataaaatcaaaggtgctggaggtgat。
其中,上述基因序列划线部分为gluc蛋白的原始分泌信号肽基因。
采用overlappcr或基因合成等基因编辑技术(包括其他分子技术),用金黄色葡萄球菌蛋白a将gluc原始序列中划线部分替换。
pcr过程如下:
首先,取金黄色葡萄球菌o326隔夜培养的菌液100μl,培养条件:bhi培养基,37℃,200rpm,煮沸5分钟后,取8μl上清作为模板,分别加入taqdna聚合酶10μl及10μm浓度的引物1“5'-ggaattcatgactttacaaatacatacagggg-3'”与引物2“5'-cctcattattttcggttggtttagcatttgcagcaggtg-3'”各1μl,进行pcr扩增,pcr条件为:95℃加热1分钟,61.2℃加热10秒,72℃加热1分钟,共35个循环。pcr产物送生物公司进行基因序列测序验证,得到产物序列如seqidno:4所示。
然后,取9μl的上述pcr反应产物,分别加入taqdna聚合酶10μl及10μm浓度的引物3“5'-ccgctcgagttatagtggaggtcgtggaaac-3'”1μl,以gluc的合成序列作为模板,进行pcr扩增,pcr条件为:95℃加热1分钟,63℃加热10秒,72℃加热1分钟,共35个循环。pcr产物经测序验证,得到重组gaussia荧光素酶序列seqidno:5如下:
ggaattcatgatgactttacaaatacatacagggggtattaatttgaaaaagaaaaacatttattcaattcgtaaactaggtgtaggtattgcatctgtaactttaggtacattacttatatctggtggcgtaacaccagctgcaaatgctaaaccaaccgaaaataatgaggactttaatattgttgccgtcgcttctaattttgctactactgatttggatgcagatcgtgggaaattacctggtaaaaagttgccattagaagttcttaaggaaatggaagcaaacgcccgtaaagcaggttgcactcgtggatgcttaatttgtttaagtcacattaaatgcacgccaaaaatgaaaaagtttatccctggaagatgtcatacttatgaaggcgataaggaatctgcacaaggaggaatcggtgaagctattgttgatattccagagattccaggttttaaggacttagaaccaatggaacaatttattgctcaagttgacttatgcgttgactgcacgactggttgtctaaaaggtctagctaatgttcaatgtagcgatttattgaagaaatggttgcctcaacgatgtgcaacttttgcaagtaaaatccaaggtcaagtcgataaaatcaaaggtgctggaggtgattaactcgagcgg。
上述重组序列通过ecori与xhoi的双酶切,采用t4dna连接酶连接在携带木糖诱导启动子xylra的穿梭载体punk质粒上,形成蛋白表达质粒。该质粒通过化学转导(本领域人员看到“化学转导”是否就可以知道其具体步骤而且该步骤是唯一确定的?如果不是则需要提供化学转导的具体步骤)在大肠杆菌dh5α菌株中,利用该质粒上的红霉素抗性(eryr)及氯霉素抗性(cmr)的双重筛选,挑取耐受50μg/ml的红霉素阳性克隆菌株,并进行单菌落扩增。从扩增菌液总获取阳性表达质粒后后,通过2.5kv的电脉冲转化到金黄色葡萄球菌rn4220菌株中,构建完成重组gluc荧光素酶的表达体系。
当然,该质粒也可以通过上述双酶切方法将目标片段构建在pet28a质粒上,并转化到大肠杆菌bl21,大肠杆菌mds42等表达菌株中。同样的,通过上述双酶切反应,也可以将目标片段构建在pbt2、pecto、pmad等穿梭质粒上;或者通过invitrogen公司的商业试剂盒gateway系统,利用λ噬菌体特异识别位点(attb与attp位点)的bp酶与lr酶催化重组反应,将目标基因片段构建在具有上述λ噬菌体特异识别位点的pkor1、pmk4等穿梭表达质粒上。上述穿梭表达质粒转化到金黄色葡萄球菌rn4220中进行扩增与修饰后,可进一步将修饰后的质粒转化到其他野生型或突变型金黄色葡萄球菌中表达重组蛋白。
由于本发明保护的内容是重组蛋白的基因序列,至于其质粒的构建与表达等步骤是为了检验该重组蛋白的目的功效,不是发明的保护内容,对这部分内容的要求是本领域技术人员依据公开的步骤重复实施例,可以达到发明所说的效果就可以,所以对于这部分内容公开充分是必要的要求,请确认根据以上内容是否可以重现实施例。
实施例2
将天然荧光素酶及本发明重组gaussia荧光素酶的表达菌株分别施以质量分数为5%的木糖和5%葡萄糖作为调控因子,在250转/分钟及37℃条件下进行表达,并测得生长曲线如图1所示。其中,5%木糖用于诱导目标序列表达,5%葡萄糖用于抑制目标序列表达。结果显示,在牛脑浸出液培养基(bhi)中,天然荧光素酶与重组gaussia荧光素酶在不同诱导剂的调控下显示出同样的生长趋势,生长速率没有显著性差异。
实施例3
对天然荧光素酶及重组gaussia荧光素酶的表达菌株分别施以质量分数为5%的木糖和5%葡萄糖作为调控因子,在250转/分钟及37℃条件下进行表达,再加入10μm的反应底物腔肠素(ctz)后,每30分钟取1毫升菌液,分别测定荧光强度和菌液浓度,读取600nm处吸光度值,结果如图2显示,在相同菌液浓度下,5%的木糖诱导表达的重组gaussia荧光素酶催化产生的荧光信号比天然荧光素酶增强10倍;5%的葡萄糖抑制表达的重组gaussia荧光素酶催化产生的荧光信号也比天然荧光素酶增强10倍。
实施例4
对天然荧光素酶及重组gaussia荧光素酶的表达菌株分别施以质量分数为5%的木糖和5%葡萄糖作为调控因子,在250转/分钟及37℃条件下进行表达,在加入10μm的反应底物腔肠素(ctz)后,每30分钟取1毫升菌液,5000g离心5分钟取上清液,并用0.1mm的磷酸缓冲溶液对沉淀部分的菌体进行重悬。分别测定上清液(即荧光素酶胞外分泌部分)和重悬菌液(即荧光素酶胞内部分)的荧光强度,荧光素酶胞外分泌量与胞内分泌量的比值结果如图3所示,表明在诱导因子作用下,5%的木糖诱导表达与5%的葡萄糖抑制表达,重组gaussia荧光素酶与天然荧光素酶的胞外分泌率均不同程度地提高;并且,重组gaussia荧光素酶的胞外分泌率比天然荧光素酶的胞外分泌率提高了5倍。
实施例5
天然荧光素酶及重组gaussia荧光素酶的表达菌株分别在细菌培养液(bhi液体培养基)中培养至吸光度值为1.0(od600),分别吸取10微升菌液滴在含有不同诱导因子的细菌培养基表面,图4a为质量分数5%木糖;图4b为质量分数5%葡萄糖,在37℃培养箱中培养24小时,形成直径约8.9毫米的菌斑。再喷施以10μm的反应底物腔肠素(ctz)后分别成像仪器测定菌斑的荧光强度。结果表明,在不同诱导因子作用下,重组gaussia荧光素酶与天然荧光素酶所对应的菌斑荧光强度均不同程度地提高,其中,图4b中天然荧光素酶从抑制状态的无信号检出,增强到图4a中诱导表达状态的100单位强度;而重组gaussia荧光素酶则从图4b抑制状态的25单位强度,增强到图4a诱导表达状态的600单位强度。重组gaussia荧光素酶的荧光信号显著强于天然荧光素酶。而且,随着荧光素酶的表达,重组gaussia荧光素酶在培养基上的胞外分泌量也比天然荧光素酶高,体现在重组gaussia荧光素酶所对应的菌斑光斑直径比天然荧光素酶对应的菌斑光斑直径显著扩大。
序列表
<110>自然资源部第三海洋研究所
<120>重组gaussia荧光素酶
<160>5
<170>siposequencelisting1.0
<210>1
<211>185
<212>prt
<213>人工序列(artificialsequence)
<400>1
metglyvallysvalleuphealaleuilecysilealavalalaglu
151015
alalysprothrgluasnasngluasppheasnilevalalavalala
202530
serasnphealathrthraspleuaspalaaspargglylysleupro
354045
glylyslysleuproleugluvalleulysglumetglualaasnala
505560
arglysalaglycysthrargglycysleuilecysleuserhisile
65707580
lyscysthrprolysmetlyslyspheileproglyargcyshisthr
859095
tyrgluglyasplysgluseralaglnglyglyileglyglualaile
100105110
valaspileprogluileproglyphelysaspleugluprometglu
115120125
glnpheilealaglnvalaspleucysvalaspcysthrthrglycys
130135140
leulysglyleualaasnvalglncysseraspleuleulyslystrp
145150155160
leuproglnargcysalathrphealaserlysileglnglyglnval
165170175
asplysilelysglyalaglyglyasp
180185
<210>2
<211>144
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgatgactttacaaatacatacagggggtattaatttgaaaaagaaaaacatttattca60
attcgtaaactaggtgtaggtattgcatctgtaactttaggtacattacttatatctggt120
ggcgtaacaccagctgcaaatgct144
<210>3
<211>556
<212>dna
<213>人工序列(artificialsequence)
<400>3
atgggtgtaaaagtattatttgctcttatttgtattgctgttgcggaggctaaaccaacc60
gaaaataatgaggactttaatattgttgccgtcgcttctaattttgctactactgatttg120
gatgcagatcgtgggaaattacctggtaaaaagttgccattagaagsttcttaaggaaat180
ggaagcaaacgcccgtaaagcaggttgcactcgtggatgcttaatttgtttaagtcacat240
taaatgcacgccaaaaatgaaaaagtttatccctggaagatgtcatacatatgaaggcga300
taaggaatctgcacaaggaggaatcggtgaagctattgttgatattccagagattccagg360
ttttaaggacttagaaccaatggaacaatttattgctcaagttgacttatgcgttgactg420
cacgactggttgtctaaaaggtctagctaatgttcaatgtagcgatttattgaagaaatg480
gttgcctcaacgatgtgcaacttttgcaagtaaaatccaaggtcaagtcgataaaatcaa540
aggtgctggaggtgat556
<210>4
<211>170
<212>dna
<213>人工序列(artificialsequence)
<400>4
ggaattcatgactttacaaatacatacagggggtattaatttgaaaaagaaaaacattta60
ttcaattcgtaaactaggtgtaggtattgcatctgtaactttaggtacattacttatatc120
tggtggcgtaacacctgctgcaaatgctaaaccaaccgaaaataatgagg170
<210>5
<211>667
<212>dna
<213>人工序列(artificialsequence)
<400>5
ggaattcatgatgactttacaaatacatacagggggtattaatttgaaaaagaaaaacat60
ttattcaattcgtaaactaggtgtaggtattgcatctgtaactttaggtacattacttat120
atctggtggcgtaacaccagctgcaaatgctaaaccaaccgaaaataatgaggactttaa180
tattgttgccgtcgcttctaattttgctactactgatttggatgcagatcgtgggaaatt240
acctggtaaaaagttgccattagaagttcttaaggaaatggaagcaaacgcccgtaaagc300
aggttgcactcgtggatgcttaatttgtttaagtcacattaaatgcacgccaaaaatgaa360
aaagtttatccctggaagatgtcatacttatgaaggcgataaggaatctgcacaaggagg420
aatcggtgaagctattgttgatattccagagattccaggttttaaggacttagaaccaat480
ggaacaatttattgctcaagttgacttatgcgttgactgcacgactggttgtctaaaagg540
tctagctaatgttcaatgtagcgatttattgaagaaatggttgcctcaacgatgtgcaac600
ttttgcaagtaaaatccaaggtcaagtcgataaaatcaaaggtgctggaggtgattaact660
cgagcgg667
- 还没有人留言评论。精彩留言会获得点赞!