铜绿假单胞菌群体感应体系抑制剂的快速筛选模型及其构建方法与流程
本发明属于生物
技术领域:
,特别涉及一种快速筛选铜绿假单胞菌群体感应体系抑制剂的方法。
背景技术:
:铜绿假单胞菌是常见的革兰氏阴性菌,为临床上常见的能引起严重感染的机会致病菌之一,其对抗菌药物存在天然或获得性的多重耐药性,治疗难度较大。群体感应(quorumsensing,qs)是细菌之间通过产生、释放并感知信号分子来进行细菌信息交流的一种机制。细菌本身会产生一系列的自诱导信号分子,其可根据信号分子的浓度来检测周围环境中自身或其他细菌的数量变化,当细菌密度达到一定时,信号分子浓度达到阈值,细菌会启动相关基因的表达,如产生毒力因子,形成生物膜,菌体发光或产生色素等。铜绿假单胞菌的群体感应系统主要由基于酰基高丝氨酸内酯化合物(n-acyl-homoserinelactones,ahls)的las和rhl系统以及pqs信号系统组成。las系统由信号分子受体lasr和ahl信号分子合成酶lasi组成,rhl系统由信号分子受体rhlr和ahl信号分子合成酶rhli组成。其中las系统的信号分子为n-3-氧十二酰基高丝氨酸内酯(n-3-oxododecanoyl-homoserinelactone,3-oxo-c12-hsl),rhl系统的信号分子为正丁基高丝氨酸内酯(n-butyl-homoserinelactone,c4-hsl)。当这两个系统的受体蛋白和信号分子形成复合物,结合到靶基因dna启动子区域时,就会激活一系列毒力基因如弹性蛋白酶和绿脓菌素等。pqs信号系统是以pqsr为受体蛋白,2-庚基-3-羟基-4-喹诺酮(2-heptyl-3-hydroxy-4-quinolone,pqs)为信号分子的调控系统,pqs与pqsr蛋白结合后,会调控如弹性蛋白酶、绿脓菌素和凝集素等毒力因子的表达。铜绿假单胞菌毒力因子的表达和生物膜的形成都受群体感应系统调控,因此,抑制细菌的群体感应系统,可以在不杀死细菌的情况下抑制其致病性。与传统的抗菌药物相比,群体感应抑制剂不会对细菌耐药性产生选择性压力,理论上不会引起细菌耐药性的产生。快速筛选高效的群体感应抑制剂,将成为解决铜绿假单胞菌感染和耐药性问题的有效途径。传统的筛选细菌群体感应体系的方法用细菌生物感应器紫色杆菌cv026和乙酰基高丝氨酸内酯进行检测,其需要24小时,时间太长。因此有必要提供一种用于快速筛选铜绿假单胞菌群体感应体系抑制剂的方法。技术实现要素:基于此,本发明的目的在于提供一种用于快速筛选铜绿假单胞菌群体感应体系抑制剂的方法。为实现上述目的,本发明具体技术方案如下:一种铜绿假单胞菌群体感应抑制剂的筛选体系,包括:las系统筛选模型、rhl系统筛选模型和pqs信号系统筛选模型中的至少一种;所述las系统筛选模型为:含有质粒a和质粒b的大肠杆菌;所述质粒a上包含有lasr蛋白的编码序列;所述质粒b包含有荧光素酶的编码序列;所述荧光素酶的编码序列上带有可以与lasr蛋白结合的启动子;所述rhl系统筛选模型为:含有质粒c和质粒d的大肠杆菌;所述质粒c上包含有rhlr蛋白的编码序列;所述质粒d包含有荧光素酶的编码序列;所述荧光素酶的编码序列上带有可以与rhlr蛋白结合的启动子;所述pqs信号系统筛选模型为:含有质粒e和质粒f的大肠杆菌;所述质粒e上包含有pqsr蛋白的编码序列;所述质粒f包含有荧光素酶的编码序列;所述荧光素酶的编码序列上带有可以与pqsr蛋白结合的启动子。在其中一些实施例中,所述铜绿假单胞菌群体感应抑制剂的筛选体系包括las系统筛选模型、rhl系统筛选模型和pqs信号系统筛选模型。在其中一些实施例中,所述可以与lasr蛋白结合的启动子的核苷酸序列如seqidno.3所示。在其中一些实施例中,所述可以与rhlr蛋白结合的启动子的核苷酸序列如seqidno.10所示。在其中一些实施例中,所述可以与pqsr蛋白结合的启动子的核苷酸序列如seqidno.15所示。在其中一些实施例中,所述大肠杆菌为大肠杆菌dh5α菌株。本发明还提供了一种铜绿假单胞菌群体感应抑制剂的筛选体系的构建方法,具体技术方案如下:一种铜绿假单胞菌群体感应抑制剂的筛选体系的构建方法,包括构建las系统筛选模型、rhl系统筛选模型和pqs信号系统筛选模型中的至少一种,其中,(1)构建质粒a和质粒b,所述质粒a上包含有lasr蛋白的编码序列;所述质粒b包含有荧光素酶的编码序列,所述荧光素酶的编码序列上带有可以与lasr蛋白结合的启动子;将所述质粒a和所述质粒b共转导至大肠杆菌中,得las系统筛选模型;(2)构建质粒c和质粒d,所述质粒c上包含有rhlr蛋白的编码序列;所述质粒d包含有荧光素酶的编码序列,所述荧光素酶的编码序列上带有可以与rhlr蛋白结合的启动子;将所述质粒c和所述质粒d共转导至大肠杆菌中,得rhl系统筛选模型;(3)构建质粒e和质粒f,所述质粒e上包含有pqsr蛋白的编码序列;所述质粒f包含有荧光素酶的编码序列,所述荧光素酶的编码序列上带有可以与pqsr蛋白结合的启动子;将所述质粒c和所述质粒d共转导至大肠杆菌中,得pqs信号系统筛选模型。本发明还提供了一种铜绿假单胞菌群体感应抑制剂的筛选方法,具体技术方案如下:一种铜绿假单胞菌群体感应抑制剂的筛选方法,包括:(1)向使用las系统筛选模型、rhl系统筛选模型和pqs信号系统筛选模型中的任一项中所述的大肠杆菌中,加入阿拉伯糖诱导剂和自诱导小分子;(2)荧光强度抑制实验:药物组:分别加入待筛选药物,培养3.5~6h后,检测荧光强度和细菌数量;溶剂组:加入空白溶剂,培养3.5~6h后,检测荧光强度和细菌数量;(3)对比所述药物组和所述溶剂组的荧光强度变化。在其中一些实施例中,步骤(1)为:在对数生长中期的大肠杆菌培养液中,加入0.08%~0.12%的阿拉伯糖诱导剂和8~12μm的自诱导小分子。在其中一些实施例中,所述las系统筛选模型中使用的自诱导小分子为n-3-氧十二酰基高丝氨酸内酯;所述rhl系统筛选模型中使用的自诱导小分子为正丁基高丝氨酸内酯;所述pqs信号系统筛选模型中使用的自诱导小分子为2-庚基-3-羟基-4-喹诺酮。在其中一些实施例中,步骤(3)所述对比所述药物组和所述溶剂组的荧光强度变化包括:分别计算药物组和溶剂组的荧光强度和细菌数量的比值,得单位荧光强度;以所述溶剂组的单位荧光强度为100%计,所述药物组的单位荧光强度≤70%时,待筛选药物为具有铜绿假单胞菌群体感应抑制活性的药物。基于上述技术方案,本发明具有以下效果:本发明通过大量创造性劳动,分别在大肠杆菌中导入质粒用于模拟铜绿假单胞菌的las系统、rhl系统和pqs信号系统三种群体感应系统,得到las系统筛选模型、rhl系统筛选模型和pqs信号系统筛选模型,选取其中一种或一种以上的组合作为铜绿假单胞菌群体感应抑制剂的筛选体系。本发明向所述的筛选模型中加入诱导剂和自诱导分子后,自诱导分子与受体蛋白形成复合体,复合体结合到靶基因的启动子区域,激活荧光素酶的表达,从而可以通过荧光强度可视化地体现群体感应效应的发生。当待筛选药物能够抑制筛选模型的荧光强度时,说明其可以干扰或抑制铜绿假单胞菌的群体感应效应。通过本发明所述的筛选体系筛选铜绿假单胞菌群体感应抑制,在加入待筛选药物后,仅需培养3.5~6小时,小于传统筛选方法培养所需的24h,大大缩短了筛选时间。通过上述筛选模型中模拟的群体感应系统调控荧光素酶基因的化学发光来指示抑制剂的抑制效果,可快速筛选各群体感应系统的抑制剂,所筛选出的有效抑制剂可用于铜绿假单胞菌抑菌药物的开发,筛选得到的铜绿假单胞菌抑菌药物,与传统的抗菌药物相比,群体感应抑制剂不会对细菌耐药性产生选择性压力,避免了引起细菌的耐药性,而且还能够避免普通抗菌药物对于正常菌群的杀伤。附图说明图1为实施例3所述的小分子药物抑制las系统的检测结果图;图2为实施例3所述的小分子药物对荧光霉素本身发光的抑制效果结果图;图3为实施例4中las系统在海洋菌株粗提取物中筛选铜绿假单胞菌群体感性系统的抑制剂的效果的检测结果图;图4为实施例4中rhl系统在海洋菌株粗提取物中筛选铜绿假单胞菌群体感性系统的抑制剂的效果的检测结果图;图5为实施例4中pqs信号系统在海洋菌株粗提取物中筛选铜绿假单胞菌群体感性系统的抑制剂的效果的检测结果图;图6为实施例4中海洋菌株粗提取物对荧光霉素本身发光的抑制效果结果图。具体实施方式为了便于理解本发明,下面将参照实施例对本发明进行更全面的描述,以下给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。应理解,下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用试剂,均为市售产品。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
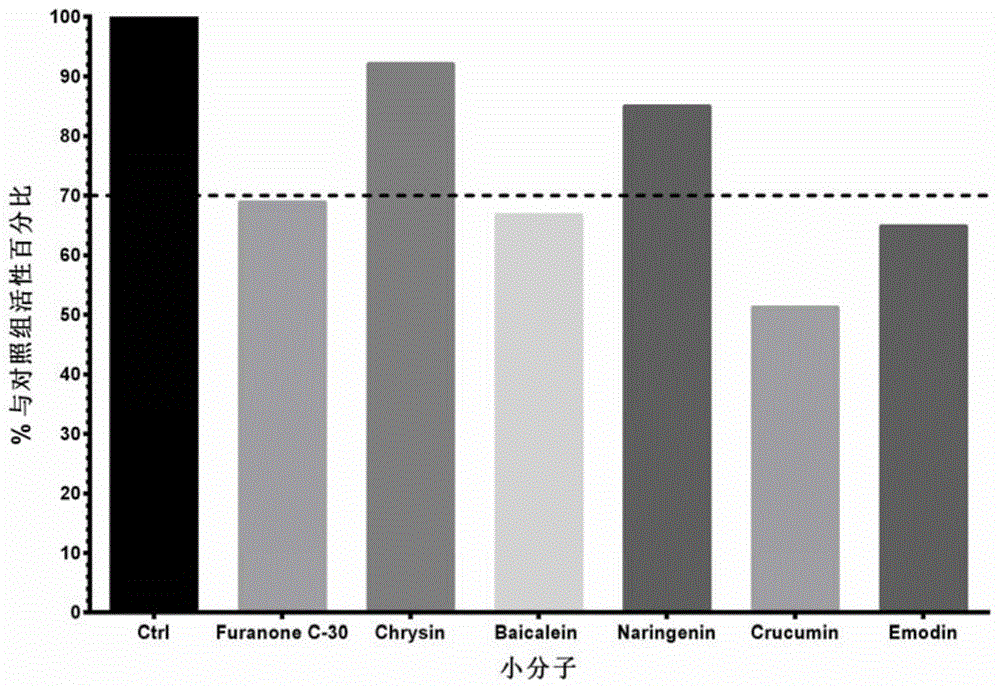
的技术人员通常理解的含义相同。在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。下面将结合具体实施例对本发明进行详细说明:实施例1将铜绿假单胞菌的群体感应系统las系统、rhl系统及pqs信号系统分别构建在大肠杆菌中,具体步骤如下:1、构建las系统:(1)构建lasr蛋白过表达质粒lasr-pbad30其中,lasr基因geneid:881789。lasr-pbad30构建的具体步骤如下:引物序列:lasr-f(seqidno.1):aaagaattcaggaggtaaatggccttggttgaclasr-r(seqidno.2):aaatctagatcagagagtaataagacc从铜绿假单胞菌野生株pao1基因组中pcr出含有lasr基因序列的目标片段。pcr反应体系如表1:pcr程序如表2:将pbad30质粒和lasr片段用限制性内切酶ecoi和xbai37℃水浴双酶切30min,纯化后进行22℃连接3h,将连接产物转化入大肠杆菌dh5α中,即构建好lasr-pbad30质粒。(2)构建带lasr蛋白结合序列lasb基因的启动子(promoter)和luxabcde荧光素酶基因的lasbpromoter-luxabcde-pet28a质粒。其中,带lasr蛋白结合序列lasb基因的启动子的核苷酸序列(seqidno.3)为:gcgcgtcccggagctgggggcaacctagctgccacctgcttttctgctagctattccagcgaaaacatacagatttccggcgaaatcaaggctacctgccagttctggcaggtttggccgcgggttctttttggtacacgaaagcaccgtcgaaaacgggaccgagccaggggagtgcagttccttctacccgaaggactgatacggctgttccgatcagcccacaaggcggcggtaagcgtcggccgagtacttcggcctgaaaaaaccaggagaactgaacaag带lasr蛋白结合序列lasb基因的启动子的核苷酸序列与luxabcde荧光素酶基因直接连接,该序列能够在阿拉伯糖诱导剂和自诱导小分子与lasr蛋白的复合物的激活下,启动表达荧光素酶。其中,luxabcde荧光素酶基因的核苷酸序列,genbankaccessionnumberm90093。构建lasbpromoter-luxabcde-pet28a质粒的具体步骤如下:采用引物lasbpromoter-f、lasbpromoter-r从pao1基因组中pcr出lasbpromoter目标片段。lasbpromoter-f(seqidno.4):aaaagatctggtaccgcgcgtcccggagctggggglasbpromoter-r(seqidno.5):aaatctagatcagagagtaataagaccpcr体系如表3:pcr程序如表4:采用引物luxabcde-f、luxabcde-r从pbav1k质粒中pcr出luxabcde目标片段。luxabcde-f(seqidno.6):attccatgggaatgaaatttggaaactttttgcttacatacluxabcde-r(seqidno.7):attggatccttaactatcaaacgcttcggttaagcttapcr程序如表5:pcr程序如表6:将pet28a质粒和lasbpromoter片段用限制性内切酶bgiii和xbai37℃水浴双酶切30min,纯化后进行22℃连接3h,将连接产物转化入大肠杆菌dh5α中。再将构建好的lasbpromoter-pet28a质粒和luxabcde片段用限制性内切酶ncoi和bamhi37℃水浴双酶切30min,纯化后进行22℃连接3h,将连接产物转化入大肠杆菌dh5α中,即构建好lasbpromoter-luxabcde-pet28a质粒。将以上lasr-pbad30、lasbpromoter-luxabcde-pet28a两种质粒共转导入大肠杆菌dh5α菌株,涂板,从平板中挑取该单菌落接种到5ml添加有30μg/ml卡那霉素和100μg/ml氨苄青霉素的lb培养基中,37℃、250rpm振荡过夜,以1%接种量转接到lb培养基中,在37℃、250rpm振荡至对数生长中期,加入0.1%阿拉伯糖诱导剂和10μm3-oxo-c12-hsl,并以不加阿拉伯糖诱导剂和自诱导小分子3-oxo-c12-hsl组为对照组,30℃振荡培养4h后用酶标仪测试菌液的发光值和细菌数量,验证所构建的体系能否正常工作。测试的结果如表7所示。表7las系统(lasr/pbad30和lasb-luxabcde/pet28a)测试结果由表7可见,同时加入阿拉伯糖诱导剂和自诱导小分子3-oxo-c12-hsl的菌液可检测出较强的发光值,可见构建得到的las系统能够正常工作。2、构建rhl系统:(1)构建rhlr蛋白过表达质粒rhlr-pbad30,其中,rhlr基因的geneid:878968。构建rhlr-pbad30质粒的具体步骤如下:采用引物rhlr-f、rhlr-r从pao1基因组中pcr出目标片段。rhlr-f(seqidno.8):aaagaattcaggaggtaaatgaggaatgacggarhlr-r(seqidno.9):aaatctagatcagatgagacccagcpcr反应体系如表8:pcr程序如表9:将pbad30质粒和rhlr片段用限制性内切酶ecoi和xbai37℃水浴双酶切30min,纯化后进行22℃连接3h,将连接产物转化入大肠杆菌dh5α中,即构建好rhlr-pbad30质粒。(2)构建带rhlr蛋白结合序列rhlab基因的启动子和luxabcde荧光素酶基因的rhlabpromoter-luxabcde-pet28a质粒其中,带rhlr蛋白结合序列rhlab基因的启动子的核苷酸序列(seqidno.10)为:catgccttttccgccaacccctcgctgttccccgccggccgctctggcacgccttatcgcgggcgggcaggggcttatgcgcaggcggccgcccgtcctgtgaaatctggcagttaccgttagctttcgaattggctaaaaagtgttcatcggctacgcgtgaacacggacgccaatcgtttgcgcaggccgatctgcaagacccacacaagcccc带rhlr蛋白结合序列rhlab基因的启动子的核苷酸序列与luxabcde荧光素酶基因直接连接,能够在阿拉伯糖诱导剂和自诱导小分子与rhlr蛋白的复合物的激活下,启动表达荧光素酶。构建rhlabpromoter-luxabcde-pet28a质粒的具体步骤如下:采用引物rhlabpromoter-f、rhlabpromoter-r从pao1基因组中pcr出rhlabpromoter目标片段。rhlabpromoter-f(seqidno.11):aaaggtacccatgccttttccgccaarhlabpromoter-r(seqidno.12):aaatctagaggggcttgtgtgggtpcr反应体系如表10:pcr程序如表11:将lasb-luxabcde-pet28a质粒和rhlabpromoter片段用限制性内切酶kpni和xbai37℃水浴双酶切30min,纯化后进行22℃连接3h,将连接产物转化入大肠杆菌dh5α中,即构建好rhlabpromoter-luxabcde-pet28a质粒。将rhlr-pbad30和rhlabpromoter-luxabcde-pet28a两种质粒共转导入大肠杆菌dh5α菌株。并以不加阿拉伯糖诱导剂和自诱导小分子c4-hsl组为对照组。待菌液长到对数生长中期时,加入0.1%阿拉伯糖诱导剂和10μmc4-hsl,30℃振荡培养4h后用酶标仪测试菌液的发光值和细菌数量。结果如表12所示:表12rhl系统(rhlr/pbad30和rhlab-luxabcde/pet28a)测试结果由表12可见,同时加入阿拉伯糖诱导剂和自诱导小分子c4-hsl的菌液可检测出较强的发光值,可见构建得到的rhl系统能够正常工作。3、构建pqs信号系统:(1)构建pqsr蛋白过表达质粒pqsr-pbad30,pqsr基因geneid:879994。构建pqsr-pbad30质粒的具体步骤如下:采用引物pqsr-f、pqsr-r从pao1基因组中pcr出目标片段。pqsr-f(seqidno.13):aaagaattcaggaggtaaatgcctattcataacctpqsr-r(seqidno.14):aaatctagactactctggtgcggcgcpcr反应体系如表13:pcr程序如表14:将pbad30质粒和pqsr片段用限制性内切酶ecoi和xbai37℃水浴双酶切30min,纯化后进行22℃连接3h,将连接产物转化入大肠杆菌dh5α中,即构建好pqsr-pbad30质粒。(2)构建带pqsr蛋白结合序列pqsabcde基因的启动子和luxabcde荧光素酶基因的pqsabcdepromoter-luxabcde-pet28a质粒其中,带pqsr蛋白结合序列pqsabcde基因的启动子的核苷酸序列(seqidno.15)为:cgcccttcttgcttggttgccgttctcggatcccgcgcagcccggtgggtgtgccaaatttctcgcggtttggatcgcgccgattgccgcggcctacgaagcccgtggttcttctccccgaaactttttcgttcggactccgaatatcgcgcttcgcccagcgccgctagtttcccgttcctgacaaagcaagcgctctggctcaggtatctcctgatccggatgcatatcgctgaagagggaacgttctgtc构建pqsabcdepromoter-luxabcde-pet28a质粒的具体步骤如下:采用引物pqsabcdepromoter-f、pqsabcdepromoter-r从pao1基因组中pcr出pqsabcdepromoter目标片段。pqsabcdepromoter-f(seqidno.16):aaaggtacccgcccttcttgcttggttpqsabcdepromoter-r(seqidno.17:aaatctagagacagaacgttccctcttpcr反应体系如表15pcr程序如表16:将lasb-luxabcde-pet28a质粒和pqsabcdepromoter片段用限制性内切酶kpni和xbai37℃水浴双酶切30min,纯化后进行22℃连接3h,将连接产物转化入大肠杆菌dh5α中,即构建好pqsabcdepromoter-luxabcde-pet28a质粒。带pqsr蛋白结合序列pasabcde基因的启动子的核苷酸序列与luxabcde荧光素酶基因直接连接,改序列能够在阿拉伯糖诱导剂和自诱导小分子与pqsr蛋白的复合物的激活下,启动表达荧光素酶。将pqsr-pbad30和pqsabcdepromoter-luxabcde-pet28a两种质粒共转导入大肠杆菌dh5α菌株。并以不加阿拉伯糖诱导剂和自诱导小分子pqs组为对照组。待菌液长到对数生长中期时,加入0.1%阿拉伯糖诱导剂和10μmpqs,30℃振荡培养4h后用酶标仪测试菌液的发光值和细菌数量,实验结果如表17所示。表17pqs系统(pqsr/pbad30和pqsabcde-luxabcde/pet28a)测试结果由表17可见,同时加入阿拉伯糖诱导剂和自诱导小分子pqs的菌液可检测出较强的发光值,可见构建得到的pqs系统能够正常工作。实施例2为了排除待筛选药物/化合物/天然产物等对荧光素酶自身发光的抑制效果,我们选用大肠杆菌的乳糖和色氨酸的杂合启动子,即tac启动子,构建不需要诱导即可表达荧光素酶的tac-luxabcde-pet28a质粒,将质粒转导入大肠杆菌dh5α菌株中,即可用于验证所筛选的提取物是否对荧光素酶自身发光有影响。其中,tac启动子的序列(seqidno.18)如下:ttgacaattaatcatcggctcgtataatgtac-luxabcde-pet28a质粒的构建方法如下:引物序列:tac-f(seqidno.19):gatctttgacaattaatcatcggctcgtataatgggtacctttttac-r(seqidno.20):ctagaaaaggtacccattatacgagccgatgattaattgtcaaapcr反应体系如表18:pcr反应体系体积ul10umtac-f110umtac-r110xpnkbuffer2t4polynucleotidekinase110mmatp2ddh2o13total20将合成的片段磷酸化,退火使两条链互补配对。37℃水浴20min后95℃加热10min,自然冷却。将pet28a质粒用bgiii和xbai双酶切,37℃30min,纯化后与tacpromoter片段进行连接,22℃连接3h后将连接产物转入大肠杆菌dh5α中。再将构建好的tacpromoter-pet28a质粒和luxabcde片段用限制性内切酶ncoi和bamhi37℃水浴双酶切30min,纯化后进行22℃连接3h,将连接产物转化入大肠杆菌dh5α中,即构建好tacpromoter-luxabcde-pet28a质粒。通过被筛选药物是否对含有tacpromoter-luxabcde-pet28a质粒的大肠杆菌dh5α的荧光有抑制作用,从而验证所筛选的提取物是否对荧光素酶自身发光有影响。实施例3分别采用实施例1中构建得到的具有las系统的大肠杆菌,以商业化的群体感应抑制剂furanonec-30(呋喃酮c-30)为阳性对照,筛选对于群体感应系统的抑制效果的小分子化合物。采用实施例2所述的方法,排除小分子化合物对荧光素酶自身发光的抑制效果的影响。试验中采用的小分子化合物如表19:筛选的实验步骤为:将工程菌接种到5ml含有30μg/ml卡那霉素和100μg/ml氨苄青霉素的lb培养基中,37℃、250rpm振荡过夜,以1%接种量转接到lb培养基中,在37℃、250rpm振荡至对数生长中期,加入0.1%阿拉伯糖诱导剂和10μm自诱导小分子3-oxo-c12-hsl,每孔150ml菌液分装到白色96孔板上,分别加入50μm待筛选的小分子化合物、10μm阳性对照药呋喃酮c-30,30℃振荡培养4h后用酶标仪测试菌液的发光值和细菌数量,计算发光值与细菌数比值。其中,小分子化合物的母液浓度为2.5mm,溶解在dmso中。以加入等量dmso的样品为对照组。其中,以上提及的试剂来源如表20:以对照组的发光值与细菌数比值为100%计,各小分子化合物对于las系统的检测结果如图1所示,对于荧光素酶自身发光抑制检测结果如图2所示。结果可见,黄岑素、姜黄素和大黄素的对照组活性百分比小于70%,故将黄芩素、姜黄素和大黄素用含tac-luxabcde-pet28a质粒的菌株进行验证,验证这几个小分子是否对荧光素酶自身发光有影响。经过验证,姜黄素和大黄素对荧光素酶自身发光有较强影响,而黄芩素对荧光素酶自身发光未有明显影响,具有las系统群体感应抑制活性,可继续进行后续的研究。实施例4分别采用实施例1中构建得到的具有las系统、rhl系统和pqs信号系统的大肠杆菌,对从海洋菌株中提取的粗提取物进行筛选,检测其抑制群体感应系统的效果。筛选的实验步骤为:将工程菌接种到5ml含有30μg/ml卡那霉素和100μg/ml氨苄青霉素的lb培养基中,37℃、250rpm振荡过夜,以1%接种量转接到lb培养基中,在37℃、250rpm振荡至对数生长中期,加入0.1%阿拉伯糖诱导剂和10μm自诱导小分子(分别为3-oxo-c12-hsl、c4-hsl以及pqs),每孔150ml菌液分装到白色96孔板上,分别加入50μg/ml海洋菌株粗提取物,30℃振荡培养4h后用酶标仪测试菌液的发光值和细菌数量,计算发光值与细菌数比值。其中,海洋菌株粗提取物的母液浓度为2.5mg/ml,溶解在dmso中。以加入等量dmso的样品为对照组。其中,以上提及的试剂来源如表21:以对照组的发光值与细菌数比值为100%计,结果如图3~图5所示。其中,图3为las系统的筛选结果,图4为rhl系统的筛选结果,图5为pqs信号系统的筛选结果。图3~图5中从左至右第一条柱为对照组结果,即100%。经过筛选,得到与对照组相比发光活性小于70%的提取物,如表21所示。表21筛选结果为了排除提取物对荧光素酶自身发光的抑制效果,采用实施例2所述方法,用于验证所筛选的提取物是否对荧光素酶自身发光有影响,结果如图6所示。除了r31粗提取物对荧光素酶自身发光有较强影响,其他提取物对荧光素酶自身发光未有明显影响,因此所筛选出来的提取物可用于进行下一步的研究。以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对以上实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。序列表<110>中山大学<120>铜绿假单胞菌群体感应体系抑制剂的快速筛选模型及其构建方法<160>20<170>siposequencelisting1.0<210>1<211>33<212>dna<213>人工序列(artificialsequence)<400>1aaagaattcaggaggtaaatggccttggttgac33<210>2<211>27<212>dna<213>人工序列(artificialsequence)<400>2aaatctagatcagagagtaataagacc27<210>3<211>286<212>dna<213>人工序列(artificialsequence)<400>3gcgcgtcccggagctgggggcaacctagctgccacctgcttttctgctagctattccagc60gaaaacatacagatttccggcgaaatcaaggctacctgccagttctggcaggtttggccg120cgggttctttttggtacacgaaagcaccgtcgaaaacgggaccgagccaggggagtgcag180ttccttctacccgaaggactgatacggctgttccgatcagcccacaaggcggcggtaagc240gtcggccgagtacttcggcctgaaaaaaccaggagaactgaacaag286<210>4<211>35<212>dna<213>人工序列(artificialsequence)<400>4aaaagatctggtaccgcgcgtcccggagctggggg35<210>5<211>27<212>dna<213>人工序列(artificialsequence)<400>5aaatctagatcagagagtaataagacc27<210>6<211>41<212>dna<213>人工序列(artificialsequence)<400>6attccatgggaatgaaatttggaaactttttgcttacatac41<210>7<211>38<212>dna<213>人工序列(artificialsequence)<400>7attggatccttaactatcaaacgcttcggttaagctta38<210>8<211>33<212>dna<213>人工序列(artificialsequence)<400>8aaagaattcaggaggtaaatgaggaatgacgga33<210>9<211>25<212>dna<213>人工序列(artificialsequence)<400>9aaatctagatcagatgagacccagc25<210>10<211>216<212>dna<213>人工序列(artificialsequence)<400>10catgccttttccgccaacccctcgctgttccccgccggccgctctggcacgccttatcgc60gggcgggcaggggcttatgcgcaggcggccgcccgtcctgtgaaatctggcagttaccgt120tagctttcgaattggctaaaaagtgttcatcggctacgcgtgaacacggacgccaatcgt180ttgcgcaggccgatctgcaagacccacacaagcccc216<210>11<211>26<212>dna<213>人工序列(artificialsequence)<400>11aaaggtacccatgccttttccgccaa26<210>12<211>24<212>dna<213>人工序列(artificialsequence)<400>12aaatctagaggggcttgtgtgggt24<210>13<211>35<212>dna<213>人工序列(artificialsequence)<400>13aaagaattcaggaggtaaatgcctattcataacct35<210>14<211>26<212>dna<213>人工序列(artificialsequence)<400>14aaatctagactactctggtgcggcgc26<210>15<211>253<212>dna<213>人工序列(artificialsequence)<400>15cgcccttcttgcttggttgccgttctcggatcccgcgcagcccggtgggtgtgccaaatt60tctcgcggtttggatcgcgccgattgccgcggcctacgaagcccgtggttcttctccccg120aaactttttcgttcggactccgaatatcgcgcttcgcccagcgccgctagtttcccgttc180ctgacaaagcaagcgctctggctcaggtatctcctgatccggatgcatatcgctgaagag240ggaacgttctgtc253<210>16<211>27<212>dna<213>人工序列(artificialsequence)<400>16aaaggtacccgcccttcttgcttggtt27<210>17<211>27<212>dna<213>人工序列(artificialsequence)<400>17aaatctagagacagaacgttccctctt27<210>18<211>29<212>dna<213>人工序列(artificialsequence)<400>18ttgacaattaatcatcggctcgtataatg29<210>19<211>44<212>dna<213>人工序列(artificialsequence)<400>19gatctttgacaattaatcatcggctcgtataatgggtacctttt44<210>20<211>44<212>dna<213>人工序列(artificialsequence)<400>20ctagaaaaggtacccattatacgagccgatgattaattgtcaaa44当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1