一种抗Aβ1-42蛋白聚集的合成多肽及其合成方法、应用与编码该合成多肽的基因与流程
本发明涉及多肽技术领域,特别涉及一种抗aβ1-42蛋白聚集的合成多肽及其合成方法、应用与编码该合成多肽的基因。
背景技术:
阿尔茨海默病(alzheimer’sdisease,ad)又称老年痴呆症,是一种以认知功能障碍为主的神经退行性疾病,其核心症状包括记忆力减退、学习能力下降、自理能力降低、对事物的理解力和判断力变差、行为情绪性等。ad的发生是基于基因、环境及行为共同作用的结果,随着人口老龄化进程加剧以及有效预测、治疗ad手段的缺乏,全球ad患者的数量逐年递增,此病已成为继心脏病、癌症、中风之后,导致老人死亡的第四大病因,因此开发对ad有效干预措施和治疗药物已成为倍受关注的社会问题。ad典型的病理特征主要有如下三点:一、脑神经元外出现的β淀粉样蛋白(aβ)异常沉积及其进一步形成的老年斑(sp);二、神经细胞内高度磷酸化的tau蛋白异常聚集形成的神经纤维缠结,神经元细胞纠缠会导致细胞凋亡;三、神经元缺失伴随着胶质细胞增生。ad的致病机制非常复杂,科学家们提出了多种假说,包括aβ级联假说、tua蛋白假说、胆碱功能假说等,其中,aβ级联假说是接受最广的学说之一,目前,关于ad的研究主要集中于aβ级联假说,这一假说亦是研究预防或治疗ad相关食品、药品的主流方向。
β淀粉样蛋白(aβ)是跨膜淀粉样前体蛋白(app)在内质网、高尔基体、溶酶体等细胞器经β、γ分泌酶的蛋白水解作用产生的小分子多肽。aβ级联假说认为,人体内的aβ处于平衡状态,当产生的aβ不能被及时降解、清除而在细胞外大量沉积时,神经毒素随之产生,进而引发ad。神经胶质细胞是脑内aβ的主要来源,通常所说的aβ多指aβ1-40或aβ1-42,其中aβ1-40倾向于形成典型的长纤维,主要起到延长纤维的作用,而aβ1-42更倾向于形成球形的斑块样沉积,更易聚集且不易降解,毒性更大,是构成ad老年斑的核心成分。根据该学说,减少aβ1-42蛋白的产生、提高aβ1-42蛋白的降解机制和抑制aβ1-42蛋白的聚集是ad预防、治疗以及检测的主要靶点。
目前用于抗aβ1-42蛋白聚集的主要药物包括高牛磺酸、褪黑素等。高牛磺酸是结合于aβ1-42蛋白单体的一种葡萄糖胺聚糖,可降低aβ1-42蛋白聚合,二期临床实验表明高牛磺酸可改善重症ad患者的认知功能,褪黑素可拮抗aβ1-42蛋白的聚集,研究发现在aβ1-42蛋白过表达的转基因小鼠中褪黑素可降低老年斑的聚集。此外,一些具有抗aβ1-42蛋白聚集的生物活性肽也正在研究中。生物活性肽是指对生物体具有良好生理功能的肽类化合物,来源广泛,包括由生物体中直接分离提取的天然多肽,通过化学或者生物方式合成的合成多肽,其中天然多肽所耗费的时间长、成本高、产量低、质量不可控,然而合成多肽具有纯度高、成本低、所需时间少、可规模化批量化生产等特点,现阶段多采用固相合成法合成多肽。
相较而言,多肽类的抑制剂有很好的生物相容性和拟生态性质,其合成和修饰比较便捷,稳定性好,与免疫系统相互作用的机会较小,穿透性强,不少以肽为基础的抑制剂表现出良好的抑制效果,所以肽和肽模拟物是有前景的预防和治疗ad的先导物。
技术实现要素:
为了克服现有技术存在的不足,本发明的目的是提供一种抗aβ1-42蛋白聚集的合成多肽及其合成方法、应用与编码该合成多肽的基因。
本发明的目的在于提供一种抗aβ1-42蛋白聚集的合成多肽。
本发明的目的还在于提供合成所述的一种抗aβ1-42蛋白聚集的合成多肽的方法。
本发明的目的还在于提供编码所述的一种抗aβ1-42蛋白聚集的合成多肽的基因。
本发明的另一目的在于提供所述的一种抗aβ1-42蛋白聚集的合成多肽的应用。
本发明的目的至少通过如下技术方案之一实现。
本发明提供的一种抗aβ1-42蛋白聚集的合成多肽,名称为lgfh,其氨基酸序列为leu-gly-phe-his,如seqidno:1所示;其中,leu为亮氨酸的氨基酸相应残基,gly为甘氨酸的氨基酸相应残基,phe为苯丙氨酸的氨基酸相应残基,his为组氨酸的氨基酸相应残基。
本发明提供的一种编码所述抗aβ1-42蛋白聚集的合成多肽的基因,碱基序列为cucggcuucuac,如seqidno:2所示,碱基数为12bp;其中,cuc为亮氨酸的密码子,ggc为甘氨酸的密码子,uuc为苯丙氨酸的密码子,uac为组氨酸的密码子。
本发明提供的一种合成所述抗aβ1-42蛋白聚集的合成多肽的方法,包括如下步骤:
按照所述抗aβ1-42蛋白聚集的合成多肽的氨基酸序列,从氨基酸序列的c端到n端,将fmoc保护氨基酸和树脂进行逐一偶联,然后用切割液脱除树脂和保护氨基酸侧链保护基,获得合成多肽粗品,粗品纯化后得到所述抗aβ1-42蛋白聚集的合成多肽。
优选地,所述树脂为二氯树脂。
进一步地,所述切割液的各组分体积比为:tfa(94.5%)、水(2%)、edt(2.5%)、tis(1%)。
进一步地,所述纯化包括:高效液相色谱仪纯化,并采用液相色谱-质谱/质谱(lc-ms)进行定性分析,测定其氨基酸序列。
本发明提供的一种抗aβ1-42蛋白聚集的合成多肽能够应用于制备抗aβ1-42蛋白聚集的食品或药品,同时也可应用于预防或治疗ad的食品、药品的研发。
与现有技术相比,本发明具有如下优点和有益效果:
本发明提供抗aβ1-42蛋白聚集的合成多肽,具有显著抗aβ1-42蛋白聚集的功效,能够改善记忆力,延缓阿尔兹海默症发病,可广泛应用于制备抗aβ1-42蛋白聚集、预防或治疗阿尔兹海默症的食品或药品的研发。因而,本发明提供的合成多肽能对ad及其他神经退行性疾病进行有效预防或治疗,在一定程度上改善神经退行性疾病的医疗状况,具有一定的社会价值和经济效益。
附图说明
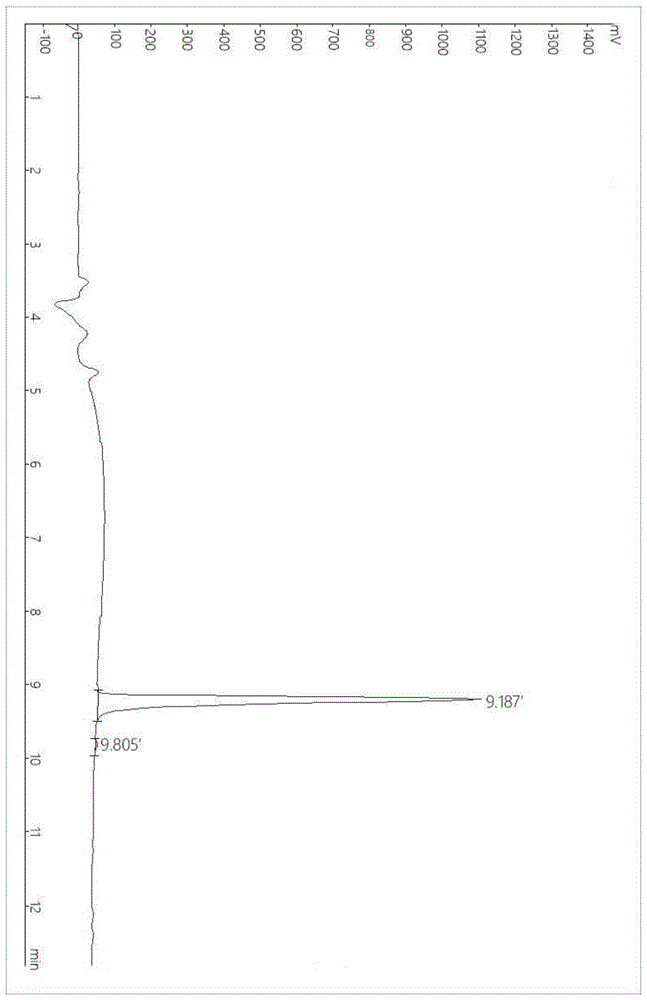
图1a为实施例1合成的多肽lgfh的高效液相色谱图;
图1b为实施例1合成的多肽lgfh的液相色谱-质谱/质谱(lc-ms)图;
图2a为实施例2中阴性对照组(controlgroup)、模型组(modelgroup)以及分别加入浓度为0.05mm的合成多肽(预孵育24h)、浓度为0.1mm的合成多肽(预孵育24h)、浓度为0.5mm的合成多肽(预孵育24h)、浓度为1mm的合成多肽(预孵育24h)的mtt细胞存活率柱形图,其中,“*”表示该组与对照组之间具有显著性差异;
图2b为实施例2中阴性对照组、模型组、合成多肽预孵育24h时0.1mm的多肽低剂量组和0.5mm的多肽高剂量组的细胞分局流式图。
图2c为实施例2中阴性对照组、模型组、合成多肽(预孵育24h)浓度为0.1mm的多肽低剂量组和合成多肽(预孵育24h)浓度为0.5mm的多肽高剂量组的aβ1-42蛋白聚集率柱形图,其中,“*”表示该组与对照组之间具有显著性差异;
图3a为实施例3中阴性对照组(controlgroup)、模型组(modelgroup)以及分别加入浓度为0.05mm的合成多肽(预孵育48h)、浓度为0.1mm的合成多肽(预孵育48h)、浓度为0.5mm的合成多肽(预孵育48h)浓度为1mm的合成多肽(预孵育48h)的mtt细胞存活率柱形图,其中,“*”表示该组与对照组之间具有显著性差异;
图3b为实施例3中阴性对照组、模型组、合成多肽(预孵育48h)浓度为0.1mm的多肽低剂量组和合成多肽(预孵育48h)浓度为0.5mm的多肽高剂量组的细胞分局流式图。
图3c为实施例3中阴性对照组、模型组、合成多肽(预孵育48h)浓度为0.1mm的多肽低剂量组和合成多肽(预孵育48h)浓度为0.5mm的多肽高剂量组的aβ1-42蛋白聚集率柱形图,其中,“*”表示该组与对照组之间具有显著性差异。
具体实施方式
以下结合附图和实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
具体实施例中,本发明提供的一种抗aβ1-42聚集的合成多肽,名称为lgfh,氨基酸序列为:leu-gly-phe-his,如序列表seqidno:1所示;
其中,leu为亮氨酸的氨基酸相应残基,gly为甘氨酸的氨基酸相应残基,phe为苯丙氨酸的氨基酸相应残基,his为组氨酸的氨基酸相应残基。
本发明的抗aβ1-42蛋白聚集的合成多肽可通过多肽固相合成法或基因工程技术合成;
其中,通过多肽固相合成法合成时,采用标准fmoc方案,选用二氯树脂;采用fmoc保护氨基酸n端,各保护氨基酸为fmoc-l-leu-oh、fmoc-gly-oh、fmoc-l-phe-oh、fmoc-l-his-oh。保护氨基酸和树脂进行逐一偶联可采用固相合成领域常规的偶联试剂和活化试剂,包括采用4-二甲氨基吡啶(dmap)和二环己基碳二亚胺(dcc)完成第一个保护氨基酸和树脂的偶联,采用1-羟基苯并三唑(hobt)进行余下保护氨基酸之间的偶联。按照多肽c端到n端的氨基酸顺序,将保护氨基酸和树脂进行逐一偶联,然后裂解液脱除树脂和保护氨基酸侧链保护基,获得合成多肽粗品,对合成多肽粗品纯化后,得到抗aβ1-42蛋白聚集的合成多肽。
具体实施例中,本发明基于aβ级联假说,采用e22g-aβ42-mcherryhek-293转基因细胞模型对合成多肽lgfh预防进行ad老年斑聚集的体外研究。
采用四环素诱导e22g-mcherryhek-293细胞株进行体外实验。四环素能够诱导aβ蛋白在细胞内聚集而产生毒性,可模拟ad患者体内神经元细胞老年斑的病理发展过程。四环素诱导使aβ蛋白在细胞内形成红色荧光蛋白并发出红色荧光,采用cytoflexs流式细胞仪进行对mcherry红色荧光进行定位、定量检测。
实施例1
固相合成法合成多肽lgfh
1、合成路线工艺流程
以二氯树脂为载体,先把树脂溶胀,再将第一个氨基酸的c端羧基与树脂上的活性位点氯反应,待首个氨基酸接在树脂上以后,进行脱水缩合接第二个氨基酸,缩合完成后再脱fmoc保护。按照如seqidno:1所示的氨基酸序列重复操作,从c端到n端依次接完其余的氨基酸,最后用切割试剂把多肽从树脂上切割下来,所述切割试剂中各组分的体积比为tfa(94.5%)、水(2%)、edt(2.5%)、tis(1%)。
2、合成过程
以二氯树脂为载体,先把二氯树脂溶胀,称取1.28g二氯树脂,放入反应柱里,然后在反应柱里加入20mldcm试剂,振荡30min,活化待用。连接首个氨基酸,通过沙芯抽滤掉dcm溶剂,加入1.05倍二氯树脂摩尔量的fmoc-l-his-oh,再加入10倍二氯树脂摩尔量的diea(二异丙基乙胺),最后加入10mldmf溶解,振荡1h。反应完后用dmf和dcm交替清洗6遍。加入20ml含体积分数为20%哌啶的dmf溶液,5min后去除dmf溶液。再加入20ml含体积分数为20%哌啶的dmf溶液,振荡15min进行脱保护。接着,去除哌啶溶液,取15粒树脂(二氯树脂),用乙醇洗三次,加入茚三酮、吡啶及苯酚各一滴,然后在105℃-110℃加热5min,变深蓝色为阳性反应,可以继续接下一个氨基酸,如果不变色则为阴性,需要重新脱保护。接下来进行首次清洗,依次用15mldmf(n,n-二甲基甲酰胺)、15ml甲醇及15mldmf清洗,清洗的次数为两次。加入3倍树脂(二氯树脂)摩尔量的fmoc-l-phe-oh,3倍树脂摩尔量的hbtu,均用10mldmf的dmf溶液溶解,加入10倍树脂摩尔量的diea,反应30min进行缩合。接着进行第二次清洗,依次用15毫升dmf、15毫升甲醇及15毫升dmf清洗,清洗的次数为两次。去除溶剂,取15粒二氯树脂,用乙醇洗三次,加入茚三酮、吡啶及苯酚各200ml,然后在105℃-110℃加热5min,无色为阳性反应,若为蓝色则需要重新缩合。按照以上方法重复操作,依次接完剩余的氨基酸,完成肽链的延伸。等最后一个氨基酸接好以后整条肽的合成便已反应完成,用dmf洗涤反应3遍,dcm洗涤反应3遍,甲醇洗涤反应3遍,最后抽干肽树脂以完成最后的收缩阶段。
3、氨基酸侧链脱保护与树脂的切割
配置切割液15ml,其中切割液各组分的体积百分比为:tfa(94.5%)、水(2%)、edt(2.5%)、tis(1%)。将树脂(二氯树脂)装入烧瓶中,恒温(30℃)振荡2h。将裂解液用氮气吹干,然后倒入离心管中,倒入40ml乙醚。封口并放入离心机中离心5min,离心速率为3000rpm,倒掉上清液,留下底部白色沉淀。再用乙醚洗6次,然后常温挥干,即得粗品肽。
4、hplc纯化
首先将所述粗品肽放入器皿中,用30-50ml体积分数为50%的乙腈水溶液完全溶解,超声2min。再用0.45μm滤膜过滤溶解液。取3μl溶解液用分析级hplc分析粗品肽以便于后续制备。流动相是水和乙腈,时间30min,梯度洗脱,先将hplc用起始梯度平衡5min然后进样,起始梯度体积比为:水95%,乙腈5%,结束梯度体积比为:水5%,乙腈95%。将溶解好的样品做进样准备。制备hplc平衡10min,起始梯度为:水95%,乙腈5%,结束梯度为:水25%,乙腈75%,梯度时间40min。收集从检测器出来的样品。以上过程均在symphony型12通道多肽合成仪中完成,合成的多肽(抗aβ1-42蛋白聚集的合成多肽)经shimadzu高效液相色谱仪纯化,纯度达到99%以上,并采用液相色谱-质谱/质谱联用技术(lc-ms)进行定性分析,测定其氨基酸序列。
合成的多肽的高效液相色谱图和液相色谱-质谱/质谱(lc-ms)图分别如图1a和图1b所示,由图1a和图1b分析表明,合成的多肽的一级氨基酸序列是leu-gly-phe-his,即得到目标多肽,合成获得抗aβ1-42蛋白聚集的合成多肽。
实施例2
合成多肽lgfh(抗aβ1-42蛋白聚集的合成多肽)预孵育24h体外抗aβ1-42蛋白聚集的活性实验
1、实验方法
培养基的配制:取35ml高糖培养基(dmem)、取4ml胎牛血清(fbs)、1mll-谷氨酰胺、40μl的hygromycinb和20μl的blasticidins抗生素配制成40ml的完全培养基。
合成多肽(lgfh)溶液的配制:称取4.543mg的多肽lgfh,用10ml所述完全培养基溶解,过0.22μm的滤头后,母液浓度为1mm,再用所述完全培养基将母液稀释至上述实验所需浓度。
2mg/ml四环素溶液配制:称取10mg的四环素,用5ml的1ípbs缓冲液配制,过0.22μm的滤头后,-20℃避光保存备用。
采用e22g-mcherryhek-293细胞进行培养和实验。实验分组:阴性对照组(controlgroup,e22g-mcherryhek-293细胞,不加入四环素诱导);模型对照组(modelgroup,e22g-mcherryhek-293细胞,采用四环素诱导);多肽lgfh低剂量组(0.1mm)和多肽lgfh高剂量组(0.5mm),每组设三个平行。
使用6孔板进行细胞铺板,每孔的细胞个数为20000,细胞贴壁生长24h后,按照实验分组分别加入所述完全培养基和合成多肽溶液(lgfh多肽溶液)。培养24h后,对各组进行换液,按照实验分组分别加入所述完全培养基和合成多肽溶液(lgfh多肽溶液),其中模型对照组、多肽lgfh低剂量组(0.1mm)和多肽lgfh高剂量组(0.5mm)需另加入四环素,四环素在完全培养基中的质量分数为10μg/ml,继续诱导培养72h。采用cytoflexs流式细胞仪进行对mcherry红色荧光进行检测,采用561激发器下的ecd通道。其中,aβ聚集率的计算如下所示:
aβ聚集率=处理组平均荧光强度/模型组强度*100%。
实施例3
合成多肽lgfh(抗aβ1-42蛋白聚集的合成多肽)预孵育48h体外抗aβ1-42蛋白聚集的活性实验
1、实验方法
培养基的配制:取35ml高糖培养基(dmem)、取4ml胎牛血清(fbs)、1mll-谷氨酰胺、40μl的hygromycinb和20μl的blasticidins抗生素配制成40ml的完全培养基。
合成多肽(lgfh)溶液的配制:称取4.543mg的多肽lgfh,用10ml所述完全培养基溶解,过0.22μm的滤头后,母液浓度为1mm,再用所述完全培养基将母液稀释至上述实验所需浓度。
2mg/ml四环素溶液配制:称取10mg的四环素,用5ml的1ípbs缓冲液配制,过0.22μm的滤头后,-20℃避光保存备用。
采用e22g-mcherryhek-293细胞进行培养和实验。实验分组:阴性对照组(controlgroup,e22g-mcherryhek-293细胞,不加入四环素诱导);模型组(modelgroup,e22g-mcherryhek-293细胞,采用四环素诱导);多肽lgfh低剂量组(0.1mm)和多肽lgfh高剂量组(0.5mm),每组设三个平行。
使用6孔板进行细胞铺板,每孔的细胞个数为20000,细胞贴壁生长24h后,按照实验分组分别加入所述完全培养基和合成多肽溶液(lgfh多肽溶液)。培养48h后,对各组进行换液,按照实验分组分别加入所述完全培养基和合成多肽溶液(lgfh多肽溶液),其中模型对照组、多肽lgfh低剂量组(0.1mm)和多肽lgfh高剂量组(0.5mm)需另加入四环素,四环素在完全培养基中的质量分数为10μg/ml,继续诱导培养72h。采用cytoflexs流式细胞仪进行对mcherry红色荧光进行检测,采用561激发器下的ecd通道。其中,aβ聚集率的计算如下所示:
aβ聚集率=处理组平均荧光强度/模型组强度*100%。
2、实验结果
阴性对照组及空白对照组(controlgroup)是未加入四环素诱导的细胞,模型组(modelgroup)则是加入四环素诱导的细胞,lgfh是加入不同浓度合成多肽lgfh的实验组。阴性对照组和不同浓度的合成多肽lgfh预敷育24h的mtt细胞存活率图如图2a所示;阴性对照、模型对照组、0.1mm的多肽低剂量组和0.5mm的多肽高剂量组预敷育24h的分局流式图和aβ1-42蛋白聚集率柱形图分别如图2b、2c所示;
由实施例2可知,多肽预孵育24h时,从图2a可看出,细胞的存活率呈一定的浓度依赖性,出现高浓度抑制现象。多肽浓度为0.1mm时具有促细胞增殖现象但与对照组不存在现显著性差异,多肽浓度为0.5mm时细胞存活率在80%-100%之间,即不存在细胞毒性,因此可选择0.1、0.5mm两种浓度进行后续实验;由图2b分局流式图可知,模型对照组的mcherry荧光强度高于阴性对照组,多肽给药组的mcherry荧光强度相较于模型对照组均有所降低。用mcherry平均荧光强度来展示aβ1-42蛋白聚集率,由图2caβ1-42蛋白聚集柱形图可知,相较于阴性对照组,模型对照组的多肽aβ1-42蛋白聚集率显著性增加,说明造模成功。相较于模型对照组,高(0.5mm)、低(0.1mm)剂量的多肽给药组的aβ1-42蛋白聚集率均呈显著性降低,其中多肽低剂量组的aβ1-42蛋白聚集率下降较多,说明多肽lgfh可降低aβ1-42蛋白聚集率,而且低剂量组的抗aβ1-42蛋白聚集效果优于高剂量组。
阴性对照组和不同浓度的合成多肽lgfh预敷育48h的mtt细胞存活率图如图3a所示;阴性对照、模型对照组、0.1mm的多肽低剂量组和0.5mm的多肽高剂量组预敷育48h的的分局流式图和aβ1-42蛋白聚集率柱形图分别如图3b、3c所示。
由实施例3可知,多肽预孵育48h时,从图3a可看出,细胞的存活率存在浓度依赖性,出现高浓度抑制现象。多肽浓度为0.1mm时具有促细胞增殖作用但与对照组不存在现显著性差异,多肽浓度为0.5mm时细胞存活率在80%-100%之间,不存在细胞毒性,因此可选择0.1、0.5mm两种浓度进行后续实验;由图3b分局流式图可知,模型对照组的mcherry荧光强度高于阴性对照组,多肽给药组的mcherry荧光强度相较于模型对照组均有所降低。采用mcherry平均荧光强度来展示aβ1-42蛋白聚集率,由图3caβ1-42蛋白聚集图可知,相较于阴性对照组,模型对照组的多肽aβ1-42蛋白聚集率显著性增加,说明造模成功。相较于模型对照组,高(0.5mm)、低(0.1mm)剂量的多肽给药组的aβ1-42蛋白聚集率均呈显著性降低,其中多肽低剂量组的aβ1-42蛋白聚集率下降较多,说明多肽lgfh可降低aβ1-42蛋白聚集率,而且低剂量组的抗aβ1-42蛋白聚集效果优于多肽高剂量组。
上述结果表明,相同浓度的多肽预孵育时间无论是24h还是48h,均存在抗aβ1-42蛋白聚集的作用;多肽预孵育时间相同时,高、低剂量的多肽浓度均具有抗aβ1-42蛋白聚集的作用,而且,0.1mm多肽低剂量组的抗aβ1-42蛋白聚集效果优于多肽高剂量组。因此,0.1mm合成多肽lgfh预孵育24h和48h时均具有较好的改善记忆、抑制ad的发病进程,可应用于制备抗aβ1-42蛋白聚集以及预防、治疗ad的食品或药品,对包括ad疾病在内的神经退行性疾病进行有效预防和治疗。
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
序列表
<110>华南理工大学
<120>一种抗aβ1-42蛋白聚集的合成多肽及其合成方法、应用与编码该合成多肽的基因
<160>2
<170>siposequencelisting1.0
<210>1
<211>4
<212>prt
<213>人工合成(人工序列)
<400>1
leuglyphehis
1
<210>2
<211>12
<212>dna/rna
<213>人工合成(人工序列)
<400>2
cucggcuucuac12
- 还没有人留言评论。精彩留言会获得点赞!
- 针对磷酸化TAU蛋白的骆驼科单结构域抗体以及生产其缀合物的方法与流程
- 一种用于预防或治疗阿尔茨海默症的组合物的制作方法与工艺
- 骨形成蛋白‑9作为制备治疗和/或预防与胆碱能系统退变相关疾病的药物组合物的用途的制作方法与工艺
- 一种用于增强记忆力的血浆提取物及其制备方法和应用与流程
- 用于治疗神经退化性疾病的新化合物的制作方法与工艺
- 一种高灵敏度可回收纳米生物传感器及其制备方法与应用与流程
- 从血浆中分离用于治疗阿尔兹海默症的混合物的方法及混合物和应用与流程
- 2‑吲哚酮衍生物及其开环衍生物及合成方法与用途与流程
- 神秘果叶提取物在治疗阿尔兹海默病的药物制备中的应用的制造方法与工艺
- 一种Tau蛋白抑制剂及在制备治疗阿尔兹海默症的药物中的应用的制造方法与工艺