针对磷酸化TAU蛋白的骆驼科单结构域抗体以及生产其缀合物的方法与流程
本发明涉及针对磷酸化tau蛋白的抗体及其缀合物。本发明还涉及这些抗体缀合物用于治疗或者诊断由磷酸化tau蛋白所介导的疾病的用途。
背景技术:
所有痴呆症病例的约70%是由于阿尔茨海默氏病(AD),它与对认知重要的脑区和神经回路的选择性损伤相关。阿尔茨海默氏病的特征是神经纤维缠结(NFT),尤其是在海马的锥体神经元以及大量淀粉样蛋白斑块中。
对于AD脑标本的超微结构研究已显示NFT主要由成对螺旋丝(PHF)组成,并且这些丝是成对的轴向相对的原纤维,直径大约10nm,具有65nm的规律周期性的螺旋立体构象(Kidd 1963Nature,197,192–3;等人.1976J Neurol Sci.,27,173–81)。在1985年,Brion等人(Archives de biologie(Bruxelles),95,229–235)证实PHF的主要成分是蛋白tau,一种微管蛋白相关蛋白(MAP)。这个结果被数个作者所确认:Grundke-Iqbal等人.1986Proc Natl Acad Sci U.S.A.,83,4913–7;Kosik等人.1986Proc Natl Acad Sci U.S.A.,83,4044–8;Delacourte和Defossez 1986J Neurol Sci.,76,173–86;Wood等人.1986Proc Natl Acad Sci U.S.A.,83,4040–3;Nukina和Ihara 1986J Biochem.,99,1541–4;Pollock等人.1986Lancet,2,1211;Montejo de Garcini等人.1986Biochem Biophys Res Commun.,141,790–6.接着显示在NFT中的蛋白tau被异常地磷酸化(Grundke-Iqbal和Iqbal,等人.1986Proc Natl Acad Sci U.S.A.,83,4913–7;Ihara等人.1986J Biochem.,99,1807–10;Iqbal等人.1986Lancet,2,421–6;Brion等人.1986Lancet,2,1098;等人.1993J Biol Chem.,268,24374–84),其导致了正常的tau和其它MAP的隐没(sequestration)(Alonso等人.1994Proc Natl Acad Sci U.S.A.,91,562–6;Alonso等人.1997Proc Natl Acad Sci U.S.A.,94,298–303),这引起微管的拆卸,并且因此破坏轴突输送、正常的神经元和突触功能,导致突触的损失和神经元的死亡。过度磷酸化的tau还变成不溶解的,并且自聚集成为成对螺旋丝(PHF)和NFT。所有这些过程的结局是痴呆症。Tau磷酸化是通过多种激酶和磷酸酶之间的平衡所调节的(Iqbal等人.2005Biochim Biophys Acta,1739,198–210;Blennow等人.2006Lancet,368,387–403)。随着异常磷酸化tau的量的增加,在AD脑中tau的水平相比年龄相匹配的对照中的高约八倍(Khatoon等人.1992J Neurochem.,59,750–3)。目前未知tau和NFT的形成是否是AD的原因或结果(Blennow等人.2006Lancet,368,387–403)。
在70年代,tau被首次分离并鉴定为MAP(Weingarten等人.1975Proc Natl Acad Sci U.S.A.,72,1858–62;Cleveland等人.1977J Mol Biol.,116,227–47;Cleveland等人.1977J Mol Biol.,116,207–25),并且主要在神经元中表达(Tucker 1990Brain Res Brain Res Rev.,15,101–20;Schoenfeld和Obar 1994Int Rev Cytol.,151,67–137)。人tau基因位于染色体17,占据超过100kb并且含有至少16个外显子(Neve等人.1986Brain Res.,387,271–80;Andreadis等人.1992Biochemistry,31,10626–33;Andreadis等人.1995Nucleic Acids Res.,23,3585–93)。通过选择性剪接,tau基因产出不同的mRNA并且导致产生六种tau同种型(Goedert等人.1989Neuron,3,519–26;Himmler等人.1989Mol Cel Biol.,9,1381–8)。六种tau同种型彼此的区别在于存在三或四个微管结合重复(R)(每个31至32个氨基酸)和存在一个、两个、或零个氨基末端插入(N)(每个29个氨基酸),产生了0N3R、1N3R、2N3R、0N4R、1N4R、和2N4R tau。Tau蛋白的六种同种型从352个至441个氨基酸(Goedert等人.1989Neuron,3,519–26;Himmler等人.1989Mol Cell Biol.,9,1381–8;Goedert等人.1989The EMBO J.,8,393–9)。这些同种型的每种可能发挥特定的生理功能,因为它们在发育期间是差异表达的。例如,0N3R tau是仅存在于胎儿脑中的同种型,然而所有六种同种型都在成年期表达(Kosik等人.1989Neuron,2,1389–97;Goedert和Jakes 1990EMBO J.,9,4225–30;Buée等人.2000Brain Res Brain Res Rev.,33,95–130)。
在正常脑中4R:3R tau的mRNA和蛋白比例近似相等,但是在大部分的神经退行性tau蛋白病(tauopathies)中的失调(disturbance)通常增加这些比例(Hanger等人.2009Trends Mol Med.,15,112–9)。使用特异性mAb,过度磷酸化的/病态的tau蛋白可以通过Western印记而可视化,如在55至74kDa间的条带(Buée等人.2000Brain Res Brain Res Rev.,33,95–130)。
Tau441(441个氨基酸)含有80个丝氨酸/苏氨酸和五个假定酪氨酸磷酸化位点,并且确定的tau功能是通过它的微管结合结构域(R)结合微管,从而促进微管的组装和稳定(Weingarten等人.1975Proc Natl Acad Sci U.S.A.,72,1858–62;Cleveland等人.1977J Mol Biol.,116,227–47;Cleveland等人.1977J Mol Biol.,116,207–25;等人.1990Acta Histochem Suppl.,39,357–64;Nixon和Sihag 1991Trends Neurosci.,14,501–6;Drechsel等人.1992Mol Biol Cell.,3,1141–54;Brandt和Lee 1993J Neurochem.,61,997–1005)。Tau促进微管组装的活性是通过它的磷酸化程度调节的。过度磷酸化抑制tau刺激微管组装的能力(Lindwall和Cole 1984J Biol Chem.,259,5301–5)。tau的AD过度磷酸化已经在超过40个丝氨酸/苏氨酸位点被鉴定(Hasegawa等人.1992J Biol Chem,267,17047–54;Morishima-Kawashima等人.1995J Biol Chem.,270,823–9;Hanger等人.1998Trends Mol Med,15,112–9;Vega等人.2005Brain Res Brain Mol Res.,138,135–44)。发现AT8mAb识别的表位Ser202的磷酸化与缠结的形成相关,并且据报道是AD型的tau病理的早期标记物(Mercken等人.1992Acta Neuropathol.,84,265–72;Biernat等人.1992EMBO J.,11,1593–7;Su等人.1994Neuroreport,5,2358–62;Hernández等人.2003Neurob Aging.,24,1087–94;Blazquez-Llorca等人.2011J Alzheimer’s Dis.,26,683–98)。另据报道,接近tau的C端的Ser422的磷酸化与NFT的发展密切相关。发现在Ser422处tau磷酸化的量随AD的严重性而增加,并且该磷酸化位点还是AD突出的病理(Bussière等人.1999Acta Neuropathol.,97,221–30;Augustinack等人.2002Acta Neuropathol.,103,26–35;Haase等人.2004J Neurochem.,88,1509–20;Pennanen和2005Biochem Biophys Res Commun.,337,1097–101;Deters等人.2008Eur J Neurosci.,28,137–47;Grueninger等人.2011Mol Cell Biochem.,357,199–207)。
与淀粉样蛋白β(Aβ)沉积不同,在AD脑中NFT以定型的(stereotypical)且可预测的模式发展(Arnold等人.1991Cereb Cortex,1,103–16;Braak和Braak 1991Acta Neuropathol.,82,239–59;Braak等人.2006Acta Neuropathol.,112,389–40)。Braak和Braak(1991Acta Neuropathol.,82,239–59)在他们的临床病理学研究中提出了描述NFT的进展的六个阶段。第一NFT始终出现在横嗅(鼻周的)区域(阶段I),连同合适的内嗅皮质,然后传播至海马的CA1区域(阶段II)。接着,NFT发展并在边缘结构例如海马结构的下托(subiculum)中(阶段III)以及杏仁核、丘脑和屏状核中(阶段IV)积聚。最后,NFT出现在所有的同形皮质(isocortical)区域(同形皮质阶段),相关的区域先受影响并且更为严重(阶段V),随后影响初级感觉、运动和视觉区域(阶段VI)。纹状体和黑质的严重受累发生在同形皮质阶段后期(Serrano-Pozo,Frosch,等人.2011Cold Spring Harb Perspect Med.,1,a006189)。来自不同小组的多个临床病理学研究确定脑中的NFT负担与痴呆症的严重性和持续时间相关(Arriagada等人.1992Neurology,42,631–9;Bierer等人.1995Arch Neurol.,52,81–8;Gómez-Isla等人.1997Ann Neurol.,41,17–2;Giannakopoulos等人.2003Neurology,60,1495–500;Ingelsson等人.2004Neurology,62,925–31)。以上描述的NFT的选择性分布与AD型痴呆综合征的典型的分级神经心理学谱相匹配(Serrano-Pozo等人.2011Cold Spring Harb Perspect Med.,1,a006189)。
在阿尔茨海默氏病(AD)中,过度磷酸化和错误折叠的tau的积聚发生在神经元的胞体、树突和轴突。神经纤维缠结(NFT)与胞体中聚集的tau有关,并且主要在海马、内嗅皮质和同形皮质层的中型锥体神经元中发现。神经纤维网细丝(Neuropil threads)(Braak等人.1986Neurosci Lett.,65,351–5)是小的、成碎片的、曲折的过程,在细胞体间穿梭。这些曲折的纤维(Duyckaerts等人.1989Neuropathol Appl Neurobiol.,15,233–47)含有PHF,PHF在携带缠结的神经元的树突中积聚(Braak和Braak 1988Neuropathol Appl Neurobiol.,14,39–44)。在AD中神经纤维网细丝总是伴随神经纤维缠结,并且出现在神经元纤维退化的早期阶段(Braak等人.1994Acta Neuropathol.,87,554–67)。最后,另外的tau损伤:在神经炎斑块周围发现含有过度磷酸化的tau的营养不良的神经突起。它们主要由富含在成对螺旋丝(PHF)中的轴突过程构成(Kidd 1964Brain,87,307–20)。有趣地是,营养不良的神经突起还可以对淀粉样前体蛋白(APP)、线粒体孔蛋白和嗜铬粒蛋白A是免疫反应性的(Su等人.1998Acta Neuropathol.,96,463–71;Dickson等人.1999Exp Neurol.,156,100–10;Woodhouse等人.2006Acta Neuropathol.,112,429–37;Pérez-Gracia等人.2008Acta Neuropathol.,116,261–8)。
除阿尔茨海默氏病(AD)之外,称为tau蛋白病的相关神经退行性疾病家族的特征还在于含有tau的神经纤维缠结的沉积。这些包括进行性核上性麻痹(PSP;斯-里-奥(Steele-Richardson-Olszewski)疾病)、皮质基底核退化(CBD)、皮克病(Pick’s disease,PD)、由tau突变引起的与染色体17关联的额颞痴呆症伴帕金森(FTDP-17)。在这些tau蛋白病的每一种中,神经元纤维病理是由异常地过度磷酸化tau组成的,并且在新皮质中的这些病理变化与痴呆症相关。不同的tau聚集和丝存在于不同的疾病中,并且由不同的tau同种型成分(tau 3R或4R)产生。例如,由于编码第二微管结合重复(R2)的外显子10的排斥,在皮克病中大多数tau是3R同种型。相反,在CBD和PSP中,大多数tau是4R(Morris等人.1999Mov Dis.,14,731–6;Sergeant等人.2005Biochim Biophys Acta.,1739,179–197;Yoshida 2006Neuropathology,26,457–470;Liu和Gong 2008Mol Neurodegener.,3,8;Zhong等人.2012J Biol Chem.,287,20711–9;Avila等人.2013Aging Dis.,4,23–8;Iqbal等人.2013Front Neurol.,4,112)。
淀粉样蛋白斑块和tau损伤的体内检测对于进行阿尔茨海默氏病(AD)和其它tau蛋白病早期诊断以及随访治疗效果至关重要。目前这些损伤的检测基于对于这些变化具有良好亲和性和特异性的分子。至今,在人中,正电子发射断层扫描(PET)和磁共振成像(MRI)使得淀粉样蛋白斑块可视化。然而,在体内成像方式中所使用的大多数化合物不能结合tau损伤。因此,需要开发特异性的tau成像试剂。最近,Maruyama等人证实了在AD患者中使用[11C]-PBB3-PET使得在体内使tau损伤可视化成为可能(Maruyama等人.2013Neuron.,79,1094-108)。尽管如此,需要放射性同位素标记化合物以及空间分辨率低仍然是基于PET方法的主要缺点。相反,MRI具有更高的空间分辨率,并且广泛用于动物和患者成像。即使如此,低灵敏度的MRI需要开发能够检测患者中NFT的专用的造影剂。
常规的免疫球蛋白是异四聚体,由两条重链和两条轻链组成,组合分子量约150kDa。在骆驼科(Camelidae)成员中,相当比例的血清抗体是同源二聚体IgG,分子量约80kD(Hamers-Casterman等人.1993Nature,363,446-448)。这些重链免疫球蛋白(Ig)包含三个结构域,其可变区被称为VHH。重组VHH(约12至14kD的尺寸)构成完整的抗原结合结构域并显示出广阔的抗原结合谱。扩大它们的高变区,并表现出独特的特性,如三至四个(与常规抗体VL相互作用的)疏水框架残基被更多亲水性氨基酸取代。为了稳定扩大的CDR,除了常规的二硫键以外,在单峰骆驼CDR1和CDR3之间,在美洲驼的CDR2和CDR3之间,VHH可具有额外的二硫键(Harmsen和De Haard 2007Appl Microbiol Biotechnol.,77,13-22;Muyldermans 2001J Biotechnol.,74,277-302)。扩展的CDR3环可以采取凸面构象,而常规的互补位被限制在凹的或者平面结构(Muyldermans 2001J Biotechnol.,74,277-302)。这些特征允许VHH识别对于常规抗体而言免疫原性较差的独特表位(Lafaye等人.2009Mol Immuno.,46,695-704;Wernery 2001J Vet Med B Infect Dis Vet Public Health.,48,561-568)。尽管VHH被定义为单价抗体,默认排除任何亲合力效果,被测量表示为体外IC50的生物活性可类似于常规的二价抗体分子(Thys等人.2010Antiviral Res.,87:257-264)。
已经描述了如噬菌体展示的方法从免疫的骆驼或者美洲驼的VHH库中选择抗原特异性VHH。VHH基因克隆至噬菌体展示载体中,通过筛选获得抗原结合物,选择的VHH在细菌中表达。与常规抗体片段(Fab或者scFv)相比,重组VHH具有许多优点,因为只克隆了一个结构域,且因为这些VHH表达良好,高度溶于水性环境并且在高温下是稳定的。由于VHH的尺寸小,约12-14kDa,它们迅速通过肾脏过滤,肾脏过滤的截断值约60kDa,导致在血液中快速清除。此外,小尺寸导致快速的组织穿透。VHH血清半衰期短,约2小时,相较于scFv的4h和IgG的50h而言,这对于使用成像的体内诊断而言是有利的,并且有利于偶联至感兴趣物质的VHH进行靶向从而用于治疗疾病,因为人们可以预期非特异结合的VHH将从组织中迅速消除。进一步的,具有至少8.5等电点的VHH能够通过微胞饮作用(micropinocytosis)和吸收介导的内吞作用而迁移穿过BBB。这样的VHH可用于肽载体的制备将感兴趣物质递送穿过哺乳动物血脑屏障(国际申请WO2009/004495和WO 2010/004432)。
技术实现要素:
在产生本发明的研究框架内,本发明人用阿尔茨海默氏病脑(海马)提取物中富含的磷酸化tau(phosphorylated-tau)(磷酸化tau(phospho-tau)、磷酸化tau(phosphor-tau)或磷酸化tau(p-tau))和磷酸化tau蛋白,免疫两只羊驼(alpacas)(羊驼(Lama pacos))。通过噬菌体展示文库的构建和筛选鉴定靶向磷酸化tau的VHH。接着细菌表达,通过免疫印迹和ELISA针对磷酸化tau表位筛选选择的VHH,之后在来自患有神经病理学确认的AD或其它tau蛋白病的人病例的脑切片上测试,以及在来自患有缠结病理的转基因小鼠模型的脑切片上测试。本发明人鉴定了一种被称为Tau-A2或A2的VHH,在突变的tau转基因小鼠中以及在AD人脑样本中,它免疫标记胞体缠结、神经纤维网细丝和营养不良的神经突起。此外,VHH Tau-A2允许在其它tau蛋白病、额颞痴呆症、皮质基底核退化和进行性核上性麻痹中的神经胶质磷酸化tau内含物的检测。这种VHH Tau-A2具有氨基酸序列SEQ ID NO.4,包含氨基酸序列SEQ ID NO.1所示的CDR1(互补决定区1)、氨基酸序列SEQ ID NO.2所示的CDR2和氨基酸序列SEQ ID NO.3所示的CDR3。VHH Tau-A2特异性识别在tau磷酸化肽C端中的磷酸化丝氨酸422(pS422)。进一步的,使用位点特异性偶联方法,以顺磁性的试剂钆(Gd)或Alexa488荧光团进行VHH Tau-A2的标记,产生功能有效的VHH缀合物。在静脉施用荧光VHH Tau-A2之后,活体(live)双光子显微术显示VHH Tau-A2从血管中逐渐溢出,并且穿透入脑实质中,精确趋向缠结。
相应地,本发明提供了一种分离的骆驼科重链抗体的可变结构域(称为VHH),其特征在于,其针对磷酸化tau蛋白,优选针对磷酸化tau蛋白的磷酸化丝氨酸422。
如本文中所使用的,tau蛋白涉及熟知的tau蛋白的六种同种型(Goedert等人.1989Neuron,3,519–26;Himmler等人.1989Mol Cel Biol.,9,1381–8),优选4R同种型。
在一个优选的实施方案中,本发明的VHH是通过使用衍生自tau蛋白的C端的序列是CSIDMVDS(PO3H2)PQLATLAD(SEQ ID NO.6)的单磷酸化肽、或人阿尔茨海默氏病脑(优选海马)提取物富含的磷酸化tau、或磷酸化tau蛋白对骆驼科进行免疫而获得的,所述磷酸化tau蛋白比如是其中丝氨酸422被磷酸化的磷酸化tau蛋白,优选使用衍生自tau蛋白的C端的序列是CSIDMVDS(PO3H2)PQLATLAD(SEQ ID NO.6)的单磷酸化肽。
人阿尔茨海默氏病脑(优选海马)提取物中富含的磷酸化tau可以如在Mercken等人1992Acta Neuropathol.,84,265-272中描述的获得。
有利的是,本发明的VHH通过包含以下步骤的方法获得:
(a)使用衍生自tau蛋白的C端的序列是CSIDMVDS(PO3H2)PQLATLAD(SEQ ID NO.6)的单磷酸化肽、或人阿尔茨海默氏病脑(优选海马)提取物富含的磷酸化tau、或磷酸化tau蛋白免疫骆驼科,优选羊驼,所述磷酸化tau蛋白比如是其中丝氨酸422被磷酸化的磷酸化tau蛋白,优选使用衍生自tau蛋白的C端的序列是CSIDMVDS(PO3H2)PQLATLAD(SEQ ID NO.6)的单磷酸化肽,
(b)分离经免疫的骆驼科的外周淋巴细胞,获得总RNA并合成相应的cDNA(本领域公知方法;例如参见Lafaye等人.1995Res Immunol.,146,373-82;Erratum in:1996,Res Immunol.,147,61),
(c)构建编码VHH结构域的cDNA片段的文库,
(d)使用PCR将步骤(c)中获得的编码VHH结构域的cDNA转录为mRNA,将mRNA转换为核糖体展示形式,并且通过核糖体展示选择VHH结构域,以及
(e)在载体中表达VHH结构域,例如,一种合适的载体是pET22(Novagen,Cat.No.69744-3),并且,任选地,纯化经表达的VHH结构域。
在所述方法的优选的实施方案中,在步骤(a)中,使用500μg的序列是CSIDMVDS(PO3H2)PQLATLAD(SEQ ID NO.6)的肽、或人阿尔茨海默氏病脑(优选海马)提取物富含的磷酸化tau、或其中丝氨酸422被磷酸化的磷酸化tau蛋白,在第0天、21天和40天免疫骆驼科。结合的骆驼科抗体可以使用多克隆兔抗骆驼IgG(例如,参见Muyldermans 1994Protein Eng.,7,1129-35)和辣根过氧化物酶标记的羊抗兔抗体检测。
在所述方法的另一个优选的实施方案中,在步骤(c)中,可以通过PCR扩增编码VHH结构域的DNA片段,并且将获得的PCR产物连接至噬菌体载体(合适的噬菌体载体的实例是pHEN;Hoogenboom等人.1992J Mol Biol.,227,381-8)构建所述文库。
在所述步骤(c)的具体的实施方案中,使用序列SEQ ID NO.7(命名为CH2FORTA4)和SEQ ID NO.8(命名为VHBACKA6)的引物,通过PCR扩增编码VHH结构域的DNA片段,并且使用序列SEQ ID NO.9(命名为VHBACKA4)和SEQ ID NO.10(命名为VHFOR36)的引物对扩增产物进行第二轮PCR。这种方法在国际PCT申请号WO 2004/044204中描述。
核糖体展示技术能够在体外选择蛋白质连同编码它的mRNA。编码特定蛋白例如VHH片段的DNA文库在体外被转录。纯化mRNA,并且用于体外翻译。由于mRNA缺少终止密码子,核糖体停滞(stalls)在mRNA的末端,产生mRNA、核糖体和功能蛋白的三元复合物(Hanes和Plückthum 1997Proc Natl Acad Sci U.S.A.,94,4937-42)。针对潜在的配体测试这些三元复合物的文库(在抗体的情况中,针对抗原)。三元复合物(核糖体、mRNA、蛋白质)与配体的结合,允许回收连接配体的编码mRNA,并且通过逆转录酶PCR(RT-PCR)转录为cDNA。选择和回收的周期可以被重复,以富集稀少配体结合分子和选择具有最佳亲和性的分子。本领域公知核糖体展示选择的方法;参见例如Mouratou等人.2007Proc Natl Acad Sci U.S.A.,104,17983-8。
在本发明的VHH的优选实施方案中,其氨基酸序列从N端至C端包含氨基酸序列SEQ ID NO.1(对应于VHH的CDR1)、氨基酸序列SEQ ID NO.2(对应于CDR2)和氨基酸序列SEQ ID NO.3(对应于CDR3)。
在一个优选的实施方案中,所述VHH由以下氨基酸序列组成:
-SEQ ID NO.4,对应于VHH Tau-A2的全长形式,或者
-SEQ ID NO.5,对应于VHH Tau-A2的短的形式。
如此处所用,术语“分离的”涉及VHH,其已经从它的天然环境中分离出来。在一些实施方案中,例如通过电泳(如,SDS-PAGE、等电聚焦(IEF)、毛细管电泳)或色谱(如,凝胶过滤、离子交换或者反相HPLC)所确定的,VHH被纯化至高于95%或者99%的纯度。针对抗体纯度评价方法的综述,参见例如Flatman等人.2007J Chromatogr B Analyt Technol Biomed Life Sci.,848,79-87。
如此处所用,术语“VHH”涉及来自骆驼科(骆驼、单峰骆驼、美洲驼、羊驼等)重链抗体的可变抗原结合结构域(参见Nguyen等人.2000EMBO J.,19,921-930;Muyldermans 2001J Biotechnol.,74,277-302以及综述Vanlandschoot等人.2011Antiviral Res.92,389-407)。VHH也可命名为纳米抗体(Nanobody)(Nb)。
有利的是,根据本发明的VHH具有碱性的等电点(pI),优选8.5至10.5,并且更优选9.5至10.5。
本发明包括如上述所限定的天然、重组或合成的VHH。
如此处所用,术语“重组”涉及采用遗传工程的方法(克隆、扩增)来生产所述VHH。
如此处所用,术语“合成”涉及通过体外化学的和/或酶促的合成来生产所述VHH。
根据本发明的VHH能够是单体的形式或者同源多聚体的形式,如同源二聚体或同源三聚体。
本发明还提供了一种获得针对如以上所限定的磷酸化tau蛋白的VHH的方法,其包含使用衍生自tau蛋白的C端的序列是CSIDMVDS(PO3H2)PQLATLAD(SEQ ID NO.6)的单磷酸化肽、或人阿尔茨海默氏病脑(优选海马)提取物中富含的磷酸化tau、或磷酸化tau蛋白免疫骆驼科的步骤,所述磷酸化tau蛋白比如是其中丝氨酸422被磷酸化的磷酸化tau蛋白,优选包含如以上所限定的步骤(a)至(e)。
本发明还提供一种分离的骆驼科血清,优选羊驼血清,其包含根据本发明的VHH。
本发明还提供了一种SEQ ID NO.5所示的VHH Tau-A2的分离的变体,其中所述VHH变体针对如以上所限定的磷酸化tau蛋白的磷酸化丝氨酸422,并且其中所述变体的氨基酸序列与氨基酸序列SEQ ID NO.5具有至少95%的同一性,或者以递增优选顺序至少96%、97%、98%或99%的同一性。
除非另有说明,在此提及的两个序列之间同一性的百分比是通过两个序列的全长的比对所计算的。
在所述变体的优选实施方案中,其氨基酸序列从N端至C端包含氨基酸序列SEQ ID NO.1、氨基酸序列SEQ ID NO.2和氨基酸序列SEQ ID NO.3。
在另一个优选的实施方案中,所述变体具有含有以下突变的氨基酸序列SEQ ID NO.5:
-在氨基酸序列SEQ ID NO.5的位置3的谷氨酰胺残基(Gln,Q)被选自以下的氨基酸残基取代:天冬氨酸(Asp,D)和谷氨酸(Glu,E),优选Glu,
-在氨基酸序列SEQ ID NO.5的位置52的异亮氨酸残基(Ile,I)被选自以下的氨基酸残基取代:丙氨酸(Ala,A)和甘氨酸(Gly,G),优选Gly,
-在氨基酸序列SEQ ID NO.5的位置86的缬氨酸残基(Val,V)被选自以下的氨基酸残基取代:丙氨酸(Ala,A)、丝氨酸(Ser,S)、苏氨酸(Thr,T)、天冬酰胺(Asn,N)、谷氨酰胺(Gln,Q)、天冬氨酸(Asp,D)、谷氨酸(Glu,E)、赖氨酸(Lys,K)、精氨酸(Arg,R)和甘氨酸(Gly,G),优选Gly,
-以及,任选地,在氨基酸序列SEQ ID NO.5的N端位置添加两个氨基酸残基,并且选自:二肽谷氨酸-缬氨酸(E-V)和天冬氨酸-缬氨酸(D-V),优选D-V。
在一个具体的实施方案中,所述VHH变体由氨基酸序列SEQ ID NO.15组成。
在另一个具体的实施方案中,所述VHH变体由氨基酸序列SEQ ID NO.16组成(与氨基酸序列SEQ ID NO.5相比,该VHH变体在N端位置不包含添加的二肽)。
本发明还提供了一种VHH衍生物,其由包含根据本发明的VHH或VHH变体(优选SEQ ID NO.15所示的VHH变体)的多肽组成,所述多肽包含的所述VHH或VHH变体能够结合磷酸化tau蛋白,优选磷酸化tau蛋白的磷酸化丝氨酸422。
在另一个具体的实施方案中,所述VHH衍生物具有式P-C-Z或者Z-C-P,优选P-C-Z,其中:
-P是100至500个、优选100至150个氨基酸的肽,其包含根据本发明的VHH或VHH变体,或由根据本发明的VHH或VHH变体组成,其中所述氨基酸序列不含有可接触的(accessible)还原的半胱氨酸残基,并且优选不含还原的半胱氨酸残基,
-C是半胱氨酸残基,
-Z是1至10个氨基酸的间隔序列,优选1至10个中性的或带负电的氨基酸的间隔序列,其中Z的氨基酸残基是相同的或不同的,并且其中Z不含半胱氨酸残基。
在本发明的意义内,表述“不可接触的还原的半胱氨酸残基”指对于根据本发明所限定的缀合步骤不可接触的半胱氨酸残基。
在一个优选的实施方案中,所述VHH衍生物具有式P-C-Z或者Z-C-P,优选P-C-Z,其中:
-P是100至500个、优选100至150个氨基酸的肽,其不含有可接触的还原的半胱氨酸残基,并且优选不含还原的半胱氨酸残基。
-C是半胱氨酸残基,
-Z代表,
a)2至10个氨基酸的间隔序列,优选2个氨基酸的间隔序列,其中Z的氨基酸残基选自:丝氨酸(S)、丙氨酸(A)、缬氨酸(V)和甘氨酸(G),以及更优选丝氨酸(S)、丙氨酸(A)和缬氨酸(V),并且其中Z的至少两个氨基酸残基是不同的,或者
b)2至10个氨基酸的间隔序列,优选2至10个中性的或带负电的氨基酸的间隔序列,其中Z包含二肽丝氨酸-丙氨酸(S-A)或丝氨酸-缬氨酸(S-V),并且其中Z不含半胱氨酸残基。
有利的是,半胱氨酸残基C是立体上可接触的。
有利的是,氨基酸间隔序列Z的氨基酸残基选自:丙氨酸、缬氨酸、丝氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甘氨酸、丝氨酸、苏氨酸、酪氨酸、天冬酰胺和谷氨酰胺,优选地丙氨酸、缬氨酸和丝氨酸。
有利的是,当Z是如在a)中所限定的时,氨基酸间隔序列Z包含1个或至少1个丝氨酸,更有利的是,氨基酸间隔序列Z仅由丝氨酸和丙氨酸残基组成,或者仅由丝氨酸和缬氨酸残基组成。
在这种VHH衍生物的一个优选实施方案中,氨基酸间隔序列Z由2个氨基酸的序列组成,如氨基酸序列S-A或者S-V。
式P-C-Z的VHH衍生物的氨基酸序列P在其C端具有1至10个氨基酸的间隔序列Y,优选地,1至10个中性的或者带负电的氨基酸的间隔序列,其中所述氨基酸间隔序列Y的氨基酸残基是相同的或不同的,并且其中所述氨基酸间隔序列Y不含半胱氨酸残基。
式Z-C-P的VHH衍生物的氨基酸序列P在其N端具有1至10个氨基酸的间隔序列Y,优选地,1至10个中性的或者带负电的氨基酸的间隔序列,其中所述氨基酸间隔序列Y的氨基酸残基是相同的或不同的,并且其中所述氨基酸间隔序列Y不含半胱氨酸残基。
有利的是,氨基酸间隔序列Y的氨基酸残基选自丙氨酸、缬氨酸、丝氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甘氨酸、丝氨酸、苏氨酸、酪氨酸、天冬酰胺和谷氨酰胺,优选丙氨酸、缬氨酸、丝氨酸和甘氨酸。
优选,氨基酸间隔序列Y代表4个中性氨基酸的间隔序列,比如氨基酸序列G-G-G-S(SEQ ID NO.11)。
式P-C-Z的VHH衍生物的氨基酸序列P还在其N端具有1至50个氨基酸的序列X,其中所述氨基酸序列X的氨基酸残基是相同的或不同的,并且其中所述氨基酸序列X不包含半胱氨酸残基。
式Z-C-P的VHH衍生物的氨基酸序列P还在其C端具有1至50个氨基酸的序列X,其中所述氨基酸序列X的氨基酸残基是相同的或不同的,并且其中所述氨基酸序列X不包含半胱氨酸残基。
氨基酸序列X包含标签和酶切位点,所述标签比如6×His标签(SEQ ID NO.12),所述酶切位点比如氨基酸序列LVPRGS(SEQ ID NO.13)所示的凝血酶切位点。
在一个优选的实施方案中,根据本发明的VHH衍生物具有式P’-C-Z、P’-Y-C-Z、X-P’-C-Z、X-P’-Y-C-Z、Z-C-P’、Z-C-Y-P’、Z-C-P’-X或者Z-C-Y-P’-X,其中P’是根据本发明的VHH或VHH的变体。
本发明还提供了一种式P-C-Z或Z-C-P的分离的寡肽、优选如以上所限定的P-C-Z。
有利的是,所述VHH衍生物从N端至C端包含氨基酸标签比如6×His标签、酶切位点比如凝血酶切位点、根据本发明的VHH或VHH变体、氨基酸间隔序列、半胱氨酸和第二氨基酸间隔序列。这种VHH衍生物对应着式X-P’-Y-C-Z的VHH衍生物,其中P’是VHH或VHH变体。
在一个优选的实施方案中,所述VHH衍生物具有氨基酸序列SEQ ID NO.14(Tau-A2-SH)。
在另一个优选的实施方案中,所述VHH衍生物具有氨基酸序列SEQ ID NO.17(Tau-A2var-SH)。这种VHH衍生物包含根据本发明的SEQ ID NO.15所示的VHH变体。
本发明还提供一种分离的多核苷酸,其编码根据本发明的VHH、VHH变体或者VHH衍生物。
一种根据本发明的多核苷酸,其是通过重组DNA技术和/或化学DNA合成的公知方法获得的。
本发明还提供一种重组表达盒,其包含在转录启动子控制下的根据本发明的多核苷酸,转录启动子允许在宿主细胞中调节所述多核苷酸的转录。所述多核苷酸还可以连接至适当的控制序列,控制序列允许在宿主细胞中调节其翻译。
本发明还提供一种重组载体(例如,重组表达载体),其包含根据本发明的多核苷酸。有利的是,所述重组载体是包含根据本发明的表达盒的重组表达载体。
如此处所用,术语“载体”涉及能够扩增与其连接的另一核酸的核酸分子。术语包括作为自我复制的核酸结构的载体,以及并入宿主细胞基因组的载体,其中所述载体引入所述宿主细胞中。某些载体能够指导与其可操作连接的核酸的表达。这种载体此处被称为“表达载体”。
本发明还提供一种宿主细胞,其包含根据本发明的重组表达盒或重组载体。宿主细胞是原核或真核宿主细胞。
术语“宿主细胞”涉及在其中引入有外源性核酸的细胞,包括这些细胞的后代。宿主细胞包括“转化体”和“转化细胞”,其包括初始的转化细胞及其衍生后代,而不考虑传代次数。在核酸含量方面,后代可能不完全和母细胞相同,但可能包含突变。在原始转化的细胞中筛选或选择的具有相同功能或者生物活性的突变后代也包括在此处。
一种原核宿主细胞,其表达具有6×组氨酸标签的氨基酸序列SEQ ID No.4所示的VHH Tau-A2,其于2014年1月16日以I-4835的编号保藏在法国巴黎邮编15,75724,Dr Roux街28号的法国微生物培养物保藏中心(CNCM)。
一种表达氨基酸序列SEQ ID No.14所示的VHH Tau-A2-SH的原核宿主细胞,其于2014年1月16日以I-4836的编号保藏在法国巴黎邮编15,75724,Dr Roux街28号的法国微生物培养物保藏中心(CNCM)。
一种表达氨基酸序列SEQ ID No.17所示的VHH Tau-A2var-SH(也命名为TauA2VAR-SH)的原核宿主细胞,其于2015年1月21日以I-4951的编号保藏在法国巴黎邮编15,75724,Dr Roux街28号的法国微生物培养物保藏中心(CNCM)。
本发明还提供一种用于在如上述所限定的宿主细胞中生产根据本发明的式P-C-Z或Z-C-P所示寡肽的方法,包括步骤:
-提供含有根据本发明的重组表达盒或重组载体的宿主细胞,
-培养所述宿主细胞,
-以及,任选地,纯化式P-C-Z或Z-C-P所示寡肽。
用于纯化寡肽的方法是本领域公知的,比如色谱(如离子交换色谱、凝胶渗透色谱和反相色谱)。
本发明还提供了一种诊断或者治疗剂,其包含直接或者间接、共价或非共价连接至感兴趣物质的根据本发明的VHH、VHH变体或者VHH衍生物(尤其是如上述限定的式P-C-Z或Z-C-P的VHH衍生物)。
根据本发明的感兴趣物质能够或不能穿透哺乳动物或者人类血脑屏障。如果感兴趣物质穿透所述血脑屏障,则利用根据本发明的VHH、VHH变体或者VHH衍生物(尤其是如上述限定的式P-C-Z或Z-C-P的VHH衍生物)可以允许增强所述感兴趣物质穿过血脑屏障的递送。
在一个实施方案中,所述感兴趣物质是诊断或者治疗化合物。
在另一个实施方案中,所述感兴趣物质是包含诊断或者治疗化合物的脂质体或者聚合实体(Villaraza等人.2010Chem Rev.,110,2921-2959)。
有利的是,所述诊断化合物选自:
-酶,比如辣根过氧化物酶、碱性磷酸酶、葡萄糖-6-磷酸酶或者β-半乳糖苷酶;
-荧光团,比如绿色荧光蛋白(GFP)、在光谱紫外(UV)部分的波长处激发的蓝色荧光染料(例如AMCA(7-氨基-4-甲基香豆素-3-乙酸);Alexa)、在蓝光处激发的绿色荧光染料(如FITC、Cy2、Alexa)、在绿光处激发的红色荧光染料(例如罗丹明、德克萨斯红、Cy3、Alexa Fluor染料546、564和594)、或者远红光激发的染料(如Cy5),通过电子探测器(CCD相机、光电倍增管)进行可视化;
-放射性同位素,如可用于PET成像的18F、11C、13N、15O、68Ga、82Rb、44Sc、64Cu、86Y、89Zr、124I、152Tb,或者可以用于SPECT/闪烁扫描研究的67Ga、81mKr、99mTc、111In、123I、125I、133Xe、201Tl、155Tb、195mPt,或者可用于放射自显影或原位杂交的14C、3H、35S、32P、125I,或者可用于标记化合物的211At-、212Bi-、75Br-、76Br-、131I-、111In、177Lu-、212Pb-、186Re-、188Re-、153Sm-、90Y;
-NMR或者MRI造影剂,比如顺磁剂钆(Gd)、镝(Dy)和锰(Mn),以及基于铁氧化物的超顺磁剂(如MION、SPIO或者USPIO)或基于铂铁的超顺磁剂(SIPP),以及X-核比如18F、13C、23Na、17O、15N;
-纳米颗粒,比如金纳米颗粒(B.Van de Broek等人,ACSNano,卷5,No.6,4319-4328,2011)或者量子点(A.Sukhanova等人,2012Nanomedicine,8 516-525)。
在一个优选的实施方案中,所述诊断化合物是荧光团,更优选Alexa或者MRI造影剂,更优选地钆。
当诊断剂用于检测,它可以包括用于闪烁扫描研究的放射性原子,例如99Tc或者123I,或者用于核磁共振(NMR)成像(还称为MRI)的自旋标记,比如13C、9F、Fe、Gd、123I、111In、Mn、15N或者7O。
有利的是,所述治疗化合物选自:肽、酶、核酸、病毒和化学化合物。它可以是止痛化合物、抗炎化合物、抗抑郁化合物、抗惊厥化合物、细胞毒性化合物或者抗神经退行性化合物。
如上述所限定的感兴趣物质可以直接且共价地或者非共价地连接至根据本发明的VHH、VHH变体或者VHH衍生物(尤其是如上述限定的式P-C-Z或Z-C-P的VHH衍生物),或者连接至所述VHH、VHH变体或者VHH衍生物(尤其是如上述限定的式P-C-Z或Z-C-P的VHH衍生物)的末端之一(N或者C端),或者连接至所述VHH、VVH变体或者VHH衍生物的氨基酸之一的侧链。感兴趣物质还可以通过间隔序列的方式间接且共价地或者非共价地连接至所述VHH、VHH变体或者VHH衍生物,或者连接至所述VHH、VHH变体或者VHH衍生物(尤其是如上述限定的式P-C-Z或Z-C-P的VHH衍生物)的末端之一,或者连接至所述VHH、VHH变体或者VHH衍生物的氨基酸之一的侧链。传统的将感兴趣物质连接至肽尤其是抗体的方法,是本领域中已知的(比如,参见Ternynck和Avrameas 1987“Techniques immunoenzymatiques”Ed.INSERM,Paris;Hermanson,2010,Bioconjugate Techniques,Academic出版社)。
许多化学交联方法也是本领域已知的。交联剂可能是同双功能的(即,有两个官能团进行相同的反应)或异双功能的(即,有两个不同的官能团)。大量的交联剂是市售可获得的。它们使用的详细说明很容易从商业供应商获得。多肽的交联和缀合物制备的一般参考是:WONG,Chemistry of protein conjugation and cross-linking,CRC出版社(1991)。
使用本领域公知的常规的有机化学技术,根据本发明的VHH、VHH变体或者VHH衍生物(尤其是如上述限定的式P-C-Z或Z-C-P的VHH衍生物)可标记有特异性的放射性同位素或者NMR或MRI造影剂或荧光团或纳米颗粒或酶,参见例如March,J.ADVANCED ORGANIC CHEMISTRY:REACTIONS,MECHANISMS,AND STRUCTURE(第三版,1985);Hermanson,2010,Bioconjugate Techniques,Academic出版社。
此外,通过本领域公知的多种方法,直接通过重氮碘对重氮化的氨基衍生物进行碘化(参见Greenbaum 1936F Am J.Pharm.,108,17)、或者通过将不稳定的重氮化胺转换成稳定的三氮烯、或者通过将非放射性卤代前体转换成稳定的三烷基锡衍生物,随后三烷基锡衍生物转化成碘代化合物,根据本发明的VHH、VHH变体或者VHH衍生物还可以标记有任何合适的放射性碘同位素,例如但不限于131I、125I、或者123I。参见Satyamurthy和Barrio 1983J Org Chem.,48,4394;Goodman等人.1984J Org Chem.,49,2322;Mathis等人.1994J Labell Comp Radiopharm.,905;Chumpradit等人.1991J Med Chem.,34,877;Zhuang等人.1994J Med Chem.37,1406;Chumpradit等人.1994J Med Chem.,37,4245。
尤其是,通过任意的本领域公知的多种技术,根据本发明的VHH、VHH变体或者VHH衍生物可以标记有123I以便用于SPECT。参见,例如Kulkarni 1991Int J Rad Appl Inst.(B部分)18,647。
根据本发明的VHH、VHH变体或者VHH衍生物还可以被放射标记有已知的金属放射性标记,比如锝99m(99mTc)。修饰取代基从而引入结合这种金属离子的配体,这可以由放射标记领域的普通技术人员之一实现,而无需过度实验。金属放射性标记的根据本发明的VHH、VHH变体或者VHH衍生物,然后可以用于检测神经纤维缠结、神经纤维网细丝或营养不良的神经突起。制备99mTc放射性标记的衍生物是本领域公知的。参见例如Zhuang等人.1999Nucl Med Biol.,26,217-24;Oya等人,1998,Nucl Med Biol.,25:135-40;Horn等人.1997Nucl Med Biol.,24,485-98。
本发明还涉及用于获得直接或者间接偶联有感兴趣物质的根据本发明的VHH、VHH变体或者VHH衍生物(尤其是如上述限定的式P-C-Z或Z-C-P的VHH衍生物)(功能性缀合物)的偶联方法。
根据第一种策略,通过使用非位点特异性方法,将根据本发明的VHH、VHH变体或者VHH衍生物缀合至感兴趣物质。所述非位点特异性方法包括将感兴趣物质和根据本发明的VHH、VHH变体或者VHH衍生物进行缀合的步骤。
当感兴趣物质是金属时,如NMR或者MRI造影剂(例如,顺磁剂钆(Gd)、镝(Dy)和锰(Mn),以及基于铁氧化物或者铂铁的超顺磁剂,以及X-核,比如18F、13C、23Na、17O、15N,或者比如金属放射性同位素(例如,90Y、177Lu、64Cu、99mTc、111In、212Pb、212Bi),非位点特异性的方法采用螯合剂,并包括以下步骤:
(i)将以酯或酸酐形式激活的螯合剂,优选以酯形式激活的螯合剂,和根据本发明的VHH、VHH变体或者VHH衍生物的赖氨酸残基进行缀合,以及
(ii)将步骤(i)的配体和感兴趣物质进行螯合。
采用螯合剂的非位点特异性方法的替代方法,是这样一种方法,在其中感兴趣物质用螯合剂进行“预螯合”,这种方法包括以下步骤:
(i’)将感兴趣物质和以酯或酸酐形式激活的螯合剂,优选以酯的形式激活的螯合剂,进行螯合,以及
(ii’)将步骤(i’)的预螯合的感兴趣物质和根据本发明的VHH、VHH变体或者VHH衍生物的赖氨酸残基进行缀合。
步骤(i)或(ii’)的缀合期间,温度可以从1变化到40℃,并且优选从4至20℃。溶液可以搅拌1至6小时。优选地,步骤(i)或(ii’)缀合期间的pH保持在7至8.5。
在有咪唑或者没有咪唑的PBS/NaCl中进行缀合步骤(i)或(ii’)。
缀合步骤(i)或(ii’)期间,以酯或酸酐形式激活的螯合剂可以溶解在缓冲液中,如磷酸盐缓冲(PBS)溶液。
在一个优选的实施方案中,以酯或酸酐形式激活的螯合剂和VHH、VHH变体或者VHH衍生物的赖氨酸残基的氨基官能团之间的摩尔比范围从1至10,优选是4。
缀合步骤(i)和螯合步骤(ii)之间、或者螯合步骤(i’)和缀合步骤(ii’)之间,可以有通过渗透过滤或者透析进行的缓冲液交换步骤。有利的是,溶液是渗透过滤的,例如采用VivaspinTM装置。这种缓冲液交换步骤期间,在范围从1至5℃的温度冷却介质。这种缓冲液交换步骤期间,例如用醋酸钠溶液交换缓冲溶液,优选搅拌0至6个小时,更优选2至3小时。
螯合步骤(ii)或(i’)期间,溶液搅拌1至4小时,优选2至3小时。优选,在1至60℃进行螯合步骤,更优选在4℃。
然后,可以有通过渗透过滤或者透析进行的第二缓冲液交换步骤。有利的是,溶液是渗透过滤的,例如采用VivaspinTM装置。此第二缓冲液交换步骤期间,在范围从1至5℃的温度冷却介质。第二渗透过滤步骤期间,例如用含有NaCl的PBS混合物(PBS/NaCl;有利的是300mM NaCl)交换缓冲溶液,并且通过相同的方法进行浓缩(渗透过滤)。
根据赖氨酸的数量,每VHH、VHH变体或者VHH衍生物的感兴趣物质平均密度可以从0至赖氨酸的数目+1之间变化。优选,每VHH、VHH变体或者VHH衍生物的感兴趣物质平均密度可以从0至6之间变化。
根据第二策略,通过使用位点特异性方法将根据本发明的式P-C-Z或Z-C-P的VHH衍生物缀合至感兴趣物质。位点特异性方法有以下优点:
-标记的式P-C-Z或Z-C-P的VHH衍生物是化学上明确的,因为这种方法提供明确的缀合物,这是针对人类使用的一个基本特征(质量控制、安全性…),
-方法简便且标准,因为用感兴趣物质来标记式P-C-Z或Z-C-P的VHH衍生物可以在单一步骤中进行,反应时间短且程序简单。无需在线监测,并且在标记程度和结合性能之间不用实现权衡。对于进一步的优化、实验重复性和生产规模的扩大有关键的优势,
-该方法不影响式P-C-Z或Z-C-P的VHH衍生物的关键性质:例如,缀合物的pI维持在8.5以上,从而应当允许穿过BBB。此外,不存在可能和缀合物竞争靶标的剩余未标记式P-C-Z或Z-C-P的VHH衍生物;反应时间短且处于生理性pH的温和条件防止式P-C-Z或Z-C-P的VHH衍生物免于潜在的降解和/或活性损失,
-该方法具有通用性,因为它允许灵活且模块化的方法,在其中可分别制备各种式P-C-Z或Z-C-P的VHH衍生物和造影剂、荧光团或其它感兴趣的分子,然后在单一步骤中进行组合。因此,轻易获得一组缀合物用于优化以及通过IHC(免疫组织化学)和MRI(磁共振成像)进行的下游评价,以及上述所有,
-该方法允许提高总产率,同时降低反应步骤数,在VHH的赖氨酸或组氨酸上没有副反应,并且整体维持VHH的功能与三维结构。
根据本发明的位点特异性方法包含通过硫代加成(缀合步骤)将根据本发明的式P-C-Z或Z-C-P的VHH衍生物和带有感兴趣物质的巯基反应性化合物之间进行缀合步骤,所述带有感兴趣物质的巯基反应性化合物比如以下限定的带有感兴趣物质的式(I)或(I’)的马来酰亚胺化合物。然而,非位点特异性缀合需要初始缓冲液的交换,VHH、尤其是Tau-A2-SH或Tau-A2var-SH和带有感兴趣物质的巯基反应性化合物之间的位点特异性缀合,可以直接在PBS/NaCl/咪唑缓冲液中实施。在温和的条件可以有效控制半胱氨酸上的特异性硫代加成,所述策略允许减少反应的步骤数并改进工艺的总产率,而没有A.Papini等人Int.J.Pept.Protein Res.,1992,39,348-355;B.Rudolf等人,J.Organomet.Chem,1996,522,313-315;J.Paulech等人,Biochim.Biophys.Acta,2013,1834,372-379中先前提到的任何潜在副反应。
重组蛋白经常和His-标签一起表达,His-标签允许通过固定化金属亲和性色谱(IMAC)将其纯化。当使用Ni2+次氮基三乙酸树脂时,它们通常在含有500mM咪唑的PBS缓冲液中被洗脱。在非位点特异性的方法中,咪唑的氮可以促进NHS酯的水解(即降解反应物),并由此干扰缀合(G.T.Hermanson,Bioconjugate Techniques,Academic出版社,2013;P.Cuatrecasas等人,Biochemistry,1972,11,2291-2299)。因此,缓冲液交换步骤必须包括在上游亲和性纯化和缀合之间的过程中从而除去咪唑。如以前几个小组所报道的,其中显示了组氨酸侧链烷基化,预期咪唑和马来酰亚胺基团之间副反应(A.Papini等人;B.Rudolf等人;J.Paulech等人)。尽管如此,在亲和柱洗脱缓冲液中,带有感兴趣物质的巯基反应性化合物可直接缀合至VHH,尤其是Tau-A2-SH或Tau-A2var-SH,马来酰亚胺试剂过量有限,尽管咪唑过量很多摩尔。
可以在范围从0至20℃的温度,优选4℃,例如从2至4小时,进行式P-C-Z或Z-C-P的VHH衍生物的半胱氨酸和巯基反应性化合物比如下式(I)或(I’)的马来酰亚胺化合物之间的硫代加成。
优选在范围从4至7.5,更优选在6.8的pH,实现寡肽的半胱氨酸和巯基反应性化合物之间的硫代加成,其中巯基反应性化合物,比如以下式(I)或(I’)的马来酰亚胺化合物。低于pH=4反应不是最佳的,而超过7.5则反应不是特异性的(在赖氨酸上反应)。缀合步骤可以在有或没有咪唑的PBS/NaCl中进行,优选存在咪唑。
然后,可以有通过渗透过滤或者透析进行缓冲液交换步骤。有利的是,溶液是渗透过滤的,例如采用VivaspinTM装置。然后,通过相同的方法(渗透过滤)浓缩溶液。
然而,当缀合步骤在有咪唑的PBS/NaCl中进行时,优选不进行随后的渗透过滤或者透析步骤(为了不除去咪唑)。
无论是对于非特异性的方法或者特异性的方法,感兴趣物质如上述所限定的。
根据一个优选的实施方案,感兴趣物质是上述所限定的治疗或者诊断化合物,优选诊断化合物选自:上述所限定的荧光团、放射性同位素、和NMR或MRI造影剂。
本发明人发现,当感兴趣物质是荧光团、或者NMR或MRI造影剂时,合成的缀合物保留了未标记的VHH的关键功能特性。
根据优选的实施方案,感兴趣物质是荧光团,比如在蓝光处激发的绿色荧光染料,尤其是FITC、Cy2、Alexa优选Alexa
根据另一个优选的实施方案,感兴趣物质是NMR或MRI造影剂,比如顺磁剂钆(Gd)、镝(Dy)和锰(Mn),以及基于铁氧化物的超顺磁剂(如MION、SPIO或者USPIO)或基于铂铁的超顺磁剂(SIPP),以及X-核比如18F、13C、23Na、17O、15N,以及更优选感兴趣物质是NMR或MRI造影剂,其选自顺磁剂钆(Gd)、镝(Dy)和锰(Mn),优选顺磁剂钆(Gd)。
螯合剂选自:1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)、二乙三胺五乙酸(DTPA)、1,4,7-三(羧甲基氮杂)环十二烷-10-氮杂乙酰胺(DO3A)、次氮基三乙酸(NTA)(Chong等人.2008Bioconjug Chem.,19,1439-47)、D-青霉胺(Pen)、2,3-二巯基琥珀酸(DMSA)、2,3-二巯基-1-丙磺酸(DMPS)(Andersen 1999Chem.Rev.,99,2683-2710)、2,3-二巯基丙醇(BAL)、三乙烯四胺(Trien)、四硫代钼酸铵(TTM)阴离子(Brewer和Askari 2005J.Hepatol.,42,S13-S21)、乙二胺四乙酸(EDTA)、2-(p-异硫氰酰苄基)-6-甲基-二乙三胺五乙酸(IB4M)(Nwe等人.2011J Inorg Biochem.,105,722-7)、羟基吡啶酮(HOPO)(Villaraza等人.2010Chem Rev.,110,2921-59)。
当感兴趣物质是钆时,优选DOTA是螯合剂。
本发明还提供如上述限定的式P-C-Z或Z-C-P所示VHH衍生物,其中所述的半胱氨酸残基C通过硫化物键(sulphide bond)优选通过硫醚或二硫键连接至少一种感兴趣物质。有利的是,所述的半胱氨酸残基C通过巯基反应性化合物连接至少一种感兴趣物质,其中巯基反应性化合物带有所述感兴趣物质。
在本发明的意义内,巯基反应性化合物是马来酰亚胺、卤代乙酰基、烷基卤或氮杂环丙烷化合物、丙烯酰衍生物、芳基化剂或巯基-二硫键交换剂(thiol-disulfide exchange reagent)(Hermanson G.T.,2010,Bioconjugate Techniques,Academic出版社)。
在本发明的意义内,马来酰亚胺化合物是带有至少一个马来酰亚胺官能团的化合物,优选1至6个马来酰亚胺官能团,更优选一个马来酰亚胺官能团。
优选地,巯基反应性化合物是通过马来酰亚胺官能团的C-C双键和半胱氨酸残基C发生反应的马来酰亚胺化合物。
本发明的马来酰亚胺化合物可以是以下式(I)所示的:
其中:
-B、B’1、B’2和B”是相同的或不同的,其各自独立地是选自以下的单键或间隔序列:多元醇,比如聚乙二醇(PEG),其优选具有2至12个氧乙烯(OE)单元;聚烯烃,其优选具有2至12个芳香环;聚烷基,其优选具有2至12个碳原子;乙烯基聚合物,比如聚(甲基丙烯酸烷基酯),其优选具有2至12个甲基丙烯酸基团;聚醛,其优选具有2至12个羰基;聚酸酯,其优选具有2至12个酯基,
-D、D’和D”是相同的或不同的,其各自独立地是选自胺、酰胺、氨基醇、尿素、硫脲、氨基甲酸酯、碳酸酯、酯、醚、硫醚、芳基、杂芳基比如三唑、肟基,
-A是单键或者螯合剂,
-SI是感兴趣物质,
-X’是酸、胺、酰胺、酯、醚、烷基、烯基、炔基、芳基或者杂芳基官能团,以及
-n=1至100,优选地n=1、2或者3。
在本发明的意义之内:
-烷基选自(C1-C12)烷基,并且优选(C1-C6)烷基,比如甲基、乙基、n-丙基、异丙基、n-丁基、仲丁基、叔丁基和异丁基;
-烯基选自2至12个优选2至6个碳原子的烃链,有至少一个碳碳双键。烯基的示例包括乙烯、丙烯、异丙烯、2,4-戊二烯;
-炔基选自2至12个优选2至6个碳原子的烃链,有至少一个碳碳叁键;
-芳基表示衍生自至少一个简单芳香环的任何官能团或者取代基;芳香环对应着具有离域π系统的任何平面环形化合物,在所述离域π系统中环的每一个原子包括p轨道,所述p轨道彼此重叠。更具体地说,术语芳基包括但不限于苯、联苯、1-萘、2-萘、蒽基、芘基、及其取代的形式。本发明的芳基优选地包括4至12个碳原子,更优选地5或者6个碳原子;
-杂芳基表示衍生自至少一个如上述限定的芳香环的任何官能团或者取代基,并且含有选自P、S、O和N的至少一个杂原子。术语杂芳基包括但不限于呋喃、吡啶、吡咯、噻吩、咪唑、吡唑、噁唑、异噁唑、三唑、噻唑、异噻唑、四唑、吡哒唑、吡啶、吡嗪、嘧啶、哒嗪、苯并呋喃、异苯并呋喃、吲哚、异吲哚、苯并噻吩、苯并[c]噻吩、苯并咪唑、吲唑、苯并噁唑、苯并异噁唑、苯并噻唑、喹啉、异喹啉、喹喔啉、喹唑啉、噌啉、嘌呤和吖啶。本发明的芳基和杂芳基包括优选地4至12个碳原子,更优选5或者6个碳原子;
根据本发明的酸、胺、酰胺、酯、醚和硫醚优选具有1至12更优选1至6个碳原子。
根据优选的实施方案,A是螯合剂,以及感兴趣物质SI是荧光团(例如Alexa)或者NMR或MRI造影剂(例如钆)。
有利的是,螯合剂A选自1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)、二乙三胺五乙酸(DTPA)、1,4,7-三(羧甲基氮杂)环十二烷-10-氮杂乙酰胺(DO3A)、次氮基三乙酸(NTA)、D-青霉胺(Pen)、2,3-二巯基琥珀酸(DMSA)、2,3-二巯基-1-丙磺酸(DMPS)、2,3-二巯基丙醇(BAL)、三乙烯四胺(Trien)、四硫代钼酸铵(TTM)阴离子、乙二胺四乙酸(EDTA)、2-(p-异硫氰酰苄基)-6-甲基-二乙三胺五乙酸(IB4M)或羟基吡啶酮(HOPO)。
有利的是,感兴趣物质SI是钆,以及螯合剂是DOTA。
根据一个尤其优选的实施方案,本发明的马来酰亚胺化合物是式(I’)所示:
其中,B、B’1、B’2、B”、A、SI以及n是上述所限定的。
通过固相方法,优选使用Fmoc化学,以及更优选在Fmoc-Gly-Wang树脂上合成式(I)或(I’)的马来酰亚胺化合物。
根据一个优选的实施方案,本发明的马来酰亚胺化合物是式(I’)所示:
其中,B、B’1、B’2、B”、A、SI以及n如上述所限定的,也属于本发明的一部分。
本发明的另一个目的是带有半胱氨酸残基的如以上所限定的式P-C-Z或Z-C-P的VHH衍生物,其中半胱氨酸残基连接至至少一种感兴趣物质(例如荧光团,比如Alexa或者NMR或MRI造影剂比如钆),优选通过巯基反应性化合物,更优选通过根据本发明所限定的马来酰亚胺化合物连接至至少一种感兴趣物质,所述式P-C-Z或Z-C-P的VHH衍生物是根据本发明的位点特异性方法获得的。
本发明还提供通过本发明的非位点特异性方法获得的缀合至感兴趣物质的VHH或者VHH变体,以及缀合至巯基反应性化合物(比如式(I)的马来酰亚胺化合物)的式P-C-Z或Z-C-P的VHH衍生物,其中巯基反应性化合物携带根据本发明的位点特异性方法获得的感兴趣物质。
如果感兴趣物质是肽,可以通过遗传工程将根据本发明的VHH、VHH变体或者VHH衍生物以及所述感兴趣物质制备成融合多肽,其包含根据本发明的VHH、VHH变体或者VHH衍生物以及合适的肽。可方便地在已知的合适宿主细胞中表达这种融合多肽。
通过注射,比如静脉内、动脉内、鞘内(通过脊髓液)、腹腔内、肌肉内或者皮下注射、或通过滴鼻,将根据本发明的VHH、VHH变体、VHH衍生物、治疗或诊断剂可施用至受试者(哺乳动物或人)。
当根据本发明的VHH、VHH变体或者VHH衍生物施用至人受试者时,那么可以进行人源化以便降低在人中的免疫原性。用于生产人源化抗体或其片段的方法是本领域公知的(Vincke等人.2009,J Biol Chem.,284,3273-84)。
根据本发明的诊断剂可用于脑成像、用于诊断或者监测神经纤维缠结、神经纤维网细丝或营养不良的神经突起所介导的疾病,如tau蛋白病,包括阿尔茨海默氏病(AD)、皮克病(PD)、额颞痴呆症(FTD)、皮质基底核退化(CBD)和进行性核上性麻痹(PSP),优选AD、FTD、CBD和PSP。
本发明还提供一种试剂盒,其包含根据本发明的VHH、VHH变体或者VHH衍生物(尤其是式P-C-Z或Z-C-P的VHH衍生物)以及上述所限定的感兴趣物质,和任选地诊断剂。
本发明还提供了一种试剂盒,其包含根据本发明的诊断剂和诊断剂。
根据本发明的试剂盒可用于脑成像、用于诊断或者监测神经纤维缠结、神经纤维网细丝或营养不良的神经突起所介导的疾病,如tau蛋白病,包括阿尔茨海默氏病(AD)、皮克病(PD)、额颞痴呆症(FTD)、皮质基底核退化(CBD)和进行性核上性麻痹(PSP),优选AD、FTD、CBD和PSP。
本发明还提供了根据本发明的诊断剂在受试者中诊断或者监测神经纤维缠结、神经纤维网细丝或营养不良的神经突起所介导的疾病的用途,所述疾病如tau蛋白病,包括阿尔茨海默氏病(AD)、皮克病(PD)、额颞痴呆症(FTD)、皮质基底核退化(CBD)和进行性核上性麻痹(PSP),优选AD、FTD、CBD和PSP。
如此处所用,“受试者”是哺乳动物,优选人,最优选疑似患有神经纤维缠结、神经纤维网细丝或营养不良的神经突起所介导的疾病的人,所述疾病如tau蛋白病,包括阿尔茨海默氏病(AD)、皮克病(PD)、额颞痴呆症(FTD)、皮质基底核退化(CBD)和进行性核上性麻痹(PSP),优选AD、FTD、CBD和PSP。
本发明还提供在受试者中体外或者离体诊断神经纤维缠结、神经纤维网细丝或营养不良的神经突起介导的疾病的方法,所述疾病如tau蛋白病,包括阿尔茨海默氏病(AD)、皮克病(PD)、额颞痴呆症(FTD)、皮质基底核退化(CBD)和进行性核上性麻痹(PSP),优选AD、FTD、CBD和PSP,包括步骤:
a)用根据本发明的诊断剂体外接触来自所述受试者的适当生物样本,以及
b)在所述生物样本中,确定磷酸化tau蛋白的存在或者不存在,
所述磷酸化tau蛋白的存在表明所述受试者患有神经纤维缠结、神经纤维网细丝或营养不良的神经突起介导的疾病,如tau蛋白病,包括阿尔茨海默氏病(AD)、皮克病(PD)、额颞痴呆症(FTD)、皮质基底核退化(CBD)和进行性核上性麻痹(PSP),优选AD、FTD、CBD和PSP。
可以通过确定VHH-抗原或VHH变体-抗原复合物(即,针对磷酸化tau蛋白的VHH)的存在或者不存在,来进行步骤b)。
本发明还提供在受试者中体外或者离体监测神经纤维缠结、神经纤维网细丝或营养不良的神经突起介导的疾病的进展或消退(regression)方法,所述疾病如tau蛋白病,包括阿尔茨海默氏病(AD)、皮克病(PD)、额颞痴呆症(FTD)、皮质基底核退化(CBD)和进行性核上性麻痹(PSP),优选AD、FTD、CBD和PSP,包括步骤:
a)用根据本发明的诊断剂体外接触来自所述受试者的适当生物样本,
b)在所述生物样本中,确定磷酸化tau蛋白的量,以及
c)将步骤b)确定的量和所述受试者先前获得的磷酸化tau蛋白的量进行比较,
磷酸化tau蛋白的量显著增加,构成了神经纤维缠结、神经纤维网细丝或营养不良的神经突起介导的所述疾病的进展的标志,磷酸化tau蛋白的显著降低构成了神经纤维缠结、神经纤维网细丝或营养不良的神经突起介导的所述疾病的消退的标志。
如此处所用,术语“显著增加”和“显著降低”分别指的是,相较于来自所述受试者适当生物样本中所先前确定的并用作参考量的磷酸化tau蛋白的量,在适当的生物样本中磷酸化tau蛋白的量更高或量更低。
还可以通过确定VHH-抗原或VHH变体-抗原复合物的量来进行步骤b)。
所述适当的生物样本可以是脑活检或者尸脑组织。
根据本发明的方面,其涉及在脑活检或尸检脑组织中检测神经纤维缠结、神经纤维网细丝或营养不良的神经突起的方法,所述方法可包括用根据本发明的诊断剂溶液孵育福尔马林固定的组织。孵育后,诊断化合物标记组织中的神经纤维缠结、神经纤维网细丝或营养不良的神经突起,通过任何标准的方法可以检测或观察染色的或标记的神经纤维缠结、神经纤维网细丝或营养不良的神经突起。这样的检测手段包括显微技术,比如明场、荧光、激光共聚焦和交叉极化显微镜。定量活检或尸组织中的神经纤维缠结、神经纤维网细丝或营养不良的神经突起的量的方法,涉及例如根据本发明的诊断剂、或其水溶性、无毒的盐和活检或者尸组织匀浆进行孵育。由本领域公知的方法获得组织并进行匀浆。尽管其它诊断化合物比如酶、荧光团、纳米颗粒或者NMR或MRI造影剂也可以使用,有利地,诊断化合物是放射性同位素标记的化合物。
本发明还提供一种在受试者体内成像神经纤维缠结、神经纤维网细丝或营养不良的神经突起的方法,包括步骤:
a)在受试者中施用可检出量的根据本发明的诊断剂,受试者优选是人,以及
b)通过成像方法,检测所述受试者中的诊断剂。
根据本发明的这种方法允许确定受试者脑中神经纤维缠结、神经纤维网细丝或营养不良的神经突起的存在和位置,受试者优选是人。
如此处所用,“可检出量”指的是所施用的诊断剂的量足以能够检测诊断剂对磷酸化tau蛋白的结合。
如此处所用,“成像有效量”指的是所施用的诊断剂的量足以能够成像所述诊断剂对磷酸化tau蛋白的结合。
用于检测体内神经纤维缠结、神经纤维网细丝或营养不良的神经突起的成像方法包括非侵入性神经影像学技术,比如磁共振波谱(MRS)或成像(MRI)、或者伽马成像比如正电子发射断层扫描(PET)或单光子发射计算机断层扫描(SPECT)。
出于体内成像的目的,可用的检测仪器的类型是选择给定标记的主要因素。例如,基于钆、铁或者锰的造影剂,可以用来通过磁共振波谱(MRS)或成像(MRI)来检测连接至所述感兴趣物质的根据本发明的VHH、VHH变体或者VHH衍生物。放射性同位素比如19F、荧光团比如Alexa或者NMR或MRI造影剂比如钆还特别适合本发明方法中的体内成像。所使用的仪器的类型将指导对感兴趣物质的选择。例如,所选的放射性核素必须具有能够被给定类型仪器检测到的衰变类型。另一个考虑涉及造影剂的或者放射性核素的半衰期。对于放射性同位素,半衰期应该足够长,从而在脑的最大摄取时它仍然能够被检测到,但是也要足够短从而受试者不维持有害的辐射。可以使用伽马成像检测根据本发明的放射性标记的VHH、VHH变体或者VHH衍生物,其中检测发射的适当波长的伽马辐射。伽马成像方法包括,但不限于,SPECT和PET。优选的是,对于SPECT检测,所选择的放射性同位素将缺失颗粒发射,但将产生140至200keV范围的大量光子。对于PET检测,放射性标记将是发射正电子的放射性核素,比如19F,其湮灭而形成两个511keV的伽马射线,伽马射线被PET相机检测到。
通常,可检测的诊断剂的剂量将取决于以下考虑的不同而不同,比如患者年龄、条件、性别和疾病程度、禁忌症、如果有,伴随的治疗和其它变量,由本领域的技术人员调整。对受试者的施用可以是局部的或者系统性的,并通过静脉内、动脉内、鞘内(通过脊髓液)等实施。根据检查的身体部位,施用还可以是皮内或者腔内。足够的时间过去之后,以便于化合物与磷酸化tau蛋白结合,例如30分钟至48小时,通过常规成像技术比如MRS/MRI、SPECT、平面闪烁成像、PET、和任何新兴的成像技术等来检查所研究的受试者区域。具体的规程将有必要地取决于如上所述的患者特定因素,并且取决于所检查的身体部位、所用的施用方法和标记类型;具体程序的确定对于技术人员而言是常规的。
本发明还提供作为诊断剂的连接至根据本发明的诊断化合物的根据本发明的VHH、VHH变体或者VHH衍生物,尤其是式P-C-Z或Z-C-P的VHH衍生物。
本发明还提供一种药物组合物,其包含上述所限定的治疗剂和药学上可接受的载体。
如此处所用,“药学上可接受的载体”旨在包含与药学施用兼容的任何和所有溶剂、分散介质、包衣、抗细菌和抗真菌剂、等渗和吸收延缓剂等。合适的载体描述于最新版本的Remington's Pharmaceutical Sciences中,这是本领域标准的参考文本。这些载体或者稀释剂的优选示例包括,但不限于,水、盐水、林格氏溶液、葡萄糖溶液和5%人血清白蛋白。还可使用脂质体、阳离子脂质体和非水载体比如固定油。用于药物活性物质的这种介质和试剂的使用是本领域公知的。除非任何传统介质或试剂和上述限定的治疗剂不兼容,其在本发明组合物中的使用就可以考虑。
本发明还提供根据本发明的VHH、VHH变体、VHH衍生物、治疗剂或者药物组合物作为药物,特别是用于治疗由神经纤维缠结、神经纤维网细丝或营养不良的神经突起所介导的疾病,如tau蛋白病,包括阿尔茨海默氏病(AD)、皮克病(PD)、额颞痴呆症(FTD)、皮质基底核退化(CBD)和进行性核上性麻痹(PSP),优选AD、FTD、CBD和PSP。
本发明还提供预防或治疗由神经纤维缠结、神经纤维网细丝或营养不良的神经突起所介导的疾病的方法,所述疾病如tau蛋白病,包括阿尔茨海默氏病(AD)、皮克病(PD)、额颞痴呆症(FTD)、皮质基底核退化(CBD)和进行性核上性麻痹(PSP),优选AD、FTD、CBD和PSP,包括向有需求的受试者施用根据本发明的治疗剂或药物组合物。
如此处所用,术语“治疗”包括出于治疗、治愈、缓解、减轻、改变、弥补、改善、提高或者影响疾病、疾病症状或者患病倾向的目的,向患者施用根据本发明的VHH、VHH变体、VHH衍生物、治疗剂或药物组合物,其中所述患者患有疾病、疾病症状或者患病倾向。
术语“预防”是指由神经纤维缠结、神经纤维网细丝或营养不良的神经突起所介导的疾病,如tau蛋白病,包括阿尔茨海默氏病(AD)、皮克病(PD)、额颞痴呆症(FTD)、皮质基底核退化(CBD)和进行性核上性麻痹(PSP),优选AD、FTD、CBD和PSP的进展得以降低和/或消除,或者由神经纤维缠结、神经纤维网细丝或营养不良的神经突起所介导的疾病,如tau蛋白病,包括阿尔茨海默氏病(AD)、皮克病(PD)、额颞痴呆症(FTD)、皮质基底核退化(CBD)和进行性核上性麻痹(PSP),优选AD、FTD、CBD和PSP的发作得以延迟或消除。
另一方面,本发明涉及根据本发明的VHH、VHH变体或者VHH衍生物,尤其是式P-C-Z或Z-C-P的VHH衍生物用于制备将上述限定的感兴趣物质递送穿过哺乳动物血脑优选人血脑屏障的肽载体的用途。
本发明还提供连接至治疗化合物的根据本发明的式P-C-Z或Z-C-P的VHH衍生物作为治疗剂。
除了前述特征,本发明还包括其它特征,将通过以下描述得以显现,这涉及用于说明本发明的实施例以及附图。
附图说明
图1显示Inti和Rascar血清针对磷酸化tau和tau蛋白的结合。使用兔抗羊驼抗体检测羊驼多克隆抗体。
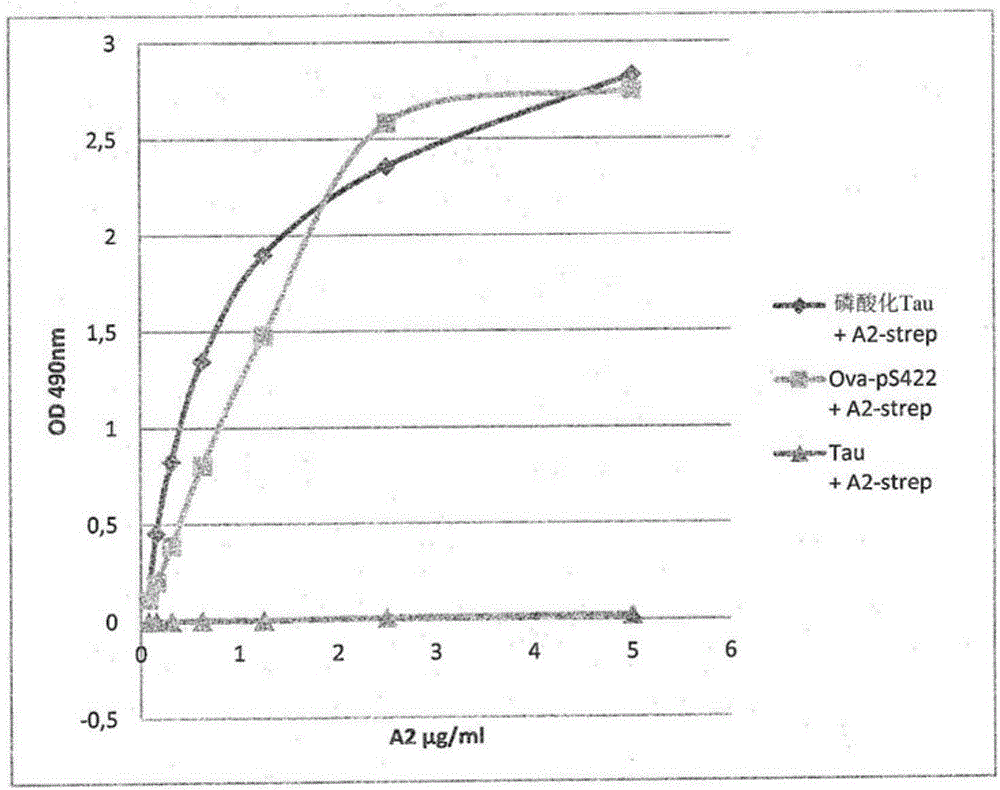
图2显示纯化的VHH Tau-A2与磷酸化tau、tau(未磷酸化)和Ova-pS422肽的结合。
图3显示在来自患有不同的tau蛋白病的病例的人石蜡切片上使用VHH Tau-A2和mAb AT8的NFT免疫组织化学染色:AD(图3A)、FTD(图3B)、PSP(图3B)和PD(图3C)。
图4显示在Tg4510小鼠自由浮动切片上使用VHH Tau-A2和mAb AT8的NFT免疫组织化学染色。
图5显示通过VHH Tau-A2和Tau-pS422mAb显色的AD脑提取物和磷酸化tau(p-tau)的western印记。泳道1和3:分别是p-tau+Tau-A2和Tau-pS422mAb。泳道2和4:分别是AD提取物+Tau-A2和Tau-pS422mAb。
图6显示马来酰亚胺-(DOTA/Gd)3(化合物1)的固相合成。
图7显示Tau-A2及其衍生物的生物化学和组织学表征。A:通过instantBlue染色的SDS-PAGE凝胶进行VHH Tau-A2-SH(泳道1)和Tau-A2-S-AF488(泳道2)的蛋白谱分析。B:在3-10IEF凝胶上通过NEPHGE确定Tau-A2衍生物的pI。C:在Tg4510石蜡切片上通过Tau-A2-S-AF488进行NFT体外成像。VHH的存在通过添加针对VHH的兔多克隆抗体而显色。D:阴性对照:在无TauPS2APP VHH的石蜡切片上仅使用兔抗VHH Tau-A2进行IHC。E:通过Tau-A2-S-AF488在Tg4510自由浮动切片上的皮质中直接荧光染色NFT。F:通过Tau-A2-S-AF488在Tg4510自由浮动切片上的海马中直接荧光染色NFT。
图8显示在8月龄Tg4510小鼠中脑注射Tau-A2-S-AF488之后NFT的体内成像。箭头表明NFT的标记。比例尺=50μm。
图9显示Tau-A2-S-AF488从血管扩散和标记NFT的体内双光子成像。A:以10mg/kg静脉注射Tau-A2-S-AF488之后1分钟、120分钟、180分钟,在Tg4510小鼠的皮质区中荧光的最大强度投影。然而在iv注射之前仅能检测到微弱的非特异性信号,在iv注射后几秒(T1),观察到树枝状管的强染色。在120分钟后观察到NFT的特异性标记(白色箭头),在180分钟后具有最大强度(3D重构(MIP))。在两只小鼠上进行实验。B:在IV注射Tau-A2-S-AF488后四小时,收集脑,对5μm的石蜡切片进行IHC。用兔多克隆抗VHH抗体显色存在和通过Tau-A2-S-AF488标记NFT。
图10显示用于表达的最佳化Tau-A2-SH的氨基酸序列。SEQ ID NO.14所示的Tau-A2-SH。SEQ ID NO.17所示Tau-A2var-SH。
图11显示Tau-A2变体的生物化学和组织学表征。A:通过instant Blue染色的SDS-PAGE凝胶进行VHH Tau-A2-SH(左)和Tau-A2var-SH(右)的蛋白谱分析。B:在3-10IEF凝胶上通过NEPHGE确定Tau-A2-SH(泳道1)和Tau-A2var-SH(泳道2)的pI。C:VHH Tau-A2-SH和VHH Tau-A2var-SH对包被的磷酸化Tau蛋白的ELISA结合。使用无关VHH进行阴性对照。VHH结合通过添加鼠抗His标签mAb显色,鼠抗His标签mAb通过过氧化物酶标记的抗鼠抗体显色。D:通过对Tg4510小鼠进行IHC比较VHH Tau-A2-SH和VHH Tau-A2var-SH。VHH以2μg/ml的浓度使用,它们的存在通过抗His鼠mAb、接着通过过氧化物酶标记的抗鼠Ig显色。
图12显示在8月龄Tg4510小鼠中静脉注射Tau-A2var-S-(DOTA/Gd)3之后NFT的体内成像。在IV注射Tau-A2var-S-(DOTA/Gd)3后4小时,收集脑,对5μm的石蜡切片进行IHC。用兔多克隆抗VHH抗体显色存在和通过Tau-A2var-S-(DOTA/Gd)3标记NFT。
具体实施方式
实施例I:产生偶联至ALEXA或钆造影剂的抗-磷酸化TAUVHH及其体外/体内评价
材料和方法
1.抗tau特异性VHH(Tau-A2)的生产、选择和纯化
1.1抗原的制备以及在羊驼内诱导体液免疫反应
受试者
来自AD患者(Braak V和VI期)的人皮质脑组织获自NeuroCEB脑库。该库和脑捐献计划有关,由患者协会财团(consortium of patients associations)(包括法国阿尔茨海默氏病协会)运行,并根据法国法律的要求由法国研究和大学部(Ministry of Research and Universities)宣布。根据法国生物伦理法,对脑捐献获得明确的书面同意。
根据Mercken等人(1992Acta Neuropathol.,84,265-272)进行组织提取。在10体积的含有10%的蔗糖的10mM Tris、1mM EGTA、0.8M NaCl pH7.4中匀浆来自AD脑的皮质(0.2g),并且在4℃以27,000×g离心20min。移除沉淀并将上清液调节至1%N-月桂酰肌氨酸和1%β-巯基乙醇并孵育,同时在37℃旋转2.5小时。在20℃以100,000g离心上清液混合物35分钟。使用PBS轻柔地洗涤含有PHF的沉淀,并且最后使用相同的缓冲液重悬。
使用tau沉淀物免疫一只羊驼(Inti),并且使用偶联至KLH(Eurogentec)的衍生自tau蛋白的C端的序列是CSIDMVDS(PO3H2)PQLATLAD(SEQ ID NO.6)的单磷酸化肽免疫另一只羊驼(Rascar)。
250μl(500μg)的两种抗原和250μl的弗氏完全佐剂混合用于首次免疫,与250μl的弗氏不完全佐剂用于随后的免疫。在第0、21和40天的三次免疫接种后,在第52天,取血清样本,通过ELISA使用重组磷酸化tau蛋白或重组非磷酸化tau蛋白监测免疫反应。
1.2文库构建与筛选
在第52天收集250ml免疫动物的血液,通过在Ficoll(Pharmacia)不连续梯度上离心来分离外周血淋巴细胞,并保存于-80℃直至进一步使用。按照之前在Lafaye P等人(1995,Res Immunol.,146,373-382)中描述的获得总RNA和cDNA,并且使用CH2FORTA4和VHBACKA6引物通过PCR扩增编码VHH结构域的DNA片段,所述引物分别退火至VH基因的3′和5′侧翼区域。使用引物VHBACKA4和VHFOR36,扩增的产物用作第二轮PCR的模板。引物互补于扩增产物的5′和3′端,以及在VHH基因的末端并入SfiI和NotI限制性位点。消化PCR产物并连接至噬菌体表达载体pHEN1。获得的文库包含两个子文库,一个源自tau沉淀物,另一个衍生自偶联KLH的磷酸化肽。使用两个子文库生产和分离噬菌体,并随后合并。
针对全长磷酸化tau蛋白进行文库筛选(>6x108克隆)。使用在PBS中的抗原(10μg/ml)在4℃包被Nunc Immunotubes(Maxisorp)管过夜。通过与包被管在37℃下轻微搅动孵育1小时,进行噬菌体(1012转导单位)筛选。在三轮筛选中的每一轮分别使用不同的阻断剂:2%脱脂乳、1:4稀释的Licor阻断缓冲液(Biosciences)、以及4%BSA。使用HRP/抗M13单克隆抗体缀合物(GE Healthcare)通过标准的ELISA程序筛选噬菌体克隆用于检测(见下面)。使用磷酸化tau蛋白和tau蛋白平行地进行筛选。
1.3VHH表达
使用NcoI和NotI限制性位点,在载体pHEN1中所选纳米抗体的编码序列亚克隆至含有6-组氨酸标签的细菌表达载体pET23d。用IPTG(0.5mM)在16℃过夜诱导后,转化的大肠杆菌BL21(DE3)pLysS细胞在细胞质中表达VHH。根据制造商的说明,通过IMAC从细胞质提取物使用带有Ni2+的HiTrap粗提柱(GE Healthcare)分离纯化的VHH。在50mM磷酸钠缓冲液、300mM NaCl和500mM咪唑缓冲液中洗脱VHH,并在含有300mM NaCl的PBS缓冲液(PBS/NaCl)中透析。
选择的VHH的编码序列还被亚克隆至在C端含有Strep标签的经修饰的pASKIBA2表达载体(Skerra和Schmidt1999Biomol Eng.,16,79-86)。使用相同的限制性位点。用脱水四环素(anhydrotetracycline,AHT,200μg/l)在16℃过夜诱导后,转化的大肠杆菌XL2-Blue Ultracompetent细胞在外周胞质中表达VHH。然后根据制造商的说明,使用Strep-Tactin柱(IBA)纯化来自细菌提取物的VHH。
2.VHH Tau-A2偶联至MRI造影剂和荧光团
2.1常规合成方法
除非另有说明,氨基酸衍生物和试剂分别购自Novabiochem和Sigma-Aldrich。用6N HCl在110℃水解化合物20小时之后,通过定量氨基酸分析(AAA)使用Beckman 6300分析仪确定肽和VHH溶液的浓度(净蛋白含量)。在连接有UV检测器2487(220nm)和Q-TofmicroTM光谱仪(Micromass)且带有电喷雾离子(正模式)源(Waters)的Alliance 2695系统上进行RP-HPLC/MS分析。在自动上样器上样本冷却至4℃。用乙腈+0.025%甲酸(A)/水+0.04%TFA+0.05%甲酸(B)进行线性梯度,持续10或者20min。所用的柱是XBridgeTMBEH300C18(3.5μm,2.1x100mm)(Waters)(梯度10-100%A)。源温度维持在120℃,去溶剂化温度为400℃。锥电压是40V。在添加有B的各自缓冲液中以0.4-1mg/ml的浓度注射样本。
如在图6中所示,通过固相肽合成,使用9-芴甲基氯甲酸酯(Fmoc)化学制备马来酰亚胺-(DOTA/Gd)3化合物1。
2.2Tau-A2-SH的生产
用NcoI和XhoI限制性位点,将Cys的工程化VHH(Tau-A2-SH)编码序列克隆至细菌表达载体pET23d。简言之,Tau-A2-SH(SEQ ID NO.14)从N至C端包含6-组氨酸标签、凝血酶切位点、VHH Tau-A2序列、随后G3S间隔序列和三个额外的氨基酸CSA。用IPTG(0.5mM)在16℃过夜诱导后,转化的大肠杆菌BL21(DE3)pLysS细胞在细胞质中表达Tau-A2-SH。根据制造商的说明,通过IMAC从细胞质提取物使用带有Ni2+的HiTrap粗提柱(GE Healthcare)分离纯化的VHH。在含有500mM咪唑的PBS/NaCl中洗脱蛋白,并且在PBS/NaCl中透析。
AAA:Ala 14.3(14),Arg 9.6(10),Asp+Asn 7.3(6),Glu+Gln 11.2(10),Gly 18.4(19),His 5..7(6),Ile 4.2(4),Leu 8.6(8),Lys 5.3(5),Phe 4(4),Pro 2.9(2),Ser 18.9(23),Thr 10.5(12),Tyr 6.1(7),Val 11.5(11).
MS:15499.286(C669H1047N205O213S4计算的15498.190)。MS对应于N端删除蛋氨酸的蛋白。
2.3合成Tau-A2-S-Alexa(Tau-A2-S-AF488)
存在于Tau-A2-SH三肽的C端的半胱氨酸用于将Tau-A2-SH偶联至马来酰亚胺Alexa荧光团(Invitrogen)。含有Tau-A2-SH的溶液的pH调整在6.8至7。然后将溶液与10倍摩尔过量的三(2-羧乙基)膦(TCEP)在室温轻微搅动30分钟,以允许完全还原任何分子间二硫键。添加溶解于二甲基甲酰胺(DMF)的10倍摩尔过量的马来酰亚胺Alexa荧光团。尤其是为了高效率的缀合,在最终溶液中,DMF的体积百分比保持5%以下。在避光下,在室温下进行缀合2小时。然后使用含有300mM NaCl(总浓度)的PBS通过连续透析去除未缀合的马来酰亚胺荧光团。
2.4合成Tau-A2-S-(DOTA/Gd)3
在缀合之前,使用TCEP(24.6μg,5eq)处理Tau-A2-SH(4.2ml,在PBS/NaCl中0.32mg/ml pH 6.8)30分钟,以防止VHH的二聚化。将在水性溶液中的马来酰亚胺-(DOTA/Gd)3(0.78mg,3.8eq相对于每VHH 1巯基基团)(78μl)添加到蛋白中,并且在4℃搅动3小时。然后在PBS/NaCl中使用Slide-A-Lyzer盒(Thermo Scientific)透析溶液(3,500MWCO)。使用缓冲液B(20μl)稀释一份(20μl))Tau-A2-SH和Tau-A2-S-(DOTA/Gd)3用于RP-HPLC/MS分析。进一步的,一份(10μl)相同的化合物在20mM Tris缓冲液pH7.3(90μl)中被稀释,用于ELISA分析。以65%的产率获得4.2ml的Tau-A2-S-(DOTA/Gd)3(0.24mg/ml)。这是通过终产物Tau-A2-S-(DOTA/Gd)3实际的量除以其期望的量(净蛋白含量)计算的。用于进一步实验,使用Vivaspin 2离心过滤器装置(3,000MWCO PES)浓缩Tau-A2-S-(DOTA/Gd)3溶液四倍。
AAA:Ala 13.4(14),Arg 9.6(10),Asp+Asn 8.0(6),Glu+Gln 11.8(10),Gly 24.4(22),His*(6),Ile 4.2(4),Leu 8.6(8),Lys 18.9*(8),Phe 4(4),Pro 29(2),Ser 16.8(23),Thr 10.7(12),Tyr 6.1(7),Val 11.4(11)。(*由于与铵共洗脱,而His不能被确定。由于在分析的条件中与马来酰亚胺衍生物共洗脱,Lys是过高估计的)。
MS:17887.549(C751H1174N227O244S4Gd3计算的17886.980)。
3.通过免疫组织化学和生物化学体外表征Tau-A2和Tau-A2缀合物
3.1受试者
人脑组织获自NeuroCEB脑库。在Tg4510(Santacruz等人.2005Science,309,476-81)转基因小鼠上进行临床前实验。严格按照法国和欧洲的法律的伦理标准(欧洲共同体理事会对用于科学目的动物的保护指令2010/63/EU)并且经当地动物护理和使用委员会的批准后进行动物实验程序。使用高剂量戊巴比妥钠(100mg/kg)处死动物,然后用10%缓冲的福尔马林灌注固定。而后,摘除其脑,浸入福尔马林至少24小时,并储存在4℃。
3.2组织提取物
根据Mercken等人(1992Acta Neuropathol.,84,265-272)进行组织提取。
3.3免疫印迹
将磷酸化tau蛋白重悬于样本缓冲液(Invitrogen)中。脑提取物重悬于含有8M尿素的样本缓冲液(Invitrogen)中。用NuPAGE Novex 4–12%Bis–tris凝胶(Invitrogen)通过聚丙烯酰胺凝胶电泳(PAGE)分离之后,半干转移到Hybond-C(Amersham)上,使用Xcell II印记模块(Invitrogen)进行western印记。免疫化学反应之前,在4%脱脂乳溶液中封闭膜。用VHH(具有His或Strep标签)或抗p-tau 422mAb(Grueninger等人.2011Mol Cell Biochem.,357,199-207)进行膜的免疫印迹,用兔抗His标签(eBioscience)多克隆抗体随后是过氧化物酶标记的羊抗兔免疫球蛋白(Abcam)显色,或者用抗Strep标签单克隆抗体(比如以编号I-4703提交至CNCM的杂交瘤生产的抗体C23-21)随后是过氧化物酶标记的兔抗鼠免疫球蛋白(Bio-rad)显色。最后,使用化学发光试剂盒(GE Healthcare)对过氧化物酶活性进行可视化。
3.4ELISA
在4℃通过用稀释于PBS中的1μg/ml的磷酸化tau、或tau蛋白、或偶联至卵清蛋白的SEQ ID NO.6所示的磷酸化肽孵育过夜,来包被微滴定板(Nunc,丹麦)。用PBS中的0.1%Tween 20缓冲液洗板。Tau-A2(具有His或Strep标签)稀释于PBS中的0.5%明胶0.1%Tween 20缓冲液。37℃孵育2h之后,分别在添加兔抗His标签多克隆抗体(eBiosciences)随后是过氧化物酶标记的羊抗兔免疫球蛋白(Abcam)之前再次洗板,或者在添加抗Strep标签单克隆抗体(比如抗体C23-21)随后是过氧化物酶标记的兔抗鼠免疫球蛋白(Bio-rad)之前再次洗板,最后根据制造商规程用OPD(o-邻苯二胺盐酸盐,Dako)显色。
3.5序列分析
通过GATC Biotech测序编码VHH的DNA,用Serial Cloner处理序列。
3.6确定pI
通过等电聚焦使用IEF 2-9凝胶(Invitrogen)确定VHH的pI。使用在正极施加样品的NEPGHE(非平衡pH梯度凝胶电泳),因为其允许在包括pH 8.5至10.5的碱性凝胶范围进行最佳蛋白分析。规程详见SERVAGel IEF 3-10说明手册。
3.7免疫组织化学和免疫荧光
在福尔马林固定的组织(石蜡包埋的或者冷冻切片或者振动切片机切片)上进行免疫组织化学。采用标准IHC规程并根据各组织条件进行调整。因为大多免疫染色实验是使用石蜡切片进行的,此处给出石蜡包埋材料的详细规程。脑组织的免疫染色在4μm厚的石蜡切片上进行。使用人和小鼠组织(AD或者其它tau蛋白病的人患者,和Tg4510小鼠(Santacruz等人.2005Science,309,476-481)。二甲苯中对切片进行脱石蜡,通过乙醇(100%,90%和70%)进行再水化,各个溶液5min,最后带至流动的自来水中进行10min。然后,在98%甲酸中孵育5分钟,在流动的自来水下再次洗涤,对于内源的过氧化物酶采用3%过氧化氢和20%甲醇进行淬灭,最后在水中洗涤。在TBS+0.5%Tween中2%牛血清白蛋白中对切片孵育30min来封闭非特异性结合。然后应用适当稀释的一抗(1-10μg/ml的具有His或者Strep标签的VHH),在4℃在潮湿室中过夜孵育切片。用TBS-Tween洗涤切片,并在室温与TBS-Tween中的1/1000二抗兔抗His标签或者自制的生物素化抗strep mAb C23-21孵育1小时。然后,根据制造商说明用Dako REALTM检测系统Peroxidase/DAB+的试剂进行切片的孵育。进行发色(DAB)显示,直至获得良好信噪比(大约5min)。用TBS-Tween洗涤后,切片用苏木精复染。为了标记NFT,将生物素化的AT8(ThermoScientific)用作平行的阳性对照。
使用Tau-A2-S-AF488使用振动切片机(Leica VT1000S)在Tg4510小鼠获得的40μm厚的自由浮动切片(free floating section)上进行NFT的免疫荧光染色。在以PBS洗涤3次×5分钟后,通过使用含有2%BSA的PBS-triton 0.2%孵育15分钟封闭切片,然后更换为1μg/ml的在PBS-triton 0.2%中的Tau-A2-S-AF488,并且在4℃孵育过夜。最后使用PBS洗涤切片,并且使用水性封片(mounting)介质(Mowiol)封片。
4.通过双光子成像和相关免疫组织化学体内评价Tau-A2和Tau-A2缀合物
4.1受试者
Tau-A2和Tau-A2-S-(DOTA/Gd)3的体内评价在Tg4510转基因小鼠上进行。
4.2VHH和IHC的立体定位注射
采用每注射2μl的VHH以0.5μl/min的速率,在Tg4510雌性转基因小鼠(n=2)麻醉小鼠上进行立体定位注射。用异氟烷(1-2%)和空气(1L/min)混合物麻醉小鼠。将其置于立体定位框架中,用Dremel头颅双侧穿孔。Blunt Hamilton注射器用于注射MRI造影剂。各个小鼠在各半球额皮质和海马中接受4次注射。额皮质的立体定位坐标是距离前囱前+0.86mm,距离中线横向±1.5mm,距离硬脑膜垂直-0.65mm。海马中的立体定位坐标是距离前囱后-2.18mm,距离中线横向±1.5mm,距离硬脑膜垂直-1.8mm。注射后的2或24小时,麻醉小鼠,心脏内灌注PBS中的4%多聚甲醛(pH 7.6)。摘除脑,然后按照相同的固定方式(fixative)在4℃进行过夜固定。制备4μm厚的石蜡切片。使用上述免疫组织化学方法检测脑组织中VHH的存在。
4.3使用Tau-A2-S-AF488在Tg4510小鼠中进行双光子显微术
1)穿颅术
通过吸入异氟烷(在纯O2中1%体积/体积)麻醉两只8月龄Tg4510小鼠,并放置于保温毯(37℃)上。使用立体定位框架鉴定运动皮质的位置。皮下注射2%利多卡因50μl,用于在去除皮肤的切口位置局部麻醉。使用手术刀进行少于2mm的穿颅术。在脑内注射VHH Tau-A2-S-AF488的情况中,切开硬脑膜。在静脉注射的情况中,保持硬脑膜的完整。为避免运动伪影(movement artifacts),头颅开口使用2%低熔点琼脂糖和盖玻片覆盖。固定光学窗口,并且使用牙科接合剂(dental cement)与头颅密封,覆盖全部暴露的头颅、伤口边缘和盖玻片的边缘。
2)施用Tau-A2-S-AF488
脑内注射:1.2μg(1.5μL)的Tau-A2-S-AF488被注射至一只Tg4510小鼠距皮质表面1.5mm深的脑中。然后在注射之后的4小时期间进行双光子成像。
静脉注射:270μg(150μl)的Tau-A2-S-AF488缓慢注射至一只Tg4510小鼠尾静脉。然后在随后的3小时进行双光子成像。
3)双光子成像
用双光子激光扫描显微镜系统和PrairieView软件(Prairie Technologies,Middelton,WI,USA),使用具有调谐至920nm的2光子激光(MaiTai DeepSee,Spectra Physics,Mountain View,CA,USA)的16x 0.9NA水浸物镜(Nikon,东京,日本)进行双光子成像。在512x 512捕获图像,像素尺寸0.5μm。应注意在组织中使用小于20mW的激光功率。
5.获得兔多克隆抗VHH抗体
使用经纯化的羊驼免疫球蛋白免疫兔。在第二步中纯化针对VHH的兔多克隆抗体。首先通过免疫色谱使用蛋白A-琼脂糖4B珠分离多克隆抗体。然后通过使用标记有Tau-A2var-SH的琼脂糖4B珠实施另一免疫色谱。根据制造商的说明(GE)实施琼脂糖的标记。产生的纯化的抗体表现为小于总兔抗体的1%,并且称为兔多克隆抗VHH抗体。这些抗体结合Tau-A2VHH。
结果
1.多克隆反应、文库构建、以及特异性抗tau VHH的选择
在3次免疫接种后,收集Inti(脑提取物)和Rascar(tau-pS422)的血清,并且通过ELISA分析它们与磷酸化tau和非磷酸化tau的结合(图1)。Inti和Rascar的血清识别磷酸化tau和非磷酸化tau,尽管Inti的免疫反应似乎较Rascar的免疫反应更好。然而前者不能显著区分磷酸化tau和非磷酸化tau,并且后者显示对磷酸化tau更高的免疫应答。
为了确保存在于血清中的一种或多种抗磷酸化tau抗体能够在固定的小鼠组织中识别tau损伤,对来自TauPS2APP小鼠的冷冻超薄切片机浮动切片和非冷冻振动切片机浮动切片进行IHC(Grueninger F.等人,2010,Neurobiol Dis.,37:294-306)。Inti的血清不显示任何tau损伤的免疫染色,然而Rascar的血清证实对超薄切片机和振动切片机切片上的NFT的特异性tau染色(数据未显示)。
尽管在IHC中使用Inti多克隆血清缺失对NFT的免疫检测,不能排除在它的血浆中存在磷酸化tau特异性抗体。的确,IHC信号的缺失可能由于抗磷酸化tau抗体的低频率,所述抗体能够识别存在于TauPS2APP小鼠的NFT中的磷酸化tau的表位。合并获得自这两只动物的两个文库用于筛选实验。
来自外周血淋巴细胞的总RNA用作cDNA合成的模板。然后使用这种cDNA,通过PCR扩增VHH编码序列,并且克隆至载体pHEN1。后续的转化产生两个文库,每个约3×108克隆。合并两个文库,并且采用磷酸化tau经过3次筛选循环,通过噬菌体展示选择显示最佳亲和性的VHH。通过磷酸化tau和tau蛋白进行ELISA测试96个独立的克隆。仅发现一个克隆特异性地结合磷酸化tau(VHH Tau-A2)。
该VHH亚克隆至载体pET23或者载体pASK IBA2以便允许VHH分别和His-标签或者链霉亲和素-标签进行高水平表达。获得细菌培养物的<1mg/l产率。通过SDS-PAGE和RP-HPLC/MS显示单结构域产物纯化至同质(数据未显示);其pI值在9.5以上。动态光散射实验显示Tau-A2在纯化后是单体的(RH=4.5±0.3nm),并且不聚合。VHH Tau-A2的氨基酸序列如SEQ ID NO.4所示。
2.通过VHH Tau-A2识别NFT
2.1VHH Tau-A2识别在C端tau肽中的磷酸化丝氨酸422
在致病形式的tau上数个丝氨酸和苏氨酸是磷酸化的。为评价磷酸化在表位识别中的作用,对磷酸化tau和偶联至卵清蛋白(Ova)蛋白的衍生自tau蛋白的C端的单磷酸化肽(序列CSIDMVDS(PO3H2)PQLATLAD;SEQ ID NO.6)进行ELISA。磷酸化tau是在多个位点包括S422磷酸化的全长tau蛋白。VHH Tau-A2结合两种化合物表明VHH Tau-A2识别包括磷酸化丝氨酸422(pS422)的表位(图2)。
2.2VHH Tau-A2对NFT的免疫反应性
检验了人AD脑、来自其它tau蛋白病的组织中(额颞痴呆症[FTD]、进行性核上性麻痹[PSP]和皮克病[PD])和转基因Tg4510小鼠脑中VHH特异性免疫反应性的分布。
在来自AD患者的石蜡切片中VHH Tau-A2显示良好的免疫检测NFT的能力(图3A)。还在FTD病例(少突胶质细胞螺旋体)和PSP病例(星形细胞簇)中观察到tau阳性神经胶质内含物(图3B)。有趣的是,通过参照抗tau AT8mAb鉴定的典型的细胞内含物(皮克体(Pick bodies))对于Tau-A2是阴性的(图3C),突出了VHH一定的特异性。与其它tau蛋白病相反,皮克体仅由3R tau蛋白构成。因此假设Tau-A2主要识别具有4个重复的tau。来自野生型小鼠的组织未观察到标记。
对于石蜡包埋组织的平行结果,显示使用VHH Tau-A2的NFT免疫检测对于小鼠自由浮动振动切片机切片很容易获得(图4)。
为了确认在脑组织上VHH Tau-A2的免疫反应性,对获得自AD患者的脑提取物进行western印记免疫测定。Tau-pS422mAb(Grueninger等人.2011Mol Cell Biochem.,357,199–207)用作参照抗体。重组磷酸化tau(p-tau)平行装载至SDS-PAGE凝胶。磷酸化tau蛋白通过VHH Tau-A2和Tau-pS422mAb显色。在AD提取物中,使用Tau-A2和Tau-pS422的免疫检测得到对应于磷酸化tau的一个主要的条带,在70至100kDa。使用Tau-pS422mAb观察到具有分子量130至150kDa的两个额外的条带,表明在AD脑中存在聚集的tau-pS422,这通过Tau-A2十分轻微的显色(图5)。
3.Cys-工程化的Tau-A2和抗体偶联至Alexa马来酰亚胺
从N至C端含有6-组氨酸标签、凝血酶切位点、VHH Tau-A2序列、随后G3S间隔序列和三个额外的氨基酸CSA的Cys-工程化的Tau-A2克隆至载体pET23d,以允许高水平的表达(称为Tau-A2-SH或A2-SH;SEQ ID NO.14)。通过硫代加成将Tau-A2-SH和马来酰亚胺Alexa缀合。通过SDS-PAGE、IEF/NEPGHE(图7A和7B)和RP-HPLC/MS分析得到的产物Tau-A2-S-AF488。通过SDS-PAGE和RP-HPLC/MS显示它被纯化至同质。所有的分析显示Tau-A2-SH完全转化成明确的缀合物,称为Tau-A2-S-AF488,在VHH Tau-A2上具有单AF488。Tau-A2-SH具有约10(9.5至10.5之间)的pI,并且该值在AF488缀合后略有下降,仍保持在大于9.5(参见图7B)。通过DLS分别测量Tau-A2-SH和Tau-A2-S-AF488的流体动力学半径(RH)。随时间的尺寸分布显示Tau-A2-SH的平均RH是2.66±0.0788nm,以及Tau-A2-S-AF488的平均RH是3.576±0.225nm,这表明它们两个在溶液中是以单体的形式。
4.使用VHH Tau-A2-S-AF488检测NFT
4.1Tg4510小鼠脑片的体外标记
在直接与小鼠脑切片孵育之后,通过标准的IHC(图7C-D)和直接的荧光染色(图7E-F),Tau-A2-S-AF488显示在Tg4510小鼠中检测NFT良好的能力。
4.2在脑内注射后双光子成像
在Tg4510小鼠脑中直接脑内注射1.2μg(1.5μL),接着穿颅术和硬脑膜穿孔之后,进行Tau-A2-S-AF488的体内双光子成像。观察到大量CSF和高自发荧光(即使在注射之前)。尽管有这些对于合适的双光子成像的限制,在局部皮质注射之后检测到NFT的特异性染色(图8)。
4.3在静脉注射VHH Tau-A2-S-AF488之后双光子成像
10mg/kg剂量的Tau-A2-S-AF488注射至两只Tg4510小鼠的尾静脉(270μg,150μL)。先前通过MRI检查这些小鼠的BBB的完整性,在小鼠中信号改变的缺失表明BBB没有破坏(数据未显示)。注射之后,使用双光子显微术在脑窗持续记录4小时的脑中缀合物的溢出和染色(z=距离表面达360μm深)。图9A显示相同区域内Tau-A2-S-AF488在长达180分钟之内随着时间的体内成像(最大强度投影-MIP)。在iv注射后几秒,观察到树枝状管的强染色,20分钟后剧烈降低,只有少数毛细管仍保留染色。这表明缀合的VHH在循环中半衰期短(10-20分钟)。在iv注射后120分钟,开始显示NFT。红色通道中没有信号,表明荧光信号是特异性的(数据未显示),并不是因为常规的自发荧光。注射之后,使用双光子显微术在脑窗持续记录3小时的脑中VHH Tau-A2-S-AF488的溢出和染色(距离直接的皮质表面达350μm深)。除强自发荧光背景和大量的CSF以外(参见上面),Tg4510小鼠显示显著的脑萎缩。在iv注射后几秒,观察到密集管的强染色。在注射后2小时,观察到NFT的特异性tau染色,尽管保持了自发荧光信号。即使在注射后3小时,观察到NFT的持久和特异性的标记(图9A),表明Tau-A2-S-AF488的脑半衰期扩展至数小时。
在静脉注射Tau-A2-S-AF488后4小时,收集脑,制备5μm厚的石蜡切片。然后使用兔多克隆抗VHH抗体进行IHC,以确认扩散和通过Tau-A2-S-AF488标记的NFT(图9B)。
6.对照实验
在无NFT的小鼠中的评价
Tau-A2-S-AF488静脉注射至野生型无NFT的C57BL/6小鼠。使用双光子显微术分析,脑实质中没有观察到特异性体内染色(数据未显示)。
和常规IgG抗体的比较
Tg4510小鼠中iv注射缀合AF488的抗Tau mAb(Grueninger等人.2010Neurobiol.Dis.,37,294-306)不允许检测NFT,这表明这表明这种标准抗Tau-pS422免疫球蛋白没有显著的溢出。
7.结论
在iv注射后使用双光子显微术,VHH Tau-A2-S-AF488显示其穿过BBB,并在穿过第二(质膜)屏障后穿透入神经元到达细胞质靶标的能力。NFT标记的长期检测(3小时)也表明在脑中这种VHH的长半衰期。
8.偶联至MRI造影剂的抗体
使用钆(MRI造影剂)标记VHH Tau-A2-SH,使用1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)作为螯合剂。使用位点特异性偶联策略,其涉及硫代加成Tau-A2-SH至合成的马来酰亚胺-(DOTA/Gd)3化合物。Tau-A2-SH完全转化成明确的缀合物Tau-A2-S-(DOTA/Gd)3,如通过RP-HPLC/MS所示的,具有65%的产率。Tau-A2-S-(DOTA/Gd)3的pI相比未标记的Tau-A2-SH之一略有降低(数据未显示)。
实施例II:合成TAU-A2-SH的变体:TAU-A2VAR-SH
VHH Tau-A2特异性地检测磷酸化Tau,但是其生产水平相当低,平均150μg/L,并趋向聚集。因此需要提供一种具有改进性能的VHH Tau-A2的变体。
位于SEQ ID NO.14所示的VHH Tau-A2-SH的2个疏水区域的2个疏水性氨基酸被突变:在位置76的异亮氨酸被甘氨酸取代(I76G),以及在位置110的缬氨酸被甘氨酸取代(V110G)(图10)。这些突变提高了VHH的亲水性,具有提高的GRAVY指数,从Tau-A2-SH的-0.280至变体的-0.365(GRAVY或Grand平均亲水性指数表明蛋白的溶解度:正GRAVY(疏水的)、负GRAVY(亲水的))。在位置26的谷氨酰胺还被突变为谷氨酸(Q26E),并且天冬氨酸(D)和缬氨酸(V)添加至位置22和23之间,略降低pI(更弱的碱性)(图10)。这些突变氨基酸的三个(D23、E26和G110)位于CDR外。这种突变体称为Tau-A2var-SH(SEQ ID NO.17)。
VHH Tau-A2var-SH(SEQ ID NO.17)克隆至pET23d载体,并且在大肠杆菌中表达。在Ni-NTA树脂上通过在咪唑中洗脱纯化。通过数个方法进行Tau-A2-SH与Tau-A2var-SH的比较分析:
-SDS-PAGE在约15-16KDa的表观分子量处仅显示一个条带(图11A)。观察到Tau-A2var-SH的较佳的生产估计具有0.8-1mg/L的表达率,高于亲本相对物5倍。此外,Tau-A2var-SH具有较低的聚集趋势。pI是9.68与Tau-A2-SH相比略弱的碱性(图11B)。
-通过ELISA评价两种VHH识别磷酸化Tau的能力(图11C)。比较Tau-A2var-SH和Tau-A2-SH的结合曲线,对于它们识别磷酸化Tau未显示任何差异(图11C)。
-进一步评估Tau-A2var-SH的功能活性,然后在来自NFT小鼠模型的组织上(Tg4510小鼠)实施IHC。在脑片和不同的化合物孵育之后,通过抗His二抗显色,在使用两种化合物的小鼠组织上观察NFT的检测(图11D)。与Tau-A2相比,使用Tau-A2var免疫染色甚至略有提高。
在亲和柱洗脱之后,直接在非透析的(non-dialized)的蛋白溶液中,使用类似的方法标记VHH Tau-A2var-SH。
然后已经揭示了使用VHH Tau-A2var-S-(DOTA/Gd)3在体内检测NFT的能力。10mg/kg剂量的Tau-A2var-S-(DOTA/Gd)3注射至两只Tg4510小鼠的尾静脉(270μg,150μL)。静脉注射Tau-A2var-S-(DOTA/Gd)3后4小时,收集脑,制备5μm厚的石蜡切片。然后,用兔多克隆抗VHH抗体进行IHC。NFT在皮质中被标记(图12)。这些数据确认通过Tau-A2var-S-(DOTA/Gd)3脑穿透、扩散和NFT的标记。
结论
这些结果显示Tau-A2var以与Tau-A2类似的方式表现对于磷酸化tau和NFT的识别。在iv注射之后使用IHC研究,VHH Tau-A2var-S-(DOTA/Gd)3显示其穿过BBB,并在穿过第二(质膜)屏障后穿透入神经元到达细胞质靶标的能力。
- 还没有人留言评论。精彩留言会获得点赞!