一种具有肿瘤靶向的新型Pt(IV)配合物的制备方法及其应用与流程
本发明属于药物化学领域,具体涉及一种具有肿瘤靶向的新型pt(iv)配合物的制备方法及其应用。
背景技术:
癌症作为疾病中的第2大死亡原因,不仅严重的威胁了人类生命与健康,而且给家庭、社会国家造成了沉重的负担,干扰着我国经济建设和社会发展,是一个非常突出的社会公共卫生问题。自1967年rosenberg等人发现顺铂具有抗癌活性以来,顺铂作为一种临床化疗的高效抗肿瘤药物,被广泛用于实体瘤的治疗,包括睾丸癌、卵巢癌、子宫劲癌、肺癌以及膀胱癌等。尽管顺铂表现出抗癌广谱性,但顺铂缺乏对肿瘤细胞的选择性以及对患者体内正常细胞存在致命的伤害,因而在临床化疗治疗中出现不同程度的毒副作用、耐药性或交叉耐药性等表现。同时,由于上市的铂类抗肿瘤药物均目前上市的铂类抗癌药物均为2价铂的配合物,其化学性质活泼,稳定性差,在消化道发生化学反应而降解,同时脂溶性低也是影响药物吸收的主要因素之一,因此成为了临床用药的一系列障碍。所以,寻找提高具有选择性的抗肿瘤药物且克服pt(ii)药物缺点是临床化疗需攻破的难题。
八面体的pt(iv)配合物作为潜在的前药在血浆中具有一定的动力学惰性,一旦进入到人体癌细胞内将会被内源性还原剂(谷胱甘肽、抗坏血酸等)激活,释放pt(ii)配合物,发挥药物活性导致细胞凋亡。为了满足更高的配位数,pt(iv)配合物在pt中心的轴向位置需要两个以上的配体,以精细调节配合物的动力学稳定性、氧化还原电位、亲脂性和生物活性提高了机会。此外,在轴向位置键接功能分子的方法在不改变亲本化合物活性的情况下,可增加细胞对肿瘤细胞的摄取和特异性。具有代表性的pt(iv)配合物赛特铂(jm216),仍处于临床(iii)期的研究。尽管具有口服活性的优势,但在疗效方面,与顺铂、卡铂比较活性并不突出;同时,目前的临床化疗大部分采用联合用药,与铂类药物联用的大部分抗肿瘤药物以静脉注射形式具有最佳疗效,因而寻找全口服给药的联合化疗方案较难等一系列的问题导致jm216进入临床试验研究数达十几年仍迟迟不能上市。由于赛特铂非离去基团引入了不对称的胺配体,使得其作用机制与经典上市的铂类药物存在一定的差异。主要表现在与dna结合的变化,不对称胺配体诱导的加合物不被dna错配修复蛋白识别,由于丢失dna错配修复而避免用药耐药性。
肿瘤靶向分子与铂配合物结合形成具有靶向的药物,不仅可以提高药物的活性,而且可以减小药物的副作用。肿瘤细胞通常对一些维生素有贪婪的食欲,维生素内化中涉及的受体在细胞表面过度表达。因此,维生素键接铂配合物可能是潜在具有靶向的抗肿瘤药物。其中,生物素(维生素h或b7),由连接有戊酸取代基的四氢噻吩环稠合的脲基环组成。它是一种细胞生长促进剂,并且在细胞信号传导和基因调控中起着关键的作用。在近几年生物素引起了广泛的关注,原因如下几点:1)对癌细胞的摄取量高于正常细胞,且对正常细胞无毒副作用;2)结合给药体系,可以增加药物的细胞吸收,且能使得药物更安全和有有针对性地向特定的肿瘤组织递送;3)主要通过在乳腺,肺,卵巢和肾癌细胞中过表达的钠依赖性多维生素转运体(smvt)来吸收。因此,我们基于不对称的胺配体、具有靶向作用的生物素配体,我们设计了如(i)式或(ii)式结构的配合物,我们期望该配合物能针对特定某个癌症细胞发挥抗肿瘤活性,且能克服经典铂类药物的耐药性及减小用药的毒副作用。
技术实现要素:
本发明的目的是克服现有技术中的不足,提供一种具有肿瘤靶向的新型pt(iv)配合物。
本发明的第二个目的是提供一种具有肿瘤靶向的新型pt(iv)配合物的制备方法。
本发明的第三个目的是提供一种具有肿瘤靶向的新型pt(iv)配合物的应用。
本发明的技术方案概述如下:
一种具有肿瘤靶向的新型pt(iv)配合物,其结构式i或式ii所示:
其中z为cl-或
一种具有肿瘤靶向的新型pt(iv)配合物式i或式ii的制备方法,包括如下步骤:
1、以三氯胺铂酸钾为原料,溶于适量的纯化水中,分别加入碘化钾和环己胺,水浴45℃~60℃,反应3~7h,抽滤,所得滤饼用纯化水润洗2~3次,甲醇润洗1~2次,60℃~80℃干燥,得i/cl中间体。其中三氯胺铂酸钾、环己胺和碘化钾的摩尔比为1:1:1;
2、将步骤1中制备所得的i/cl中间体加入适量的纯化水溶于烧杯中,水浴45℃~60,℃均匀搅拌。称取适量的agno3溶于纯化水,缓慢滴加于烧杯中,继续反应约1~4h。反应结束后,抽滤除去agi、agcl沉淀,收集滤液。其中,i/cl中间体与agno3的摩尔比为1:2;
3、将步骤2中的滤液收集,加热至45℃~70℃,称取z加入溶液中,45℃~70℃均匀搅拌反应1~4h,制得以氨基和环己胺为不对称的载体基团的pt(ii)配合物,产物使用纯化水润洗2~3次,甲醇润洗1~2次,60℃~80℃干燥。
其中z为cl-或
4、将步骤3制备的pt(ii)配合物溶于适量的纯化水中,45℃~65℃水浴均匀搅拌,量取适量的h2o2缓慢滴加至该反应体系中,均匀搅拌反应2~5h,抽滤,收集滤液,蒸发浓缩除去水溶液,所得产物水洗2~3次,甲醇润洗1~2次,45℃~60℃干燥,制得轴向含有两个羟基的pt(iv)配合物前体。其中pt(ii)配合物与h2o2的摩尔比为1:1。
其中z为cl-或
5、以生物素为原料,溶于适量的dmf溶剂中,分别加入n-羟基琥珀酰亚胺和碳化二亚胺盐酸,在室温条件下,均匀搅拌过夜。反应结束后,将反应混合液缓慢滴入冰水中,则有大量的白色固体析出,制得生物素琥珀酰亚胺酯。抽滤,甲醇润洗2次,真空干燥。其中生物素与n-羟基琥珀酰亚胺的摩尔比为1:1。
6、将步骤4制备的含有两个羟基的pt(iv)配合物前体溶于适量的dmso中,置于100ml圆底烧瓶中。称取步骤5中制备的生物素琥珀酰亚胺酯加入上述反应液中,水浴60℃,反应过夜。反应结束后,抽滤除去反应液中少量未溶的固体,收集滤液。将滤液使用体积比为1:1的乙醚与甲醇重结晶析出产物,抽滤,母液润洗2~3次,真空干燥,制得轴上含有一羟基和单取代生物素靶向配体的pt(iv)配合物。
7、将步骤3制备的pt(ii)配合物溶于适量的纯化水中,称取n-氯代丁二酰亚胺溶于纯化水中,缓慢滴加至该反应体系中,室温避光均匀搅拌过夜。反应完毕,抽滤,收集滤液,减压蒸发浓缩,分别用乙醇、乙醚润洗产物2~3次,制得轴向含有羟基和氯的pt(iv)配合物前体,其中pt(ii)和n-氯代丁二酰亚胺的摩尔比为1:1。
其中z为cl-、
8、将步骤7制备的轴向上含有羟基和氯的pt(iv)配合物前体溶于dmf溶剂,且加入缩合剂tbtu和三乙胺,水浴40℃~60℃,均匀搅拌。随后,称取生物素加入上述反应体系中,继续反应过夜。反应结束后,抽滤,除去反应液中少量的未溶固体,收集滤液。将反应液分别加入适量的ch2cl2和纯化水进行萃取2~3次除去反应液中的缩合剂,收集有机相液体,蒸发浓缩除去有机溶剂,产物使用体积比为1:1的乙醚与甲醇重结晶析出产物,母液润洗2~3次,真空干燥,制得轴上含有氯和单取代生物素靶向配体的pt(iv)配合物。
一种具有肿瘤靶向的新型pt(iv)配合物式i或式ii在制备抗肿瘤药物中的应用。如结构式i或式ii中以不对称氨基和环己胺为载体基团,它克服经典顺铂类药物的耐药性的重要组成部分,且在轴上一端引入了靶向配体生物素,将铂类药物与生物素接合给药不仅增加了药物的细胞吸收,而且使得药物更安全和有针对性地向肿瘤组织递送;在轴上的另一端我们引入氯化物,使得新型pt(iv)配合物的氧化还原电位的负值降低并且增加其还原动力,以及在另一端我们保留一个羟基,使得新型pt(iv)配合物进入到人体后有利于跟体内还原剂(如谷胱甘肽、抗坏血酸)优先结合,还原成pt(ii)配合物以达到治疗肿瘤的效果。此外,选择了奥沙利铂离去基团草酸钾作为新型pt(iv)配合物的离去配体,改善新型pt(iv)配合物的水溶性。具有肿瘤靶向的新型pt(iv)配合物对特定某些肿瘤细胞具有一定的细胞活性,且能克服经典铂类药物的耐药性及减小用药的毒副作用。
本发明的主要优点在于:
1)本发明提供的结构式i或式ii所示的配合物,保留赛特铂载体基团的不对称氨配体,使其药物通过静脉注射进入到人体内所诱导的加合物不被dna错配修复蛋白识别,使dna错配修复的丢失而避免了用药耐药性;在轴向一端引入具有靶向作用的生物素配体,另一端引入氯化物使得铂配合物的氧化还原电位的负值降低并且增加还原动力或另一端保留一个羟基使得新型pt(iv)配合物进入到人体后有利于跟体内还原剂(如谷胱甘肽、抗坏血酸)优先结合,还原成pt(ii)配合物以达到治疗肿瘤的效果;并且在实例中部分配合物已经初步显现出优于现有的顺铂、奥沙利铂的抗肿瘤活性,故其有望成为未来新型具有靶向作用的pt(iv)配合物;
2)本方法合成过程简单易操作,且后处理是通过重结晶,操作简单易行,并且反应过程中没有高温高压,也没有使用剧毒物质,安全环保,有利于工业化生产。
本发明提到的上述特征,或实例提到的特征可以任意组合。本案说明书所揭示的所有特征可与任何组合形式并用,说明书中所揭示的各个特征,可以任何可提供相同、均等或相似目的的替代性特征取代。因此除有特别说明,所揭示的特征仅为均等或相似特征的一般性例子。
附图说明
图1为实施例1中一种具有肿瘤靶向的新型pt(iv)配合物a-1的氢谱图;
图2为实施例1中一种具有肿瘤靶向的新型pt(iv)配合物a-1的质谱图;
图3为实施例2中一种具有肿瘤靶向的新型pt(iv)配合物a-2的氢谱图;
图4为实施例2中一种具有肿瘤靶向的新型pt(iv)配合物a-2的质谱图;
图5为实施例3中一种具有肿瘤靶向的新型pt(iv)配合物a-3的氢谱图;
图6为实施例3中一种具有肿瘤靶向的新型pt(iv)配合物a-3的质谱图;
图7为实施例4中一种具有肿瘤靶向的新型pt(iv)配合物a-4的氢谱图;
图8为实施例4中一种具有肿瘤靶向的新型pt(iv)配合物a-4的质谱图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明,尤其实施例的具体实验条件仅是举例说明而不限制本发明的范围。除非另外说明,否则所有的百分数和比率都按重量计算。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅做示范之用。
发明采用的试剂及材料
三氯胺铂酸钾、碘化钾和环己胺、氯化钾、草酸钾、生物素均为市售产品
本发明一种具有肿瘤靶向的新型pt(iv)配合物式i或式ii的制备中,pt(ii)配合物以及pt(iv)配合物前体合成路线如下:
1、以20g(1.2mol)三氯胺铂酸钾为原料,溶于200ml纯化水中,然后加入19.7g(1.8mol)碘化钾和6.6g(1.2mol)环己胺,水浴65℃,反应5小时,抽滤,滤饼用纯化水润洗2~3次,50ml甲醇润洗1次,70℃干燥,得25.81gi/cl中间体。产率:97.65%。
2、将步骤1中制备得到的25.81g(1.2mol)i/cl中间体加入400ml纯化水溶于烧杯中,水浴65℃,均匀搅拌。称取17.6gagno3(2mol)溶于纯化水,缓慢滴加于烧杯中,继续反应2.5h。反应结束后,抽滤除去agi、agcl沉淀,收集滤液;
3、将步骤2中收集的滤液,加热至65℃,称取8g(2mol)kcl加入溶液中,65℃搅拌反应3h,制得以氨基和环己胺为不对称的载体基团的pt(ii)配合物,产物使用50ml纯化水润洗2~3次,甲醇润洗1~2次,80℃干燥,得pt(ii)配合物13.424g。产率:64.47%。
其中z为cl。
anal.calcdforc6h16cl2n2pt(%):c,18.85;n,7.32;h,4.18.
found(%):c,19.91;n,7.36;h,4.52.
ir(ν,cm-1):v(nh)br3240,3194cm-1,vs(ch),vas(ch):2922,2859cm-1,δ(nh):
1453cm-1,v(c-c):1299cm-1,v(pt-cl):783cm-1,v(pt-n):534cm-1.
1hnmr(600mhz,dmso):δ4.66-4.91(m,3h),4.0(m,1h),2.14-2.30(m,2h),
1.49-1.76(m,4h),0.94-1.28(m,4h).
hr-ms(m/z):[c6h16cl2n2pt+h]+=382.0411(100%),381.0390(97.4%),383.0413
(74.6%),384.0382(63.9%),385.0383(47.7%)。
4、将步骤2中收集滤液,加热至65℃,称取草酸钾4.279g(1mol)加入溶液中,65℃搅拌3h,制得以氨基和环己胺为非对称的载体基团的pt(ii)配合物,产物使用50ml纯化水润洗2~3次,甲醇润洗1~2次,80℃干燥,得pt(ii)配合物15.85g。产率:72.73%。
其中z为
anal.calcdforc8h16n2o4pt(%):c,24.04;n,7.01;h,4.01.
found(%):c,24.12;n,6.85;h,4.32.
ir(ν,cm-1):v(nh)br3267,3116cm-1,vs(ch),vas(ch):2936,2854cm-1,δ(nh):
1448cm-1,v(c-o):1696,1586cm-1,v(c-c):1248cm-1,v(pt-o):807cm-1,v(pt-n):633cm-1.
1hnmr(600mhz,dmso):δ5.12(s,2h),4.27(s,3h),2.14-2.22(m,2h),1.63-1.71(m,2h),1.48-1.56(m,1h),0.97-1.26(m,6h).
hr-ms(m/z):[c8h16n2o4pt+h]+=400.0831(100%),399.0809(97.4%),401.0832(74.6%).
5、将步骤3制备的pt(ii)配合物4g(1.2mol)溶于100ml纯化水中,50℃水浴,均匀搅拌,量取h2o210ml缓慢滴加至该反应体系中,均匀搅拌反应4h,抽滤,收集滤液,蒸发浓缩除去水溶液,所得产物水洗2~3次,甲醇润洗1~2次,50℃干燥,制得轴向含有两个羟基的pt(iv)配合物前体1.99g。产率:45.83%。1hnmr(600mhz,dmso):δ5.97-6.32(m,3h),4.2(s,2h),2.57(m,1h),1.74(m,4h),1.46(m,4h),1.21(m,4h)。hr-ms(m/z):[c6h18cl2n2o2pt+h]+=416.2134。
6、将步骤4制备的pt(ii)配合物4g(1.2mol)溶于100ml的纯化水中,50℃水浴均匀搅拌,量取h2o27ml缓慢滴加至该反应体系中,均匀搅拌反应4h,抽滤,收集滤液,蒸发浓缩除去水溶液,所得产物水洗2~3次,甲醇润洗1~2次,50℃干燥,制得轴向含有两个羟基的pt(iv)配合物前体3.27g。产率:75.28%。
1hnmr(600mhz,dmso):δ5.94-6.21(m,3h),4.2(s,2h),2.57(m,1h),1.74(m,4h),1.46(m,4h),1.21(m,4h)。hr-ms(m/z):[c8h18n2o6pt+h]+=434.3241。
7、将步骤3制备的pt(ii)配合物2.5g(1.2mol)溶于100ml的纯化水中,称取n-氯代丁二酰亚胺0.87g(1.2mol)溶于纯化水中,缓慢滴加至该反应体系中,室温避光均匀搅拌过夜。反应完毕,抽滤,收集滤液,减压蒸发浓缩,分别用乙醇、乙醚润洗产物2~3次,制得轴向含有羟基和氯的pt(iv)配合物前体1.59g。产率:56.01%。1hnmr(600mhz,dmso):δ4.2(s,1h),2.57(m,1h),1.74(m,4h),1.46(m,7h),1.21(m,4h)。hr-ms(m/z):[c6h17cl3n2opt+h]+=434.0127(100%),433.0106(97.4%),436.0097(95.5%),435.0076(94.3%)。
8、将步骤4制备的pt(ii)配合物2.5g(1.2mol)溶于适量的纯化水中,称取n-氯代丁二酰亚胺0.84g(1.2mol)溶于纯化水中,缓慢滴加至该反应体系中,室温避光均匀搅拌过夜。反应完毕,抽滤,收集滤液,减压蒸发浓缩,分别用乙醇、乙醚润洗产物2~3次,制得轴向含有羟基和氯的pt(iv)配合物前体2.08g。产率:73.62%。1hnmr(600mhz,dmso):δ4.2(s,1h),2.57(m,1h),1.74(m,4h),1.46(m,7h),1.21(m,4h)。hr-ms(m/z):[c8h17cln2o5pt+h]+=452.0546(100%),451.0525(97.4%),453.0548(74.6%),454.0517(32.00%),455.0519(23.8%)。
9、称取生物素2g(2.046mol),溶于适量的dmf溶剂中,分别加入n-羟基琥珀酰亚胺1.1g(2.25mol)和碳化二亚胺盐酸2.4g(3.05mol),在室温条件下,均匀搅拌过夜。反应结束后,将反应混合液缓慢滴入冰水中,则有大量的白色固体析出,抽滤,甲醇润洗2次,真空干燥,制得生物素琥珀酰亚胺酯3.53g。产率:62%。1hnmr(600mhz,dmso):δ4.1and4.3(m,2h),3.1(m,1h),2.8(dd,5h),2.6(t,2h),2.59(d,1h)1.3-1.7(m,6h)。hr-ms(m/z):[c14h19n3o5s+h]+=342.3812。
实施例1:制备如i式所示的配合物(a-1),即:
称取步骤5中制备含有两个羟基的pt(iv)配合物前体1g(1.6mol)溶于适量的dmso中,置于100ml圆底烧瓶中。称取步骤9中制备的生物素琥珀酰亚胺酯0.95g(1.6mol)加入上述反应液中,水浴60℃,均匀搅拌过夜。反应结束后,抽滤除去反应液中少量未溶的固体,收集滤液。将滤液使用体积比为1:1的乙醚与甲醇重结晶析出产物,抽滤,母液润洗2~3次,真空干燥,制得轴上含有一羟基和单取代生物素靶向配体的pt(iv)配合物0.4g,其氢谱图如图1所示,其质谱图如图2所示。产率:26.7%。1hnmr(600mhz,dmso):δ6.59-6.72(s,1h),6.33-6.48(s,1h),5.97-6.32(m,3h),4.27-4.35(m,1h),4.08-4.19(s,1h),3.05-3.14(m,1h),2.77-2.83(m,1h),2.61-2.71(s,1h),2.55-2.60(m,2h),1.93-2.27(m,4h),0.93-1.74(m,14h)。ir(kbr,cm-1):3378.32s,3220.25s(br),2930.33s,2855.37s,2358.99s,1685.93vs,1622.55vs,1453.34s,1331.26s,957.04s,891.64s,675.15s。hr-ms(m/z):[c16h32cl2n4o4pts+h]+=642.1242(100%),641.1221(97.4%),643.1243(74.6%),644.1212(63.9%),645.1214(47.7%)。
实施例2:制备如i式所示的配合物(a-2),即:
称取步骤7中制备含有一氯和一羟基的pt(iv)配合物前体1g(1.12mol)溶于适量的dmf溶剂中,随后加入缩合剂tbtu1.1g(1.12mol)和三乙胺0.24g(1mol),加入反应体系中,水浴40℃,均匀搅拌。称取生物素0.526g(0.499mol)加入反应液中,继续反应过夜。反应结束后,抽滤,除去反应液中少量未溶的固体,收集滤液。将反应液分别加入适量的ch2cl2和纯化水进行萃取3次除去反应液中的缩合剂,收集有机相液体,蒸发浓缩除去有机溶剂,产物使用体积比为1:1的乙醚与甲醇重结晶析出产物,母液润洗2~3次,真空干燥,制得轴上含有氯和单取代生物素靶向配体的pt(iv)配合物0.36g,其氢谱图如图3所示,其质谱图如图4所示。产率:23.02%。1hnmr(600mhz,dmso):δ6.32-6.46(m,2h),4.27-4.34(s,1h),4.10-4.16(s,1h),3.06-3.14(s,1h),2.87-2.92(s,1h),2.80-2.85(m,1h),2.67-2.76(m,2h),2.55-2.62(m,1h),2.13-2.34(m,4h),1.07-1.71(m,17h)。ir(kbr,cm-1):3212.13s,3065.16s(br),2934.25s,2849.12s,2355.20s,1682.99vs,1451.69s,1351.30s,1157.75s,748.96s。hr-ms(m/z):[c16h31cl3n4o3pts+h]+=661.1250。
实施例3:制备如i式所示的配合物(a-3),即:
称取步骤6中制备含有两个羟基的pt(iv)配合物前体1g(1.6mol)溶于适量的dmso中,置于100ml圆底烧瓶中。称取步骤(9)中制备的生物素琥珀酰亚胺酯0.95g(1.6mol)加入上述反应液中,水浴60℃,均匀搅拌过夜。反应结束后,抽滤除去反应液中少量未溶的固体,收集滤液。将滤液使用体积比为1:1的乙醚与甲醇重结晶析出产物,抽滤,母液润洗2~3次,真空干燥,制得轴上含有一羟基和单取代生物素靶向配体的pt(iv)配合物0.48g,其氢谱图如图5所示,其质谱图如图6所示。产率:32.00%。1hnmr(600mhz,dmso):δ6.99-7.18(s,1h),6.29-6.42(s,2h),5.94-6.21(m,3h),4.25-4.31(m,1h),4.07-4.14(m,1h),3.02-3.11(m,1h),2.77-2.82(m,1h),2.64-2.73(s,1h),2.54-2.59(m,1h),1.97-2.19(m,4h),1.04-1.73(m,16h)。ir(kbr,cm-1):3389.39s,3224.89s(br),2932.07s,2856.32s,2358.01s,1711.10vs,1682.48vs,1454.31s,1367.56s,953.09s,807.45s,762.05s。hr-ms(m/z):[c18h32n4o8pts+h]+=660.1655(100%),659.1635(97.4%),661.1658(21.2%),662.1697(14.5%).
实施例4:制备如i式所示的配合物(a-4),即:
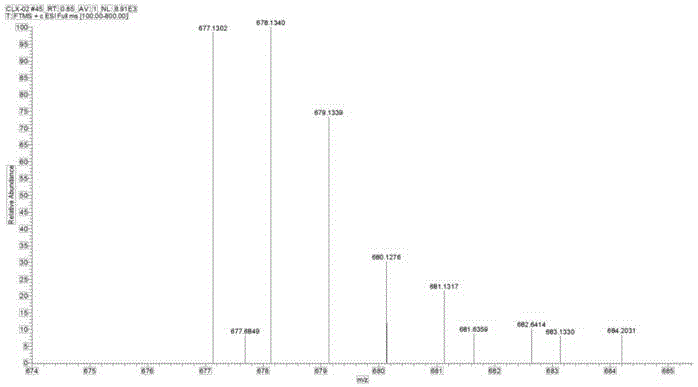
称取步骤8中制备含有一氯和一羟基的pt(iv)配合物前体1g(1.12mol)溶于适量的dmf溶剂中,随后加入缩合剂tbtu1.06g(1.12mol)和三乙胺0.24g(1mol),加入反应体系中,水浴40℃,均匀搅拌。称取生物素0.53g(0.499mol)加入反应液中,继续反应过夜。反应结束后,抽滤,除去反应液中少量未溶的固体,收集滤液。将反应液分别加入适量的ch2cl2和纯化水进行萃取3次除去反应液中的缩合剂,收集有机相液体,蒸发浓缩除去有机溶剂,产物使用体积比为1:1的乙醚与甲醇重结晶析出产物,母液润洗2~3次,真空干燥,制得轴上含有氯和单取代生物素靶向配体的pt(iv)配合物0.36g,其氢谱图如图7所示,其质谱图如图8所示。产率:24.00%。1hnmr(600mhz,dmso):δ6.27-6.45(s,2h),4.24-4.31(t,1h),4.01-4.13(m,1h),3.01-3.10(s,1h),2.76-2.83(m,2h),2.66-2.75(m,1h),2.53-2.59(m,1h),2.09-2.37(m,4h),1.94-2.03(s,1h),1.01-1.78(m,17h)。ir(kbr,cm-1):3425.15s,3250.10s(br),2933.32,2859.32s,2359.12s,2341.50s,1693.37vs,1557.17s,869.30s,743.25s。hr-ms(m/z):[c18h31cln4o7pts+h]+=678.1340(100%),677.1302(97.4%),679.1339(74.6%),680.1276(32.00%).
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明保护范围。
以mtt法测试了本发明所得的具有靶向作用的新型pt(iv)配合物对人体肺癌细胞a549、人体乳腺癌细胞mcf-7、人体肝癌细胞hepg-2以及人体结肠癌细胞sw480的体外抗肿瘤活性,分别选择顺铂、赛特铂作为阳性对照。肿瘤细胞株培养及实验方法如下所述:
smcc-7721和a549细胞培养在10%胎牛血清的rpmi1640生长培养基中,mcf-7和hepg-2培养在含有10%胎牛血清的dmem/f-12中,培养条件:饱和湿度、37℃、5%co2的培养环境。使用mtt[3-(4,5-二甲基噻唑基)-2,5-二苯基四唑溴化物]测定法评估a-1,a-2,a-3,a-4和顺铂的细胞毒性。细胞培养条件取对数生长期的细胞计数,调整细胞密度,每孔4000~8000个细胞。在孔板中,设加药、对照即只加药物和调零即只加无细胞培养液三个组别。培养24小时贴壁,配合物提前溶解在dmso中,对照顺铂溶解在pbs中,当测试时用完全培养基稀释成所需浓度,注意dmso终浓度不能超过0.1%。每个浓度设6个复孔。加药后培养48小时,加20μl浓度为5mg/ml的mtt孵育4小时,吸去液体,加入150μl的dmso,使甲瓒完全溶解。30min内,用酶标仪490波长测定od值,并计算抑制率。试验平行进行3次,根据抑制率计算半数抑制率ic50值,结果列于表1中。
表1本发明一种具有肿瘤靶向的新型pt(iv)配合物在各癌细胞中的ic50值(μm)
- 还没有人留言评论。精彩留言会获得点赞!