RFP标记小细胞肺癌细胞系及其建立和应用的制作方法
本发明属于细胞系领域,具体涉及小细胞肺癌细胞系及其建立和应用。
背景技术:
肺癌是发病率最高的恶性肿瘤,是癌症防治的重点。肺癌按组织病理学可以分为小细胞肺癌(small-celllungcancer,sclc)和非小细胞肺癌(non-smallcelllungcancer,nsclc)。小细胞肺癌的癌细胞多为类圆形或菱形,胞浆少,类似淋巴细胞,可能是起源于神经外胚层的kulchitsky细胞或者嗜银细胞。胞浆中含有神经内分泌颗粒,具有内分泌和化学受体功能,能分泌多种肽类物质,可引起类癌综合症。流行病学统计显示:小细胞肺癌约占所有肺癌总数的15%左右;未经治疗的小细胞肺癌患者的中位生存期仅为2到3个月。小细胞肺癌的发病与烟草吸食密切相关。因此,在东欧和亚洲等烟草消费量大的地区,小细胞肺癌的发病率长期保持在较高水平。
在临床上,小细胞肺癌虽然对化疗较敏感,但相比较其他类型肺癌而言,小细胞肺癌在临床上表现为肿瘤侵染性强,具有快速生长、早期转移的特点,其发生转移的时间早,转移率高,病程进展快,预后差,长期生存率很低。小细胞肺癌几乎可以向全身各个脏器进行转移,尤其以中枢神经系统、骨骼、肝脏等最为好发。90%以上的小细胞肺癌患者在就诊时就已经发生胸腔内转移(纵隔淋巴结或肺内转移),2/3以上的患者甚至出现脑、骨、肝等远处转移。因此,肿瘤转移成为小细胞肺癌治疗所面临的棘手问题。
肿瘤转移是恶性肿瘤的基本生物学特征之一,高达95%以上的小细胞肺癌患者最终将因肿瘤转移或疾病复发而死亡。因此,探索小细胞肺癌侵袭转移与复发的机制,寻求有效抑制小细胞肺癌转移与复发的药物具有重要意义。目前,人们对肿瘤转移过程,特别是早期过程的认识和了解仍十分欠缺,只从肿瘤患者临床观察中积累资料或寻找线索是相当有限的。要想了解肿瘤转移早期阶段所发生的各种改变及其分子机理,从而有效地进行干预非常困难。而任何新的肿瘤防治方法和措施(包括新的抗癌药物、手术方法、射线剂量及投照部位和方法等)未经动物实验便在肿瘤患者身上试用是不道德的甚至是违法的。因此,肿瘤细胞模型和动物模型在肿瘤转移机理的基础研究及抗癌新方法的疗效观察和评估中是绝对不可缺少的。就小细胞肺癌而言,建立高转移小细胞肺癌细胞模型和动物模型是研究小细胞肺癌的复发与转移规律、评价抗小细胞肺癌药物疗效的基础。
目前,对于小细胞肺癌细胞的转移研究主要集中在骨转移、脑转移等远处转移,研究小细胞肺癌的特异性胸腔转移对于小细胞肺癌的早期诊断可能具有特别重要的潜在意义,而且对于小细胞肺癌的特异性转移机制的研究也有重要的意义。
技术实现要素:
有鉴于此,本发明提供了一种红色荧光蛋白(redfluorescentprotein,rfp)标记小细胞肺癌ltep-p细胞系及其建立和应用。该rfp标记小细胞肺癌ltep-p细胞系肿瘤特性稳定,具有特异性胸腔内高转移性的特点,能够稳定持续表达红色荧光蛋白使得其易于被观察,便于在肺癌转移的各阶段进行实时显示、跟踪、计算和测量等研究工作。
为此,本发明采取了以下技术方案:
一种rfp标记小细胞肺癌ltep-p细胞系,是以小细胞肺癌ltep-p细胞株为母细胞,转染包装有rfp的plein逆转录病毒,再经g418抗性筛选,获得稳定持续表达红色荧光蛋白(rfp)的小细胞肺癌ltep-p细胞系。
所述rfp标记小细胞肺癌ltep-p细胞系,又记为ltep-p-rfp肿瘤细胞,呈近于圆形,透亮,具有强的体外成瘤能力和特异胸腔内高转移性。
上述rfp标记小细胞肺癌ltep-p细胞系通过以下方法建立:
将包装细胞pt67与含rfp基因的plein质粒共培养以转染包装细胞pt67,再经g418抗性筛选,获得产病毒rfp阳性细胞克隆(即,细胞克隆中含有表达rfp的plein逆转录病毒载体);
用所述产病毒rfp阳性细胞克隆转染小细胞肺癌ltep-p细胞株,再经g418抗性筛选,获得所述rfp标记小细胞肺癌ltep-p细胞系。
进一步,上述rfp标记小细胞肺癌ltep-p细胞系通过以下方法建立:
(1)将包装细胞pt67培养至70%-80%汇合度时,与转染试剂和含rfp基因的plein质粒充分浸润,在室温(25℃)共同混合孵育18小时后,置37℃、5%co2孵箱中培养48小时,再转入含200~1000μg/mlg418的rpmi1640培养液中置于37℃、5%co2孵箱中培养7天,然后,转入含10%胎牛血清的rpmi-1640培养液中并置于37℃、5%co2孵箱中培养18小时,得到含病毒载体的pt67细胞上清液(简称为病毒上清,其中病毒载体为高表达rfp的plein逆转录病毒载体);
(2)分离步骤(1)所得的pt67细胞上清液,并收集其中的病毒载体进行滴度测定,确定含有最佳病毒感染浓度的病毒载体的细胞上清液(也可称为具有最佳病毒感染浓度的pt67细胞上清液)待用;
(3)小细胞肺癌ltep-p细胞生长至对数期时,用步骤(2)所确定的具有最佳病毒感染浓度的细胞上清液与rpmi1640培养液按照1:1的体积比混合,共培养72小时;72小时后胰酶消化,1:1传代培养于含200μg/mlg418的rpmi1640培养液中,培养过程中g418浓度逐步提高到800μg/ml;用克隆环分离表达rfp的克隆细胞,在含10%胎牛血清的rpmi1640培养液中置于37℃、5%co2、饱和湿度中培养扩增,收集ltep-p-rfp肿瘤细胞。
在本发明的一具体实例中,步骤(1)中,所述的转染试剂为n-[1-(2,3-二油酰基)]-n,n,n-三甲胺丙烷甲基硫酸盐。
在本发明的一具体实例中,步骤(1)中,所述的转染试剂为n,n,n-三甲基-3-(2-甲基烯丙酰氨基)-1-氯化丙铵硫酸盐。
在本发明中,所述plein质粒含增强rfp基因和抗新霉素(neo)基因双顺反子,二者通过内部核糖体进入位点连接。
另外,本发明还提供了如上所述的rfp标记小细胞肺癌ltep-p细胞系的应用,包括但不限于:
所述的rfp标记小细胞肺癌ltep-p细胞系用于在裸鼠中产生小细胞肺癌瘤块。所述的裸鼠优选balb/c-nude裸鼠。
所述的rfp标记小细胞肺癌ltep-p细胞系在建立小细胞肺癌裸鼠模型中的应用。
所述的rfp标记小细胞肺癌ltep-p细胞系在作为小细胞肺癌发生、小细胞肺癌发展或小细胞肺癌转移的细胞模型中的应用。
所述的rfp标记小细胞肺癌ltep-p细胞系在研究小细胞肺癌发生机理、耐药机理或筛选治疗小细胞肺癌药物中的应用。
其中,所述的rfp标记小细胞肺癌ltep-p细胞系在建立小细胞肺癌裸鼠模型中的应用,可以采用如下所示的方法:
①收集生长良好的ltep-p-rfp肿瘤细胞接种到裸鼠皮下,3周后肿瘤生长至0.8cm×1.0cm×1.2cm时取出肿瘤组织;
②将步骤①的肿瘤组织的碎块肺原位接种在裸鼠肺内,1周后裸鼠肺内见肿瘤生长并取出肿瘤组织;
③将步骤②的肿瘤组织的碎块肺原位接种在裸鼠肺内,隔天用小动物活体荧光成像仪在激发488nm发射507nm波段下对裸鼠的肺部进行非侵袭性的实时成像观察,在裸鼠体内观察到胸腔内转移时取出转移灶;
④将步骤③的转移灶的碎块肺原位接种在裸鼠肺内,隔天用小动物活体荧光成像仪在激发488nm发射507nm波段下对裸鼠的肺部进行非侵袭性的实时成像观察,在裸鼠体内观察到胸腔内转移,在裸鼠体内即建立具有特异胸腔内高转移特性的小细胞肺癌模型。
将步骤④的转移灶取出,可从中获得高转移的小细胞肺癌细胞,行原代培养后冻存备用。
本发明建立了表达rfp的小细胞肺癌ltep-p细胞系,通过光学形态观察发现所述rfp标记小细胞肺癌ltep-p细胞系呈近于圆形,透亮无杂点,成团生长,进一步的研究还表明所述rfp标记小细胞肺癌ltep-p细胞系具有强的体外成瘤能力、特异性胸腔转移特性和高转移性。所述rfp标记小细胞肺癌ltep-p细胞系既可以用于体外细胞研究,也可以接种动物体内用于整体动物实验,应用所述的rfp标记小细胞肺癌ltep-p细胞系经裸鼠肺原位接种后可建立原位接种胸腔内高转移裸鼠模型,在医学生物学领域具有很强的实用价值。
综合可见,通过将rfp标记小细胞肺癌ltep-p细胞系应用在裸鼠肺内原位接种建立裸鼠模型中的实验观测,本发明rfp标记小细胞肺癌ltep-p细胞系表现出具有以下特征:1)rfp标记十分稳定,在肿瘤细胞生长、增殖及分裂过程中不会丢失和减弱。2)rfp标记无毒、无害,并不因新的特征明显改变原来细胞的生物学特性。3)方便观察,rfp标记后小细胞肺癌ltep-p细胞系与裸鼠体内各种正常细胞容易区分,不需固定、染色等,操作简便。4)适合活细胞状态及体内动态观察,便于对小细胞肺癌ltep-p细胞系在裸鼠体内的生长、浸润、转移等的瞬时状况和进展过程进行实时显示和跟踪,同时通过现有的方法对各种重要器官中肿瘤细胞的数量作出准确的测量和计算,从而能够建立一种新的简便、准确、客观判断肿瘤转移的方法,以便动态观察移植瘤生长,以及在移植瘤生长过程中新生血管形成过程。
因此,本发明rfp标记小细胞肺癌ltep-p细胞系可为研究者深入研究小细胞肺癌的发病机理、转移机理、发病和转移的特征生物标志物筛选、耐药机理、新药筛选等提供新的实验模型,是小细胞肺癌基础研究和临床前期应用的理想细胞系。同时,本发明rfp标记小细胞肺癌ltep-p细胞系也为小细胞肺癌研究提供新的更接近于临床肿瘤生物学特性的实验材料,也提示该细胞系可以作为相关机制的研究模型。本发明rfp标记小细胞肺癌ltep-p细胞系还可为化疗耐药机制相关研究提供了有效的模型。
相比于现有技术,本发明的有益效果如下:
(1)本发明的rfp标记的小细胞肺癌ltep-p细胞系的肿瘤特性稳定,能够在裸鼠体内建立具有特异胸腔内高转移特性的小细胞肺癌模型,为研究侵袭性癌症小细胞肺癌的转移机制研究提供了模型,也为相应的动物模型,尤其是局部转移的肺原位接种胸腔内高转移裸鼠模型(原位移植可以模仿原始原发性肿瘤微环境)的建立提供了实验材料。
(2)本发明的rfp标记小细胞肺癌ltep-p细胞系能够稳定持续表达红色荧光蛋白,非常方便观察,便于后续研究的进一步进行。
附图说明
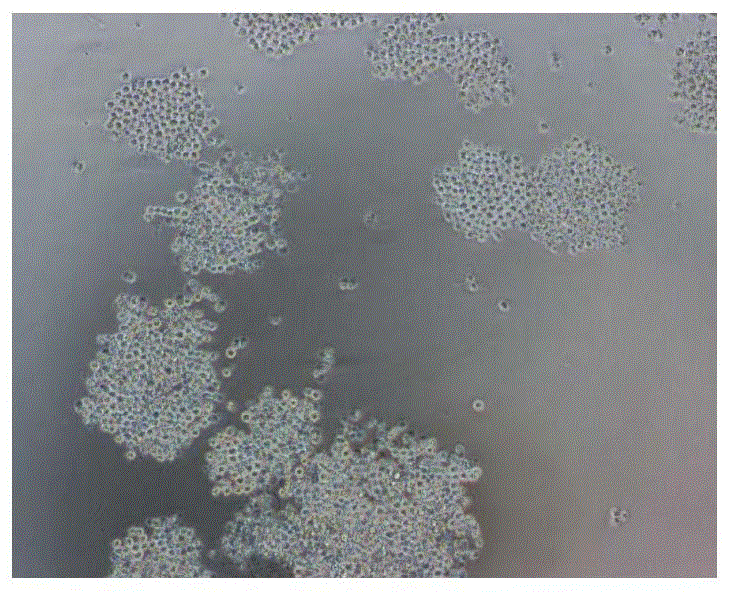
图1a、图1c、图1e分别为实施例1得到的rfp标记小细胞肺癌ltep-p细胞系的不同取样点在普通显微镜下的光学形态图片,放大倍数为200倍。
图1b、图1d、图1f分别为实施例1得到的rfp标记小细胞肺癌ltep-p细胞系的不同取样点在荧光显微镜(525nm绿色激发光)下的光学形态图片,放大倍数为200倍。
图2是用fluorvivo(model-100,indecbiosystems,roper,ca,usa)小动物活体荧光成像仪在激发488nm发射507nm波段下对转移灶接种第10天的裸鼠的肺部进行非侵袭性的活体成像得到的图像。
具体实施方式
下面结合具体实施例和附图,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
下列实施例中未注明具体条件的实验方法,可采用本领域中的常规方法,例如参考《分子克隆实验指南》(第三版,纽约,冷泉港实验室出版社,newyork:coldspringharborlaboratorypress,1989)或按照供应商所建议的条件等。
下列实施例中未特别说明的各种仪器、原料和试剂均为本领域熟知的市售产品,可通过商业途径获得。在下列实施例中列出的所使用的具体材料及其来源,仅仅是示例性的,并不意图限制本发明,与如下组织、细胞、试剂和仪器的类型、型号、品质、性质或功能相同或相似的材料均可以用于实施本发明。
材料及来源说明:
人小细胞肺癌细胞株ltep-p,购于中国医学科学院肿瘤医院。
包装细胞pt67是由nih3t3衍生的包装细胞系,表达10al病毒包膜。包装细胞pt67购于美国atcc。
rpmi-1640培养液购自美国hyclone公司,10%胎牛血清购自杭州四季青生物有限公司。
dotap脂质体转染试剂(美国roche公司),又称dotap硫酸甲酯,中文化学名为n-[1-(2,3-二油酰基)]-n,n,n-三甲胺丙烷甲基硫酸盐,又称为n-(2,3-二油酰氧基-1-丙基)三甲胺硫酸甲酯,即,英文化学名为n-[1-(2,3-dioleoyloxy)propyl]-n,n,n-trimethylammoniummethylsulfatereagent。
n,n,n-三甲基-3-(2-甲基烯丙酰氨基)-1-氯化丙铵硫酸盐,可由n,n,n-三甲基-3-(2-甲基烯丙酰氨基)-1-氯化丙铵和硫酸按照化学计量比(摩尔比为2:1)进行常规的酸碱反应得到。n,n,n-三甲基-3-(2-甲基烯丙酰氨基)-1-氯化丙铵为市售产品。
plein质粒含增强rfp基因和抗新霉素(neo)基因双顺反子,二者通过内部核糖体进入位点连接。plein质粒购于美国anticancer公司。
裸鼠为balb/c-nude裸鼠,购自上海斯莱克实验动物有限公司,实验动物质量合格证编号为scxk(沪)2012-0002。
实施例1:rfp标记小细胞肺癌ltep-p细胞系的建立
(1)预先在转染前24小时,胰酶消化细胞并计数,将包装细胞pt67按照2×105/孔接种于六孔板,置于37℃、5%co2孵箱中,在含10%胎牛血清的rpmi-1640培养液中培养至70%汇合度(汇合度是指细胞转染当时细胞生长覆盖的面积大约占孔板底部的面积百分数);
(2)将步骤(1)的pt67细胞与转染试剂和含rfp基因的plein质粒充分浸润,在室温(25℃)共同混合孵育18小时后,置37℃、5%co2孵箱中培养48小时,再转入含200~1000μg/mlg418的rpmi1640培养液中置于37℃、5%co2孵箱中培养7天,然后,转入含10%胎牛血清的rpmi-1640培养液中并置于37℃、5%co2孵箱中培养18小时,得到含病毒载体的细胞上清液(简称为病毒上清,其中病毒载体为高表达rfp的plein逆转录病毒载体);
(3)收集步骤(2)得到的病毒上清,在包装细胞pt67中测定并标定病毒滴度,确定含有最佳病毒感染浓度的病毒载体的pt67细胞的上清液(70%-90%细胞转染);其中,标定病毒滴度的方法按常规进行,具体如下:按1×105/孔的细胞量在6孔板中各接种pt67细胞培养24h。用含10%胎牛血清的培养基rpmi-1640将步骤(2)得到的病毒上清分别稀释成1×10-3、1×10-4、1×10-5、1×10-6,与5μl鱼精蛋白(0.1g/l)混合后,加入到pt67细胞培养孔常规培养24h,换液后继续培养24h,加g418至终浓度400mg/l选择培养,每周给细胞更换含有g418的新鲜培养液2~3次。14天后,在光镜下计数存活的细胞克隆,并乘以稀释倍数,即为病毒滴度。
(4)将小细胞肺癌ltep-p细胞以1×105/孔的细胞量分别加入6孔板中,置于37℃、5%co2、饱和湿度的孵箱中,在含10%胎牛血清的rpmi-1640培养液培养,当小细胞肺癌ltep-p细胞生长至对数期时,吸去培养液,用无血清rpmi-1640培养液洗1次,在体积比为1:1的pt67细胞的上清液(是指含有最佳病毒感染浓度的病毒载体的pt67细胞的上清液)与rpmi-1640培养液的混合液中共培养72小时;72小时后胰酶消化,1:1传代培养于含200μg/mlg418的rpmi1640培养液中,培养过程中g418浓度逐步提高到800μg/ml(每传代3次分别提高一次,200μg/ml、400μg/ml、600μg/ml、800μg/ml);用克隆环分离表达rfp的克隆细胞,常规培养(含10%胎牛血清的rpmi-1640培养液、37℃、5%co2、饱和湿度中培养)扩增,收集生长良好(光镜下观察,细胞呈近于圆形,透亮无杂点,成片生长)的ltep-p-rfp肿瘤细胞。
其中,上述步骤(2)中,转染试剂可以采取dotap硫酸甲酯,也可以采取n,n,n-三甲基-3-(2-甲基烯丙酰氨基)-1-氯化丙铵硫酸盐,均可以实现稳定转染,产生高表达rfp的plein逆转录病毒载体,获得富含病毒载体的细胞上清液。
转染试剂为dotap硫酸甲酯时,步骤(2)的具体过程如下:
将2μg的plein质粒和20μg的dotap硫酸甲酯分别稀释在250μl的不含胎牛血清的rpmi-1640培养液(即无血清rpmi-1640培养液)中,然后将dotap硫酸甲酯稀释液滴加到plein质粒稀释液中,边加边用旋涡振荡器振荡,室温(25℃)静置半小时,得到混合液;弃去pt67细胞六孔板中的原培养液,换2ml新鲜的含10%胎牛血清的rpmi-1640培养液,按照每孔2μg的plein质粒,将上述混合液加入pt67细胞六孔板中,室温(25℃)共同混合孵育18小时后,更换2ml新鲜的含10%胎牛血清的rpmi-1640培养液,再将pt67细胞六孔板置于37℃、5%co2孵箱中培养48小时(在荧光显微镜下观察到细胞内特异的红色荧光,确认质粒已转染成功);然后,将pt67细胞六孔板转入含200~1000μg/mlg418的rpmi-1640培养液中并置于37℃、5%co2孵箱中培养7天,7天内g418的浓度逐渐增加,浓度梯度为100μg/ml或200μg/ml),此时,存活的细胞即为筛选出的能产生病毒载体的细胞;最后,将pt67细胞六孔板转入含10%胎牛血清的rpmi-1640培养液中并置于37℃、5%co2孵箱中培养18小时,观察细胞生长情况,得到富含病毒载体的细胞上清液(简称为病毒上清)。
转染试剂为n,n,n-三甲基-3-(2-甲基烯丙酰氨基)-1-氯化丙铵硫酸盐时,步骤(2)的具体过程如下:
将8μg的n,n,n-三甲基-3-(2-甲基烯丙酰氨基)-1-氯化丙铵硫酸盐和80μg的plein质粒混合,加入到100μl的不含胎牛血清的rpmi-1640培养液(即无血清rpmi-1640培养液),静置半小时,得到复合物,将上述复合物按1:10(体积比)加入到含10%胎牛血清的rpmi-1640培养液(即,培养液与复合物的体积比为10:1)得到混合液;弃去pt67细胞六孔板中的原培养液,换2ml新鲜培养液,按照每孔10μgplein质粒,将上述混合液加入pt67细胞六孔板中,室温(25℃)共同混合孵育18小时,更换2ml新鲜的含10%胎牛血清的rpmi-1640培养液;再将pt67细胞六孔板置于37℃、5%co2孵箱中培养48小时(在荧光显微镜下观察到细胞内特异的红色荧光,确认质粒已转染成功);然后,将pt67细胞六孔板转入含200~1000μg/mlg418的rpmi-1640培养基中并置于37℃、5%co2孵箱中培养7天(7天内g418的浓度逐渐增加,浓度梯度为100μg/ml或200μg/ml),此时,存活的细胞即为筛选出的能产生病毒载体的细胞);最后,将pt67细胞六孔板转入含10%胎牛血清的rpmi1640培养液中并置于37℃、5%co2孵箱中培养18小时,观察细胞生长情况,得到富含病毒载体的细胞上清液(简称为病毒上清)。
实施例2:rfp标记小细胞肺癌ltep-p细胞系的生物学特性及应用
a.rfp标记小细胞肺癌ltep-p细胞系的形态学观察
实施例1得到的rfp标记小细胞肺癌ltep-p细胞(即ltep-p-rfp肿瘤细胞),置于普通显微镜下观察,可见细胞呈近于圆形,透亮无杂点,成团生长,有部分细胞团附着在培养皿底部,细胞团上半部分悬于培养液中。图1a、图1c、图1e展示了rfp标记小细胞肺癌ltep-p细胞系的不同取样点在普通显微镜下的光学形态图片,放大倍数为200倍。
实施例1得到的rfp标记小细胞肺癌ltep-p细胞(即ltep-p-rfp肿瘤细胞),置于荧光显微镜(525nm绿色激发光)下观察,可见细胞在黑暗背景中显示强烈红色荧光,且荧光较均匀的分布于整个细胞,能较好地显示细胞的形态轮廓,红色荧光的位置和数量与普通显微镜下观察到的细胞相对应。图1b、图1d、图1f展示了rfp标记小细胞肺癌ltep-p细胞系的不同取样点在荧光显微镜下的光学形态图片,放大倍数为200倍。
b.细胞的成瘤性
收集生长良好的ltep-p-rfp肿瘤细胞接种到裸鼠皮下,观察记录是否成瘤,1周后肉眼可见肿瘤,3周后肿瘤生长至0.8cm×1.0cm×1.2cm,该细胞表现出非常强的体外成瘤能力。
c.细胞的转移特性(小细胞肺癌胸腔内高转移裸鼠模型的建立)
①收集生长良好的ltep-p-rfp肿瘤细胞接种到裸鼠皮下,1周后肉眼可见肿瘤,3周后肿瘤生长至0.8cm×1.0cm×1.2cm时处死荷瘤裸鼠,无菌条件下剥离瘤体,放入rpmi1640培养液中,剔除结缔组织,将肿瘤组织分割成1mm×1mm×1mm肿瘤组织碎块;
②另取6只裸鼠用1%(质量百分比浓度)戊巴比妥钠按照40mg/kg裸鼠行胸腔注射麻醉,右肋下做长约1cm的横切口,逐层进入胸腔,暴露肺右叶,将步骤①的肿瘤组织碎块植入肺叶中,用8-0外科无创缝线缝合固定,检查无活动性出血后用5-0外科缝线逐层关闭胸腔;整个操作过程在超净工作台中完成,术后不用抗生素;1周后肺原位接种的6只裸鼠肺内均见肿瘤生长并取出肿瘤组织;
③将取自步骤②的裸鼠肺内的ltep-p-rfp肿瘤组织,切成1mm3大小的肿瘤组织块,运用上述的肺原位接种技术将肿瘤块种植到15只6周龄的雌性裸鼠肺部,在实验过程中,每天观察动物的状况,隔天用fluorvivo(model-100,indecbiosystems,roper,ca,usa)小动物活体荧光成像仪在激发488nm发射507nm波段下对所有裸鼠的肺部进行非侵袭性的实时成像观察,实验期间有动物死亡,记录动物的死亡日期。最后所有荷瘤裸鼠肺被解剖并取出,在同等曝光条件下荧光成像。结果显示:1只裸鼠在第10天出现纵隔及对侧肺内转移,3只裸鼠在第12天出现纵隔等胸腔内转移,2只裸鼠在第13天出现纵隔等胸腔内转移,其余9只裸鼠在第8天至第11天死亡且均未出现转移。
④将步骤③的裸鼠体内的转移灶取出,并按前述方法将转移灶分别原位接种于10只裸鼠肺内,并采取步骤③相同的方式观察动物的状况并对所有裸鼠的肺部进行非侵袭性的实时成像观察。结果显示:1只裸鼠于第11天死亡且未出现转移,其余9只均在第10-13天出现纵隔等胸腔内转移。图2提供了裸鼠在转移灶接种第10天在光学活体成像仪下进行活体成像的图像,图像显示裸鼠纵隔内见淋巴结多发转移(图2中白线指示的位置有多处强烈的红色荧光)。
从步骤④所得的出现纵隔等胸腔内转移的裸鼠中取出转移灶,可从中获得高转移的小细胞肺癌细胞,行原代培养后冻存备用。
由此可见,上述rfp标记小细胞肺癌ltep-p细胞系,是以小细胞肺癌ltep-p细胞株为母细胞,转染包装有rfp的plein逆转录病毒,再经g418抗性筛选,获得稳定持续表达红色荧光蛋白(rfp)的小细胞肺癌ltep-p细胞系。其是通过将包装细胞pt67与含rfp基因的plein质粒共培养以转染包装细胞pt67,再经g418抗性筛选,获得产病毒rfp阳性细胞克隆;再用产病毒rfp阳性细胞克隆转染小细胞肺癌ltep-p细胞株,并经g418抗性筛选,建立得到的rfp标记小细胞肺癌ltep-p细胞系。上述rfp标记小细胞肺癌ltep-p细胞系,又记为ltep-p-rfp肿瘤细胞,呈近于圆形,透亮,具有强的体外成瘤能力和特异胸腔内高转移性。
综合以上实验观察与验证,可以发现,通过将rfp标记小细胞肺癌ltep-p细胞系应用在裸鼠肺内原位接种建立裸鼠模型中的实验观测,rfp标记小细胞肺癌ltep-p细胞系表现出具有以下特征:1)rfp标记十分稳定,在肿瘤细胞生长、增殖及分裂过程中不会丢失和减弱。2)rfp标记无毒、无害,并不因新的特征明显改变原来细胞的生物学特性。3)方便观察,rfp标记后小细胞肺癌ltep-p细胞系与裸鼠体内各种正常细胞容易区分,不需固定、染色等,操作简便。4)适合活细胞状态及体内动态观察,便于对小细胞肺癌ltep-p细胞系在裸鼠体内的生长、浸润、转移等的瞬时状况和进展过程进行实时显示和跟踪,同时通过现有的方法对各种重要器官中肿瘤细胞的数量作出准确的测量和计算,从而能够建立一种新的简便、准确、客观判断肿瘤转移的方法,以便动态观察移植瘤生长,以及在移植瘤生长过程中新生血管形成过程。
由此可见,本发明的目的已经完整并有效的予以实现。本发明的方法以及原理已在实施例中予以展示和说明,在不背离所述原理的情况下,实施方式可作任意修改。所以,本发明包括了基于权利要求精神及权利要求范围的所有变形实施方式。
- 还没有人留言评论。精彩留言会获得点赞!