一种基于聚合物二元醇的酸敏感化合物及其制备方法与流程
本发明涉及有机合成领域,更具体的说是涉及一种基于聚合物二元醇的酸敏感化合物及其制备方法。
背景技术:
药物载体,是指能改变药物进入人体的方式和在体内的分布、控制药物的释放速度并将药物输送到靶向器官的体系。药物载体的种类众多,较为成熟的有微囊与微球、纳米材料和脂质体。
其中用纳米材料作为药物载体可实现靶向运输、缓释给药的目的;纳米材料能够穿越许多生物屏障到达病灶部分,例如通过血脑屏障把药物输送到脑部,从而使得一些原本很难治愈的疾病有了治愈的可能。在人体内,有的环境为水性环境,有的环境为油性(脂溶性)环境;但现有的纳米材料要么在水性溶液中溶解性较差,要么在油性溶液中溶解性较差,这大大限制了纳米材料在药物载体领域中的实际应用。
技术实现要素:
针对现有技术存在的不足,本发明的目的在于提供一种基于聚合物二元醇的酸敏感化合物及其制备方法;该酸敏感化合物具有两亲性,能够作为药物载体使用。
为实现上述目的,本发明提供了如下技术方案:一种基于聚合物二元醇的酸敏感化合物,包括下列重量份物质组成:
聚合物二元醇1份;
乙烯基二乙二醇醚1-4份;
所述聚合物二元醇为聚乙二醇、聚丙二醇、聚丁二醇和聚己二酸丁二醇酯中的任意一种;所述聚合物二元醇的数均分子量为500-4000;
所述酸敏感化合物的数均分子量为3000-15000。
作为本发明的进一步改进,当聚合物二元醇为聚乙二醇时,酸敏感化合物的分子结构式为
当聚合物二元醇为聚丙二醇时,酸敏感化合物的分子结构式为
当聚合物二元醇为聚丁二醇时,酸敏感化合物的分子结构式为
当聚合物二元醇为聚己二酸丁二醇酯时,酸敏感化合物的分子结构式为
作为本发明的进一步改进,一种基于聚合物二元醇的酸敏感化合物的制备方法,包括以下步骤:
步骤一:根据设定的重量份配备原料,将聚合物二元醇和除水剂放入反应容器中搅拌混合,混合均匀后,在温度为130℃的条件下除水,除水时间为5-10min;
步骤二:将反应溶剂和催化剂依次加入到步骤一的反应容器中搅拌混合,混合均匀后;再将乙烯基二乙二醇醚加入到反应容器中搅拌混合,然后在转速为200-400r/min,温度为15-25℃的条件下进行反应,反应时间为2-4h;反应完全后进行纯化,得到酸敏感化合物。
作为本发明的进一步改进,所述除水剂为甲苯。
作为本发明的进一步改进,所述催化剂为对甲苯磺酸
作为本发明的进一步改进,所述溶剂为对二氯甲烷
作为本发明的进一步改进,步骤二中的溶剂在加入反应容器前要经过预处理,预处理过程为将二氯甲烷和氢化钙依次加入到反应器中,在温度为40-60℃,转速为300r/min的条件下进行处理,处理时间为4h。
作为本发明的进一步改进,步骤二中将乙烯基二乙二醇醚加入到反应容器中搅拌混合是指用滴管将乙烯基二乙二醇醚以每秒一滴的速度加入到反应容器中。
作为本发明的进一步改进,所述酸敏感化合物作为药物载体使用。
本发明的有益效果:通过以聚合物二元醇和乙烯基二乙二醇醚作为反应物进行反应,以对甲苯磺酸作为催化剂,以二氯甲烷作为溶剂,直接一步反应得到酸敏感化合物;其中聚合物二元醇为聚乙二醇、聚丙二醇、聚丁二醇和聚己二酸丁二醇酯中的任意一种;这些聚合物二元醇在水、磷酸盐缓冲溶液、生理盐水中都具有很高的溶解度,对人体的毒副作用很小;同时生物相容性很好,在水溶液中对蛋白质的构象和酶的活性均无有害的影响;
在本发明中,水分对聚合物二元醇和乙烯基二乙二醇醚的反应存在影响很大,水分的存在会使得本发明的产率极低,同时生成的酸敏感聚合物的分子量很小,无法得到理想的产物;为了尽可能减少水分对本发明的影响,在反应前,要先对溶剂二氯甲烷进行精制纯化,通过用氢化钙来除去二氯甲烷中含有的水蒸气;同时对用甲苯对聚合物二元醇进行处理,这样就大大降低了水分对本发明的影响,使得尽可能得到理想产物;此外,在将乙烯基二乙二醇醚加入到装有聚合物二元醇的反应容器中进行反应时,要采用滴管滴加的方式,滴加速度为每秒一滴,目的是防止反应过于剧烈,产生较多的副产物;采用滴加能使反应更加温和,最终容易制得理想的产物,聚合程度较高;聚合物二元醇的两端为羟基,羟基会与乙烯基二乙二醇醚中的乙烯基发生反应,生成含有缩醛键的酸敏感化合物,由于缩醛键的存在,酸敏感化合物在酸性条件下就能发生分解;本发明的反应时间仅为2-4h,反应时间短,反应步骤仅为1步,特别适合工业化生产。
本发明制得的酸敏感化合物,具有两亲性,在水性溶液和油性溶液中都具有较好的溶解性,能够在水中自组装成纳米胶束。同时还可以在酸性条件下发生降解,不会产生安全隐患以及资源的浪费,生态环保,利于可持续发展;并且还能够作为药物载体使用,特别适合作为一些药物的靶向载体。
附图说明
图1为实施例1制得的酸敏感化合物的核磁氢谱图;
图2为实施例1制得的酸敏感化合物的红外光谱图;
图3为实施例2制得的酸敏感化合物的核磁氢谱图;
图4为实施例2制得的酸敏感化合物的红外光谱图;
图5为实施例3制得的酸敏感化合物的核磁氢谱图;
图6为实施例3制得的酸敏感化合物的红外光谱图;
图7为实施例4制得的酸敏感化合物的核磁氢谱图;
图8为实施例4、5、6制得的酸敏感化合物的核磁氢谱图;(其中PPG4为实施例4试样,PPG3为实施例5试样,PPG2为实施例6试样);
图9为实施例4制得的酸敏感化合物的红外光谱图;
图10为实施例4、5、6和7制得的酸敏感化合物的红外光谱图;(其中PPG4为实施例4试样,PPG3为实施例5试样,PPG2为实施例6试样,PPG1为实施例7试样);
图11为实施例4制得的酸敏感化合物酸降解前后的核磁氢谱图;
图12为实施例4制得的酸敏感化合物酸降解前后的红外光谱图;
图13为实施例4制得酸敏感化合物酸降解前后的凝胶色谱图;
具体实施方式
下面结合附图和实施例,对本发明进一步详细说明。
实施例1:
步骤一,二氯甲烷的精制纯化:取200mL二氯甲烷放入干净干燥的500mL单口烧瓶中,加入2.0g氢化钙固体粉末,在温度为45℃,转速为300r/min的条件下进行处理,处理时间为4h,制得精制后的二氯甲烷;
步骤二,聚乙二醇的除水处理:将10.0g聚乙二醇放入200mL圆底烧瓶中,接着向圆底烧瓶中倒入50mL甲苯搅拌混合,混合均匀后,在温度为130℃的条件下共沸除水,除水时间为5min;除水结束后,将圆底烧瓶放在室温下冷却;
步骤三,进行反应:往圆底烧瓶中倒入精制后的二氯甲烷50mL,并加入5mg对甲苯磺酸搅拌混合,混合均匀后,将40.0g乙烯基二乙二醇醚用滴管以每秒一滴的速度滴加到圆底烧瓶中搅拌混合,然后在转速为300r/min,温度为20℃的条件下进行反应,反应时间为3h;反应结束后向反应体系中加入饱和碳酸氢钠水溶液至pH=7-8,以除去对甲苯磺酸,减压浓缩,用二氯甲烷萃取3次,收集有机层,加入8g无水硫酸钠进行除水,减压过滤除去无水硫酸钠,再用旋转蒸发仪减压除去溶剂,得到酸敏感化合物。
其反应式为:
酸敏感化合物的分子结构式为:
通过用凝胶色谱仪进行检测,检测得到酸敏感化合物的数均分子量Mn=9742,重均分子量Mw=10618,PDI=1.09;
实施例2:
步骤一,二氯甲烷的精制纯化:取200mL二氯甲烷放入干净干燥的500mL单口烧瓶中,加入2.0g氢化钙固体粉末,在温度为45℃,转速为300r/min的条件下进行处理,处理时间为4h,制得精制后的二氯甲烷;
步骤二,聚丁二醇的除水处理:将10.0g聚丁二醇放入200mL圆底烧瓶中,接着向圆底烧瓶中倒入50mL甲苯搅拌混合,混合均匀后,在温度为130℃的条件下共沸除水,除水时间为8min;除水结束后,将圆底烧瓶放在室温下冷却;
步骤三,进行反应:往圆底烧瓶中倒入精制后的二氯甲烷50mL,并加入5mg对甲苯磺酸搅拌混合,混合均匀后,将40.0g乙烯基二乙二醇醚用滴管以每秒一滴的速度滴加到圆底烧瓶中搅拌混合,然后在转速为300r/min,温度为20℃的条件下进行反应,反应时间为3h;反应结束后向反应体系中加入饱和碳酸氢钠水溶液至pH=7-8,以除去对甲苯磺酸,减压浓缩,用二氯甲烷萃取3次,收集有机层,加入8g无水硫酸钠进行除水,减压过滤除去无水硫酸钠,再用旋转蒸发仪减压除去溶剂,得到酸敏感化合物。
其反应式为:
酸敏感化合物的分子结构式为
通过用凝胶色谱仪进行检测,检测得到酸敏感化合物的数均分子量Mn=9882,重均分子量Mw=20555,PDI=2.08
实施例3:
步骤一,二氯甲烷的精制纯化:取200mL二氯甲烷放入干净干燥的500mL单口烧瓶中,加入2.0g氢化钙固体粉末,在温度为45℃,转速为300r/min的条件下进行处理,处理时间为4h,制得精制后的二氯甲烷;
步骤二,聚己二酸丁二醇酯的除水处理:将10.0g聚己二酸丁二醇酯放入200mL圆底烧瓶中,接着向圆底烧瓶中倒入50mL甲苯搅拌混合,混合均匀后,在温度为130℃的条件下共沸除水,除水时间为10min;除水结束后,将圆底烧瓶放在室温下冷却;
步骤三,进行反应:往圆底烧瓶中倒入精制后的二氯甲烷50mL,并加入5mg对甲苯磺酸搅拌混合,混合均匀后,将40.0g乙烯基二乙二醇醚用滴管以每秒一滴的速度滴加到圆底烧瓶中搅拌混合,然后在转速为300r/min,温度为20℃的条件下进行反应,反应时间为3h;反应结束后向反应体系中加入饱和碳酸氢钠水溶液至pH=7-8,以除去对甲苯磺酸,减压浓缩,用二氯甲烷萃取3次,收集有机层,加入8g无水硫酸钠进行除水,减压过滤除去无水硫酸钠,再用旋转蒸发仪减压除去溶剂,得到酸敏感化合物。
其反应式为:
酸敏感化合物的分子结构式为
通过用凝胶色谱仪进行检测,检测得到酸敏感化合物的数均分子量Mn=9242,重均分子量Mw=21349,PDI=2.31;
实施例4
步骤一,二氯甲烷的精制纯化:取200mL二氯甲烷放入干净干燥的500mL单口烧瓶中,加入2.0g氢化钙固体粉末,在温度为45℃,转速为300r/min的条件下进行处理,处理时间为4h,制得精制后的二氯甲烷;
步骤二,聚丙二醇的除水处理:将10.0g聚丙二醇放入200mL圆底烧瓶中,接着向圆底烧瓶中倒入50mL甲苯搅拌混合,混合均匀后,在温度为130℃的条件下共沸除水,除水时间为7min;除水结束后,将圆底烧瓶放在室温下冷却;
步骤三,进行反应:往圆底烧瓶中倒入精制后的二氯甲烷50mL,并加入5mg对甲苯磺酸搅拌混合,混合均匀后,将40.0g乙烯基二乙二醇醚用滴管以每秒一滴的速度滴加到圆底烧瓶中搅拌混合,然后在转速为300r/min,温度为20℃的条件下进行反应,反应时间为3h;反应结束后向反应体系中加入饱和碳酸氢钠水溶液至pH=7-8,以除去对甲苯磺酸,减压浓缩,用二氯甲烷萃取3次,收集有机层,加入8g无水硫酸钠进行除水,减压过滤除去无水硫酸钠,再用旋转蒸发仪减压除去溶剂,得到酸敏感化合物PPG4。
实施例5
步骤一,二氯甲烷的精制纯化:取200mL二氯甲烷放入干净干燥的500mL单口烧瓶中,加入2.0g氢化钙固体粉末,在温度为45℃,转速为300r/min的条件下进行处理,处理时间为4h,制得精制后的二氯甲烷;
步骤二,聚丙二醇的除水处理:将10.0g聚丙二醇放入200mL圆底烧瓶中,接着向圆底烧瓶中倒入50mL甲苯搅拌混合,混合均匀后,在温度为130℃的条件下共沸除水,除水时间为7min;除水结束后,将圆底烧瓶放在室温下冷却;
步骤三,进行反应:往圆底烧瓶中倒入精制后的二氯甲烷50mL,并加入5mg对甲苯磺酸搅拌混合,混合均匀后,将30.0g乙烯基二乙二醇醚用滴管以每秒一滴的速度滴加到圆底烧瓶中搅拌混合,然后在转速为300r/min,温度为20℃的条件下进行反应,反应时间为3h;反应结束后向反应体系中加入饱和碳酸氢钠水溶液至pH=7-8,以除去对甲苯磺酸,减压浓缩,用二氯甲烷萃取3次,收集有机层,加入8g无水硫酸钠进行除水,减压过滤除去无水硫酸钠,再用旋转蒸发仪减压除去溶剂,得到酸敏感化合物PPG3。
实施例6
步骤一,二氯甲烷的精制纯化:取200mL二氯甲烷放入干净干燥的500mL单口烧瓶中,加入2.0g氢化钙固体粉末,在温度为45℃,转速为300r/min的条件下进行处理,处理时间为4h,制得精制后的二氯甲烷;
步骤二,聚丙二醇的除水处理:将10.0g聚丙二醇放入200mL圆底烧瓶中,接着向圆底烧瓶中倒入50mL甲苯搅拌混合,混合均匀后,在温度为130℃的条件下共沸除水,除水时间为7min;除水结束后,将圆底烧瓶放在室温下冷却;
步骤三,进行反应:往圆底烧瓶中倒入精制后的二氯甲烷50mL,并加入5mg对甲苯磺酸搅拌混合,混合均匀后,将20.0g乙烯基二乙二醇醚用滴管以每秒一滴的速度滴加到圆底烧瓶中搅拌混合,然后在转速为300r/min,温度为20℃的条件下进行反应,反应时间为3h;反应结束后向反应体系中加入饱和碳酸氢钠水溶液至pH=7-8,以除去对甲苯磺酸,减压浓缩,用二氯甲烷萃取3次,收集有机层,加入8g无水硫酸钠进行除水,减压过滤除去无水硫酸钠,再用旋转蒸发仪减压除去溶剂,得到酸敏感化合物PPG2。
实施例7
步骤一,二氯甲烷的精制纯化:取200mL二氯甲烷放入干净干燥的500mL单口烧瓶中,加入2.0g氢化钙固体粉末,在温度为45℃,转速为300r/min的条件下进行处理,处理时间为4h,制得精制后的二氯甲烷;
步骤二,聚丙二醇的除水处理:将10.0g聚丙二醇放入200mL圆底烧瓶中,接着向圆底烧瓶中倒入50mL甲苯搅拌混合,混合均匀后,在温度为130℃的条件下共沸除水,除水时间为7min;除水结束后,将圆底烧瓶放在室温下冷却;
步骤三,进行反应:往圆底烧瓶中倒入精制后的二氯甲烷50mL,并加入5mg对甲苯磺酸搅拌混合,混合均匀后,将10.0g乙烯基二乙二醇醚用滴管以每秒一滴的速度滴加到圆底烧瓶中搅拌混合,然后在转速为300r/min,温度为20℃的条件下进行反应,反应时间为3h;反应结束后向反应体系中加入饱和碳酸氢钠水溶液至pH=7-8,以除去对甲苯磺酸,减压浓缩,用二氯甲烷萃取3次,收集有机层,加入8g无水硫酸钠进行除水,减压过滤除去无水硫酸钠,再用旋转蒸发仪减压除去溶剂,得到酸敏感化合物PPG1。
实施例4-7的反应式均为
实施例4-7的制得酸敏感化合物的结构式为:
实施例4试样PPG4的数均分子量Mn=10187,重均分子量Mw=11206,PDI=1.10;
实施例5试样PPG3的数均分子量Mn=7458,重均分子量Mw=8472,PDI=1.27;
实施例6试样PPG2的数均分子量Mn=6342,重均分子量Mw=7420,PDI=1.17;
实施例7试样PPG1的数均分子量Mn=3847,重均分子量Mw=5039,PDI=1.31;
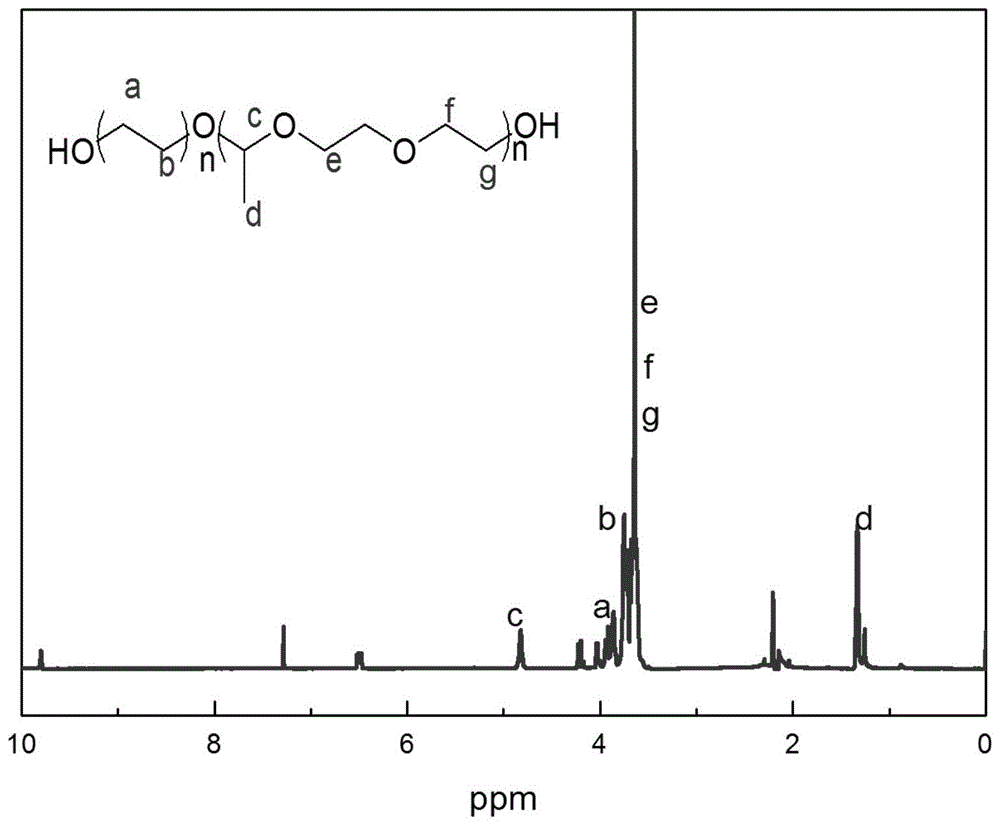
由图1可知:(1H NMR(500MHz,CDCl3)δ4.83(dq,J=10.6,5.2Hz,1H),4.20(t,J=13.3Hz,2H),4.02(dd,J=12.2,6.8Hz,2H),3.96–3.81(m,2H),3.81–3.71(m,2H),3.69–3.56(m,4H),2.26–2.12(m,9H),1.43–1.20(m,3H).)。从核磁氢谱中明显看到在化学位移4.83处,积分得到有1个氢,分别对应产物c处的一个氢;在该比例下,化学位移为3.69-3.56处的一组峰,积分发现有4个氢,4个氢是对应产物e处的两个亚甲基的4个氢;化学位移为3.81–3.71处的一组,积分发现有2个氢,对应f处两个氢;化学位移为3.96–3.81处的一组峰,积分发现有2个氢,这2个氢是对应产物g处的2个氢;在化学位移4.02处,积分得到有2个氢,对应产物b处的2个氢;在化学位移4.20处,积分得到有2个氢,分别对应产物a处的2个氢;在化学位移1.43–1.20处,积分得到有3个氢,是对应产物d处的3个氢。该核磁图谱与预期整体吻合。
由图2可知:在3392cm-1和1380cm-1附近分别是羟基的伸缩振动和弯曲振动;2870cm-1附近有较宽的谱图,这是甲基,亚甲基和次甲基的伸缩震动,但又在1340cm-1处是次甲基的弯曲震动,所以有次甲基的存在;在1080cm-1附近有一个双峰,这是对称醚伸缩振动的谱图,判定为C-O-C醚键。
图1和图2同时证明了实施例1所得产物的合成成功。
由图3可知:(1H NMR(500MHz,CDCl3)δ5.02–4.64(m,1H),3.86–3.68(m,2H),3.70–3.55(m,6H),3.41(s,2H),1.62(s,2H),1.40–1.17(m,3H).)从核磁氢谱中明显看到在化学位移5.02–4.64处,积分得到有1个氢,分别对应产物d处的一个氢;在该比例下,化学位移为3.86–3.68处的一组峰,积分发现有2个氢,是对应产物h处的亚甲基的2个氢;化学位移为3.70–3.55处的有三组峰,积分发现有6个氢,分别对应产物c、f、g处两个氢;化学位移为3.41处的一组峰,积分发现有2个氢,这2个氢是对应产物a处的2个氢;在化学位移1.62处,积分得到有2个氢,分别对应产物b处的2个氢;在化学位移1.40–1.17处,积分得到有3个氢,分别对应产物e处的3个氢;核磁图谱与预期整体吻合。
由图4可知:在3480cm-1和1384cm-1附近分别是羟基伸缩振动和弯曲振动;2872cm-1附近有较宽的谱图,这是甲基,亚甲基和次甲基的伸缩震动,但又在1340cm-1处是次甲基的弯曲震动,所以有次甲基的存在;在1194cm-1附近有一个双峰,这是对称醚伸缩振动的谱图,判定为C-O-C醚键。
图3和图4同时证明了实施例2所得产物合成成功;
由图5可知:(1H NMR(500MHz,CDCl3)δ4.95–4.63(m,1H),4.22–3.92(m,2H),3.79–3.68(m,2H),3.62(dd,J=14.4,10.5Hz,6H),2.33(s,1H),1.68(d,J=18.7Hz,2H),1.39–1.09(m,3H).)从核磁氢谱中明显看到在化学位移4.95–4.63处,积分得到有1个氢,分别对应产物e处的一个氢;在该比例下,化学位移为4.22–3.92处的一组峰,积分发现有2个氢,是对应产物g处的亚甲基的2个氢;化学位移为3.79–3.68处的有一组峰,积分发现有2个氢,分别对应产物d处两个氢;化学位移为3.62处的三组峰,积分发现有6个氢,这6个氢是分别对应产物a和双醚键中间及两边处的2个氢;在化学位移1.68处,积分得到有2个氢,分别对应产物b处的2个氢;在化学位移1.39–1.09处,积分得到有3个氢,分别对应产物f处的3个氢;核磁图谱与预期整体吻合。
由图6可知:在3450cm-1和1388cm-1附近分别是羟基的伸缩振动和弯曲振动;2872cm-1附近有较宽的谱图,这是甲基,亚甲基和次甲基的伸缩震动,但又在1340cm-1处是次甲基的弯曲震动,所以有次甲基的存在;在1122cm-1附近有一个双峰,这是对称醚伸缩振动的谱图,判定为C-O-C醚键。在1734cm-1附近有一个尖峰,这是碳氧双键伸缩振动的谱图,初步判定这是个酯键。
图5和图6同时证明了实施例3所得产物合成成功;
由图7可知:(1H NMR(500MHz,CDCl3)δ4.82(ddt,J=15.7,10.3,5.1Hz,2H),3.83–3.69(m,4H),3.68–3.56(m,6H),1.50–1.24(m,3H),1.20–1.00(m,3H).)从核磁氢谱中明显看到在化学位移4.82处,积分得到有2个氢,分别对应产物d处的一个氢c处的一个氢;在该比例下,化学位移为3.83–3.69处的两组峰,积分发现有4个氢,分别是对应产物h、a处的亚甲基的2个氢;化学位移为3.68–3.56处的有三组峰,积分发现有6个氢,分别对应产物f处两个亚甲基的四个氢和g的两个氢;化学位移为1.50–1.24处的一组峰,积分发现有3个氢,这3个氢是对应产物b处的3个氢;在化学位移1.20–1.00处,积分得到有3个氢,分别对应产物e处的3个氢;核磁图谱与预期整体吻合。
由图9可知:在3400cm-1和1382cm-1附近分别是羟基的伸缩振动和弯曲振动;2872cm-1附近有较宽的谱图,这是甲基,亚甲基和次甲基的伸缩震动,但又在1340cm-1处是次甲基的弯曲震动,所以有次甲基的存在;在1124cm-1附近有一个双峰,这是对称醚伸缩振动的谱图,判定为C-O-C醚键。
图7和图9同时证明了实施例3所得产物合成成功;
由图8可知:通过比较实施例4、5和6产物的核磁图谱可以看出3个图线基本吻合,说明都是同一种物质;
由图10可知:通过比较实施例4、5、6和7产物的红外谱图可以看出4个图线基本吻合,说明合成了同一种物质;
图8和图10证明了实施例4、5、6和7制得的产物是同一种物质。
酸降解试验:
将1.0g酸敏感化合物(实施例4制得)在pH=4.0的PBS缓冲溶液中搅拌降解;反应48h后向反应体系中加入饱和碳酸氢钠水溶液至pH=7-8,除去对甲苯磺酸,减压浓缩,用二氯甲烷萃取3次,收集有机层,加入8g无水硫酸钠除水;减压过滤除去无水硫酸钠,再用旋转蒸发仪减压除去溶剂,得到降解后的产物;由图11可知:降解前从核磁氢谱中明显看到在化学位移4.82处,积分得到有1个氢,但是降解后谱图的峰消失,说明次甲基消失;但在降解后化学位移10.0处突然出现一个尖峰,这是醛基的谱图;降解前化学位移为1.50-1.24处的一组峰的强度很强,但在降解后峰的强度变弱,间接说明聚合物初步降解;再加上次甲基的消失,醛基的出现,更加应证聚丙二醇和乙烯基二乙二醇醚聚合的产物已经发生降解。
由图12可知:在3400cm-1是羟基的伸缩振动,降解后的峰的宽度强度明显增加,说明有更多的羟基出现;2872cm-1附近有较宽的谱图,这是甲基,亚甲基和次甲基的伸缩震动,但降解后在1340cm-1处是次甲基的弯曲震动消失,说明次甲基消失,;降解后在1124cm-1附近有一个双峰变成两个尖峰,这是对称醚分解的谱图,初步判定为C-O-C醚键降解为醛基。
由图13可知:降解前的测试结果为数均分子量Mn=10187,重均分子量Mw=11206,PDI=1.10;降解后的测试结果为数均分子量Mn=3380,重均分子量Mw=3498,PDI=1.03。可知降解后的聚合物的分子量下降,初步说明降解成功。
图11、12和13共同证明了实施例4制得的酸敏感化合物能够发生酸降解。
其降解机理为:
装载尼罗红实验:
将0.1g实施例4制得酸敏感化合物溶于10ml四氢呋喃中,形成溶液A,将0.5ml溶液A与5ml去离子水混合,然后加入0.05g尼罗红,在100rad/min的条件搅拌10min,形成混合液;然后对混合液进行紫外测试;
实验结果:由于尼罗红不溶于水,所以在只有尼罗红时,紫外光谱图中没有吸收峰;而当用本发明的酸敏感化合物纳米胶束装载尼罗红后,在其紫外光谱中发现在495cm-1处有一个吸收峰,因此可证明本发明制得的酸敏感化合物纳米胶束封装药物的可行性,即本发明制得的酸敏感化合物能够作为药物载体使用。
本发明的一种基于聚合物二元醇的酸敏感化合物,是以聚合物二元醇和乙烯基二乙二醇醚作为反应物进行反应,以对甲苯磺酸作为催化剂,以二氯甲烷作为溶剂,直接一步反应得到酸敏感化合物;其中聚合物二元醇为聚乙二醇、聚丙二醇、聚丁二醇和聚己二酸丁二醇酯中的任意一种;这些聚合物二元醇在水、磷酸盐缓冲溶液、生理盐水中都具有很高的溶解度,对人体的毒副作用很小;同时生物相容性很好,在水溶液中对蛋白质的构象和酶的活性均无有害的影响。
在本发明中,水分对聚合物二元醇和乙烯基二乙二醇醚的反应存在影响很大,水分的存在会使得本发明的产率极低,同时生成的酸敏感聚合物的分子量很小,无法得到理想的产物;为了尽可能减少水分对本发明的影响,在反应前,要先对溶剂二氯甲烷进行精制纯化,通过用氢化钙来除去二氯甲烷中含有的水蒸气;同时对用甲苯对聚合物二元醇进行处理,这样就大大降低了水分对本发明的影响,使得尽可能得到理想产物;此外,在将乙烯基二乙二醇醚加入到装有聚合物二元醇的反应容器中进行反应时,要采用滴管滴加的方式,滴加速度为每秒一滴,目的是防止反应过于剧烈,产生较多的副产物;采用滴加能使反应更加温和,最终容易制得理想的产物,聚合程度较高;聚合物二元醇的两端为羟基,羟基会与乙烯基二乙二醇醚中的乙烯基发生反应,生成含有缩醛键的酸敏感化合物,由于缩醛键的存在,酸敏感化合物在酸性条件下就能发生分解;本发明的反应时间仅为2-4h,反应时间短,反应步骤仅为1步,特别适合工业化生产。
本发明制得的酸敏感化合物,具有两亲性,在水性溶液和油性溶液中都具有较好的溶解性,能够在水中自组装成纳米胶束。同时还可以在酸性条件下发生降解,不会产生安全隐患以及资源的浪费,生态环保,利于可持续发展;并且还能够作为药物载体使用,特别适合作为一些药物的靶向载体。
以上所述仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!