耳念珠菌的实时荧光定量PCR检测试剂盒及其专用引物、TaqMan探针的制作方法
本发明涉及生物检测领域,具体地,本发明涉及耳念珠菌的实时荧光定量pcr检测试剂盒及其专用引物、taqman探针。
背景技术:
耳念珠菌(candidaauris)是一种首次在日本报道的新病原,后来在全世界各地都有报道。基因分析显示一些耳念珠菌克隆株显示不同耐药性的机制。尽管加强了感染预防和控制措施,c.auris还是会引起重症监护室的院内爆发,其传播流行是一个特别令人关注的问题。以前,侵袭性念珠菌病主要由白色念珠菌引起,现在逐渐向非白假丝酵母转变,例如c.auris这种多重耐药物种,如氟康唑,经验性抗真菌治疗可能存在问题。c.auris能够在危重病人间迅速蔓延,有潜力成为一种占主导地位的机会性致病病原体。此外,使用常规表型和分子技术鉴定困难,不利于感染预防控制。对耳念珠菌进行早期诊断并加以及时治疗是预防侵袭性曲霉病相对有效的方法。因此,建立一种特异性高、准确、灵敏、快速、方便、成本低廉的耳念珠菌检测方法是降低侵袭性曲霉病发生和危害的重要途径。
c.auris在系统发育上与希木龙念珠菌(c.haemulonii)物种的同源性很高,报道显示c.haemulonii分离株经常被错误鉴别为c.auris。使用生色琼脂可以用来区分c.auris和c.haemulonii分离株,但是耗时长,远不能满足临床上对耳念珠菌进行快速准确检测的需要。尽管用于微生物鉴定的分子技术具有优势,但是在区分这两种真菌上可能出现偏差。例如基质辅助激光解吸电离-飞行时间质谱(maldi-tofms)可导致c.anuris被错误鉴定为c.haemulonii和c.albicans。遗传基因座的测序,包括rrna的d1/d2,rpb1,rpb2和内部转录间隔区(its),已被证明可用于鉴定c.auris,但它不是实验室用于念珠菌属物种鉴定的常用技术。
因此,开发一种能够快速准确检测c.auris的方法将会很有前景。
技术实现要素:
为此,在本发明的第一方面,本发明提出了rdna基因作为耳念珠菌生物标志物的用途。根据本发明的实施例,所述rdna基因包括其its1-its4核苷酸序列。发明人发现,耳念珠菌的rdna基因its1-its4为耳念珠菌保守序列,其中部分序列具有特异性,可作为理想的引物和探针设计模板,用于耳念珠菌核酸检测方法的研究。以耳念珠菌rdna基因(seqidno:17)序列为生物靶标建立耳念珠菌的实时荧光定量pcr检测方法,对于临床上对耳念珠菌感染进行快速诊断具有非常重要的作用。
根据本发明的实施例,上述用途还可进一步包括如下附加技术特征至少之一:
根据本发明的实施例,所述rdna基因包括其250-349位碱基序列。发明人发现,所述rdna基因自5’端第250-349位碱基序列(seqidno:17中双下划线部分)可以作为pcr检测中引物或探针特异性扩增的模板。
在本发明的第二方面,本发明提出了一种用于pcr检测的引物组合物。根据本发明的实施例,所述引物组合物包括:
正向引物,所述正向引物具有seqidno:1所示的核苷酸序列,
tgatgtcttctcaccmatcttc(seqidno:1);
反向引物,所述反向引物具有seqidno:2所示的核苷酸序列,
tgaggcgacacaaaacg(seqidno:2)。
发明人发现,利用所述引物组合物进行耳念珠菌的pcr检测时,特异性高,可以从相差仅1个核苷酸的基因标本中找出相应的靶序列进行扩增,且灵敏度好。由此,利用所述用于pcr检测的引物组合物可以快速、方便、高效、特异且灵敏地检测出出菌体、痰、血液、支气管肺泡灌洗液等待测样品中的耳念珠菌成分。
在本发明的第三方面,本发明提出了一种试剂盒。根据本发明的实施例,所述试剂盒包括:前面所描述的引物组合物。
根据本发明的实施例,上述试剂盒还可进一步包括如下附加技术特征至少之一:
根据本发明的实施例,所述试剂盒进一步包括:探针,所述探针具有seqidno:3所示的核苷酸序列。
aatcttcgcggtggcgttgcattca(seqidno:3)。
发明人发现,利用所述探针可以实现耳念珠菌的实时荧光定量pcr检测,且利用包含所述探针和所述引物组合物的试剂盒进行耳念珠菌的实时荧光定量pcr检测时,特异性更高,灵敏度更好。
根据本发明的实施例,所述探针的3’端标记有阻抑聚合酶延伸或扩增的基团,所述探针的5’端标记有荧光基团,所述探针的3’端标记有淬灭基团。
根据本发明的实施例,所述阻抑聚合酶延伸或扩增的基团为磷酸基团。
根据本发明的实施例,所述荧光基团为hex或fam。
根据本发明的实施例,所述淬灭基团为eclipse或tamra。
根据本发明的实施例,所述正向引物与所述反向引物的摩尔浓度比为1:1。由此,利用所述试剂盒进行耳念珠菌的实时荧光定量pcr检测时,特异性更高,灵敏度更好。
根据本发明的实施例,所述探针与所述正向引物的摩尔浓度比为1:1。由此,利用所述试剂盒进行耳念珠菌的实时荧光定量pcr检测时,特异性更高,灵敏度更好。
在本发明的第四方面,本发明提出了一种检测耳念珠菌的方法。根据本发明的实施例,所述方法包括:1)以待测样品dna为模板,利用前面所描述的引物组合物或前面所描述的试剂盒对所述待测样品dna进行pcr检测;2)基于检测结果,确定待测样品中是否含有耳念珠菌。若检测结果为出现荧光扩增曲线,表明待测样品中含有耳念珠菌rdna基因;若检测结果为未出现荧光扩增曲线,表明待测样品中不含有耳念珠菌rdna基因。发明人发现,根据本发明实施例的方法可以快速、方便、高效、高特异性、高灵敏度地定性检测出菌体、痰、血液、支气管肺泡灌洗液等待测样品中的耳念珠菌成分。
根据本发明的实施例,上述方法还可进一步包括如下附加技术特征至少之一:
根据本发明的实施例,所述方法进一步包括:步骤1)之前,预先将携带耳念珠菌rdna基因的质粒作为标准品,以不同浓度的标准品作为模板,并利用前面所描述的引物组合物或前面所描述的试剂盒对所述标准品进行pcr检测;且步骤2)是通过如下方式进行的:基于待测样品与所述标准品的检测结果,确定待测样品中耳念珠菌的浓度。依据待测样品的荧光信号强度和不同已知浓度的标准品的荧光信号强度,可以得出待测样品中所含的耳念珠菌dna的拷贝数。发明人发现,根据本发明实施例的方法可以快速、方便、高效、高特异性、高灵敏度地定量检测菌体、痰、血液、支气管肺泡灌洗液等待测样品中的耳念珠菌的含量。
根据本发明的实施例,所述携带耳念珠菌rdna基因的质粒为pmd19-t-its1-its4。根据本发明的实施例,所述pmd19-t-its1-its4质粒中,its1-its4位于pmd19-t质粒的431bp位点和432bp位点之间。根据本发明的实施例,所述pmd19-t-its1-its4质粒具有如图2所示的物理图谱。由此,利用根据本发明实施例的方法检测耳念珠菌时,特异性更高,灵敏度更好。
根据本发明的实施例,所述待测样品dna来源于包括选自分离的菌体,痰、肺泡灌洗液,血液和咽拭子的至少之一。
根据本发明的实施例,所述pcr检测条件为:首先95℃30s;然后95℃5s,58℃30s,共40个循环。
附图说明
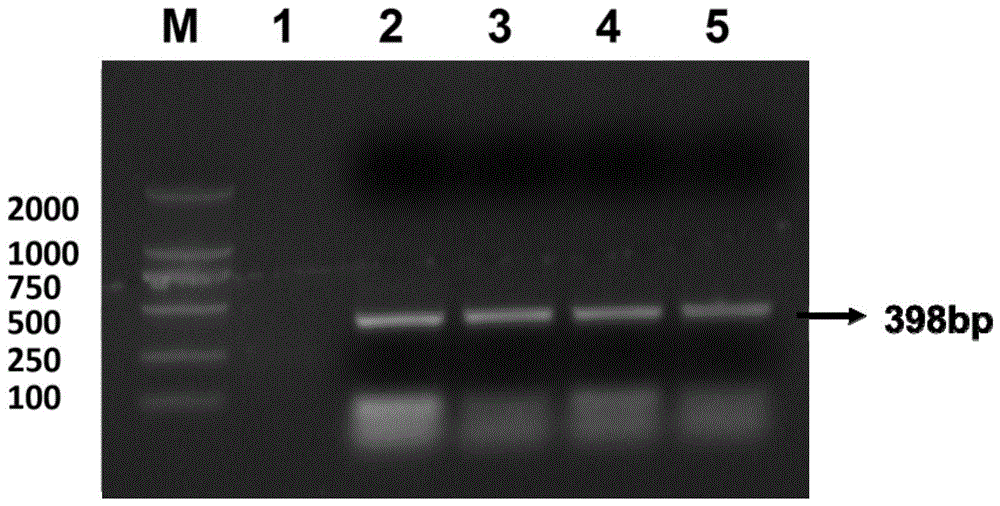
图1为根据本发明实施例的pcr扩增的耳念珠菌rdna基因特异性保守区的1%琼脂糖凝胶电泳检测结果;
图2为根据本发明实施例的携带耳念珠菌rdna基因的重组载体pmd19-t-its1/its4的物理图,其中,cloningsite表示克隆位点;
图3为根据本发明实施例的以标准品质粒为模板进行实时荧光定量pcr的扩增曲线,其中,fluorescence表示荧光强度,cycle表示循环数;
图4为根据本发明实施例的以标准品质粒为模板进行实时荧光定量pcr的标准曲线;
图5为根据本发明实施例的耳念珠菌实时荧光定量pcr检测方法特异性的检测结果,其中,fluorescence表示荧光强度,cycle表示循环数,amplificationcurves表示扩增曲线;
图6为根据本发明实施例的以不同的引物探针组合进行耳念珠菌实时荧光定量pcr检测的检测结果,其中,fluorescence表示荧光强度,cycle表示循环数。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
本发明公开了耳念珠菌rdna基因的应用,该rdna基因可以作为耳念珠菌检测的靶标。本发明还提供了根据该rdna基因的特异性保守序列设计的耳念珠菌实时荧光定量pcr检测试剂盒及其引物和taqman探针。本发明技术可用于定量检测菌体、痰、血液、支气管肺泡灌洗液等待测样品中的耳念珠菌成分,可在等温条件下快速、方便、高效、高特异性、高灵敏度地检测出耳念珠菌。
本发明的第一个目的是针对耳念珠菌rdna模板,设计实时荧光定量pcr检测的引物与taqman探针,以实现耳念珠菌的批量检测,提高检测的特异性和灵敏度。
本发明所提供的一对用于对耳念珠菌进行实时荧光定量pcr检测的引物,其上游引物(c.auris-a)的核苷酸序列如seqidno:1所示,下游引物(c.auris-b)的核苷酸序列如seqidno:2所示。由上述引物衍生的引物序列也属于本发明的保护范围。所述衍生序列是指在seqidno:1和/或seqidno:2的基础上经过一至十个碱基的取代、缺失或添加得到的引物序列。
本发明所提供的用于对耳念珠菌进行实时荧光定量pcr检测的taqman探针(taqmanprobe(c.auris)),其核苷酸序列如seqidno:3所示;所述探针为经过荧光标记的,其5’端标记有报告荧光基团,3’端标记有淬灭荧光基团;所述报告荧光基团可为hex、fam等,优选为fam;所述荧光淬灭基团可为eclipse、tamra等,优选为tamra。为防止pcr扩增时被延伸,所述探针的3’端还需经磷酸化处理。由上述taqman探针序列的衍生序列也属于本发明。所述衍生序列是指在seqidno:3的基础上,在序列的5’端和/或3’端再添加、减少一个或多个碱基得到的序列。
本发明的第二个目的是提供用于对耳念珠菌进行实时荧光定量pcr检测试剂盒。本发明所提供的实时荧光定量pcr检测试剂盒,包括上述用于对耳念珠菌进行实时荧光定量pcr检测的引物和taqman探针。
具体来讲,所述试剂盒包括以下用于20μl实时荧光定量pcr反应体系的试剂:实时荧光定量pcr反应液(takara公司产品,2×premixextaq,内含extaqhs,dntpmixture,mg2+,tlirnaseh等)10μl,无菌水7.4μl,引物加入量为:0.4μl引物c.auris-a(10μm),0.4μl引物c.auris-b(10μm),taqman探针加入量为:0.8μltaqmanprobe(c.auris)(10μm)。
为方便检测,所述试剂盒中还可包括阳性对照和阴性对照,所述阳性对照为耳念珠菌标准株基因组dna或携带耳念珠菌rdna基因的克隆质粒(优选为pmd19-t-its1-its4),所述阴性对照为不含耳念珠菌rdna基因的反应体系,如h2o(双蒸水、无菌去离子水等)。
本发明的第三个目的是提供上述引物、探针和试剂盒的应用,即在对耳念珠菌进行定性、定量检测中的应用。对耳念珠菌进行实时荧光定量pcr检测,可包括以下步骤:
1)建立标准曲线:将携带耳念珠菌rdna基因的克隆质粒作为标准品,梯度稀释成101、102、103、104、105、106、107拷贝/μl,以不同浓度的标准品作为模板,在试剂盒中引物和taqman探针的引导下进行实时荧光定量pcr检测,检测结束后,以各标准品的浓度log值(x轴)对其相应ct值(y轴)作图,绘制标准曲线;
2)提取待测样品的dna,以提取的dna为模板,在试剂盒中引物和taqman探针的引导下进行耳念珠菌rdna基因的实时荧光定量pcr检测;
3)根据荧光信号的变化及强度,对待测样品中的耳念珠菌rdna基因进行定性、定量检测,出现荧光扩增曲线表明样品中含有耳念珠菌rdna基因,未出现荧光扩增曲线表明样品中不含有耳念珠菌rdna基因,再根据样品的荧光信号强度和步骤1)中的标准曲线,得出待测样品中所含的耳念珠菌dna的拷贝数。
在上述检测方法中,所述步骤1)中携带耳念珠菌rdna基因的克隆质粒优选为pmd19-t-its1-its4。
所述步骤2)中的待测临床样本主要包括分离的菌株和痰、肺泡灌洗液、血液、咽拭子等标本。
所述步骤1)和步骤2)中的20μl实时荧光定量pcr反应体系可包括:模板1μl,实时荧光定量pcr反应液(takara公司产品,2×premixextaq,内含extaqhs,dntpmixture,mg2+,tlirnaseh等)10μl,无菌水7.4μl,引物加入量为:0.4μl引物c.auris-a(10μm),0.4μl引物c.auris-b(10μm),taqman探针加入量为:0.8μltaqmanprobe(c.auris)(10μm)。
所述步骤1)和步骤2)中的实时荧光定量pcr反应条件可为:先95℃30s;然后95℃5s,58℃30s,共40个循环。在每个循环的延伸结束时进行荧光信号检测。
总结:
本发明耳念珠菌的实时荧光定量pcr检测,首先设计针对耳念珠菌rdna基因的引物与taqman探针,再以待测样品的dna为模板,结合实时荧光定量pcr检测技术,实现对耳念珠菌进行定性、定量检测的目的。具有以下优点:
1、简便、快速:整个检测(包括加样)可在1.5小时内完成,整个检测过程比普通pcr完成一次反应节省了大概一个小时,计算机自动报告结果,无需后续实验工作(电泳等),减少了工作量。
2、特异性高:用本发明对黄曲霉、黑曲霉、土曲霉、构巢曲霉、杂色曲霉、白色念珠菌、热带念珠菌、近平滑念珠菌、克柔念珠菌、光滑念珠菌、浅白隐球菌、指甲隐球菌、新生隐球菌、桔青霉、马内菲青霉、棘状外瓶霉、皮炎外瓶霉、荚膜组织胞浆菌、尖孢镰刀菌、红色毛癣菌、金黄色葡萄球菌、鲍曼不动杆菌和人a549细胞的dna进行检测,结果均呈阴性,仅对耳念珠菌的检测结果呈阳性。本发明设计的引物和taqman探针对耳念珠菌rdna基因的特异性识别保证了实时荧光定量pcr的高度特异性,即能从相差仅1个核苷酸的基因标本中找出相应的靶序列进行扩增。
综上所述,本发明中耳念珠菌的实时荧光定量pcr检测方法明显优于现有的耳念珠菌检测方法,具有特异性高、灵敏度高、准确度高、检测速度快、低污染、对仪器设备要求低和成本低廉等优点,可用于临床、科研以及生产中对耳念珠菌进行定性和定量分析。
下面结合具体实施例对本发明做进一步详细说明。
下述实施例中所用方法如无特别说明均为常规方法,具体步骤可参见:《molecularcloning:alaboratorymanual》(《分子克隆实验指南》)[sambrook,j.,russell,davidw.,molecularcloning:alaboratorymanual,3rdedition,2001,ny,coldspringharbor.]。
所述百分比浓度如无特别说明均为质量/质量(w/w,单位g/100g)百分比浓度、质量/体积(w/v,单位g/100ml)百分比浓度或体积/体积(v/v,单位ml/100ml)百分比浓度。
实施例中描述到的各种生物材料的取得途径仅是提供一种实验获取的途径以达到具体公开的目的,不应成为对本发明生物材料来源的限制。事实上,所用到的生物材料的来源是广泛的,任何不违反法律和道德伦理能够获取的生物材料都可以按照实施例中的提示替换使用。
所用引物和探针均由华大基因公司合成。
实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,实施例将有助于理解本发明,但是本发明的保护范围不限于下述实施例。
实施例1设计对耳念珠菌进行定性、定量检测的实时荧光定量pcr引物及taqman探针
从ncbi的核酸数据库genbank(http://www.ncbi.nlm.nih.gov)检索获得耳念珠菌rdna基因的序列(genbank:mk705921.1),用dnaman软件进行比对后,获得耳念珠菌rdna基因its1-its4为耳念珠菌保守序列,其中部分序列具有特异性;选取耳念珠菌rdna基因全序列为模板,用primerpremier5.0软件设计对耳念珠菌进行实时荧光定量pcr检测的引物及taqman探针,共设计出超过8套引物、探针组合,通过敏感性和特异性检测筛选出性能最佳的一套引物,序列如下:
上游引物c.auris-a:
5’-tgatgtcttctcaccmatcttc-3’(seqidno:1);
下游引物c.auris-b:
5’-tgaggcgacacaaaacg-3’(seqidno:2);
taqmanprobe(c.auris):
5’fam-aatcttcgcggtggcgttgcattca-tamra3’(seqidno:3)。
上述引物特异性扩增耳念珠菌rdna基因的序列(genbank:mk705921.1)中自5’端第250-349位碱基序列;taqman探针的5’端标记报告荧光基团fam,3’端标记淬灭荧光基团tamra,并将探针的3’端进行磷酸化处理。
实施例2用本发明的引物及taqman探针进行耳念珠菌的实时荧光定量pcr检测
1、提取耳念珠菌的基因组dna
用ctab法提取耳念珠菌的基因组dna,具体方法包括以下步骤:
1)配制ctab(十六烷基三甲基溴化铵)抽提缓冲液(ph8.0):称取十六烷基三甲基溴化铵(ctab)30g,tris12.12g,乙二胺四乙酸(edta)5.84g,氯化钠(nacl)82g,用800ml去离子水充分搅拌溶解,再加入100ml二硫苏糖醇(dtt)溶液,用naoh调ph至8.0,最后定容到1l,室温保存;
2)配制cia溶液:cia饱和酚/氯仿/异戊醇25:24:1(v/v/v),4℃保存;
3)向耳念珠菌样本中加入600μlctab抽提缓冲液,振荡混匀后在65℃下裂解(裂解菌体释放基因组dna),裂解时间优选为30min,每隔10min充分混匀一次;
4)将裂解液放在冰水(约0℃)中冷却,冷却时间优选为10min;
5)再向裂解液中加入cia溶液(除去蛋白质并获得dna)400μl,充分混匀,4℃、10000rpm离心5min,将水相转移到新的离心管中;
6)加入等体积预冷的异丙醇(沉淀dna),颠倒混匀数次后静置5min,4℃、10000rpm离心10min;
6)轻轻倒出上清,将离心管倒置在滤纸上排干水分,用40μl去离子水重悬dna,放置-20℃备用。
2、构建携带耳念珠菌(c.auris)rdna基因的克隆质粒(实时荧光定量pcr标准品)根据耳念珠菌(c.auris)rdna基因its1-its4核苷酸序列(genbank:mk705921.1,seqidno:17)设计pcr扩增耳念珠菌rdna基因的引物(上游引物c.auris-1序列:5’-tccgtaggtgaacctgcgg-3’,下游引物c.auris-2序列:5’-tcctccgcttattgatatgc-3’),用ctab法提取耳念珠菌的基因组dna,再以耳念珠菌的基因组dna为模板,在引物c.auris-1和c.auris-2的引导下进行pcr扩增。25μlpcr反应体系为:dna模板1μl,2×taqmix(配方:taqdnapolymerase(recombinant):0.05units/μl;mgcl2:4mm;dntps(datp,dctp,dgtp,dttp):0.4mm)12.5μl,引物c.auris-1(10μm)0.5μl,引物c.auris-2(10μm)0.5μl,无菌水9.5μl。pcr反应条件为:先95℃3min,然后95℃30s,58℃30s,72℃40s,共35个循环,最后72℃7min。反应结束后,取50μlpcr扩增产物进行1%琼脂糖凝胶电泳(100v30min),结果如图1所示,经扩增获得了长度为398bp的dna片段,用琼脂糖dna胶回收试剂盒(omega公司)回收、纯化pcr扩增产物,将其连接到载体pmd19-t(购自takara公司)中,将连接产物转化大肠杆菌感受态细胞,用蓝白斑法筛选阳性克隆,对阳性克隆进行测序,测序结果表明经pcr扩增获得了序列正确的耳念珠菌rdna基因(检测基因),其核苷酸序列如seqidno:17所示(seqidno:17为插入到标准品质粒中的检测序列),而且耳念珠菌rdna基因成功连接入载体pmd19-t中的431bp位点和432bp位点之间,与预期结果相符,将携带耳念珠菌rdna基因的重组载体命名为pmd19-t-its1-its4,其物理图谱如图2所示。
tccgtaggtgaacctgcggaaggatcattattgaagctattacaaacactgatttggattttaaaactaacccaacgttaagttcaactaaacaaaacataaaactttcaacaacggatctcttggttctcgcatcgatgaagaacgcagcgaaatgcgatacgtagtatgacttgcagacgtgaatcatcgaatctttgaacgcacattgcgccttggggtattccccaaggcatgcctgtttgagcgtgatgtcttctcaccaatcttcgcggtggcgttgcattcacaaaattacagcttgcacgaaaaaaatctacgctttttttttcgttttgttgtcgcctcaaatcaggtaggactacccgctgaacttaagcatatcaataagcggagga(seqidno:17)。
将携带pmd19-t-its1-its4的阳性克隆接入lb培养基中,在37℃条件下培养15小时,培养结束后用质粒小提试剂盒(omega公司)提取质粒,得到携带耳念珠菌rdna基因的克隆质粒。
用紫外分光光度计对克隆质粒准确定量后,根据以下公式计算出其拷贝数,进行10倍梯度稀释,浓度依次为101、102、103、104、105、106、107拷贝/μl,作为标准品保存于-20℃备用。
分子量=片段大小×660g/(molbp)
3、建立实时荧光定量pcr的标准曲线
每个模板的ct值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,ct值越小。利用已知起始拷贝数的标准品可做出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代表ct值,只要获得未知样品的ct值,即可从标准曲线上计算出该样品的起始拷贝数。
以步骤2获得的拷贝数分别为101、102、103、104、105、106、107拷贝/μl的pmd19-t-its1-its4标准品质粒为模板,在实施例1中引物c.auris-a(seqidno:1)、c.auris-b(seqidno:2)及探针taqmanprobe(c.auris)(seqidno:3)的引导下用罗氏lc96荧光定量pcr仪进行实时荧光定量pcr扩增。20μl实时荧光定量pcr反应体系为:模板1μl,实时荧光定量pcr反应液(takara公司产品,2×premixextaq,内含extaqhs,dntpmixture,mg2+,tlirnaseh等)10μl,无菌水7.4μl,引物加入量为:0.4μl引物c.auris-a(10μm),0.4μl引物c.auris-b(10μm),taqman探针加入量为:0.8μltaqmanprobe(c.auris)(10μm)。实时荧光定量pcr反应条件为:先95℃30s;然后95℃5s,58℃30s,共40个循环。在每个循环的延伸结束时进行荧光信号检测。
结果显示,各稀释度的pmd19-t-its1-its4均能产生荧光信号,扩增曲线如图3所示(从左至右依次为以101、102、103、104、105、106、107拷贝/μl标准品质粒为模板的扩增曲线),从不同浓度起始模板的扩增曲线可以看出,s型曲线基线平整,指数区明显,斜率较大,平台区基本汇于一起,这些均说明在引物c.auris-a、c.auris-b及探针taqmanprobe(c.auris)的引导下模板的扩增是较为理想的。以起始模板拷贝数的对数为x轴,以107-101拷贝/μl耳念珠菌标准品质粒ct值为y轴绘制标准曲线(样品线性回归与预期浓度相关系数r值为0.92以上),标准曲线如图4所示(横坐标为标准品拷贝数q的对数值(log10),纵坐标为ct值),标准曲线相关系数为1,误差小,由标准曲线得到的线性方程为:y=-3.3239log10(q)+40.26。
4、样品检测
用ctab法提取待测样品的基因组dna(模板),每个样品设3个复孔,同时设阴性对照(不加模板,ntc),用步骤3中的反应体系及反应条件进行耳念珠菌的实时荧光定量pcr检测。将样品的ct值代入标准曲线的直线回归方程式,计算出样品拷贝数,再乘以稀释倍数再除以10,即为样品中耳念珠菌dna的拷贝数。
实施例3检测耳念珠菌实时荧光定量pcr检测方法的特异性
分别以烟曲霉、黄曲霉、黑曲霉、土曲霉、构巢曲霉、杂色曲霉、白色念珠菌、热带念珠菌、近平滑念珠菌、克柔念珠菌、光滑念珠菌、浅白隐球菌、指甲隐球菌、新生隐球菌、桔青霉、马内菲青霉、棘状外瓶霉、皮炎外瓶霉、荚膜组织胞浆菌、尖孢镰刀菌、红色毛癣菌、金黄色葡萄球菌、鲍曼不动杆菌(以上菌株均来自中国人民解放军疾病预防控制所医院感染监督中心)、人a549细胞基因dna为模板,以耳念珠菌两个临床株基因组dna为阳性对照,以无菌去离子水为阴性对照,检测本发明耳念珠菌实时荧光定量pcr检测方法的特异性。实时荧光定量pcr检测的反应体系及反应条件与实施例2中步骤3相同。
特异性检测结果如图5所示,可以看出,只有以两个耳念珠菌临床株基因组dna为模板会出现明显的s型扩增曲线(阳性),以其它菌和人(human)的基因组dna为模板均无典型扩增曲线(阴性),空白对照也无典型扩增曲线(阴性),与预期结果相符,表明本发明的检测方法具有较高的特异性。
实施例4制备用于耳念珠菌实时荧光定量pcr检测的试剂盒
本发明提供的试剂盒包括:用于对耳念珠菌进行实时荧光定量pcr检测的引物和taqman探针,上游引物(c.auris-a,seqidno:1),下游引物(c.auris-b,seqidno:2),taqman探针(taqmanprobe(c.auris),seqidno:3)。
具体的,将10μl实时荧光定量pcr反应液(2×premixextaq,内含extaqhs,dntpmixture,mg2+,tlirnaseh等),7.4μl无菌水,0.4μl(10μm)引物c.auris-a(seqidno:1),0.4μl(10μm)引物c.auris-b(seqidno:2),0.8μl(10μm)taqman探针taqmanprobe(c.auris)(seqidno:3),作为阳性对照的携带耳念珠菌rdna基因的克隆质粒(pmd19-t-its1-its4),以及作为阴性对照的双蒸水或无菌去离子水(优选)共同包装,得到用于20μl反应体系的耳念珠菌的实时荧光定量pcr检测试剂盒。
该耳念珠菌实时荧光定量pcr检测试剂盒可参考实施例2的方法使用。
对比例
实时荧光定量pcr检测的反应体系及反应条件与实施例2中步骤3基本相同,区别仅在于:所采用引物探针为表1中的引物探针组合1至8。
表1:耳念珠菌实时荧光定量pcr检测的引物及taqman探针组合
检测结果:敏感性分析结果如图6(同一耳念珠菌基因组dna为模板的扩增曲线)所示,发现当反应体系采用引物探针组合时,敏感性显著最高。
结论:利用本发明的引物探针组合1进行耳念珠菌的实时荧光定量pcr检测,灵敏度显著更高,可用于临床、科研以及生产中对耳念珠菌进行检测分析。
此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。在本发明的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
sequencelisting
<110>中国人民解放军疾病预防控制中心
<120>耳念珠菌的实时荧光定量pcr检测试剂盒及其专用引物、taqman探针
<130>pidc3193226
<160>17
<170>patentinversion3.3
<210>1
<211>22
<212>dna
<213>artificial
<220>
<223>上游引物c.auris-a
<400>1
tgatgtcttctcaccmatcttc22
<210>2
<211>17
<212>dna
<213>artificial
<220>
<223>下游引物c.auris-b
<400>2
tgaggcgacacaaaacg17
<210>3
<211>25
<212>dna
<213>artificial
<220>
<223>taqmanprobe(c.auris)
<400>3
aatcttcgcggtggcgttgcattca25
<210>4
<211>22
<212>dna
<213>artificial
<220>
<223>引物探针组合2c.auris-a
<400>4
tgatgtcttctcaccaatyttc22
<210>5
<211>22
<212>dna
<213>artificial
<220>
<223>引物探针组合3c.auris-a
<400>5
tgatgtcttctcaccaatcttc22
<210>6
<211>18
<212>dna
<213>artificial
<220>
<223>引物探针组合3c.auris-b
<400>6
tgaggcgacaacaaaacg18
<210>7
<211>21
<212>dna
<213>artificial
<220>
<223>引物探针组合4c.auris-a
<400>7
ggattttaaaactaacccaac21
<210>8
<211>19
<212>dna
<213>artificial
<220>
<223>引物探针组合4c.auris-b
<400>8
ggcgacaacaaaacgaaaa19
<210>9
<211>20
<212>dna
<213>artificial
<220>
<223>引物探针组合5c.auris-a
<400>9
tgtcttctcaccaatcttcg20
<210>10
<211>19
<212>dna
<213>artificial
<220>
<223>引物探针组合6c.auris-a
<400>10
tcttctcaccaatcttcgc19
<210>11
<211>20
<212>dna
<213>artificial
<220>
<223>引物探针组合6c.auris-b
<400>11
gatttgaggcgacaacaaaa20
<210>12
<211>21
<212>dna
<213>artificial
<220>
<223>引物探针组合7c.auris-a
<400>12
ttgcattcacaaaattacagc21
<210>13
<211>18
<212>dna
<213>artificial
<220>
<223>引物探针组合7c.auris-b
<400>13
ctgatttgaggcgacaac18
<210>14
<211>24
<212>dna
<213>artificial
<220>
<223>引物探针组合8c.auris-a
<400>14
ttggattttaaaactaacccaacg24
<210>15
<211>21
<212>dna
<213>artificial
<220>
<223>引物探针组合8c.auris-b
<400>15
cgtgcaagctgtaattttgtg21
<210>16
<211>24
<212>dna
<213>artificial
<220>
<223>引物探针组合8tapmanprobe
<400>16
tgaatgcaacgccaccgcgaagat24
<210>17
<211>398
<212>dna
<213>artificial
<220>
<223>耳念珠菌rdna检测基因
<400>17
tccgtaggtgaacctgcggaaggatcattattgaagctattacaaacactgatttggatt60
ttaaaactaacccaacgttaagttcaactaaacaaaacataaaactttcaacaacggatc120
tcttggttctcgcatcgatgaagaacgcagcgaaatgcgatacgtagtatgacttgcaga180
cgtgaatcatcgaatctttgaacgcacattgcgccttggggtattccccaaggcatgcct240
gtttgagcgtgatgtcttctcaccaatcttcgcggtggcgttgcattcacaaaattacag300
cttgcacgaaaaaaatctacgctttttttttcgttttgttgtcgcctcaaatcaggtagg360
actacccgctgaacttaagcatatcaataagcggagga398
- 还没有人留言评论。精彩留言会获得点赞!