吡啶鎓、喹啉鎓、吖啶鎓、吡喃鎓、苯并吡喃鎓或呫吨鎓反应性解吸和/或激光烧蚀电离基质及其用途的制作方法
本发明涉及有机化学化合物及此类化合物作为用于解吸和/或激光烧蚀电离谱测定法的反应性基质的用途。
背景技术:
先进的质谱测定法技术已经彻底改变了生物分子的分析。田中耕一因其发展质谱测定法中的软激光解吸技术而获得2002年诺贝尔化学奖。这些发展为当今许多利用激光解吸和/或烧蚀电离的强大质谱技术奠定了基础,包括最广泛使用的大分子的ms分析技术之一:基质辅助激光解吸电离(maldi-ms)。
maldi主要依赖于过量的辅助基质与分析物的共结晶。所得到的晶体的浅层被来自短激光脉冲的辐射所烧蚀,从而导致部分电离和样品的检测。已经很好地确立了有效的辅助基质必须在脉冲激光的波长下表现出强的光吸收(典型地,氮为337纳米,或nd:yag激光器为355纳米)。此外,它需要在溶剂蒸发后有效地与分析物分子共结晶,并促进气相中分析物的阳离子化(质子化)。因为这个原因,最常用的正离子模式maldi-ms基质例如α-氰基-4-羟基肉桂酸(chca)和2,5-二羟基苯甲酸(dhb)是促进质子转移的酸性化合物,并且它们在290-370纳米范围内具有高光学吸收率以将激光能量转移至分析物。
maldi和类似的技术使用激光能量吸收基质,以挥发和电离样品分子,用于随后的质谱仪检测。将分析物与过量的合适基质材料混合,基质材料通常是肉桂酸、苯甲酸或吡啶甲酸衍生物。激光然后用于照射基质/分析物混合物。该基质通常在激光波长下具有很强的光吸收,因此有助于在基质/分析物晶体的表面解吸和烧蚀。现在处于气相的分析物分子通常被酸性气相基质分子质子化,然后所得的带电分析物分子可以被加速到以正离子模式运行的质谱仪。许多种类的化合物可以用maldi-ms分析,包括但不限于蛋白质、肽、核苷酸、寡核苷酸、脂质、多糖和寡糖,更不用说小分子如代谢物和神经递质。
maldi和类似的技术甚至可以用作成像技术(质谱测定法成像,msi),用于识别和绘制具有接近细胞的空间分辨率的组织切片中的分子分布。
然而,maldi-ms和msi有许多缺点,包括在低分子量区域(100–600da),对某些化合物类别和maldi基质的信号干扰相对不敏感。为了解决这些问题,已经研究了使用吡喃鎓盐如四氟硼酸2,4-二苯基-吡喃鎓盐(dpp-tfb)对伯胺如神经递质进行原位化学衍生。这项工作在shariatgorji等人的neuron2014,84,697-707和shariatgorji等人的j.amsoc.massspectrom.2015,26(6),934-939中有所描述。dpp-tfb选择性地与伯胺反应,在温和的条件下生成n-烷基或n-芳基吡啶鎓衍生物。这些带电的衍生物有足够的激光解吸和电离效率,从而能够检测内源性小分子伯胺,如各种神经递质。此外,dpp-tfb衍生物经历了自辅助激光解吸电离,即不需要单独的基质分子,因为dpp-tfb盐本身充当“反应性基质”。
仍然需要用于质谱测定法检测的电离分子的改进方法。
技术实现要素:
本发明的发明人已经确定了通过用于质谱测定法的解吸和/或激光烧蚀电离分子的现有技术方法的许多缺点。
在现有技术中,吡喃鎓的二苯基衍生物(dpp)已被用作含伯胺基团的maldi和maldi-msi的反应基质。然而,许多小分子,如药物及其代谢物、内源性代谢物、神经递质及其代谢物、生物标志物、毒素和天然化合物不含伯胺,因此不适合这一技术。此外,使用dpp需要在被50%甲醇饱和的室内进行强力孵育。这增加了在maldi-ms中样品扩散和在maldi-msi中靶标化合物离域的风险。此外,基于吡喃鎓的反应性基质如dpp缺乏识别所生成离子的有效手段。
本发明的目的是提供用于解吸和/或激光烧蚀的装置,其克服或至少减轻一个或多个上述缺点。
这些目的通过使用根据所附权利要求的式i的化合物作为解吸和/或激光烧蚀电离谱测定法的反应性基质来实现。
式i的化合物具有下列结构:
其中
–ar1任选地被取代并且选自由以下组成的组中:苯基、联苯基、三联苯基、c10–c30多环芳烃和c4–c30单环或多环杂芳基;
–l–选自键、–(ch2)m–或任何π共轭连接体部分;
–g1选自–h、–me或–ar2;
–r为任选用一个或多个d、t或13c原子标记的c1–c15烷基;
–g2选自由以下组成的组中:–f、–cl、–br、–i、–no2、–cn、–or′、–oc(o)r′、–sr′、–s(o)r′、–s(o)(o)r′、–nr′r″和–(ch2)n–z–nh–nh2;
–r′和–r″各自独立地选自苯基、甲苯基和c1–c15烷基;
m和n各自独立地为0至15;
–z–选自键、–ch2–或–c(o)–;
–g3选自–h、–me或–ar3;
–ar2和–ar3中的每一个任选地独立地被取代并且独立地选自由以下组成的组中:苯基、联苯基、三联苯基、c10–c30多环芳烃和c4–c30单环或多环杂芳基;
条件是:当
如上所限定的式i的化合物作为用于解吸和/或激光烧蚀电离质谱测定法的反应性基质的用途具有许多有利特征。反应性基质可以靶向以前已知的反应性基质不能接触到的许多物质。因此,例如,除了伯胺之外,活性基质还可以与仲胺、酚氢氧化物、醛和酮反应。反应性基质可能不需要任何温育,反应在将反应性基质添加/点样/喷洒到样品上时发生,而不需要任何冷却或加热。所有的反应性基质在与靶分子反应时形成带电衍生物,因此增加了对靶分子的质谱灵敏度。此外,其他识别手段,如特定的同位素标记,可以引入到反应性基质中。
式i的化合物可以具有ia或ib,
其中
根据另一方面,本发明的目的通过根据所附权利要求的式ii的化合物来实现。
式ii的化合物具有下列结构:
其中
–ar1任选地被取代并且选自由以下组成的组中:联苯基、三联苯基、c10–c30多环芳烃和c6–c30多环杂芳基;
–l–选自键、–(ch2)m–或任何π共轭连接体部分;
–g1选自–h、–me或–ar2;
–r为任选地被一个或多个d、t或13c原子标记的c1–c15烷基;
–g2选自由以下组成的组中:–f、–cl、–br、–i、–no2、–cn、–or′、–oc(o)r′、–sr′、–s(o)r′、–s(o)(o)r′、–nr′r″和–(ch2)n–z–nh–nh2;
–r′和–r″各自独立地选自苯基、甲苯基和c1–c15烷基;
m和n各自独立地为0至15;
–z–选自键、–ch2–或–c(o)–;
–g3选自–h、–me或–ar3;
–ar2和–ar3中的每一个任选地独立地被取代并且独立地选自由以下组成的组中:苯基、联苯基、三联苯基、c10–c30多环芳烃和c4–c30单环或多环杂芳基;
条件是:当
ar1、ar2或ar3中的至少一个被氯、溴、氘或氚取代。
位于吡喃鎓环的4-位意味着位于与吡喃鎓环的氧完全相反的环位置,而不管吡喃鎓环是单环吡喃鎓、苯并吡喃鎓还是二苯并吡喃鎓环体系。式ii的化合物的优点类似于如上所述使用式i的化合物作为解吸和/或激光烧蚀电离谱测定法的反应性基质的优点。此外,式i和/或式ii的化合物可用于进一步的光谱或光谱测定方法,其中用发色团标记分子和/或对分子进行电荷标记可能被证明是有用的。这些方法包括紫外光谱和紫外成像,以及其他质谱方法,如电喷雾电离。
式ii的化合物可以具有式iia或iib,
其中
根据另一方面,本发明的目的通过使用根据所附权利要求的式iii的化合物作为用于解吸和/或激光烧蚀电离谱测定法的反应性基质来实现。
式iii的化合物具有下列结构:
其中:
–g1选自–h、–me或–ar2;
–r为任选地被一个或多个d、t或13c原子标记的c1–c15烷基;
–g2选自由以下组成的组中:–f、–cl、–br、–i、–no2、–cn、–or′、–oc(o)r′、–sr′、–s(o)r′、–s(o)(o)r′和–nr′r″以及–(ch2)n–z–nh–nh2;
–r′和–r″各自独立地选自苯基、甲苯基和c1–c15烷基;
m和n各自独立地为0至15;
–z–选自键、–ch2–或–c(o)–;
–g3选自–h、–me或–ar3;并且
–ar2和–ar3中的每一个任选地独立地被取代并且独立地选自由以下组成的组中:苯基、联苯基、三联苯基、c10–c30多环芳烃和c4–c30单环或多环杂芳基。
式iii的化合物的优势类似于如上所述使用式i或ii的化合物作为用于解吸和/或激光烧蚀电离谱测定法的反应性基质的优势。然而,式iii的化合物还可以具有原子经济性提高和/或易于制造的优点。
式iii的化合物可以具有式iiia或iiib。
以下考虑和阐述同样适用于式i、ia、ib、iii、iiia和/或如上所述的化合物的使用,就像它们与如上所述的式ii、iia和iib的化合物一样,除非另有说明或与如上所述的式i、ia、ib、ii、iia、iib、iii、iiia和iiib的定义相冲突。
ar1、ar2和ar3中的每一个可任选地独立地被选自由以下组成的组中的一个或多个取代基取代:–d、–t、–f、–cl、–br、–i、–no2、–cn、–r″′、–or″′、–oc(o)r″′、–sr″′、–s(o)r″′、–s(o)(o)r″′和–nr″′r″″,其中–r″′和–r″″各自独立地选自苯基、甲苯基和c1–c15烷基。此类取代基可能影响所讨论的ar基团的共轭程度,以及其供电子或吸电子性质。以此方式,可以调节化合物的反应性和解吸/烧蚀性质。例如,ar1可任选地被一个或多个–ph、–cl或–br基团取代。
ar1可选自由以下组成的组中:联苯基、三联苯基、萘、蒽、菲和芘。这些芳族基团已被证明能为化合物提供足够的解吸/烧蚀性质,以用作解吸和/或激光烧蚀电离谱测定法的反应性基质。
如果–l–为π共轭连接体部分,其可选自由以下组成的组中:–o–、–s–、–nh–、
–l–可以优选为键,即在ar1基团和化合物的带电芳环之间的直接键。这允许ar1基团和化合物的带电芳环之间的共轭,而不增加化合物的分子量。
–g1可以为–h。–g1可以为任选地被一个或多个–br取代基取代的苯基。由于溴化物取代基的特征同位素模式和质量亏损,这使得容易识别由化合物衍生的分子。
在一些实施方式中,式i、ia、ib、ii、iia或iib的化合物可以为
在一些实施方式中
在一些实施方式中,
根据以下详细描述,本发明的其他目的、优势和新颖性特征对于本领域技术人员来说将变得显而易见。
附图说明
为了更全面地理解本发明及其进一步的目的和优点,下面给出的详细描述应该与附图一起阅读,在附图中,相同的附图标记表示各种图中相似的项目,其中:
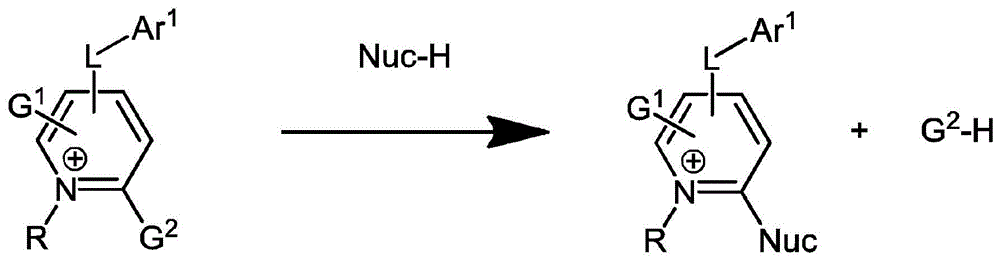
图1a示意性地说明了使用基于2-取代的n-烷基吡啶鎓的反应性基质对亲核试剂的衍生化。
图1b示意性地示出了使用基于肼的反应性基质对含羰基化合物的衍生化。
图1c示意性地说明了使用基于吡啶鎓的反应性基质的伯胺的衍生化。
图2a示意性地说明了生产基于2-取代的n-烷基吡啶鎓的反应性基质的一般合成方法。
图2b示意性地说明了可通过图2a所示的一般合成方法生产的一系列2-取代的n-烷基吡啶鎓化合物。
图3示意性说明了生产具有肼反应性部分的n-取代的吡啶反应性基质的一般合成方法。
图4是maldi质谱图,显示了11-脱氧皮质酮的腙衍生物的检测,而没有添加任何额外的辅助基质。
图5是显示了小鼠脑组织切片中氟伏沙明的maldi-msi分析的一系列图像(a)-(f)。
具体实施方式
本发明的反应性基质可有助于多种化合物的质谱分析,例如maldi-ms(i)和desi-ms(i)分析,所述化合物包括药物及其代谢物、内源性神经递质、氨基酸、代谢物、类固醇、毒素以及环境污染物、食品添加剂、食品成分和任何其它含有伯胺和仲胺、酚氢氧化物和羰基官能团的小分子。本发明的反应性基质是在以下领域对上述化合物进行快速监测/分子成像的重要工具,例如:普通生物学、普通医学、神经科学、癌症研究、药物开发、毒理学、环境科学和食品化学。
反应性基质适用于利用解吸和/或激光烧蚀的大范围质谱(ms)和质谱成像(msi)技术。这些技术包括但不限于:
基质辅助型激光解吸/电离(maldi-ms、maldi-msi);
解吸电喷雾电离(desi-ms、desi-msi);
基质辅助型激光解吸电喷雾电离(maldesi-ms、maldesi-msi);
纳米喷雾解吸电喷雾电离(nano-desi-ms、nano-desi-msi);
二次离子质谱测定法(sims、sims-msi);
基质增强型二次离子质谱测定法(me-sim、me-sims-msi);和
激光烧蚀电喷雾电离(laesi-ms、laesi-msi)。
反应性基质也可用于其他形式的光谱学或质谱测定法。例如,它们可以用于在紫外光谱或紫外成像之前用发色团标记分子。它们还可用于在使用电喷雾电离(esi)进行质谱测定法之前向分子提供永久电荷(“电荷标记”),因此可用于包含esi或maldi的液体萃取表面分析(lesa)。
反应性基质是指可以与一种或多种靶分析物分子反应并促进靶分子的质谱分析的化合物。在某些情况下,使用反应性基质可以完全避免使用另一种基质来辅助电离的需要。然而,在某些情况下,反应性基质也可以与常规的非反应性基质一起使用,以提高对靶分子的检测。
本文公开的反应性基质包含至少两个功能域:通过衍生化促进共价分析物电荷标记的高反应性域;和共轭发色团域以促进激光辅助型解吸和/或烧蚀。然而,在反应域是多环环体系的一部分的一些情况下,反应域和共轭发色团域可以整合在同一个环体系中。反应性基质也可以包含识别域;也就是说,合适的同位素或元素具有独特的同位素模式和质量亏损,以便于质谱鉴定由反应性基质衍生的化合物。
反应域
反应基质的反应域可以是具有合适离去基团的n-烷基吡啶鎓部分、具有肼部分的n-取代的吡啶、或吡喃鎓部分。由于衍生化后存在一个氮取代的吡啶部分,所有这些反应域都具有在衍生化后为分析物提供永久正电荷的优势。这极大地提高了分析物对正离子质谱测定法的灵敏度,尤其是对于难以质子化的分析物。
具有合适离去基团的反应性n-烷基吡啶鎓部分可以选择性地与包含多种常见亲核官能团中的任何一种的分子反应,所述亲核官能团包括酚羟基以及伯胺和仲胺。图1a显示了证明这种衍生化反应的反应方案。反应的发生不需要任何延长的孵育时间。n-烷基吡啶的离去基团(g2基团)可以是亲核芳族取代的任何合适的离去基团。此类离去基团包括–f、–cl、–br、–i、–no2、–cn、–or′、–oc(o)r′、–sr′、–s(o)r′、–s(o)(o)r′和–nr′r″,其中r′和r″各自独立地为苯基或c1–c15烷基。离去基团可以适当地位于吡啶环的2位或4位,这被认为是亲核芳族取代(snar)最具反应性的位置。然而,离去基团在3-位的排列已被证明也提供了足够的反应性,至少在某些情况下。n-烷基如下所述。
如图1b所示,具有反应性肼部分的氮取代吡啶可以选择性地与任何具有羰基官能团的分析物反应。反应进行得很快。肼部分通过连接体结合到吡啶环的n位或另一个位置,如2位或4位。连接体可以合适地是烷基链,任选地包含最接近肼部分的羰基。或者,连接体可以是在n取代的吡啶和肼部分的氮之间的直接键。如果肼部分(通过连接体)结合到吡啶环的碳上,吡啶环的n位被烷基化,以提供永久带电的n烷基吡啶。
吡啶反应域的n-烷基可以是任何合适的基团,如c1–c15烷基。例如,通过在特定位置具有丰富的2h、3h、13c或14c,可以使n-烷基富含同位素。这有助于通过质谱测定法衍生的分析物的鉴定。n-烷基可以是手性基团,允许分析物之间的立体异构区分。当反应域是2-取代的n-烷基吡啶鎓时,为了能够在吡啶环的2位进行亲核取代反应,n-烷基优选是非大体积的。例如,n-烷基可以是甲基。
吡喃鎓反应性部分可以选择性地与具有伯胺官能团的分析物反应,产生如图1c所示的n-烷基吡啶衍生物。该反应可能需要相当长的孵育时间,这取决于吡喃鎓部分和分析物的确切性质。
共轭发色团域
反应性基质的共轭发色团域包含选自由以下组成的组中的ar1基团:苯基、联苯基、三联苯基、c10–c30多环芳烃和c4–c30单环或多环杂芳基。多环芳烃是指包含两个或更多个稠环的碳环芳环体系。合适的多环芳烃例如在nist特别出版物922(2011年6月修订版)“多环芳烃结构指数”中被列为结构号4-521,该文献在此引入作为参考。多环芳烃可以例如选自由以下组成的组中:萘、氟、蒽、菲、芘、并四苯、
ar1基团可以提供有一个或多个取代基以调整反应性基质的性质。适合的取代基例如可包括–d、–t、–f、–cl、–br、–i、–no2、–cn、–r″′、–or″′、–oc(o)r″′、–sr″′、–s(o)r″′、–s(o)(o)r″′和–nr″′r″″,其中–r″′和–r″″各自独立地选自苯基、甲苯基和c1–c15烷基。
“共轭发色团域”是指发色团包含共轭π-体系,而不一定是发色团与反应域共轭。然而,为了提供合适的吸收率,共轭体系可以延伸到衍生的分析物的吡啶/吡喃鎓环。这在ar1基团本身不具有足够扩展的π-体系以吸收上述波长的情况下尤其优选。这是通过使用π共轭连接体部分将ar1基团连接到吡啶或吡喃鎓部分上来实现的。π共轭连接体部分意指在ar1基团和吡啶/吡喃鎓部分之间提供不间断的π共轭路径,即ar1基团和吡啶/吡喃鎓部分之间的直接键,或在直接连接ar1基团至吡啶/吡喃鎓部分的路径中仅包含sp和/或sp2杂化原子的部分。这样的部分可以如上所述是ar1基团和吡啶/吡喃鎓部分之间的直接键,或它可以为选自由以下组成的组中的部分:–o–、–s–、–nh–、
可选择适合的g1基团来调整反应性基质的发色团和反应性质。g1可选自–h、–me或–ar2,其中–ar2任选地被取代并且选自由以下组成的组中:苯基、联苯基、三联苯基、c10–c30多环芳烃和c4–c30单环或多环杂芳基。如果g1为芳基(ar2),则这可进一步将π共轭扩展到g1基团,从而改变反应性基质的吸收率。当g1为ar2基团时,通过给–ar2基团提供一个或多个取代基,可进一步调节反应性基质的反应性和发色团性质。适合的取代基可以包括–d、–t、–f、–cl、–br、–i、–no2、–cn、–r″′、–or″′、–oc(o)r″′、–sr″′、–s(o)r″′、–s(o)(o)r″′和–nr″′r″″,其中–r″′和–r″″各自独立地选自苯基、甲苯基和c1–c15烷基。
当反应域为吡喃鎓部分时,可选择适合的g3基团来调整反应性基质的发色团和反应性质。如上所述,g3基团可独立地选自与g1相同的取代基。
整合的反应域和共轭的发色团域
在一些情况下,其中反应域是多环环体系的一部分,由于反应域本身具有足够好的发色团性质,因此可能不需要单独的共轭发色团域,即反应域和共轭发色团域可以整合到同一个环体系中。例如,这可能是反应域是稠合的n-烷基吡啶鎓部分的情况,例如n-烷基吖啶部分或n-烷基喹啉部分。这种集成体系可以提供提高的原子经济性。
识别域
反应性基质可以提供有识别域,该识别域有助于用反应性基质电荷标记的分析物的质谱识别。这可以例如通过在反应性基质上提供氯或溴取代基来实现,因为这些原子提供了独特的质谱同位素模式和质量亏损。或者,反应性基质可以是通过用氘、氚或用碳同位素如13c或14c富集的烷基或芳基取代而富集的同位素。通过标记的、同位素富集的或被特定同位素取代的,意味着特定同位素(例如,2h、3h、13c或14c)在分子中某一位置的出现大大超过了在该位置自然出现的丰度。例如,“识别”同位素(例如2h、3h、13c或14c)与相关位置处最丰富的天然存在的同位素(例如1h或12c)的比率可以是至少1∶10,如至少1∶1或至少10∶1。
反应性基质具有永久正电荷,因此可以与一种或多种阴离子抗衡离子制成盐。这种盐可以例如包含一种或多种阴离子,其选自由氯化物、溴化物、碘化物、甲苯磺酸盐、甲磺酸盐、四氟硼酸盐、全氟丁磺酸盐、苯磺酸盐、六氟磷酸盐和三氟甲磺酸盐组成的非穷举组。
反应性基质在解吸和/或激光烧蚀电离质谱测定法中的应用
当准备用于质谱测定分析或成像的样品时,反应性基质物质在大多数情况下不需要与样品一起孵育。当试剂被添加/点样/喷洒到样品上时,反应同时发生,而无需任何冷却或加热。根据反应域的性质,反应性基质以具有伯胺、仲胺、酚氢氧化物、醛或酮官能团的物质为目标。所有的反应性基质在与分析物的官能团反应后都带有永久正电荷。这允许衍生的分析物的高灵敏度检测和分析。
实施例
实施例1:2-取代的n-烷基吡啶鎓反应性基质的合成
2-取代的n-烷基吡啶鎓活性基质通过模块化合成路线合成,如图2a示意性所示。这两个域(发色团域和反应域)在步骤a中使用suzuki-miyara交叉偶联反应进行融合。因此,在钯催化下用一系列芳基硼酸处理合适的2-取代的溴吡啶衍生物提供了中等至优异产率的前体化合物。这些前体可以在任选的步骤b中用n-溴代琥珀酰亚胺进行区域选择性溴化,以引入识别域。然后在步骤c中在热条件下将前体烷基化,得到所需的反应基质。通过这种方法产生的反应性基质的选择如图2b所示。值得注意的是,最终的化合物很容易通过简单的过滤分离出来,这就不需要进行可能有问题的纯化步骤。发现这些化合物在真空下储存数月后是稳定的,但是在溶液中储存时降解缓慢。
以2-氟-4-苯基吡啶为例的2-氟吡啶合成的一般程序a
所有试剂均以最高的商业质量购买,且无需进一步纯化即可使用。除非另有说明,产率是指分离的、同质的和光谱纯的材料。粗反应混合物通过硅胶色谱(e.merck硅胶,粒径0.043-0.063mm)纯化。使用带有紫外光(254纳米)的e.merck二氧化硅板(60f-254)作为显像剂进行薄层色谱。在400mhz记录1hnmr谱,在100mhz记录13c{1h}nmr谱。1h核磁共振和13c{1h}nmr谱的化学位移通过残留溶剂信号(1h,7.26ppm的cdcl3,2.05ppm的丙酮-d6,1.95ppm的cd3cn;13c77.16ppm的cdcl3,29.9ppm的丙酮-d6,1.39ppm的cd3cn)参考四甲基硅烷。lc/ms分析在配备c18色谱柱(50×3.0mm,粒径2.6μm,孔径
向4-溴-2-氟吡啶(528mg,3mmol)、苯基硼酸(399mg,3.3mmol)、pd(pph3)4(69mg,0.06mmol)在甲苯/乙醇(4∶1,25ml)中的搅拌溶液中加入na2co3(1.27g,12mmol)在水(10ml)中的溶液。将所得黄色溶液在80℃搅拌2小时,在此期间溶液变黑。冷却至室温后,用etoac(3x50ml)萃取反应混合物。合并的有机层用盐水(50ml)洗涤,用硫酸镁干燥,过滤并真空浓缩。粗产物通过从甲醇中热过滤,然后通过硅胶色谱(5%etoac的正戊烷溶液)纯化为为淡黄色固体的标题化合物(490mg,2.8mmol,94%)。
以4-(10-溴蒽-9-基)-2-氟吡啶为例的2-氟吡啶溴化的任选一般程序b
向搅拌的4-(蒽-9-基)-2-氟吡啶(715mg,2.75mmol)的chcl3(35ml)溶液中加入n-溴代琥珀酰亚胺(1.08g,6.07mmol),并且所得溶液回流48小时。冷却至室温后,混合物用水(25ml)稀释并用ch2cl2(3x25ml)萃取。合并的有机层用硫酸镁干燥,过滤并真空浓缩。通过快速柱色谱(sio2,etoac:甲苯:戊烷5:15:80(v/v/v))纯化得到为黄色固体的标题化合物(784mg,85%)。
制备以2-氟-1-甲基-4-苯基吡啶-1-碘化鎓为例的n-烷基芳基氟吡啶鎓盐的一般程序c
将2-氟-4-苯基吡啶(200mg,1.15mmol)溶解在mei(2ml)中,并且所得溶液在60℃的密封小瓶中加热72小时。过滤收集所得沉淀物,用乙醚(3×5ml)和丙酮(2ml)洗涤,并且真空干燥,得到为黄色固体的标题化合物(273mg,0.87mmol,75%)。这些化合物很容易与任何亲核溶剂反应,因此应进行相应的处理。
下列化合物举例说明了可通过上述一般方法制备的反应性基质:
2-氟-1-甲基-4-苯基吡啶-1-鎓碘化物(2)
按照一般程序a和c,由2-氟-4-溴吡啶开始制备。1hnmr(400mhz,cdcl3/cd6co):δ9.25–9.11(m,1h),8.42–8.33(m,2h),8.11–8.00(m,2h),7.72–7.57(m,3h),4.48(d,j=3.7hz,3h)。
13cnmr(100mhz,cdcl3/cd6co):δ161.7(d,j=11.4hz),144.6(d,j=7.2hz),132.8,129.7,128.1,121.1(d,j=3.0hz),110.2(d,j=21.5hz),41.2(d,j=5.2hz)。
精确质量(maldi,m/z):c12h11fn([m+])计算值:188.0870,实测值m/z188.0877。
2-氟-1-甲基-4-(萘-2-基)吡啶-1-鎓碘化物(3)
按照一般程序a和c,由2-氟-4-溴吡啶开始制备。1hnmr(400mhz,cdcl3/cd6co):δ8.90(dd,j=6.7,4.9hz,1h),8.62(d,j=2.0hz,1h),8.36(dd,j=6.7,2.1hz,1h),8.24(dd,j=5.7,2.1hz,1h),8-18–8.14(m,2h),8.10–8.02(m,1h),8.00(dt,j=8.7,2.2hz,1h),7.82–7.66(m,2h),4.36(d,j=3.5hz,3h)。
13cnmr(100mhz,cdcl3/cd6co):δ161.6(d,j=11.7hz),143.6(d,j=6.8hz),135.2,133.0,130.0,129.9,129.4,128.7,127.9,127.7,123.6,121.4(d,j=2.8),111.3(d,j=21.9hz),41.5(d,j=5.0hz)。
精确质量(maldi,m/z):c16h13fn([m+])计算值:238.1027,实测值m/z238.1028。
5-(蒽-9-基)-2-氟-1-甲基吡啶-1-鎓碘化物(4)
按照一般程序a和c,由2-氟-4-溴吡啶开始制备。1hnmr(400mhz,cdcl3/cd6co):δ8.77(s,1h),8.64(ddd,j=8.5,5.6,2.3hz,1h),8.59(dd,j=4.2,2.2hz,1h),8.18(dt,j=8.2,1.3hz,2h),8.05(dd,j=8.7,4.0hz,1h),7.61–7.52(m,6h),4.29(d,j=3.8hz,3h)。
13cnmr(100mhz,cdcl3/cd6co):δ154.4(d,j=11.4hz),145.8(d,j=6.8hz),136.0(d,j=3.8hz),137.6,130.8,130.4,129.5,127.9,126.6,126.4,125.4,115.5(d,j=20.3hz),42.9(d,j=5.1hz)。
精确质量(maldi,m/z):c20h15fn([m+])计算值:288.1183,实测值m/z288.1179。
2-氟-1-甲基-4-(菲-9-基)吡啶-1-鎓碘化物(5)
按照一般程序a和c,由2-氟-4-溴吡啶开始制备。
1hnmr(400mhz,cdcl3/cd6co):δ8.85–8.79(m,1h),8.78–8.69(m,2h),8.05–8.02(m,2h),8.00(dd,j=5.0,1.9hz,1h),7.96(s,1h),7.88(dd,j=8.2,1.2hz,1h),7.84–7.77(m,2h),7.74–7.66(m,2h),4.30(d,j=3.6hz,3h)。
13cnmr(100mhz,cdcl3/cd6co):δ163.4(d,j=11.5hz),143.9(d,j=6.7hz),132.3(d,j=1.9hz),131.7,131.2,130.9,130.8,130.1,129.7,128.6,128.5,128.4,128.3,125.8(d,j=3.2hz),125.6,124.3,123.5,115.5(d,j=20.5hz),42.3(d,j=5.0hz)。
精确质量(maldi,m/z):c20h16fn([m+])计算值:288.1183实测值m/z288.1177。
4-([1,1':3',1”-三联苯基]-5'-基)-2-氟-1-甲基吡啶-1-鎓碘化物(6)
按照一般程序a和c,由2-氟-4-溴吡啶开始制备。1hnmr(400mhz,cdcl3/cd6co):δ8.71–8.68(m,1h),8.31(dd,j=6.7,2.0hz,1h),8.26(dd,j=5.7,2.0hz,1h),8.13–8.10(m,1h),8.10(d,j=1.7hz,2h),7.80–7.76(m,4h),7.55–7.49(m,4h),7.49–7.41(m,2h),4.23(d,j=3.6hz,3h)。
13cnmr(100mhz,cdcl3/cd6co):δ162.0(d,j=11.5hz),144.1(d,j=7.0hz),143.8,139.9,134.7(d,j=2.2hz),130.7,129.6,128.9,127.9,126.1,122.2(d,j=3.1hz),111.4(d,j=20.3hz),41.9(d,j=5.1hz)。
精确质量(maldi,m/z):c24h20fn([m+])计算值:340.1496,实测值m/z340.1496
2-氟-1-甲基-4-(10-苯基蒽-9-基)吡啶-1-鎓碘化物(7)
按照一般程序a和c,由2-氟-4-溴吡啶开始制备。1hnmr(400mhz,cdcl3/cd6co):δ8.87–8.84(m,1h),7.98–7.94(m,2h),7.70(dd,j=8.7,1.4,0.8hz,2h),7.68–7.56(m,5h),7.55–7.51(m,2h),7.48–7.39(m,4h),4.38(d,j=3.7hz,3h)。
13cnmr(100mhz,cdcl3/cd6co):δ164.1(d,j=11.5hz),144.8(d,j=6.8hz),141.3,138.3,131.3,130.0,129.3,129.2,128.9,128.7,128.0(d,j=3.5hz),127.9,127.8,126.4,125.2,117.0(d,j=20.9hz),42.4(d,j=5.1hz)。
精确质量(maldi,m/z):c26h19fn([m+])计算值:364.1496,实测值m/z364.1486
4-(10-溴蒽-9-基)-2-氟-1-甲基吡啶-1-鎓(8)
按照一般程序a、b和c,由2-氟-4-溴吡啶开始制备。1hnmr(400mhz,cdcl3/cd6co):δ9.01(t,j=5.6hz,1h),8.53(dd,j=8.9,1.0hz,2h),7.78(dd,j=6.4,1.7hz,1h),7.69(dd,j=4.3,1.7hz,1h),7.56(ddd,j=9.0,6.4,1.2hz,2h),7.50(dd,j=8.7,1.1hz,2h),7.42(ddd,j=8.8,6.4,1.1hz,2h),4.36(d,j=3.7hz,3h)。
13cnmr(100mhz,cdcl3/cd6co):δ161.0(d,j=11.5hz),143.7(d,j=6.5hz),129.2,128.7(d,j=1.6hz),128.6,127.5,127.2,127.1,126.5(d,j=3.4hz),125.4,124.6,124.5,116.6(d,j=16.9hz),41.40(d,j=5.0hz)。
精确质量(maldi,m/z):c20h14brfn([m+])计算值:366.0288,实测值m/z366.0284。
4-(蒽-9-基)-2-氟-1-乙基吡啶-1-鎓(9)
按照一般程序a和c,由2-氟-4-溴吡啶开始并且使用乙基碘作为烷基化剂而进行制备。1hnmr(400mhz,cdcl3/cd6co):9.32(dd,j=6.4,4.8hz,1h),8.67(s,1h),8.12–8.07(m,2h),7.96(dd,j=6.4,1.7hz,1h),7.79(dd,j=4.8,1.7hz,1h),7.64–7.61(m,2h),7.55–7.45(m,4h),4.92(qd,j=7.4,2.4hz,2h),1.81(t,j=7.3hz,3h)。
13cnmr(100mhz,cdcl3/cd6co):δ163.3(d,j=11.3hz),143.5(d,j=6.5hz),130.9,130.5,129.0,128.7,128.1(d,j=1.7hz),127.9(d,j=3.0hz),127.8,125.9,124.4,117.3(d,j=19.5hz),51.8(d,j=4.3hz),14.8(d,j=1.0hz)。
精确质量(maldi,m/z):c21h17fn([m+])计算值:302.1340,实测值m/z302.1334。
4-(蒽-9-基)-2-氟-1-甲基吡啶-1-鎓碘化物(10)
按照一般程序a和c,由2-氟-4-溴吡啶开始制备。1hnmr(400mhz,cdcl3/cd6co):δ8.89(t,j=5.5hz,1h),8.72(s,1h),8.15–8.13(m,2h),7.92–7.90(m,1h),7.87–7.85(m,1h),7.61–7.46(m,6h),4.39(d,j=3.7hz,3h)。
13cnmr(100mhz,cdcl3/cd6co):δ163.7(d,j=11.4hz),144.6(d,j=6.8hz),131.2,130.7,129.4,129.1,128.0,127.7(d,j=3.2hz),126.2,124.8,117.6(d,j=20.9hz),42.4(d,j=5.1hz)。
精确质量(maldi,m/z):c20h15fn([m+])计算值:288.1183,实测值m/z288.1184。
4-(蒽-9-基)-2-氟-1-甲基吡啶-1-鎓三氟甲磺酸盐(11)
按照一般程序a和c,由2-氟-4-溴吡啶开始并且使用三氟甲磺酸甲酯作为甲基化剂而进行制备。
1hnmr(400mhz,cdcl3/cd6co):δ8.81–8.73(m,1h),8.72(s,1h),8.15–8.02(m,2h),7.84(dd,j=6.4,1.7hz,1h),7.78(dd,j=4.6,1.7hz,1h),7.62–7.43(m,6h),4.38(d,j=3.7hz,3h)。
13cnmr(100mhz,cdcl3/cd6co):δ163.7(d,j=11.4hz),144.6(d,j=6.8hz),131.0,130.6,129.1,128.9,128.4,(d,j=3.2hz),126.1,124.4,117.2,42.1(d,j=5.1hz)。
精确质量(maldi,m/z):c20h15fn([m+])计算值:288.1183,实测值m/z288.1176。
实施例2:衍生化模型化合物的maldi-ms灵敏度的测定
为了评价和比较合成物质作为高灵敏度maldi-msi分析的反应性基质的效率,在大鼠对照脑组织切片的皮质区域上发现了具有不同官能团的小分子。在相同的组织切片上,在每个大脑的纹状体区域选择感兴趣的矩形区域。对所有模型物质以及具有不同合成反应性基质的选定纹状体区域进行maldi-msi分析。所有衍生化合物的信噪比(s/n)值都是使用内部开发的软件计算的(kallback,p.,nilsson,a.,shariatgorji,m.&andren,p.e.msiquant--quantitationsoftwareformassspectrometryimagingenablingfastaccess,visualization,andanalysisoflargedatasets.analchem88,4346-4353(2016))。结果如下表1所示。
表1
nd=未检测出(s/n比<3)*=比所用分析物浓度高10倍
da=多巴胺;pea=苯乙胺;epi=肾上腺素;hd=大麦芽碱
从s/n值可以得出结论,乙基化和甲基化的4-(蒽-9-基)-2-氟-1-烷基吡啶-1-鎓的碘化物盐(条目9和10)为测试的模型化合物产生最佳s/n值。将传统的非反应性基质chca和dhb(分别为条目13和12)与新合成的反应性基质进行了比较,它们是用于小分子的最广泛使用的正离子模式非反应性/非选择性maldi-ms辅助基质。表1中的数据显示,与传统的非反应性基质相比,当使用合成的反应性基质时,灵敏度显著提高,从检测苯乙胺的至少10倍到分析多巴胺的约500倍。
实施例3:4-(蒽-9-基)-1-(2-肼基-2-氧代乙基)吡啶-1-鎓的合成
图3显示了合成具有结合在n-吡啶位置的反应性肼部分的反应性基质的一般方法。如下所述,通过合成4-(蒽-9-基)-1-(2-肼基-2-氧代乙基)吡啶-1-鎓来举例说明该程序。然而,请注意,boc-肼可以与酰基卤或除氯乙酰氯以外的烷基卤反应,从而能够提供具有将肼部分结合到吡啶环的氮上的各种烷基链或氧代烷基链的反应性基质。
2-(2-氯乙酰基)肼-1-羧酸叔丁酯
向搅拌的并冷却(0℃)的肼羧酸叔丁酯(1.98g,15mmol,2当量)在dcm(20ml)和吡啶(0.79g,10mmol,1.5当量)中的溶液加入氯乙酰氯(1.12g,10mmol,1.5当量)的dcm(5ml)溶液。将反应混合物搅拌6小时,并用稀释的hcl(50ml)洗涤三次。有机相用na2so4干燥。减压除去溶剂,得到为透明油状物的标题化合物(1.16g,55%)。
4-(蒽-9-基)-1-(2-(2-(叔丁氧基羰基)肼基)-2-氧代乙基)吡啶-1-鎓氯化物
将4-(蒽-9-基)吡啶(0.33g,1.29mmol,1当量,通过上述一般方法a生产)、2-(2氯乙酰基)肼-1-羧酸叔丁酯(0.54g,2.58mmol,2当量)在氯仿(2ml)中的溶液在120℃加热30分钟。将反应混合物放置结晶,过滤固体产物并用乙酸乙酯洗涤。其用蒸气扩散结晶(etoh和乙醚)纯化。黄色产物的产率(0.44g,81%)。
4-(蒽-9-基)-1-(2-肼基-2-氧代乙基)吡啶-1-鎓
在氮气下向4-(蒽-9-基)-1-(2-(2-(叔丁氧基羰基)肼基)-2-氧代乙基)吡啶-1-鎓氯化物(50mg,0.12mmol)在1ml10%meoh的dcm溶液中的搅拌的溶液逐滴加入1ml4mhcl的1,4-二噁烷溶液。将反应混合物在氮气下在室温搅拌过夜。过滤沉淀形式,用etoac洗涤并且干燥。黄色粉末的产率(36mg,94%)。1hnmr(400mhz,dmso-d6)δ9.35(d,j=6.0hz,2h),8.90(s,1h),8.42(d,j=6.3hz,2h),8.25(dd,j=8.3,1.3hz,2h),7.60(m,2h)7.55,7.41(d,2h),5.88(s,2h)。13cnmr(101mhz,dmso-d6)δ164.5,157.2,147.0,131.0,130.8,130.3,129.8,129.4,128.7,127.9,126.3,124.9,60.1。
实施例4:4-(蒽-9-基)-1-(2-肼基-2-氧代乙基)吡啶-1-鎓作为用于11-去氧皮质酮maldi-ms分析的反应性基质的用途
将合成的4-(蒽-9-基)-1-(2-肼基-2-氧代乙基)吡啶-1-鎓反应性基质加入到金属板上11-去氧皮质酮的样品中,所得衍生物通过以正离子模式操作的maldi-ms直接分析。最终的maldi光谱如图4所示。在m/z=640.6时,可以清楚地观察到对应于以腙形式与11-去氧皮质酮结合的反应性基质的峰。为了获得maldi光谱,不需要额外的辅助maldi基质物质。
在没有反应性基质和使用传统的辅助基质物质dhb的对照实验中,在相关样品浓度下观察不到11-去氧皮质酮的信号。
实施例5:进一步吡啶鎓反应性基质的合成和maldi-ms效用
下列化合物举例说明了可通过一般方法a和/或c以及下面描述的方法制备的另外的反应性基质。
4-(二苯并[b,d]噻吩-4-基)-2-氟-1-甲基吡啶-1-鎓碘化物(14)
按照一般程序a和c,由2-氟-4-溴吡啶开始制备。1hnmr(400mhz,cd3cn/cd3cl)δ8.70(dd,j=6.6,5.0hz,1h),8.50(dd,j=7.7,1.3hz,1h),8.38–8.30(m,1h),8.28(dd,j=6.6,2.0hz,1h),8.19(dd,j=5.4,2.0hz,1h),8.02–7.93(m,1h),7.80(dd,j=7.5,1.4hz,1h),7.75(dd,j=7.7,7.6hz,1h),7.62–7.56(m,2h),4.25(d,j=3.6hz,3h)。
13cnmr(101mhz,cd3cn/cd3cl)δ161.0(d,j=11.2hz),143.7(d,j=7.1hz),137.4,137.1,136.7,134.0,128.6(d,j=2.0hz),127.8,127.3,125.2,124.7,124.5,122.1(d,j=3.6hz),122.0,121.6,111.8(d,j=21.4hz),40.8(d,j=5.8hz)。
ms(m/z)c18h13fns+([m+])计算值:294.1实测值m/z294.1。
2-氟-1-甲基-4-(萘-1-基氧基)吡啶-1-鎓碘化物(15)
向2,4-二氟吡啶(3.5mmol)在dmf(4ml)中的溶液加入1-萘酚(1.5当量)和k2co3(3当量)。在室温下搅拌所得的溶液18小时并且随后用etoac和盐水萃取。通过用5%etoac的正己烷溶液洗脱的硅胶色谱分离出中间体2-氟-4-(萘-1-基氧基)吡啶。标题化合物按照一般程序c,由2-氟-4-(萘-1-基氧基)吡啶开始制备。1hnmr(400mhz,cd3cn/cd3cl)δ8.45(ddd,j=7.2,5.6,1.3hz,1h),8.11(d,j=8.9hz,1h),8.05–7.99(m,1h),7.99–7.90(m,1h),7.76(d,j=2.5hz,1h),7.66–7.55(m,2h),7.38–7.32(m,2h),7.20(dd,j=6.3,2.6hz,1h),4.06(d,j=3.5,1.3hz,3h)。
13cnmr(101mhz,cd3cn/cd3cl)δ175.1(d,j=12.5hz),161.7(d,j=273.1hz),150.8,146.4(d,j=5.4hz),135.1,133.3,132.7,129.1,129.0,128.6,128.0,120.3,119.3,113.6(d,j=2.5hz),101.5(d,j=25.4hz),41.7(d,j=5.0hz)。
ms(m/z)c16h13fno+([m+])计算值:254.1实测值m/z254.2。
2-(蒽-9-基)-4-氟-1-甲基吡啶-1-鎓碘化物(16)
按照一般程序a和c,由4-氟-2-溴吡啶开始制备。1hnmr(400mhz,cd3cn)δ9.26(dd,j=7.1,5.5hz,1h),8.96(s,1h),8.30–8.22(m,2h),8.09(td,j=6.9,3.0hz,1h),7.95(dd,j=7.0,3.0hz,1h),7.68–7.55(m,4h),7.44(dq,j=8.0,1.0hz,2h),3.78(d,j=1.0hz,3h)。
13cnmr(101mhz,cd3cn)δ173.3(d,j=280.8hz),159.0(d,j=14.1hz),153.3(d,j=13.3hz),132.9,131.9,130.3,130.2,129.7,127.2,124.7,123.5,121.5(d,j=22.1hz),117.2(d,j=22.3hz),46.8。
ms(m/z)c20h15fn+([m+])计算值:288.1实测值m/z288.1。
4-(蒽-9-基)-2-碘-1-甲基吡啶-1-鎓氯化物(17)
按照一般程序a和c,由4-氟-2-氯吡啶开始制备。1hnmr(400mhz,dmso-d6)δ9.46(d,j=6.3hz,1h),8.91–8.82(m,2h),8.29–8.18(m,3h),7.65–7.59(m,2h),7.59–7.52(m,4h),4.54(s,3h)。
ms(m/z)c20h15in+([m+])计算值:396.0实测值m/z396.0。
4-(蒽-9-基甲基)-2-氟-1-甲基吡啶-1-鎓碘化物(18)
按照一般程序a和c,由2-氟吡啶-4-基硼酸和9-(溴甲基)蒽开始制备。1hnmr(400mhz,cd3cn)δ8.67(s,1h),8.33(dd,j=6.6,4.8hz,1h),8.21–8.11(m,4h),7.64–7.51(m,5h),7.47–7.42(m,1h),5.35(s,2h),4.04(d,j=3.6hz,3h)。
13cnmr(101mhz,cd3cn)δ169.2(d,j=11.2hz),158.5(d,j=280.5hz),144.4(d,j=6.6hz),132.7,131.3,130.4,129.3,128.1,128.0,126.4,124.8,124.7(d,j=3.2hz),114.2(d,j=20.5hz),42.1(d,j=5.4hz),34.4(d,j=1.8hz)。
ms(m/z)c21h17fn+([m+])计算值:302.1实测值m/z302.2。
2-碘-1-甲基喹啉鎓氯化物(19)
按照一般程序c,由2-氯喹啉开始制备。1hnmr(400mhzdmso-d6)δ7.90(d,j=9.4hz,1h),7.72(dd,j=7.7,1.6hz,1h),7.63(ddd,j=8.7,7.1,1.6hz,1h),7.53(d,j=8.5hz,1h),7.27(ddd,j=7.7,7.1,1.1hz,1h),6.61(d,j=9.5hz,1h),3.61(s,3h);
13cnmr(101mhz,dmso-d6)δ161.1,139.7,139.2,130.8,128.7,121.9,121.1,120.1,114.6,29.0。
ms(m/z)c10h9in+([m+])计算值:270.0实测值m/z270.0。
2-氯-1-甲基喹啉-1-鎓三氟甲磺酸盐(20)
按照一般程序c,由2-氯喹啉和三氟甲磺酸甲酯开始制备。1hnmr(400mhz,dmso-d6)δ7.89(d,j=9.5hz,1h),7.71(dd,j=7.7,1.6hz,1h),7.62(ddd,j=8.6,7.1,1.6hz,1h),7.52(dd,j=8.5,0.9hz,1h),7.26(ddd,j=7.9,7.2,1.1hz,1h),6.60(d,j=9.4hz,1h),3.61(s,3h)。
13cnmr(101mhz,dmso-d6)δ161.2,139.8,139.3,130.9,128.8,122.0,121.1,120.2,114.7,29.1。
ms(m/z)c10h9cln+([m+])计算值:178.0实测值m/z178.0。
9-氯-10-甲基吖啶-10-鎓三氟甲磺酸盐(21)
按照一般程序c,由9-氯吖啶和三氟甲磺酸甲酯开始制备。1hnmr(400mhz,(cd3)2co)δ9.01(ddd,j=8.7,1.5,0.6hz,2h),8.97(dt,j=9.3,0.8hz,2h),8.60(ddd,j=9.3,6.8,1.5hz,2h),8.23(ddd,j=8.7,6.8,0.9hz,2h),5.12(s,3h).;13cnmr(101mhz,dmso-d6/(cd3)2co)δ177.3,143.2,134.4,127.3,122.6,121.6,116.5,34.0。
ms(m/z)c14h11cln+([m+])计算值:228.1实测值m/z228.1。
4-(蒽-9-基乙炔基)-2-氟-1-甲基吡啶-1-鎓碘化物(22)
将9-(丙-1-炔-1-基)蒽(1当量)、cui(0.11当量)、pd(pph3)2cl2(0.1当量)、4-溴-2-氟吡啶(2.7当量)溶解于干燥tea(15ml)中,并将反应混合物在110℃搅拌过夜。冷却至室温后,加入100ml饱和nh4cl溶液并用100ml乙醚萃取水相三次。将合并的有机相经na2so4干燥并在真空下浓缩。粗混合物通过柱色谱(硅胶,戊烷+5%甲苯和2-5%etoac)纯化,得到中间体4-(蒽-9-基乙炔基)-2-氟吡啶。标题化合物按照一般程序c,由4-(蒽-9-基乙炔基)-2-氟吡啶开始制备。1hnmr(400mhz,dmso-d6)δ9.01(dd,j=6.6,5.1hz,1h),8.97(s,1h),8.76(dd,j=5.6,1.8hz,1h),8.72(dd,j=8.7,1.0hz,2h),8.48(dd,j=6.5,1.8hz,1h),8.27(dd,j=8.4,1.1hz,2h),7.82(ddd,j=8.7,6.6,1.3hz,2h),7.71(ddd,j=8.0,6.6,1.2hz,2h),4.21(d,j=3.7hz,3h)。
ms(m/z)c22h15fn+([m+])计算值:312.1实测值m/z312.1。
3-(蒽-9-基)-2-氟-1-甲基吡啶-1-鎓碘化物(23)
按照一般程序a和c,由2-氟-3-溴吡啶开始制备。1hnmr(400mhz,dmso-d6)δ9.25–9.17(m,1h),8.94(s,1h),8.93–8.85(m,1h),8.30–8.22(m,3h),7.71(d,j=8.7hz,2h),7.64(ddd,j=8.3,6.6,1.6hz,2h),7.58(ddd,j=8.3,6.6,1.6hz,2h)。
ms(m/z)c20h15fn+([m+])计算值:288.1实测值m/z288.2。
3-(蒽-9-基)-5-氟-1-甲基吡啶-1-鎓碘化物(24)
按照一般程序a和c,由5-氟-3-溴吡啶开始制备。1hnmr(400mhz,dmso-d6)δ9.66(ddd,j=3.9,2.4,1.1hz,1h),9.22(dd,j=1.30,1.26hz,1h),8.95(ddd,j=8.2,2.5,1.4hz,1h),8.91(s,1h),8.26(ddd,j=8.4,1.4,0.7hz,2h),7.70–7.60(m,4h),7.56(ddd,j=8.7,6.6,1.4hz,2h),4.45(s,3h)。
13cnmr(101mhz,cdcl3/cd3cn)δ161.1(d,j=257.2hz),144.6,141.6(d,j=7.6hz),136.2(d,j=17.6hz),135.7(d,j=36.8hz),131.7,130.7,130.6,129.5,128.1,126.6,126.5,125.7,50.0。
ms(m/z)c20h15fn+([m+])计算值:288.1实测值m/z288.2。
2-(蒽-9-基)-6-氟-1-甲基吡啶-1-鎓三氟甲磺酸盐(25)
按照一般程序a和c,由2-氟-6-溴吡啶开始制备。1hnmr(400mhz,cd3cn)δ8.95(s,1h),8.82(dd,j=7.5,7.0hz,1h),8.27(d,j=7.7hz,2h),8.07(dd,j=8.9,4.5hz,1h),8.02–7.94(m,1h),7.70–7.56(m,4h),7.47(d,j=8.1hz,2h),3.67(d,j=3.9hz,3h)。
13cnmr(101mhz,cd3cn)δ161.8(d,j=281.4hz),153.8(d,j=8.4hz),151.5(d,j=12.8hz),133.0,132.0,131.0,130.3,129.6,129.4,129.3,127.3,124.8,115.5(d,j=21.6hz),39.0(d,j=6.6hz)。
ms(m/z)c20h15fn+([m+])计算值:288.1实测值m/z288.2。
(e)-4-(2-(蒽-9-基)乙烯基)-2-氟-1-甲基吡啶-1-鎓碘化物(26)
向烘箱干燥的玻璃容器中加入pd2(dba)3(0.01eq)、cy3p(0.04eq)和4-(蒽-9-基乙炔基)-2-氟吡啶(1eq)。将容器密封并用n2冲洗三次,然后加入0.2ml1,4-二噁烷。在室温下搅拌混合物15分钟后,加入25%甲酸水溶液(3当量),并将反应加热至80℃。2小时后,在真空下除去溶剂,且残留物通过柱色谱(戊烷、5%甲苯和2-5%etoac)纯化,得到中间体(e)-4-(2-(蒽-9-基)乙烯基)-2-氟-吡啶。标题化合物按照一般程序a和c,由(e)-4-(2-(蒽-9-基)乙烯基)-2-氟-吡啶开始制备。1hnmr(400mhz,dmso-d6)δ9.03(d,j=16.4hz,1h),8.91(dd,j=6.6,5.1hz,1h),8.74(s,1h),8.56(dd,j=6.2,1.8hz,1h),8.41–8.35(m,3h),8.23–8.15(m,2h),7.67–7.56(m,4h),7.36(d,j=16.5hz,1h),4.19(d,j=3.6hz,3h)。
ms(m/z)c22h17fn+([m+])计算值:314.1实测值m/z314.2。
2-氟-1-甲基-4-(芘-1-基)吡啶-1-鎓碘化物(27)
按照一般程序a和c,由4-氟-2-溴吡啶开始制备。1hnmr(400mhz,dmso-d6)δ9.09(dd,j=6.5,5.0hz,1h),8.58(dd,j=5.5,1.9hz,1h),8.52(d,j=8.1hz,1h),8.48–8.42(m,2h),8.41–8.30(m,4h),8.23–8.17(m,3h),4.32(d,j=3.7hz,3h)。
ms(m/z)c22h15fn+([m+])计算值:312.1实测值m/z312.2。
4-(蒽-9-基)-2-肼基-1-甲基吡啶-1-鎓(28)
向4-(蒽-9-基)-2-氟-1-甲基-吡啶鎓碘化物(10mg,0.036mmol)在乙腈中的溶液中加入肼基甲酸叔丁酯(5mg,0.036mmol)。将所得混合物搅拌1小时,然后用水和乙酸乙酯洗涤。然后在减压下蒸发合并的有机层,得到粗的经保护的中间体。将该残留物溶于0.2ml4mhcl的二噁烷溶液中,并在室温下搅拌48小时。然后用乙酸乙酯和水萃取混合物。减压蒸发合并的水层,得到黄色固体(3mg,40%)1hnmr(400mhz,dmso-d6)δ8.69(s,1h),8.23–8.06(m,2h),7.91(d,j=6.8hz,1h),7.74(dq,j=8.4,1.0hz,2h),7.63–7.39(m,4h),6.41(dd,j=1.9,0.6hz,1h),6.26(dd,j=6.8,1.9hz,1h),3.59(s,3h),3.56(s,4h)。
13cnmr(101mhz,dmso-d6)δ162.1,150.7,140.4,133.6,131.2,129.1,128.6,127.7,126.8,125.9,121.1,108.9,37.28。
ms(m/z)c20h18n3+([m]+)计算值m/z300.2,实测值m/z300.2
为了评估合成物质作为高灵敏度maldi-msi分析的反应性基质的效率,具有伯胺和/或酚基的小分子被用作测试物质。将两种浓度(0.1mg/ml和0.01mg/ml)的5-羟色胺(5-ht)、多巴胺(da)、3,4-二羟基苯乙酸(dopac)、3-o-甲基多巴(3-omd)和γ-氨基丁酸(gaba沉积(0.5μl)在maldi金属靶上。通过将合成的化合物溶解在70%乙腈(4.4mm)中来制备反应性基质溶液。自动气动喷雾器(tm-喷雾器,htx技术)用于将5ml加热试剂喷洒在斑点标准品上。喷嘴温度设定为80℃,并且试剂以80μl/分钟的流速分30次喷射。msi数据是在maldi-ft-icr(solarixxr7t-2ω,brukerdaltonics)仪器上以正电离模式通过以250μm的空间分辨率光栅扫描斑点获得的。使用内部开发的软件(msiquant)从每个斑点的平均光谱中提取所有衍生化合物的信噪比(s/n)值。结果如下表2所示。
表2
y=s/n大于3;n=s/n小于3.
从表2可以看出,所有合成的反应性基质都有效地促进了一系列分析物的电离和解吸。
实施例6:溴-吡喃鎓反应性基质用于脑组织切片中药物的maldi-msi检测的用途
通过吡喃鎓衍生化进行电荷标记已被证明可提高含小分子伯胺的maldi和desi-msi分析的灵敏度。由于这种衍生化只向目标化合物中添加碳和氢,因此所得产物的同位素模式与那些未衍生化但被离子化、解吸和非选择性检测的物种没有区别。通过向取代的吡喃鎓离子中添加溴,这导致衍生化物质的独特同位素模式和质量亏损,这使得它们与未衍生的化合物不同。
材料和试剂
除非另有说明,2,4,6-三苯基吡喃鎓(tpp)和2-(4-溴-苯基)-4,6-二苯基-吡喃鎓(br-tpp)的四氟硼酸盐、三乙胺(tea)和所有其他化学品均购自sigma-aldrich(stockholm,sweden),且无需进一步纯化即可使用。水、甲醇和三氟乙酸(tfa)从merck(hohenbrunn,germany)获得。
动物实验
所有的动物都被安置在20℃和53%湿度的空调房间(黑暗/光照周期为12小时),可以随意获取食物和水。实验是根据1986年11月24日欧洲共同体理事会关于动物伦理使用的指令(86/609/eec)进行的,并得到了卡罗林斯卡学院当地伦理委员会的批准(n350/08和n40/13)。
成年雄性c57bl/6小鼠(3个月大,charlesriverlaboratories,
组织制备和衍生化
冷冻脑组织用恒冷箱切片机(leicacm3050s;leicamicrosystems,welzlar,germany)以14μm的厚度切片,融化安装在导电氧化铟锡(ito)载玻片(brukerdaltonics)上,并在-80℃下储存。切片在氮气流下轻轻干燥,并在室温下干燥15分钟,然后使用光学扫描仪(epsonperfectionv500)对其进行光学成像。
脑样本然后被涂上tpp和br-tpp。衍生化溶液是通过将8mgtpp或br-tpp溶解在6ml含3.5μltea的80%甲醇中而制备的。自动气动喷雾器(tm-sprayer;htxtechnologies,carrboro,nc)用于在组织切片上喷洒温热试剂。喷嘴温度设定为80℃,并且试剂以110cm/min的线速度以80μl/min的流速在组织切片上喷射30次。在分析前,样品在饱和有50%甲醇溶液蒸气的室中孵育15分钟(每5分钟用氮气流干燥一次)。
质谱测定法
所有maldi-msi实验都是使用maldi-tof/tof(ultraflextreme,brukerdaltonics,bremen,德国)质谱仪进行的,该质谱仪具有正离子模式的smartbeamii2khz激光。激光功率在每次运行开始时进行优化,然后在maldi-msi实验期间保持恒定。fleximagingv4.0build32(brukerdaltonics,billerica,ma)用于maldi-msi数据的标准化和可视化。
结果
tpp及其溴化衍生物br-tpp用于绘制氟伏沙明在小鼠脑组织切片中的定位图,见图5。图5显示了在无任何辅助基质的情况下,对照组(a,d)和给药组(b,e)脑组织切片中tpp(a,b)和br-tpp(d,e)衍生的氟伏沙明(m/z609.3和687.2)的maldi-msi相对丰度和空间分布。图5还显示了经tpp(c)和br-tpp(f)处理的给药氟伏沙明的组织切片的平均光谱。数据使用彩虹标度显示,根据总离子数进行标准化。比例尺,5mm;空间分辨率=100μm。
氟伏沙明是一种选择性5-羟色胺再摄取抑制剂(ssri),最初是作为抗抑郁药开发的,但通常用于治疗焦虑症。氟伏沙明的伯胺官能团选择性地与tpp和br-tpp反应。对照和氟伏沙明给药小鼠的脑组织切片由非溴化tpp(a,b)和溴化br-tpp(d,e)衍生。使用tpp(a)和br-tpp(d)在对照脑组织切片中未检测到干扰信号,而在无任何辅助基质的情况下,衍生的氟伏沙明使用tpp(b)在m/z609.3检测到,以及使用br-tpp(e)在m/z687.2检测到。使用两种衍生剂发现氟伏沙明的分布相似,主要位于皮层和小脑。tpp衍生的氟伏沙明的同位素模式代表一种典型的非标记化合物(c),而含溴的br-tpp衍生的氟伏沙明显示出一种特定的同位素模式,可以很容易地从对应于非衍生物质的信号中区分出来。
- 还没有人留言评论。精彩留言会获得点赞!