一种干细胞凝胶颗粒生成仪的制作方法
[0001]
本申请属于干细胞凝胶颗粒制备技术领域,尤其涉及一种干细胞凝胶颗粒生成仪。
背景技术:
[0002]
干细胞凝胶颗粒主要为细胞及药物提供水凝胶载细胞,可广泛应用于生物医疗,美容行业和高校实验室。现有技术中,可以生产干细胞凝胶颗粒的仪器包括三维支架干细胞培养仪器设备系统、喷墨式干细胞凝胶颗粒成形机以及静电纺丝干细胞凝胶颗粒成形机。
[0003]
三维支架干细胞培养仪器设备系统对设备要求比较高、运用不灵活,不能实时运用原材料来进行生产制造、需要将原材料进行预处理后加入,且仪器加入原材料和收集制备后的材料不能同时进行,也无法控制材料的融合时间,造成原材料的浪费。喷墨式干细胞凝胶颗粒成形机利用喷射剪切法进行制备,静电纺丝干细胞凝胶颗粒成形机利用静电造粒法进行制备,它们的制备速度比较慢,约十万个/次,制备价格昂贵,且不能灵活使用。
技术实现要素:
[0004]
有鉴于此,本申请提供了一种干细胞凝胶颗粒生成仪,原材料和生产一体化进行,提高生产效率且结构简单。
[0005]
本申请的具体技术方案如下:
[0006]
一种干细胞凝胶颗粒生成仪,包括箱体以及安装于所述箱体上的控制模块、驱动模块以及微流控芯片;
[0007]
所述箱体设有原料箱和收集箱;
[0008]
所述微流控芯片包括进料通道以及出料通道;
[0009]
所述出料通道与所述收集箱的进料口连通,所述进料通道与所述原料箱的出料口连通;
[0010]
所述驱动模块的一端可伸入所述原料箱的连通口且与所述原料箱活动连接,使料液推入所述进料通道;
[0011]
所述控制模块与所述驱动模块电连接,控制所述驱动模块的推入速度。
[0012]
优选的,所述驱动模块包括电机、传动器以及连动杆;
[0013]
所述电机固定设于所述箱体的侧壁且与所述传动器连接,带动所述传动器沿中心轴线转动;
[0014]
所述连动杆的第一端与所述传动器活动连接,在所述传动器的转动下带动所述连动杆的第二端逐渐推入所述原料箱内。
[0015]
优选的,所述传动器包括齿轮以及驱动杆;
[0016]
所述齿轮的边缘与所述电机嵌合连接,所述驱动杆穿过所述齿轮的圆心沿所述齿轮的中心轴线方向与所述齿轮固定连接;
[0017]
所述连动杆的第一端与所述驱动杆活动连接。
[0018]
优选的,所述连动杆的第一端固定设有平板,所述平板开设有通孔,所述通孔与所述传动器螺纹连接;
[0019]
所述传动器转动过程中通过所述平板带动所述连动杆向前推入。
[0020]
优选的,所述控制模块包括单片机和控制面板;
[0021]
所述单片机安装于所述电机上,控制所述电机的转速;
[0022]
所述控制面板安装于所述箱体的外侧,所述控制面板可控制、显示所述连动杆推入所述原料箱的速度。
[0023]
优选的,所述连动杆的第二端设有封堵部,所述原料箱设有储存通道,所述封堵部与所述储存通道的底部密封配合。
[0024]
优选的,所述储存通道为四个,四个所述储存通道相互独立,四个所述储存通道分别对应四个所述连动杆,且分别与四个所述进料通道相连通。
[0025]
优选的,所述收集箱的进料口与所述原料箱的连通口相对于所述进料通道同侧。
[0026]
优选的,还包括顶盖;
[0027]
所述顶盖的第一端在所述原料箱的连通口上方与所述原料箱转动连接,所述顶盖的第二端在所述原料箱的出料口上方与所述原料箱卡合连接。
[0028]
优选的,还包括固定槽;
[0029]
所述固定槽的第一端与所述箱体转动连接,且设有供所述微流控芯片插入的插口,所述固定槽的第二端通过支架与所述箱体可拆卸连接。
[0030]
综上所述,本申请提供了一种干细胞凝胶颗粒生成仪,通过控制模块和驱动模块控制料液的流速,结合微流控芯片操控形成干细胞凝胶颗粒,将制备流程集成于一体,能够实现快速、大通量制造,制备速度约一亿个/次,有利于未来医疗行业生物3d打印技术对于干细胞颗粒原料的高需求;在提高生产效率的同时也简化了结构设计,降低制造仪器的成本。本申请的干细胞凝胶颗粒生成仪通过控制模块可以控制驱动模块的一端伸入原料箱的连通口,将原料箱内的料液推入进料通道中,且控制驱动模块推入进料通道的速度,进而控制投料速度,可以调节干细胞凝胶颗粒生成的大小和形状,以适应不同细胞生长条件的干细胞凝胶颗粒的制备。
附图说明
[0031]
为了更清楚地说明本申请实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。
[0032]
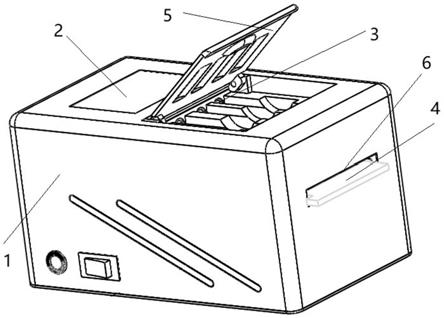
图1为本申请提供的干细胞凝胶颗粒生成仪的外部构造的立体图;
[0033]
图2为本申请提供的干细胞凝胶颗粒生成仪的内部构造的立体图;
[0034]
图3为本申请提供的干细胞凝胶颗粒生成仪的内部构造的正视图;
[0035]
图4为本申请提供的干细胞凝胶颗粒生成仪的内部构造的俯视图;
[0036]
图5为本申请提供的干细胞凝胶颗粒生成仪的微流控芯片的结构示意图。
[0037]
图示说明:1、箱体;12、原料箱;13、收集箱;14、连通口;15、储存通道;2、控制模块;
21、单片机;22、控制面板;3、驱动模块;31、电机;32、齿轮;33、驱动杆;34、连动杆;35、平板;4、微流控芯片;41、第一进料通道;42、第二进料通道;43、第三进料通道;44、第四进料通道;45、第一出料通道;46、第二出料通道;47、第一混合室;48、第二混合室;49、第三混合室;5、顶盖;6、固定槽。
具体实施方式
[0038]
为使得本申请的目的、特征、优点能够更加的明显和易懂,下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,下面所描述的实施例仅仅是本申请一部分实施例,而非全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本申请保护的范围。
[0039]
请参阅图1和图2,图1为本申请提供的干细胞凝胶颗粒生成仪的外部构造的立体图,图2为本申请提供的干细胞凝胶颗粒生成仪的内部构造的立体图。
[0040]
本申请实施例提供一种干细胞凝胶颗粒生成仪,包括箱体1以及安装于箱体1上的控制模块2、驱动模块3以及微流控芯片4;箱体1设有原料箱12和收集箱13;微流控芯片4包括进料通道以及出料通道;出料通道与收集箱13的进料口连通,进料通道与原料箱12的出料口连通;驱动模块3的一端可伸入原料箱12的连通口14且与原料箱12活动连接,使料液推入进料通道;控制模块2与驱动模块3电连接,控制驱动模块3的推入速度。
[0041]
本申请实施例中,通过控制模块2和驱动模块3控制料液的流速,结合微流控芯片4操控形成干细胞凝胶颗粒,将制备流程集成于一体,能够实现快速、大通量制造,制备速度约一亿个/次,有利于未来医疗行业生物3d打印技术对于干细胞颗粒原料的高需求;在提高生产效率的同时也简化了结构设计,降低制造仪器的成本。本申请的干细胞凝胶颗粒生成仪通过控制模块2可以控制驱动模块3的一端伸入原料箱12的连通口14,将原料箱12内的料液推入进料通道中,且控制驱动模块3推入进料通道的速度,进而控制投料速度,可以调节干细胞凝胶颗粒生成的大小和形状,以适应不同细胞生长条件的干细胞凝胶颗粒的制备。
[0042]
本申请的干细胞凝胶颗粒生成仪在使用时,先将原料倒入原料箱12内,开启控制模块2,控制驱动模块3将料液一定的速度推入进料通道,其中,驱动模块3的一端伸入原料箱12后,可以通过体积挤压的方式从原料箱12的出料口挤出料液,也可以在原料箱12内设置与驱动模块3的外型相适应的腔道,驱动模块3从腔道内将料液推出。原料在微流控芯片4内经过一系列流道最终形成干细胞凝胶颗粒,其中,微流控芯片4可以是常规市售的干细胞微流控芯片4,形成的干细胞凝胶颗粒和制备产生的废料一起通过出料通道排出至收集箱13内。当驱动模块3的一端无法再伸入原料箱12内,控制模块2将控制驱动模块3回归原位,此时再在原料箱12内补充原料,即可继续进行制备。
[0043]
请参照图2~4,其中,图3为本申请提供的干细胞凝胶颗粒生成仪的内部构造的正视图,图4为本申请提供的干细胞凝胶颗粒生成仪的内部构造的俯视图。
[0044]
进一步的,驱动模块3包括电机31、传动器以及连动杆34;电机31固定设于箱体1的侧壁且与传动器连接,带动传动器沿中心轴线转动;连动杆34的第一端与传动器活动连接,在传动器的转动下带动连动杆34的第二端逐渐推入原料箱12内。
[0045]
本申请实施例中,通过电机31带动传动器旋转,在传动器旋转的过程中,连动杆34
与传动器的连接处不断前移,从而使得连动杆34从原料箱12的连通口14进入并逐渐推入,将原料箱12内的料体挤入微流控芯片4的进料通道中。利用电机31、传动器和连动杆34的驱动方式结构设计简单且易操作,传动器和连动杆34可拆卸方便清洗和更替。同时,利用传动器的旋转轴调节连动杆34的推入速度,增强了元件运行过程中的稳定性和精确度。
[0046]
进一步的,传动器包括齿轮32以及驱动杆33;齿轮32的边缘与电机31嵌合连接,驱动杆33穿过齿轮32的圆心沿齿轮32的中心轴线方向与齿轮32固定连接;连动杆34的第一端与驱动杆33活动连接。
[0047]
本申请实施例中,利用齿轮32实现传动,能够根据实际生产需要,在不改变电机31功率的前提下,调整制备过程中的料液流速。更换直径较大、齿牙较多的齿轮32,有助于提高控制流速的精度;更换直径较小的齿轮32,有助于提高控制流速的选择范围。齿轮32和驱动杆33配合使用,能在仪器的机械构造不变的同时,提高制备效率,且扩大仪器的使用范围。
[0048]
进一步的,连动杆34的第一端固定设有平板35,平板35开设有通孔,通孔与传动器螺纹连接;传动器转动过程中通过平板35带动连动杆34向前推入。
[0049]
本申请实施例中,驱动杆33设有外螺纹,通孔设有内螺纹,驱动杆33在旋转过程中,平板35的外框由箱体1进行限位,不发生旋转,平板35带动连动杆34沿着驱动杆33的长度方向做平移运动,从而控制连动杆34的第二端伸入原料箱12将料液挤入原料通道中。驱动杆33和连动杆34采用螺纹的连接方式简单易行,且组件易更换,有利于拆装保养。连动杆34与驱动杆33通过平板35带动能够提高平移的稳定性,进而提高推进速度的精度。
[0050]
进一步的,控制模块2包括单片机21和控制面板22;单片机21安装于电机31上,控制电机31的转速;控制面板22安装于箱体1的外侧,控制面板22可控制、显示连动杆34推入原料箱12的速度。
[0051]
本申请实施例中,单片机21为常规市售产品,安装于电机31上方便调节电机31的转速。控制面板22上可以设有控制按钮以及显示屏,控制面板22可以与单片机21电连接,用户通过控制按钮设置连动杆34的推入速度,即电机31的转速,从而达到对凝胶生成速度与液滴大小的控制;连动杆34的推入速度也可以经过单片机21的信号分析在显示屏中显示,方便用户实时掌控当前制备工艺的参数和进度,从而及时完成人机交互。
[0052]
进一步的,连动杆34的第二端设有封堵部,原料箱12设有储存通道15,封堵部与储存通道15的底部密封配合。
[0053]
本申请实施例中,封堵部可以是采用化学性质稳定的柔性材料制成,与储存通道15的底部可以密封配合,改善储存通道15的密封性,从而改善推入原料通道的料液量的精度,同时还避免连动杆34做无效率的搅动,提高传动推进的效率。
[0054]
进一步的,储存通道15为四个,四个储存通道15相互独立,四个储存通道15分别对应四个连动杆34,且分别与四个进料通道相连通。
[0055]
本申请实施例中,原料箱12内可以设有四条相互独立的储存通道15,用于储存不同物相或制备前需要进行阻隔的料液,保证原料不受污染并可进行原料的定量。四个连动杆34可以通过平板35固定,在平板35的平移作用下共同以相同的速度推入,四个连动杆34也可以分别与四个传动器活动连接,并以不同的起始时间以及不同的速度推入。另外,四个储存通道15的内径可以互不相同,可根据不同的制备需求,更换不同内径的储存通道15以
及相适配的连动杆34,内径越大,在推动作用下产生的流速越大,从而调节制备的干细胞凝胶颗粒的微结构尺寸。其中,四个储存通道15可以分别用于储存海藻酸钠溶液、氯化钙溶液、具有生物相容性的油相以及含有钙离子的药物溶液。
[0056]
请参照图5,图5为本申请提供的干细胞凝胶颗粒生成仪的微流控芯片的结构示意图。在微流控芯片4内,进料通道包括第一进料通道41、第二进料通道42、第三进料通道43以及第四进料通道44,出料通道包括第一出料通道45以及第二出料通道46。第一进料通道41可以通入海藻酸钠溶液,第二进料通道42可以通入氯化钙溶液,第三进料通道43可以通入具有生物相容性的油相,第四进料通道44可以通入含有钙离子的药物溶液。其中,一个储存通道15中的料液可以通过分流的方式分别流入位于不同位置的进料通道,例如位于第一混合室47前以及第三混合室49前的两个第一进料通道41。微流控芯片4中的制备流程如下:
[0057]
首先将干细胞溶解于海藻酸钠溶液和/或氯化钙盐溶液,海藻酸钠溶液和氯化钙盐溶液在第一混合室47内进行离子交换使海藻酸盐凝胶化,同时混入油相通过流道塑性形成棒状凝胶。然后在第二混合室48中,通入含有钙离子的药物溶液,其中,药物溶液为干细胞进行定向分化的诱导剂,棒状凝胶的油相被分离除去,带有微结构的凝胶进入到药物溶液的水相中,实现去油。最后包裹凝胶的药物溶液水相混入钙离子,再在两边混入海藻酸钠溶液,通过油相包裹,在第三混合室49实现最外层凝胶包裹,形成了由内而外依次为细胞培养液、内层凝胶、药物溶液以及外层凝胶的干细胞凝胶颗粒。根据需要制备的干细胞凝胶颗粒的性质,可以灵活更换流道直径、长度不同的微流控芯片4,从而可以调节生成的干细胞凝胶颗粒的内部结构。
[0058]
进一步的,收集箱13的进料口与原料箱12的连通口14相对于进料通道同侧。
[0059]
本申请实施例中,料液从连通口14处依次流向原料箱12的出料口、进料通道以及出料通道,其中在进料通道处改变水平方向,收集箱13设置在仪器的中部,这种结构设计节省空间,并且可以延长微流控芯片4内的反应流道,以适应不同性能干细胞凝胶颗粒的制备。
[0060]
进一步的,还包括顶盖5;顶盖5的第一端在原料箱12的连通口14上方与原料箱12转动连接,顶盖5的第二端在原料箱12的出料口上方与原料箱12卡合连接。
[0061]
本申请实施例中,顶盖5可以设有与储存通道15一一对应的敞口。顶盖5的敞口可方便用户观察储存通道15内料液的液位情况,也可以通过敞口及时补充料液。顶盖5的第一端可以在原料箱12的连通口14上方与原料箱12铰接,顶盖5的第二端可以在原料箱12的出料口上方与原料箱12通过卡扣固定连接。在制备过程中将顶盖5与原料箱12的顶部闭合,可以起到防尘作用,而且顶盖5具有一定刚性,可以起到支撑并稳固原料箱12的作用,防止制备中内部组件碰撞导致原料箱12内的储存通道15产生轻微形变阻碍连动杆34的推入。
[0062]
进一步的,还包括固定槽6;固定槽6的第一端与箱体1转动连接,且设有供微流控芯片4插入的插口,固定槽6的第二端通过支架(图中未示)与箱体1可拆卸连接。
[0063]
本申请实施例中,固定槽6用于装载并固定微流控芯片4,提升微流控芯片4的稳固性。固定槽6的第一端设于箱体1上,第二端由设于箱体1上的支架支撑固定,并通过支架与箱体1可拆卸连接,可以通过调节支架的角度,改变固定槽6第二端的高度,从而改变微流控芯片4的倾斜角度,使得进料通道的高度略高于出料通道,能够加速微流控芯片4内料液流动,提高制备效率。另外,固定槽6内可以设置与控制模块2电连接的自动装卸组件,用户可
以通过控制按钮控制自动装卸组件的运行。自动装卸组件可以使微流控芯片4从插口处部分弹出,或者使微流控芯片4完全卡入固定槽6内完成装载固定,方便微流控芯片4的装卸和固定。
[0064]
以上所述,以上实施例仅用以说明本申请的技术方案,而非对其限制;尽管参照前述实施例对本申请进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本申请各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1