用于预测移植中的同种异体反应性的方法和系统与流程
本发明涉及一种用于实施用于确定移植材料的一个或多个受体与一个或多个供体之间的预测非直接识别HLA表位(PIRCHES)的数量的计算机实现的方法的方法、系统和/或数据结构。本文中所描述的方法、系统和数据结构可以识别可允许的错配,因此可以经由患者和供体的HLA衍生肽的计算机分析来提供相对安全的移植材料。
因此,本发明涉及通过快速且可靠的方法、利用新颖的数据结构或数据源来电子仿真生物学现象的计算机实现的方法的实用实施例。新颖的数据结构使得能够开发交互式软件模块,该交互式软件模块根据错配的受体HLA等位基因来确定受体或供体特定的HLA衍生肽的数量,其中错配的受体HLA等位基因被预测将由共享的(匹配的)HLA分子(PIRCHES)来呈递(present)。大量的PIRCHES与移植供体材料之后不需要的免疫反应的风险增加相关联。因此,通过快速且有效的方式来预测PIRCHES的数量使得能够改进安全移植材料的选择。而且,本发明详细说明在现有的HLA配型(例如CordMatch“脐带血配型”)应用中应当如何整合功能性。
背景技术:
同种异体的细胞、组织以及器官的移植是已经成为日益受瞩目的治疗选择的发展中的治疗方法。在不远的将来,预期从不相关供体接收移植的患者数量将会翻倍。移植之后的同种异体反应性对于临床效果影响很大,对于病理而言也具有有利效果。已知HLA错配诱发移植之后的免疫反应,但是并没有完全弄清楚在预测不需要的免疫反应的风险中所包括的各个因素。
造血干细胞移植(Hematopoietic Stem Cell Transplantation,HSCT)是快速发展的治疗方法的一个示例。HSCT的主要限制因素仍是移植物抗宿主病(graft-versus-host disease,GVHD),并且由于预期接收HSCT的患者将会增加,所以必须加快提供预防GVHD的新方法。为了克服GVHD的风险,优选地是利用所有的HLA等位基因完全匹配的供体与患者进行移植。但是,由于HLA分子在群体中的多样性,大约40%的患者无法找到这些完全匹配的供体。当无法找到完全匹配供体时,临床医生经常必须面对从多个错配供体之中选择出最好供体(即,携带最低GVHD风险的那个供体)的困难决定。
至今,确定哪一个供体是最适合的供体依赖于需要长达14天实验室工作的繁重检测,例如细胞毒性T淋巴细胞前体频率(cytotoxic T-lymphocyte precursor frequency,CTLpf)检测。少于或等于每106中一个PBL的CTLpf评分与更好的总体存活相关联(Heemskerk等,骨髓移植(Bone Marrow Transplantation),2007年,第40卷,页:193-200)。虽然能够通过实验室方法提供这样的有用信息,但是分析所需的时间被延长,并且可能导致对于需要移植的患者的进一步伤害或死亡。临床医生在选择处于由不需要的同种异体反应性所引起的副作用的危险下的脐带血或脐带血细胞移植、肾脏移植、或其他移植时,也面临着相似的问题。为了找到CTLpf检测的替代方法,已经将多个未成功的尝试用于利用两种通用的预测程序(HLAMatchmaker和HistoCheck)对于禁用的错配进行预测。
HLAMatchmaker确定抗体的潜在表位,并且已经证明其对于实体器官移植的有效性(Duquesnoy等,人类免疫(Hum.Immunol.),2002年,第60卷,页:353-63;Duquesnoy等,移植(Transplantation),2003年,第75卷,页:884-89)。HLAMatchmaker考虑到氨基酸三联体作为HLA上的表位的差异。虽然抗体在GVHD的发病中起作用,但是基于HLAMatchmaker的预测与同种异体性不相关(Guptad等,血液(Blood),2010年,第1卷,第6期,页1839-48)。
HistoCheck是基于直接识别HLA差异的观点,也就是供体T细胞识别负载非多态性肽的完整的错配HLA分子(Amir等,血液,2011年,第118卷,第6733页)。HistoCheck在肽结合槽或连接T细胞受体的区域内确定HLA分子的结构差异(Elsner等,骨髓移植(Bone Marrow Transplantation),2004,第33卷,页:165-69)。通过确定这些结果差异,目的是预测直接识别HLA差异的可能性。利用HistoCheck所获得的差异性评分也与同种异体反应性无关(Spellman等,血和骨髓移植生物学(Biol.Blood Marrow Transplant),2011年,第17卷,页:1409-15)。
鉴于现有技术,需要更可靠并且更快速的方法,用于预测与HLA错配的用于移植的供体材料是否会增加导致移植失败的风险,例如GVHD的发病,和/或死亡率增加。
技术实现要素:
鉴于现有技术,本发明潜在的技术问题是提供改进的或替换的计算机实现的方法,用于选择具有低风险不利反应的同种异体移植所适合的供体细胞或组织,或者用于预测经历移植过程的患者体内的不利的免疫应答,具体是经由确定任何给定的供体和受体对之间的PIRCHES的数量。
通过独立权利要求的各个特征来解决该技术问题。通过从属权利要求来提供本发明的优选实施例。
因此,本发明涉及一种由计算机实现的方法,该方法用于确定移植材料的一个或多个受体与一个或多个供体之间预测的间接识别HLA表位(PIRCHES)的数量,其中所述PIRCHES是来自错配的受体HLA等位基因的受体或供体特异性的HLA衍生肽,并且被预测将由共享(匹配)HLA分子进行呈递,其中所述方法包括:
a)从受体的错配HLA分子中识别肽;
b)确定a)中所识别出的肽被预测将由已选择的共享(匹配)HLA分子中的一个或多个进行呈递;
c)从供体的所有已选择的HLA分子识别肽;
d)确定c)中所识别出的肽被预测将由已选择的共享(匹配)HLA分子中的一个或多个进行呈递;
其中
e)对于每个共享的MHC I类HLA分子:任何不包括在d)中的肽组中的b)中所确定的肽是一个PIRCHE I,或者
对于每个共享的MHC II类HLA分子:任何不包括在d)中的肽组中的b)中所确定的肽是一个PIRCHE II;
其特征在于
f)根据以图形数据结构进行存储的信息来执行步骤a)到d)。
因此,除了在确定任何给定的对应方法中的PIRCHE数量的方法中使用图形数据结构之外,本发明涉及图形数据结构。该数据结构可以如所需或所期望用于本文中所述的本发明的任何方法步骤。本发明还涉及用于执行方法和/或运行如本文中所述的系统的计算机软件。在一个实施例中,本文中所述的方法其特征在于通过软件来执行步骤f),例如一个或多个软件模块。
本发明的又一实施例涉及选择和/或筛选用于移植的供体材料的系统,例如从HLA错配的不相关供体来选择具有可允许的错配的供体材料,所述系统包括根据本文中所述的方法的PIRCHE配型和HLA配型的软件模块。
在一个实施例中,本文中所述的方法其特征在于,图形数据结构中所存储的信息是生物数据的电子存储表现,或者对应于一个或多个生物实体,或者是一个或多个生物实体的抽象化。因此,本发明涉及在其中处理与“真实世界”生物实体对应的数据的计算机实现方法。这样的图形数据结构,其特征不仅在于数据结构的特定构架,并且在于实体的特定生物背景和结构所体现的关系。
本发明的新型图形数据结构及其在本文中所述的方法中的使用使得处理时间相比先前所尝试的方法显著地改进(缩短)。令人完全惊奇的是,通过本发明中所使用的数据结构能够将供体与受体之间的PIRCHE的分析提高至如此明显的程度。
在一个实施例中,本文中所述的方法其特征在于,供体和受体之间的HLA配型已经在实现本文中所述的方法之间执行。已经预先实现此方法的HLA分析数据,并且随后经由本发明的方法来处理与HLA分型相关的数据。
在一个实施例中,本文中所述的方法其特征在于,通过用于在所述HLA分子内预测人类蛋白酶体的切割位点的计算机实现方法,识别来自受体的错配HLA分子的肽和来自供体HLA分子的肽。这优选地参考本文中所述的方法的步骤a)和c)。因此,该切割位点优选地涉及由人类蛋白酶体所识别的肽链内切酶和/或蛋白酶位点。本发明的该特征的优选实施例涉及软件NetChop或者如本文中所述的可替换软件的使用,该软件能够确定肽序列的蛋白酶体切割。
在一个实施例中,本文中所述的方法其特征在于,利用用于预测所述肽与任何给定HLA分子的结合的计算机实现方法来执行权利要求1的步骤b)和步骤d)。本发明的该特征的优选实施例涉及软件NetMHCpan和/或NetMHC II,或者如本文中所述的可替换软件的使用,该软件能够确定(或者预测)HLA或MHC分子中的任何给定的(优选单体的)肽的结合。
其他结合准则可以用于预测肽是否将由该HLA分子进行呈递。所提供的值是基于先前文献中所述的结合性质,但是如果能够合理地认为PIRCHE结合呈递HLA,可以得到或使用不同的值。本文中所提到的优选值令人吃惊地工作良好。对于每个供体-受体对,识别出可呈递的受体或供体特定的HLA衍生肽(PIRCHE)。
在一个实施例中,根据设置,将呈递的共享HLA等位基因、所预测的源于供体HLA等位基因的结合物视为供体自身的肽,而将受体HLA等位基因视为受体自身的肽,然后从分析中进行排除.通常,对于每个供体-受体对,将可呈递的受体或供体特定的肽(从错配的受体HLA等位基因获得,并且被预测将由共享的HLA进行呈递)进行计数从而生成PIRCHES的数量。
优选地通过以下两个步骤来识别PIRCHE-I:
1)执行通过蛋白酶体对于氨基酸序列的预测处理的计算机评估以及经由TAP通道的传输,优选地是利用NetChop。NetChop是一个众所周知的用于基于序列分析来识别人类蛋白酶体的切割位点的基于软件的方法。单体肽优选地包括在分析中。在优选实施例中,确定C末端切割势能。整个HLA蛋白被切割(在计算机中)并且所有可切割的位置都被标记。从向后被标记的位置,优选地识别单体肽,对于单体肽进行分析用于与I类结合。
作为NetChop的替换,在现有技术中已知能够利用很多基于软件的方法,诸如MAPP、PaPro或者如Lu等人(J ZheJiang Univ Sci B,2013年9月;14(9),页:816-28)或Ginodi等人(Bioinformatics,2008年2月15日;24(4),页:477-83).
2)随后,利用NetMHCpan,对于具有高度被处理可能性(根据步骤1)的肽,针对它们将由供体与受体(优选的是HLA-A、-B、-C)之间共享的(匹配的)HLA呈递的能力进行测试.NetMHCpan是众所周知的利用人工神经网络来识别和/或预测肽与任何已知的MHC分子的结合的方法.该方法在覆盖超过150个不同的MHC分子的超过150,000的定量结合数据。能够针对HLA-A、HLA-B、HLA-C、HLA-E以及HLA-G等位基因进行预测。预测值能够以nM IC50值来给出,或者作为对于一组200000个随机自然肽的%排名。优选地,选择具有IC50结合值<500nM的肽作为相关结合体。
可以如下来识别PIRCHE II:
潜在的15个氨基酸的HLA-DR、HLA-DQ以及HLA-DP结合体的优选单肽的结合评分可以优选地利用NetMHCIIPan 2.0、NetMHCII 1-0或者NetMHCII 2.2来进行分析。NetMHCII是众所周知的利用人工神经网络来预测肽与HLA-DR、HLA-DQ、HLA-DP以及鼠MHC II类等位基因的方法。能够针对覆盖9个HLA-DR超型(supertype)、6个HLA-DQ、6个HLA-DP以及两种鼠H2II类等位基因来获取预测。预测值能够以nM IC50值来给出,或者作为对于一组1000000个随机自然肽的%排名。将具有IC50结合值<1000nM的肽视为相关。
在现有技术中已知很多能够用于确定HLA结合的可替换方法。SYFPEITHI(基于如下文献中所描述的方法:Rammensee等,Immunogenetics,41,页:178-228和Rammensee等,Landes Bioscience,1997年)和BIMAS是熟知的替代,并且适合于I类结合但是在II类结合中显示出一些不足。其他的替代涉及Tepitope(基于Stur-niolo等,1999,Nat.Biotechnol.17:555-561)、TepitopePAN、EpicCapo、PAAQD、POPI、Propred以及Multipred。
在一个实施例中,本发明涉及本文中所述的方法,其中PIRCHE-I肽具有预测的IC50结合值<10μM,优选<1000nM,更优选<500nM。
在一个实施例中,本发明涉及本文中所述的方法,其中PIRCHE-II肽具有预测的IC50结合值<20μM,优选<5μM,更优选<1000nM。
随后在图形数据结构的背景下提供和/或分析HLA衍生肽的识别及其如上所述的潜在的结合属性。
根据本发明,以及在计算机科学中,术语“图形数据结构”是包括节点(也称为顶点(vertice))的集合,以及它们之间的连接(称为边(edge))的数据类型或结构。图形数据结构可以与每个边的一些边值(诸如数值型属性)相关联。
根据本发明,优选地将数据结构的节点体现为HLA值实体和肽实体,其中优选地将该边体现为HLA值与肽实体之间的关系。
与图形数据相关联的典型操作包括“adjacent(G,x,y)”,其测试是否存在从节点x到节点y的边,“neighbors(G,x)”,其列出存在从x到y的边的所有节点y,或者“get_node_value(G,x)”,其返回与节点x相关联的值。进一步的操作是可用的并且例如能够选择或提供通过如本文中所定义的某些关系所定义的特定节点,例如当针对给定的供体-受体对,选择那些将被视为PIRCHES的肽。因此,为了针对任何给点的供体-受体对来确定与PIRCHES的数量相关的期望信息,本领域技术人员能够经由软件程序中所执行的各种操作,利用本文中所述的图形数据结构。
在一个实施例中,如本文中所述的,这样的方法或图形数据结构,其特征在于,图形数据结构包括:
-一个或多个HLA值实体,
-一个或多个肽实体,以及
-所述HLA值与肽实体之间的一个或多个关系,其中每个实体在图形数据结构中以单个实例进行呈递,并且可以向另一个实体显示一个或多个关系。
在一个优选实施例中,一个或多个HLA值实体优选地与HLA等位基因的信息的和/或计算机表示有关。在一个优选实施例中,HLA值实体与通过唯一的蛋白质序列所定义的等位基因有关,由此在本方法中优选地不考虑只显示DNA序列差异而在对应的蛋白质序列中不发生改变的HLA等位基因。这样的只显示DNA序列差异的HLA等位涉及标准HLA命名系统的段3和段4中所述的等位基因特定的特征,该特征与同义DNA序列改变或编码区之外的序列变化有关。
在一个优选实施例中,一个或多个肽实体优选地与源于HLA值实体的肽序列的信息的和/或计算机表示有关,由此可以经由计算机方法将任何给定的HLA等位基因的序列进行切割,以便从HLA蛋白质序列之中生成给定长度的肽序列,其中优选肽的氨基酸长度是5到30,优选肽的氨基酸长度是7到11,更优选肽的氨基酸长度是9,或者优选肽的氨基酸长度是12到18,更优选肽的氨基酸长度是15。
在一个实施例中,如本文中所述的,这样的方法或图形数据结构,其特征在于,HLA值实体与肽具有关系,但与其他HLA实体没有,而肽与HLA值具有关系,但是与其他肽没有。通过这组关系,形成能够有效的(快速的)查询的图形数据结构。
在一个实施例中,如本文中所述的,这样的方法或图形数据结构,其特征在于,任何给定的HLA值实体“具有”许多个肽(从1到n),其中任何给定的HLA值实体的每个肽(源于任何给定的HLA值实体的每个肽)与所述HLA值实体具有关系。因此,通过每个HLA值实体与它所连接的肽实体之间的关系来限定图形数据结构,优选地通过对应的HLA分子的氨基酸序列的预测蛋白酶体切割以及蛋白酶体切割的可能性来限定所述关系。
在一个实施例中,如本文中所述的,这样的方法或图形数据结构,其特征在于,通过对应的HLA分子的氨基酸序列的预测蛋白酶体切割来确定每个HLA值实体的肽。
在一个实施例中,如本文中所述的,这样的方法或图形数据结构,其特征在于,蛋白酶体切割的可能性是通过从0到1的切割评分来表示的(优选地,0到1之间),其中所述评分体现任何给定的HLA值实体与肽实体之间的关系属性。
在优选实施例中,如本文中所述的,这样的方法或图形数据结构,其特征在于,执行权利要求1中的步骤a)和步骤c),以便根据切割评分来确定所述肽的识别。在一个实施例中,对于任何给定的肽的切割评分(关系性质或属性)优选地是>0.5(阈值可以从0到1,优选地在0.1到0.9之间,更优选地在0.3到0.7之间,最优选地为0.5),用于针对所述HLA分子的肽识别是足够的。
在一个实施例中,如本文中所述的,这样的方法或图形数据结构,其特征在于,任何给定的HLA值实体“呈递”许多个肽(从0到n),其中任何给定的HLA值实体所呈递的每个肽与所述HLA值实体具有关系。
在一个实施例中,如本文中所述的,这样的方法或图形数据结构,其特征在于,通过所述HLA分子对于所述肽的预测结合和呈递来确定HLA值实体对于肽的呈递。
在一个优选实施例中,通过IC 50评分来表示肽呈递的可能性,其中IC 50评分体现任何给定HLA值实体与肽实体之间的关系的特性。在一个实施例中,对于权利要求1的步骤b)和步骤d),利用IC 50评分阈值来实现所述肽的确定。
在一个实施例中,如本文中所述的,这样的方法或图形数据结构,其特征在于,所述阈值对于PIRCHE I优选是IC 50评分≤500,和/或对于PIRCHE II优选是IC 50评分≤1000,其中这样的评分足够进行所述肽的预测呈递的确定。
在一个优选实施例中,所选择的HLA分子是HLA基因座A*、B*、C*、DRB1*以及DQB1*,并且可选地DPB1*和DRB3/4/5*。
本发明的另一方面涉及一种用于选择和/或筛选用于移植的供体材料的系统,例如从错配的不相关供体选择具有可允许的错配的供体材料,所述系统包括用于根据前述权利要求的方法的PIRCHE配型以及HLA配型的软件模块。
在一个优选实施例中,该用于选择和/或筛选用于移植的供体材料的系统,其特征在于,所述HLA软件模块基于高分辨率等位基因编码来实现供体与受体的HLA分型数据之间的HLA配型,优选地针对HLA基因座A*、B*、C*、DRB1*以及DQB1*,并且可选地DPB1*和DRB3/4/5*。
更优选的是,所述PIRCHE配型并入由所述HLA配型软件模块所生成的HLA配型信息,使得PIRCHE配型模块接受患者、配型配置和HLA配型的供体列表以及优选地脐带血单元(CBU),并且向服务客户返回含有丰富PIRCHE信息的输入供体列表作为输出。
在优选实施例中,该系统其特征在于,经由共享的服务整合管理软件模块来提供患者信息和搜索配置,其中将所述共享的服务整合管理软件模块连接到HLA配型和PIRCHE配型模块两者,使得患者信息和搜索配置最初由所述HLA配型软件模块来进行处理,随后经由用于分析PIRCHE数量的共享的管理模块,向所述PIRCHE配型模块提供患者、配型配置以及HLA配型的供体列表,并且优选地脐带血单元(CBU)。
该系统的各种实施例提供面向HLA配型和PIRCHE配型的组合方法,由此向移植提供者提供唯一的服务,该服务搜索具有低风险的引起不利的同种异体反应的移植材料。本文中所述的系统的技术效果是不仅提高供体数据库的查询速度,而且提供更安全的移植材料,由此提高已经接收同种异体材料移植的患者群体的健康水平。
在本发明的一个方面中,本文中所述的方法或系统,其特征在于,从一个或多个供体配置来获得与供体HLA值实体对应的信息。可以将供体配置称为“供体类型”,其涉及个别主体中可能发生的HLA等位基因和/或单体型的任何给定的潜在组合的电子的(理论的或者根据实际供体)表现。优选地,将供体配置或类型存储于另外的数据结构、数据库、资料库,和/或包括上述所有可能的供体类型的模拟。
在一个优选实施例中,优选地将供体配置存储于另外的数据结构、数据库、资料库,和/或任何给定的一个或多个理论的或实际的供体的HLA值实体和/或肽实体的模拟。在一个实施例中,优选地是将多个供体配置或供体类型存储于供体数据结构、数据库、资料库和/或模拟,基本上包括对于基本上所有可能的基因型或者单体型和/或HLA等位基因的可能组合。
短语“基本上所有”在此背景下涉及大量的,优选地所有或者每个已知的,等位基因组的蛋白质变体。因此,该方法能够有效地确定特定的供体或等位基因组是否确实与相对低的PIRCHE值相关联,并且因此将其本身呈递为优选的选择。因为本领域的技术人员能够基于所存储的数据的可靠性,或者根据某一等位基因的群体频率,在任何给定的等位基因组中,做出可能的蛋白质变体的预选择,所以该方法不限于等位基因组的所有已知蛋白序列的分析。在一个实施例中,该方法将包括等位基因组中的基本所有已知的(或相关的)蛋白质序列的分析。
在该方面的一个优选实施例中,本发明的方法或系统其特征在于,所述方法和/或系统使得能够针对一个或多个供体配置,利用受体信息(优选地与需要移植的生物受体对应)进行搜索,其中所述系统和/或方法的结果(效果)提供关于一个或多个(优选地多个)最佳匹配的错配供体配置的信息,优选地是具有最低可能数量的PIRCHES的9/10错配供体。
在一个实施例中,本发明的方法或系统其特征在于,所述方法和/或系统与供体材料的电子寄存器进行功能连接(例如,不具有存储在PIRCHES上的信息的寄存器),其中根据前述权利要求的方法和/或系统的结果使得对于与所述结果对应的一个或多个最佳匹配的错配供体材料,能够将查询从所述方法和/或系统的用户端发送到所述寄存器。本发明优选地将终端用户(例如医生或移植提供者)与包括关于所述供体材料的造血干细胞或其他供体材料寄存器进行链接。
在一个实施例中,本发明的方法或系统其特征在于,将体现HLA等位基因的任何给定组合(例如,称为单体型或基因体)在任何一个或多个人类种群(诸如,年龄、性别、种族等)中的频率的信息,并入到针对供体配置的每个潜在的HLA等位基因组合的所述配置中。
在一个实施例中,本发明的方法或系统其特征在于,基于利用“低”或“中”分辨率的HLA分型所确定的HLA等位基因的任何给定组合的已知群体频率,经由计算机实现的方法,将利用“低”或“中”分辨率的HLA分型所分型的供体材料的电子存储HLA分型数据,转换为“高”分辨率的相似或类似的HLA分型状态,由此能够利用如文中所述的系统和/或方法,查询先前经由“低”或“中”分辨率技术所获得的HLA分型数据。
用于移植所存储的大量供体样品当前只进行“低”分辨率分型或“中”分辨率分型。当显然不存在完全匹配的供体材料时,一些错配的供体材料可能也适于移植。但是,搜索匹配供体的医生在选择用于移植的“低”或“中”分辨率分型的材料,或者进一步在移植前进行高分辨率分型中面临着艰难任务。对于医生来说,当面对“低”或“中”分辨率分型的供体信息时,确定如下问题仍然是挑战:哪一个供体最可能提供可接受的同种异体材料,或者哪一个错配的等位基因组最可能与低风险的有害免疫反应相关联。因此,本发明使得能够进行“低”或“中”分辨率的HLA分型向“高”分辨率数据的转换。
考虑到对于已经遭受移植后不利的免疫反应的患者的巨大身体消耗,除了用于实现高分辨率分型的相对高的花费之外,用于预测安全移植材料,以及用于预测哪一个错配的或潜在错配的供体与低风险的不希望免疫反应相关联的方法,对于医学界至关重要。本文中所述的方法使得能够减少需要进行的任何高分辨率分型的上游以及手术(或治疗)的上游风险,由此分别避免患者、医生和医疗机构的巨大健康消耗和经济费用。
在一个实施例中,本发明的方法或系统其特征在于,所述方法和/或系统包括:a)(优选地是供体的)HLA分型数据的从“低”或“中”分辨率HLA分型到“高”分辨率数据的转换,b)所述供体信息与受体HLA信息的HLA配型,以及c)根据本文中所述的系统和/或方法的PIRCHE配型。
本发明的另一个方面涉及一种方法或系统,其特征在于,将体现HLA等位基因的任何给定组合(例如,称为单体型或基因体)在任何一个或多个人类种群(诸如,年龄、性别、种族等)中的频率的信息,并入到针对供体配置的每个潜在的HLA等位基因组合的所述配置中,其中优选地是,基于利用“低”或“中”分辨率的HLA分型所确定的HLA等位基因的任何给定组合的已知群体频率,经由计算机实现的方法,将利用“低”或“中”分辨率的HLA分型所分型的供体材料的电子存储HLA分型数据,转换为“高”分辨率的相似或类似的HLA分型状态,由此能够利用如文中所述的系统和/或方法,查询先前经由“低”或“中”分辨率技术所获得的HLA分型数据。
移植材料可以涉及用于移植的任何给定的生物材料。这样的生物材料涉及用于移植的细胞、组织、血液、尤其是脐带血、造血干细胞、或者其他前体细胞或干细胞群体、或者器官。
本发明的计算机实现使得能够实现一种有效、快速且可靠的方法,该方法用于识别对于同种异体移植的潜在可允许的供体材料。能够通过完全或部分自动的方式来处理软件所处理的数据,由此使得能够在优选实施例中实现自动的计算机实现的方法。除了针对每个供体-受体对所确定的PIRCHES的数量之外,关于受体和供体的HLA分型的数据能够被电子存储并且最终被保持在合适的数据库中。因此,本发明也涉及能够实现本文中所述的方法的计算机软件。本发明还涉及用于预测移植之后针对人类白细胞抗原(HLA)的免疫反应的优选计算机自动实现的方法,其中PIRCHES的数量与不利的免疫反应的风险相关联。
该系统优选包括具有所有已发布的HLA等位基因的信息的一个或多个数据库。当公布新的HLA等位基因序列时,可以对该数据库进行更新。除了调用所需的各个程序之外,基于任何给定计算语言的计算机软件也能够用于生成和/或更新数据库。
本发明还包括一种用于优选地在移植之前预测针对人类白细胞抗原(HLA)的免疫应答的系统,其中的免疫应答可能在移植之后发生。该系统可以包括计算设备、数据存储设备和/或适当的软件,例如相互交互以实现本文中所述的方法的单独软件模块。
在一个实施例中,该系统可以包括脐带血库的数据库(databanks或者databases),由此针对HLA分型来测试每个样品并且将信息进行电子存储。该系统也包括在另外的计算设备之间的连接,例如诊所、移植中心或医院的设备,在其中存储受体的HLA分型数据。通过多个数据库之间的连接,例如在因特网上,本发明的方法能够利用适当的软件来实现。可以将多个潜在供体样品与患者的HLA分型进行比较,并且确定针对任何给定的供体-受体对的PIRCHE的数量。鉴于基于本文中所述的方法的分析,能够做出任何给定的供体材料(例如,脐带血库或其他细胞或组织库中所存储的那些样品)是否适合于移植的临床相关的预测。
在一个实施例中,本发明涉及本文中所述的一种方法,其中在如下HLA亚型上执行HLA分型:HLA-A、HLA-B、HLA-DRB1、HLA-C、HLA-DQB1、HLA-DPB1、-DQA1、-DPA1、-G、-E、-F、MICA、MICB和/或KIR。
在一个实施例中,本发明涉及本文中所述的一种方法,其中在HLA-A、-B、-C、-DRB1、-DQB1上执行HLA分型。这5个等位基因提供了通常所使用的术语“9/10匹配”的基础,该术语参考9/10匹配的不相关供体。在此情况下,这5个基因的10个等位基因中的9个显示出匹配,但是仍有一个等位基因错配。因此,本发明使得能够,在优选实施例中,确定来自这样的9/10匹配的不相关供体的材料的使用是否安全,即该错配对于移植而言是否可允许。
本发明还涉及本文中所述的方法,该方法用于在存在多于9/10情况的错配的供体样品中的可允许HLA错配。本发明所包括的潜在供体的一个示例是单体型相合的(Haploidentical)供体,可以利用本文中所述的方法针对可允许的错配供体材料对该供体进行检测。可以将单体型相合的相关供体描述为与患者具有“50%匹配”的供体。这种类型的供体能够是父母、同胞或子女。通过限定,由于基因物质的一半来自每个父母,所以父母或者父母的子女通常是单体型相合的供体。存在50%的可能性同胞是单体型相合的供体。因为90%的父母有单体型相合的家庭成员,所以单体型相合HSCT向更多的人提供HCT的选择。其他的优势包括:供体立即可获得;不管种族背景对于所有父母的同等机会;在多个供体之间选择的能力;以及如果需要获得另外的细胞的能力。可替换地,脐带血单元(CBU)可能未显示出高等级的HLA配型,但是如果这些错配通过本文中所描述的方法确定是可允许的,仍然适合移植。CBU通常最低为4/6匹配,但是这种匹配能够在同种异体层次上产生4/10或5/10的情况。
考虑到本文中所描述的方法一定程度上依赖共享的HLA,最少的HLA配型是一个等位匹配。虽然这对于HSCT来说不可能发生,但是由于可得到的供体材料的数量有限,这样的情况对于器官移植来说频繁发生。因此,本发明能够在具有最少一个等位基因匹配的错配样品上执行。因此,该错配供体可以涉及1/10、2/10、3/10、4/10、5/10、6/10、7/10、8/10、9/10或10/10(DP错配)匹配。如果测试另外的等位基因,供体也可以显示出任何其他种类的错配,由此存在至少一个等位基因匹配。对于移植而言优选的是具有显著HLA配型的供体。如果另外的等位基因经过分型,因此供体能够是例如11/12匹配或13/14匹配。
在一个实施例中,本发明涉及本文中所述的方法,其中HLA分型包括血清和/或分子分型。在优选实施例中,本发明涉及本文中所述的方法,其中利用基于序列的分型以高分辨率级别来执行HLA分型。
在一个实施例中,本发明涉及本文中所述的方法,其中HLA分型包括针对HLAI类等位基因的外显子(exon)1-7的序列以及针对HLAII类等位基因的外显子1-6的序列。在一个实施例中,本发明涉及本文中所述的方法,其中HLA分型包括针对HLA II类等位基因的外显子2以及针对HLA I类等位基因的外显子2和外显子3的高分辨率HLA-A、-B、-C、-DRB1、-DQB1分型。这些特定的HLA分型方法被描述在本文中所提供的示例中,并且展示出超过早期分型方法的优势,提供对于需要进行分型从而识别其错配的等位基因的完全覆盖。
具体实施方式
历来,HSCT之后的同种异体反应性被认为主要是由于供体T细胞对于HLA差异的直接识别而引起的.意思是移植物T细胞识别错配HLA,该错配HLA被表达为宿主细胞的细胞表面的完整分子。但是本发明特别地基于间接识别。当在共享HLA上将从错配的宿主HLA等位基因所获得的肽进行处理并且呈递,因而被供体T细胞识别时,会引起同种异体反应性。
肽与HLA分子的结合是可预测的。预测出的结合亲和性与实验测量结果之间的差异已经被表明与不同实验室之间的测量结果的差异一样小。因为HLAI类分子对于九个氨基酸长度的肽(9-mers)具有更严格的偏好,并且需要特定的氨基酸作为锚定残基(anchor residue)位于明确定义的锚定位,所以对于这些分子的可预测性特别高。因为不同长度的肽能够利用不同位置作为锚定残基来结合,所以对于HLA II类分子的可识别性较低。因此,难以确定肽如何与HLA II类结合槽进行对准,以及肽中的哪一个氨基酸残基优选作为锚点。为了解决这个技术问题,Nielsen等人使用所谓的“核心预测器(core predictor)”来估计肽如何在II类结合槽中定位。核心预测器使得被称为NetMHCII的准确的HLA II类预测器得以开发。
虽然在预测肽与I类和II类HLA分子的肽结合取得了进展,但是在对于供体特异性抗体(DSA)的产生和同种异体反应性中所包括的因素进行评估中仍然存在着很大的不确定性。考虑到当前可用于预测肾脏移植之后的不需要的免疫反应的工具,存在如下需要:提供用于在移植之前评估潜在的不利的反应的更可靠的方法。
概念上而言,错配的指向HLA的T细胞同种异体反应性是由于HLA差异的直接识别和间接识别引起的。目前为止,旨在解释和预测对于错配HLA的临床同种异体反应性的研究主要集中于HLA差异的直接识别。直接识别包括对于负载非多态性肽的完整的错配HLA分子进行识别的供体T细胞。当HLA等位基因引发肽结合槽的差异时,所呈递的HLA分子的肽库(peptide repertoire)会在本质上不同。这些不同的肽库可以引发T细胞应答。HistoCheck算法在肽结合槽或连接T细胞受体的区域确定HLA分子的结构差异,从而预测差异评分。但是利用HistoCheck所获得的差异性评分也与同种异体反应性无关,既不是在体外,也不是在体内。
T细胞相关的同种异体反应性也能够潜在地由错配HLA等位基因的间接识别来引发。已经针对次要组织相容性(H)抗原对于间接识别进行了详细地研究。这些HLA呈递的多态性蛋白质的错配与aGVHD的风险增加以及复发的风险降低相关联。类似于源自次要H错配的肽,源自错配HLA分子的肽也能够由HLA来呈递。
错配HLA抗原的间接识别会引起T细胞相关的同种异体反应性。在间接识别期间,T细胞识别通过共享的(匹配的)HLA分子所呈递的源自多态性HLA抗原的肽。源自多态性HLA抗原的肽经常由HLA来呈递。已经将这些可间接识别的HLA表位与实体器官移植中的急性和慢性的移植物失败进行关联。因此,在自身HLA的环境下间接识别错配HLA的T细胞在临床同种异体反应性中起到了重要作用。
因此,本发明指定被预测呈递为预测的可间接识别的HLA表位(Predicted Indirectly ReCognizable HLA Epitopes,PIRCHES)的HLA衍生表位。本发明分别识别由共享的HLAI类所呈递的PIRCHES(PIRCHES-I)和由共享的HLA II类所呈递的PIRCHES(PIRCHES-II)。PIRCHES-II被示出诱导肾脏移植之后的同种异体反应性;HLA-DR所呈递的PIRCHES与供体特定的HLA IgG抗原的从头发展相关。
因此,本发明基于如下发现:HLA衍生肽的识别影响HLA错配的HSCT之后的临床同种异体反应性。为此,能够评估所预测的PIRCHES-I和PIRCHES-II的数量以及它们在HSCT的各种临床效果中的影响。基于这样的研究,本发明描述了能够在HSCT以及其他细胞或器官移植之前预测非容许的HLA错配的普遍适用方法。
现有技术的方法,诸如评估错配之间的结构匹配度的HLAMatchmaker,未提供用于预测性确定不需要的免疫反应的风险的有效方法.HLAMatchmaker考虑能够引发HLA抗体的HLA抗原上的表面的结构基础。它通过如下方式进行:将HLA I类抗原视为短序列的组合(三元组,triplets),确定这些三元组之间的差异。三元组的错配度不与aGVHD显著相关。现有技术的另一种方法由Spellman和Askar及同事进行评估的HistoCheck,基于在HLA分子内的位置和蛋白质中的氨基酸的功能相似性将HLA等位基因产品之间的氨基酸差异进行评价。利用该评价系统所获得的差异性评分不预测aGVHD。
由于利用计算机方法的先前尝试不能预测GVHD,本发明的方法代表如下的第一计算机实现方法之一:该方法利用对于不需要且潜在地危险免疫应答的可靠而高效的移植前预测,提供针对HSCT的改进的供体选择。而且,先前的尝试是利用通常评价HLA分子之间的结构/功能差异来进行的(即,基于HLA差异的直接识别或者经由抗体进行识别的可能性),本发明优选地是基于HLA错配分子的预期间接识别。本发明的方法令人惊讶地适合于预测同种异体反应性,这在以前是不可能的。因此,本发明基于如下关键原则:预测的间接识别的HLA表位(PIRCHES)与移植之后的不需要的免疫应答的可能性相关。
因此,本发明体现了同种异体反应性的风险与共享HLA分子所呈递的错配HLA衍生肽的数量增加之间的关系的技术应用。这些数量能够优选地在计算机中进行确定,并且能够被用作关于同种异体反应性(例如,GVHD)的发病的预测标记。
本发明提供了一种优选由计算机实现的方法,该方法在无法找到完全匹配的供体时,在不需要繁重的相容性检测的情况下,确定哪一个供体适于移植。本发明例如适用于多个移植设置,诸如干细胞、脐带血细胞或实体器官移植及其他。本发明基本包括了HLA配型在确定移植后的同种异体反应性或组织排斥性中发挥作用的任何移植。
考虑到患者由于移植后的不需要的免疫应答所遭受的巨大的健康损害,预测可安全移植的材料的方法对于医学界至关重要。如本文中所述的方法能够使得手术(或治疗)的上游风险减少,因此分别避免患者、医生和机构的大量健康花费和经济花费。
因此,在一个实施例中,本发明涉及用于预测移植之后对于人类白细胞抗原(Human leukocyte antigens,HLA)的免疫应答的方法,其中的免疫应答与供体和受体之间HLA错配的相关联(优选地,所引发),其中基于序列分型、优选地以高分辨率等级来进行对于供体和受体的HLA分型以便确定错配,通过确定源于错配的受体和/或供体HLA等位基因的肽的呈递和/或结合,利用计算机实现的方法来识别预测的间接识别HLA表位(PIRCHES)的数量,由此PIRCHES的数量与所述的免疫应答的可能性相关。
在一个实施例中,本发明涉及本文中所述的方法,其中所述移植包括造血干细胞移植(HSCT)。
在一个实施例中,本发明涉及本文中所述的方法,其中所述移植包括脐带血或者脐带血细胞移植。
在一个实施例中,本发明涉及本文中所述的方法,其中所述移植包括肾脏移植。
本发明的方法也可以用于预测其他医学病症(诸如二次复发性流产)情况下的不需要的免疫应答、孕期的抗体形成,或者用于在角膜移植之前评估风险。
在一个实施例中,本发明涉及本文中所述的方法,其中所述免疫应答包括不需要的同种异体反应性。
在一个实施例中,本发明涉及本文中所述的方法,其中所述免疫应答包括T细胞介导的应答(同种异体反应性)。在一个实施例中,本发明涉及本文中所述的方法,其中所述免疫应答导致急性移植物抗宿主病(aGVHD)或慢性移植物抗宿主病(cGVHD)。
基于图形数据结构的本发明的计算机实现启用一种用于识别针对同种异体移植的潜在允许供体材料的有效、快速、可靠方法。软件所处理的数据能够以完全或部分自动的方式进行处理,由此在优选实施例中启用一种自动由计算机来实现的方法。除了针对任何供体-受体对所确定的PIRCHES的数量以外,与供体和受体的HLA分析有关的数据被电子存储和保持在合适的图形结构数据库中。
在一个实施例中,该系统包括脐带血库的数据库,由此针对HLA分型对于每个样品进行测试,并且将信息进行电子存储。该系统也包括与另外的计算设备(诸如诊所、移植中心或医院的设备)之间的连接,其中存储受体的HLA分型数据。通过两个数据库之间的连接,例如在因特网上,本发明的方法能够利用适当的软件来实现。可以将多个潜在供体样品与患者的HLA分型进行比较,并且确定针对任何一个特定供体-受体对的PIRCHE的数量。根据基于本文中所述的方法的分析,能够做出给定供体材料(例如,脐带血库或其他细胞或组织库中所存储的那些样品)是否适合于移植的临床相关的预测。本发明还涉及适合于实现本文中所描述的方法的软件。
根据本方面,术语“预测(predication)”意思是关于未来可能发生的事件的描述.也可以使用术语“预报(forecast)”。“预测”从本发明的意义上来说代表对于移植之后发生免疫应答的风险或可能性的评估。基于该预测或风险评估,能够在潜在有害事件发生之前获得有价值的信息,这些信息能够用于确定进一步的治疗方法。
本发明中的术语“免疫应答”涉及如本领域技术人员所通常理解的免疫应答。免疫应答可以被理解为当抗原被识别为外源时所发生的源于免疫系统的一部分对于该抗原的应答,优选地是该免疫应答随后引发能够破坏或固定“外源”抗原或使其无害的抗体和/或淋巴细胞的产生。本发明的免疫应答可以与受体的免疫系统对于被移植材料的应答相关,或者可以与被移植的细胞、组织或器官的细胞所引起的免疫应答相关(例如,在GVHD中移植材料的T细胞反抗和/或攻击受体抗原或组织).免疫应答可以是保护机体抵抗外源物质(诸如,外源组织)的受体的防御功能,或者是被移植的材料的免疫细胞对于受体细胞或组织的反应。
人类白细胞抗原(HLA)系统是人类的主要组织相容性复合体(major histocompatibility complex,MHC)。这个超位点包括与人类的免疫系统功能相关的大量基因。该基因组位于第六号染色体,并且编码细胞表面的抗原呈递蛋白,并具有一些其他功能。某些基因所编码的蛋白由于它们作为器官移植中的因素的历史发现也被认为是抗原。主要HLA抗原是免疫功能的主要要素。与MHC I类(A、B和C)对应的HLA呈递来自细胞内部的肽(如存在,包括病毒肽)。这些肽产生自蛋白酶体中所分解的被消化的蛋白质。通常,这些特定的肽是小型聚合物,长度约9个氨基酸。外源抗体对于破坏细胞的杀伤T细胞(也称为CD8阳性或细胞毒性T细胞)进行攻击。与MHC II类(DP、DM、DOA、DOB、DQ以及DR)对应的HLA将来自细胞外部的肽呈递到T淋巴细胞.这些特定的抗原刺激辅助性T细胞的增殖,反过来辅助性T细胞刺激产生抗体的B细胞以产生针对特定抗原的抗体。
MHC基因座是哺乳动物中的最多遗传多变的编码基因座中的一些,人类HLA基因座也不例外。大多数的HLA基因座针对每个基因座表现一打或更多的等位基因组。六个基因座具有在人类种群中已检测到的超过100个等位基因。其中,最多变的是HLA-B和HLA-DRB1。
等位基因是位于基因座上的核苷酸(DNA)序列的变体,如此每个等位基因通过至少一个(单核苷酸多态性,SNP)位点不同于其他等位基因。这些变化中的多数会导致氨基酸序列的变化,而氨基酸序列的变化导致蛋白质中的主要功能差异。
“HLA”是指位于染色体6p21的人类白细胞抗原,包括用于确定例如组织移植物的受体和供体之间的匹配度的HLA基因(HLA-A、HLA-B、HLA-C、HLA-DRB1、HLA-DQB1等)。“HLA等位基因”意为两个亲代染色体中的一个染色体上的基因座中的核苷酸序列。
“HLA分型”意为识别给定位点的HLA等位基因(HLA-A、HLA-B、HLA-C、HLA-DRB1、HLA-DQB1等)。可以从来自供体和/或受体的血液或其他身体样品中获取样品,随后对其进行分析。
血清学分型(serotyping,利用抗体识别细胞表面的HLA蛋白)是HLA分型的初始方法,并且仍然被一些中心所使用。表型分型(phenotyping)与针对分型的血清学方法相关。该方法在明确HLA多态性的方面能力有限,并且与错误识别HLA类型的风险相关联。现代的分子学方法更普遍地用于个体的基因型。利用该方法,使用对于DNA的变化区域特定的PCR引物(称为PCRSSP)。如果找到合适大小的产品,假设已经识别出HLA等位基因/等位基因组。PCR-SSO也用于并入探针杂交。关于HLA分型的技术方法的综述被提供于以下两篇文献:Erilich H,Tissue Antigens(组织抗原),2012年,七月,80(1),页:1-11,和Dunn P,Int J Immuogenet(国际免疫遗传学杂志),2011,十二月,38(6),页:463-73。可以应用基因测序,并且可以与如下方法关联:传统方法,诸如Maxam-Giblert测序法、链终止测序法(Chain-termination sequencing);高级方法和从头测序法,诸如鸟枪法测序(shotgun sequencing)或酶锁链反应法(bridge PCR);或者所谓的“下一代”方法,诸如大规模并行信号测序法(massively parallel signature sequencing,MPSS)、454焦磷酸测序法(pyrosequencing)、伊鲁米那(Illumina或Solexa)测序法、SOLiD测序法以及其他类似方法。
对于HLA分型,从供体本身和/或从之前的供体材料所获得的样品,在针对移植的分离/准备期间或之后,可以用于HLA测序,以及随后与来自受体的HLA分型数据进行比较。例如,供体本身的HLA分型可以通过分析唾液、血液或其他体液以获取HLA信息的方式来进行,可选地、另外地或替换地,在HLA分析期间,可以针对相同和/或互补的HLA类型特征对于旨在移植的从供体所获得的材料(供体材料)进行分析。
“HLA错配”被定义为识别供体和受体中的不同的等位基因,其存在于任何给定的等位座中。
根据本发明,术语“两段式特定HLA蛋白分型”关于WHO委员会在2010年正对HLA系统的各个因素所制订的标准化HLA命名系统。根据该HLA命名系统,进行如下的命名:HLA-基因*段1:段2:段3:段4-后缀。基因涉及HLA基因座(A、B、C、DRB1、DQB1等)。段1涉及等位基因组。段2涉及特定HLA蛋白。段3涉及编码区内的同义DNA取代。段4用于表示非编码区中的差异。后缀用于表示基因表达中的特定特征。
“两段式特定HLA蛋白分型”中的“两段式”涉及根据本文中所使用的标准化WHO命名的段1和段2的HLA分型信息的存在。由于这种分型为本文中所处理的免疫应答提供关于特定蛋白序列的相关信息,因此这种分型通常被称为“高分辨率分型”或“特定HLA蛋白分型”。
术语“HLA等位基因组”分型涉及只针对HLA基因(基因座)和段1所提供的分型信息。该分型通常被称为“低分辨率”分型。根据本发明,任何血清分型都将被转变为分子的“低分辨率”分型。
术语“中等分辨率”或“中间分辨率”涉及某些种类的分型信息,其中一些等位基因或等位基因串的存在已经通过所使用的分型方法在患者/供体中进行定义。NMDP命名是描述这种级别的分型的一种方法。例如,A*01:AB涉及等位基因01:01或等位基因01:02(01:01/01:02),而患者/供体是这两个等位基因之一。在一些情况中,NMDP等位基因编码是通用的,其中一个编码可以包括位于给定HLA基因座的一些可能的HLA序列(等位基因)。虽然可以对于供体材料进行HLA分型,但是一些NMDP编码不提供在任何给定HLA实际呈递哪一个特定蛋白质的信息。这种分型信息被称为中等分辨率分型。
供体通常被理解为提供用于在受体中进行移植的供体材料(或者换言之生物材料,诸如但不限于细胞、组织、器官或其他身体部分、流体和/或制剂)的一个个体或多个个体(例如如下情况:为了有效的治疗相关量的用于移植的供体材料,需要多个样品或制剂,诸如脐带血单元(CBU))。对于供体或者供体的HLA分型的参考也可以分别涉及供体材料或供体材料的HLA分型。
本方法的对象受体通常是哺乳动物,优选地是人。受体通常是遭受具有需要移植的特征的病症(诸如需要进行移植的器官衰竭)的患者。通过术语“器官”,意思是包括任何身体结构或细胞组,其中包含被组织起来以实现机体特定功能的不同组织,例如心脏、肺、脑、肾脏、皮肤、肝脏、骨髓等。在一个实施例中,移植物是同种异体移植物,即个体和供体是相同种类的。受试者也可能处于如下情况:即使当症状本身未被确诊为缺乏或丧失内源性细胞的特定子集的功能,但是能够通过细胞移植进行治疗。一些疾病是可以通过移植某种干细胞来治愈的,因此这些细胞的天然或内源池未必在受体中起作用。
本发明的方法特别适用于将要接收或被预测需要细胞、组织或器官移植的患者,来预测不利的免疫应答的可能性,诸如源移植物损伤或排异反应,和/或对于非移植物组织的免疫起源损伤。例如,预期该患者将在接下来的一个月、两个月、三个月、四个月、五个月、六个月或十二个月后接收移植。可替换地,该测定方法适用于已接收移植来预测源移植物损伤或排异反应,和/或对于非移植物组织的免疫起源损伤的个体。移植之后,该方法特别适用于表现出(移植体器官的)急性器官功能障碍或疑似移植体宿主病(GVHD)的迹象的患者,特别是慢性GVHD以及其中移植物是骨髓移植的情况。
移植是出于替换受者损伤或缺失器官的目的,或者出于提供能够提供治疗效果的干细胞、其他细胞、组织或器官的目的,将细胞、组织或器官从一个身体(供体)到另一个身体(受者或患者)的移动,或者是在患者自身的身体上的一个供体位置到另一个位置,或者是从被存储的供体材料到受者身体。
同种异体移植或同种移植是细胞、组织或器官从同种类的基因不同的供体到受体的移植。移植物被称为同种异体移植体、同种异系移植体、或同种移植体。大多数的人体组织和器官移植都是同种异体移植体。同种异体移植体能够来自活体源或者遗体源。通常,能够进行移植的器官是心脏、肾脏、肝脏、肺、胰腺、肠以及胸腺。组织包括骨骼、肌腱(统称为肌骨骼移植物)、角膜、皮肤、心脏瓣膜、神经以及血管。
本发明还包括在筛查经由再生药物所产生的器官、细胞或组织的情景中的方法的使用,例如已经在体外进行构造并且用于移植的重构供体材料。干细胞技术使得能够在体外产生大量医学相关的细胞类型或组织。因此,本发明也能够用于检测已经通过生物工程和/或组织工程方法生产出的同种异体材料在移植中的适用性。
本发明包括免疫反应的风险的评价,优选地是移植前的风险评价,由此可以将任何给定的干细胞视为用于移植的供体材料。例如,造血干细胞移植(HSCT)是通常源于骨髓、周围血或脐带血的多潜能造血干细胞的移植。它是血液学和肿瘤学领域中常见的医疗过程,最经常针对具有某些血液或骨髓癌症(诸如骨髓瘤或白血病)的病人来执行。在这些情况下,通常在移植之前利用辐射或化学疗法对于受体的免疫系统进行破坏。感染和移植体抗宿主病是同种异体(allogenic,也称为allogeneic)HSCT的主要并发症。
可以将干细胞理解为未分化的生物细胞,其可以分化为特化细胞,并且能够(通过有丝分裂)分开以产生更多造血干细胞。高度可塑的成体干细胞通常用于药物治疗,例如在骨髓移植中。现在,能够通过细胞培养来人工培育造血干细胞,并且将其转变(分化)为具有与各种组织(诸如,肌肉或神经)的细胞一致的特征的特化细胞类型。潜在的干细胞移植可以涉及任何给定的干细胞疗法,因此存在着很多干细胞疗法。医学研究人员预期成体和胚胎干细胞将很快能够治疗癌症、1型糖尿病、帕金森病、亨廷顿病、乳糜泻、心功能衰竭、肌肉损伤和神经紊乱以及其他疾病。
干细胞也称为体干细胞和生殖系干细胞,能够在儿童以及成人中找到。多潜能的成体干细胞很稀有,通常数量少但是能够在包括脐带血的一些组织中找到。已经发现骨髓是成体干细胞的丰富的源之一,其已经用于治疗一些症状,包括脊髓损伤、肝硬化、慢性下肢缺血以及终末期心衰。成体干细胞可以是血细胞系限制的(多潜能的),并且通常通过它们的组织起源(间充质干细胞、脂肪干细胞、内皮干细胞、牙髓干细胞等)来命名。
多潜能的干细胞也被发现在羊水中。这些干细胞非常活跃,在没有供给的情况下广泛扩张并且是非致肿瘤的。羊水干细胞是多潜能的,能够分化为成脂细胞、成骨细胞、肌源细胞、内皮细胞、肝细胞、以及神经系。可以针对供体或针对自体同源的使用来收集羊水干细胞。
脐带血衍生的多潜能造血干细胞显示出胚胎和造血特性。表型特征表示(CB-SCs)显示胚胎细胞标记(例如,转录因子OCT-4和Nanog,特异性胚胎抗原(SSEA)-3和SSEA-4)和白细胞共同抗原CD 45,但是它们对于血细胞谱系而言是阴性的。另外,CB-SC显示出非常低的免疫原性,如非常低水平的主要组织兼容性复合物(MHC)抗原并且不能刺激同种异体淋巴细胞的增值的表达所示。
HSC通常可以从骨髓、外围血干细胞、羊水或脐带血获得。在骨髓移植的情况下,HSC是从供体的大骨被移出,通常是盆骨,通过到达大骨中心的大针来进行。该技术被称为骨髓采集,在全身麻醉的情况下进行.外围血干细胞是同种异体HSCT的干细胞的常见来源。它们能够通过被称为分离(apheresis)的过程从血液被收集。供体的血液通过手臂上的无菌针来排出,并且通过移除白细胞的设备。可以将红细胞返回给供体。外周干细胞产量可以利用每天皮下注射粒细胞菌落刺激因子来增加,其中粒细胞菌落刺激因子用于将干细胞从供体骨髓移动到外周循环。
也能够从羊水提取造血干细胞。脐带血是从出生后婴儿的脐带血和胎盘来获得的。脐带血具有高于通常在成体血液中所找到的HSC的浓度。但是,从脐带血所获得的血的少量(通常约50ml)使其与成人相比更适合于向小孩的移植。但是可以使用多个单元。利用脐带血单元的体外扩增或者使用来自不同供体的两个脐带血单元的更新的技术使得脐带血移植能够在成人中使用。脐带血能够从新生儿的脐带血中进行收集。
与其他器官不同,骨髓干细胞能够被长期冷冻(低温保藏)而不破坏过多的细胞。这对于自体HSC是必要的,因为这些细胞通常是移植手术之前的数月从受体中收集而来的。在同种异体移植的情况下,为了避免冷冻和解冻过程期间可能发生的细胞损失,优选的是新鲜的HSC。同种异体的脐带血通常被冷冻保存在脐带血库中,因为其只能在分娩时可获得。为了低温保藏HSC,必须添加防腐剂DMSO,并且细胞必须在可控速的冰箱中被非常慢地冷却,以防止在冰晶形成期间发生渗透细胞损伤。HSC可以在通常使用液氮的低温冷冻柜中被存储数年。鉴于此,本发明涉及已经如文中所述进行存储的供体材料在被考虑用于移植之前的分型和风险评估。
本发明包括免疫反应的风险评估,优选的是移植前的风险评估,由此可以将任何给定的器官或组织视为用于移植的供体材料。例如,肾脏移植或与肾脏相关的移植是将肾脏植入患者(例如,患有晚期肾脏相关疾病)的器官移植。根据供体器官的来源,肾脏移植通常被分为已故供体(原名为尸体)移植或活体供体移植。根据供体与受体之间是否存在生物学关系,活体移植通常被进一步称为相关(活体相关)移植或非相关(活体非相关)移植。
同种异体反应性被定义为淋巴细胞或者抗体与同种异体抗原的反应,其中同种异体抗原可以被理解为来自外源材料的抗原。同种异体抗原识别可以经由直接或间接的同种异体抗原识别来发生,由此T细胞可以识别同种异体抗原并且潜在地导致器官移植之后的移植排异反应。
移植物抗宿主病(GVHD)是伴随同种异体细胞、组织或器官移植的相对常见的并发症。它通常与干细胞或骨髓移植相关联,但是该术语也适用于其他形式的组织移植物或器官移植。组织(移植物)中的免疫细胞(通常为白细胞)将受体(宿主)识别为“外源”。接着,被移植的免疫细胞攻击宿主的体细胞。如果所使用的血液产品未经辐照,GVHD也可以发生在输血之后。
蛋白酶体是在所有真核细胞和古细菌内部存在的,在一些病毒中也存在的蛋白质复合物。在真核细胞中,它们位于细胞核和细胞质。蛋白酶体的主要功能是通过蛋白酶解(破坏肽键的化学反应)来降解不需要的或受损的蛋白质。由MHC I类分子所呈递的大多数抗体肽是由蛋白酶体对于细胞内部的蛋白质的降解所产生的。错配HLA抗原的蛋白酶体降解能够通过文中所描述的计算工具来进行预测.
附图说明
图1:肽的切割和结合的模拟的示意图
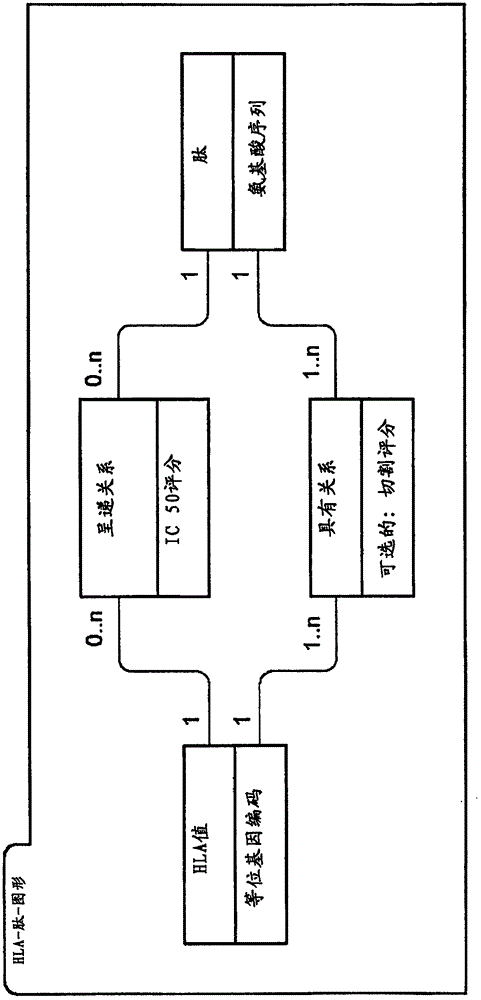
图2:图形数据结构的示意图。从功能角度,算法的核心数据结构包括HLA值、肽以及这些实体之间的关系。
图3:图形数据结构的示例包括肽节点以及HLA值实体,并且“具有”或“呈递”所述实体之间的关系。
图4:优选地经由服务整合管理器(表现层)进行组合的HLA配型和PIRCHE配型软件模块的示意图。
图5:提供作为示例的潜在系统构架的更详细总览。
图6:提供本发明的软件实现的示意图,具体是与基于网络的SaaS(网络即服务)链接的PIRCHE模块,与医疗咨询委员会进行组合。
示例
图形数据结构的相关信息
本发明的图像数据结构基本上包括所有的MHC I类HLA等位基因,并且对于每个等位基因列出具有针对蛋白酶体切割预测的评分值的所有可能的肽。在一个实施例中,预测是基于NetChop C term 3.0预测方法。该信息包括:
·HLA-ID:如IMGT/HLA数据库中所定义的HLA等位基因的ID(访问号)
○示例:HLA00005
·肽:长度为5至15个氨基酸,优选地是7至11个氨基酸,更优选地是9个氨基酸的肽。MHC I类所呈递的肽的最常见长度是7至11个氨基酸。
○示例:MAVMAPRTL(SEQ ID NO 1)
·切割评分:表示针对肽的切割预测的从0.00到1.00的值
○对于MAVMAPRTL(SEQ ID NO 1)的示例评分值:0.583079
○越高的值表示越高的切割可能性。
该评分体现肽与它所来源于的HLA等位基因之间的关系属性。
除了可以导致肽切割的原始HLA等位基因之外,该数据结构还包括可能通过任何给定的MHC I类或MHC II类HLA等位基因所呈递的所有肽的关系。针对每个可能被呈递的肽,列出了体现结合亲和力的IC 50评分(优选地是通过NetMHCpan来生成),其被认为是肽与它被给定的HLA等位基因进行呈递的可能性之间的关系属性。
·IC 50评分:表示肽的结合亲和力的从0.00到2000.00的值
○MMVLQVSAA(SEQ ID NO 2)的示例评分值:285.57
○越低的值表示越高的亲和力。
针对HLAII类分子可以呈递下面的信息:
·肽:长度优选为15个氨基酸的肽。MHC II类分子所呈递的抗原通常要长于I类分子所呈递的抗原。因此,对于结合预测,使用15个氨基酸的长度。
○示例:RAYLEGTCVDGLRRY(SEQ ID NO 3)
·评分:表示肽的结合亲和力的从0.00到2500.00的值
○RAYLEGTCVDGLRRY(SEQ ID NO 3)的示例评分值:476.80
○越低的值表示越高的结合亲和力。
概述1:针对MHC I类HLA确定PIRCHE:
将下面所述的方法设计为以移植物vs宿主(Graft vs.Host,GvH)方向来进行。
确定可能由共享的HLA来呈递的所有受体特异性肽:
在开始方法之前,找出受体与供体之间的错配HLA等位基因,或者如方法中的初始步骤,包括例如:
a.HLA等位基因匹配:共享的HLA
b.HLA等位基因错配:错配的HLA
1.对于错配的受体HLA等位基因:
a.确定切割预测>0.5的所有肽(阈值可以调整)
2.对于受体的每个共享的I类HLA等位基因:
a.针对在1.a中所确定的所有肽筛选是否存在IC 50评分<500的关系(阈值可以调整)
对于所有供体HLA值,确定可以潜在地由共享的HLA呈递的肽:
3.对于每一供体HLA等位基因:
a.确定切割预测>0.5的所有肽(阈值可以调整)
4.对于供体的每个共享的I类HLA等位基因:
a.针对在3.a中所确定的所有肽筛选是否存在IC 50评分<500的关系(阈值可以调整)
针对每个共享的HLA,将供体与受体的已确定肽进行比较:
5.和6.针对每个共享的HLA等位基因:
a.确定由受体HLA分子所呈递而未被对应的供体HLA分子所确定的所有肽
针对MHC II类HLA来确定PIRCHE II:
-基本方法与I类HLA相同
-独立于切割评分来处理所有的肽
-使用15mer肽用于结合预测
优选实施例:
-优选支持分子高分辨的等位基因编码(例如,A*02:01)
-优选支持基因座A*、B*、DRB1*以及DQB1*
实例:
表1.:HLA错配的示例
示例概述:
1.必须确定错配的HLA(C*07:04)的所有受体肽(利用某些阈值)。
2.对于每个共享的HLA(A*01:01、A*11:01、……),必须筛选它能够潜在呈递1中所确定的肽中的哪一个(利用某些阈值)。
3.确定供体的所有HLA值的所有肽。
4.对于每个共享的HLA(A*01:01、A*11:01、……),必须筛选它能够潜在呈递3中所确定的肽中的哪一个(利用某些阈值)。
5.对于每个共享的I类HLA分子:任何不包括在4的肽组中的2中所确定的肽是PIRCHE I。
6.对于每个共享的II类HLA分子:任何不包括在4的肽组中的2中所确定的肽是PIRCHE II。
这意味着因为一个肽能够由不只一个HLA分子来呈递,所以它理论上能够导致不只一个PIRCHE。
表2.:下表表示只考虑基因座C*和DRB1*的示例,并且基于人工肽数据来说明此概念。
示例1:
1.必须确定错配的HLA(C*07:04)的所有受体肽(利用某些阈值)。
-受体“具有”肽A、B、C、D、E、F、G。
2.对于每个共享的HLA,必须筛选它能够潜在呈递1中所确定的肽中的哪一个(利用某些阈值)。
-对于DRB1*03:01的HLA分子能够潜在呈递肽C和Y。由于供体不“具有”Y,所以该HLA分子实际上只能呈递C。对于错配的HLA分子,被呈递的肽不相关。
3.确定供体的所有HLA值的所有肽。
-供体具有肽A、B、H、D、E、F、G。
4.对于每个共享的HLA,必须筛选它能够潜在呈递3中所确定的肽中的哪一个(利用某些阈值)。
-对于DRB1*03:01的HLA分子能够潜在呈递肽C和Y。由于供体不“具有”C或者Y,所以该HLA分子实际上不呈递任何肽。对于错配的HLA分子,被呈递的肽不相关。
5.对于每个共享的I类HLA分子:任何不包括在4的肽组中的2中所确定的肽是PIRCHE I。
6.对于每个共享的II类HLA分子:任何不包括在4的肽组中的2中所确定的肽是PIRCHE II。
-在受体与供体之间将DRB1*03:01的被呈递肽进行比较导致在受体中仅被呈递的肽C。由于DRB1*03:01是II类等位基因,因此是PIRCHE II。
示例2:
-在该示例中,假设等位基因C*07:02具有肽A、H以及C,即供体现在“具有”肽“C”。
-DRB1*03:01HLA分子能够潜在呈递C肽。
-在受体与供体之间将DRB1*03:01的被呈递肽进行比较,导致受体的所有肽也被供体所呈递。因此,对于DRB1*03:01,不存在PIRCHE。
数据结构
从功能的角度,算法的核心图形数据结构包括HLA值、肽以及这些实体之间的关系(见图2)。
HLA值“具有”许多个肽,意味着HLA值的氨基酸序列的蛋白酶切割可以潜在导致相关的肽。对于I类HLA,这种切割的可能性通过切割评分来表示。对于II类HLA切割,由于切割模式可能尚未完全清楚,优选地不保持该值。
而且,HLA值可以“呈递”许多肽,意味着肽可以被绑定到细胞表面的HLA分子并且由其进行呈递.IC 50评分表示肽与HLA分子的实际结合的可能性。IC 50评分是针对与I类HLA值和II类HLA值的关系来进行确定的。
优选地,使用具有9个氨基酸的序列的肽作为由I类HLA所潜在呈递的肽,而使用具有15个氨基酸的序列的肽作为II类HLA所潜在呈递的肽。但是其他的肽长度也可以包括在随后的发布中。
图形数据结构提供HLA值实体、肽实体以及这些实体之间的关系。该结构包括所有相关的肽,以及针对所有相关的HLA值实体的对应切割评分,包括I类结合预测和II类结合预测。
图3中的示意图表示该数据图形的示例片段。该数据结构能够以上面的示意图中所示的形式被理想地存储在图形数据库中。可替换地,适合的存储概念包括在键值存储中的存储以及相关的数据库的表中的存储。
如图3的示例中所示,通过图形结构化的数据模型对于真实世界实体的抽象化理想地反映了生物学背景。因此,对于系统中数据的实际存储而言优选的是图形数据库。各个实体被存储为唯一的节点,因此能够有效处理数据。
键值存储提供数据的高效查询,但是因为各个实体可能被多余地存储,所以大小就尺寸而言不是最优化的。此概念体现本发明的一个实施例,特别是如果性能成为技术问题并且对于高速缓存而言是理想的。
相关的数据库管理系统针对汇集数据进行优化,并且也提供理想的存储,但是将需要针对大数据表的频繁的联合(join)操作。这将对性能有负面的影响。
图形数据库对于高度连接的数据是最优化的,并且能够结合理想的最小化存储大小来进行对于各个关系的高性能访问。而且,当文中所描述的匹配方法中所待考虑的生物学背景因素被扩展,而域模型变得更加复杂时,图形结构能够进行这样的扩展的理想整合。
应当考虑下面的范围:
肽:~3.000.000(~1.832.000 9mer肽+15mer肽)
HLA值:~10.000
关系:~10.000*1000
只包括图形结构中的能够潜在地由至少一个HLA分子进行呈递的那些肽是充分的并且是优选的。
系统构架
图4公开了将HLA配型与PIRCHE配型进行组合的软件模块的示意表示,优选地经由服务整合管理器(表现层)。
将PIRCHE配型设计为能够整合到其他应用中的服务组件。这样能够提供PIRCHE配型服务既作为独立的服务,又整合到如HLA配型系统的现有应用中。
由于PIRCHE配型服务需要具有患者和供体之间的识别出的HLA配型和错配,整合到现有HLA配型系统是理想的组合。
由于PIRCHE配型服务更喜欢高分辨率分型的HLA等位基因值,而对于一些供体通常无法找到这样的值,因此高分辨率HLA基因型的评估服务是导致更加复杂的解决方案的另一个服务整合。
HLA配型服务、高分辨率HLA基因型的评估服务、以及PIRCHE配型服务的组合提供如下的新可能性:该方案对于非高分辨率分型的供体进行大规模登记的实用性,将所有服务的结果整合到一个评分系统中,从而根据HLA配型、高分辨率HLA评估、PIRCHE以及其他因素(例如,细胞数、血型、感染疾病标记、性别以及年龄相结合)将供体进行排名。对于搜索协调者或者医生,这将能够在更短时间内识别更好的HSCT供体,从而得到更好的治疗效果。
PIRCHE配型服务接受分子的高分辨率的患者HLA数据、搜索配置文件以及(例如,匹配的供体或CBU的)分子高分辨率HLA值的列表,即已经识别出的匹配和错配的HLA值。
基于HLA-肽-图形,HLA-肽-匹配算法分析每个供体/CBU的PIRCHE I值和PIRCHE II值,并且将富有PIRCHE信息的给定供体/CBU列表返回到服务客户端。
为了将服务整合到另一个系统中,优选的是具有一个优越的服务整合管理组件,该组件是服务客户端,安排它与其他服务(如HLA配型服务和高分辨率HLA基因型评估服务)一同提供复杂的方案。
图5提供了潜在系统构架的更详细总览作为一个示例。
图5中的示意图更详细地描述PIRCHE配型服务组件。该匹配服务包括主服务层和一些子组件,最重要的是肽分析器、被呈递肽分析器、PIRCHE分析器以及HLA-肽-图形管理器。而且,它包括HLA-肽-图形存储和许多高速缓存来提高性能。
PIRCHE配型服务由客户利用匹配请求数据结构进行调用,并且提供匹配响应数据结构作为结果。
匹配请求数据结构包括搜索配置文件和患者/供体HLA配型组的组。搜索配置文件具体说明切割阈值、肽结合亲和力的IC 50评分阈值以及所请求的匹配方向(移植体vs宿主或者宿主vs移植体)。
患者/供体HLA配型组包含患者和供体的HLA配型结果。即,它包含患者和供体之间的共享HLA值和错配HLA值。由于错配是根据患者供体组合,必须针对每个待分析的供体进行提供。另外,它包含用于识别目的的患者的ID和供体的ID。
匹配响应包括PIRCHED HLA配型组。每个组包括一组PIRCHED HLA值,每个PIRCHED HLA值包括HLA值以及所确定的PIRCHED I和PIRCHED II的对应数量。另外,PIRCHED HLA配型组包含针对所考虑的HLA基因座的PIRCHED I和PIRCHED II的总数量、患者的ID以及供体的ID用于识别目的。
在内部,该系统可以由下面的子组件组成:
-HLA-肽-图形管理器负责创建和更新HLA-肽-图形。
-肽分析器利用可选的切割阈值,基于针对一组给定的HLA值的HLA-肽-图形来确定HLA衍生肽。
-被呈递肽分析器基于HLA-肽-图形,利用给定的IC 50评分阈值,确定一个给定组中的哪一个肽潜在地被呈递在一组给定的HLA分子上。该结果包括针对每个给定HLA值的一组潜在被呈递的肽。
-PIRCHE分析器取得HLA值以及患者和供体的被呈递肽的对应组,并且针对每个HLA值确定PIRCHED I或PIRCHED II的数量。
组合的HLA配型/PIRCHE系统的主要使用情况
1.用户登录到HLA配型/PIRCHE系统
2.用户创建新患者
3.用户输入患者HLA
4.用户浏览进行搜索
5.用户配置搜索配置文件并且开始搜索
6.系统利用搜索配置文件设置来执行搜索
7.系统显示搜索结果屏幕
8.用户能够在CBU结果列表与供体结果列表之间进行切换
9.用户将供体输出为csv文件(可选的)
在一个优选实施例中,可以显示供体搜索结果并且在CBU和供体搜索结果之间进行切换。
供体类型搜索
该方案将包括供体基因型数据库,该供体基因型数据库上能够针对给定患者来执行PIRCHE配型服务,从而确定潜在供体类型列表,该列表具有允许错配的基因型。
供体搜索结果屏幕的列是:
-供体类型ID
-评分(对于第一版本:PIRCHED I+PIRCHED II,随后可能进行扩展)
-HvG(宿主vs移植物错配)
-GvH(移植物vs宿主错配)
-A*
-B*
-C*
-DRB1*、
-DQB1*
-PIRCHED I
-PIRCHED II
-频率(基于用于创建供体基因型数据库的单体型频率的该供体的基因型频率)
-(供体的种族类型将添加在随后的发表中)
供体基因型数据库将能够搜索具有允许错配的供体基因型。在实际供体的现有供体登记中的典型搜索将导致根本无法得到10/10匹配的供体基因型,例如如果这样的一个供体并不存在于进行搜索的注册中。通过利用HLA和PIRCHE配型来搜索供体基因型数据库,可以确定基因型搜索模板,该模板能够将进一步的搜索引导至正确的方向,例如通过识别在某些登记中频繁出现的供体类型,例如因为社会性别(gender)、生理性别(sex)、种族等……
PIRCHE配型模块还能够用于匹配真实的CBU和供体。用户能够在CBU库存、真实供体库存以及供体基因型数据库之间进行切换。
HLA图形数据库提高PIRCHE速度
出于验证的目的,生成患者与伴随的供体的人工测试文件。该文件包含26.000对理论的患者&供体的造血干细胞,在10HLA分型之中的10个中具有1个错配,以及通过每个配对所生成的PIRCHE I+II值。
构建原则如下。患者和供体在HLA-A基因座中具有1个血清错配。该错配固定在位置上,并且这种等位基因贯穿所有下面的配对。下面的患者&供体对通过在患者和供体的位点上同时置换HLA基因座的所有现有等位基因HLA-A、HLA-B、HLA-DRB1以及HLA-DQB1来进行变化。匹配或共享的等位基因的置换即使是针对这种每个对中的单一固定错配也会引起不同的PIRCHE值。
此文件用于验证算法从较早的Perl脚本实现转换到新的HLA图形数据库结构的正确性。当所有的PIRCHE值在原始的Perl脚本中与在图形数据库中相同时,给出正确性。
原始的实现需要11小时来执行针对所有26,000个对的计算。本文中所描述的利用图形数据的实现只花费10秒来执行所有26,000个PIRCHE的计算。
速度的改善以及基于用户界面的网络浏览器现在使得该算法能够进行交互式使用。现在,1个患者与10至100个潜在供体的临床运行情况运行不到1秒。能够非常快速地将患者与不同池的潜在供体进行比较(例如来自不同的登记或不同的国家)。无需等待,答案马上出来,并且在网络浏览器提供针对网络的接口的任何位置可以获得。
因此,图形数据结构不仅提供改进的计算速度。由于数据结构的生物背景、数据中所呈递的生物样品(非直接地,而是假设该数据与患者样品间接对应)、以及最终改进的识别允许的错配HLA供体材料的速度,本发明提供出乎意料的技术效果和优势。至今,可允许的错配HLA供体材料的选择和匹配的较早方法速度慢并且受限于所使用的生物方法(即,只搜索10/10匹配)以及先前所使用的相对低效的计算方法。
因此,除了为了更快速的计算所使用的新颖数据结构以外,通过关于生物背景的新颖特征与识别可允许的错配(间接呈递vs直接呈递)所使用的原理的组合来限定本发明。这些特征的组合引起意想不到的协同作用,带来快得多的处理时间,因此整个新颖的方法朝向从世界各地查询多个造血干细胞或供体组织数据库以及登记处,努力搜索以找到可允许的供体材料。
软件实现
将文中所描述的系统并入到能够访问潜在的HLA图形数据库的直观可视化浏览器界面。该可视化界面还引起PIRCHE速度的改进,并且启用在供体材料搜索期间的更多交互运行的模式。关于HLA配型的先前尝试和相似的搜索引擎严重受限于它们的慢处理时间。根据自组织的早期系统,在发送请求之后,在最初的一或更多天提供针对特定查询的结果。
图形数据库结构启用测试文件运行时间从11h减少至10sec(≈26.000患者/供体对)。
该系统的软件实现将“软件即服务”(Software as a Service,SaaS)Json-REST界面进行并入,允许将PIRCHE整合到任何给定的现有供体选择系统。因此,可以将本发明(数据结构及其查询)本身作为能够与其他HLA配型服务整合的模块来进行呈递。
- 还没有人留言评论。精彩留言会获得点赞!