用于MALDI的样品制备方法及其自动化系统与流程
相关申请的交叉引用本申请要求在2014年8月18日提交的美国临时申请no.62/038,509的申请日权益,该申请的公开内容在此通过引用被并入本文。
背景技术:
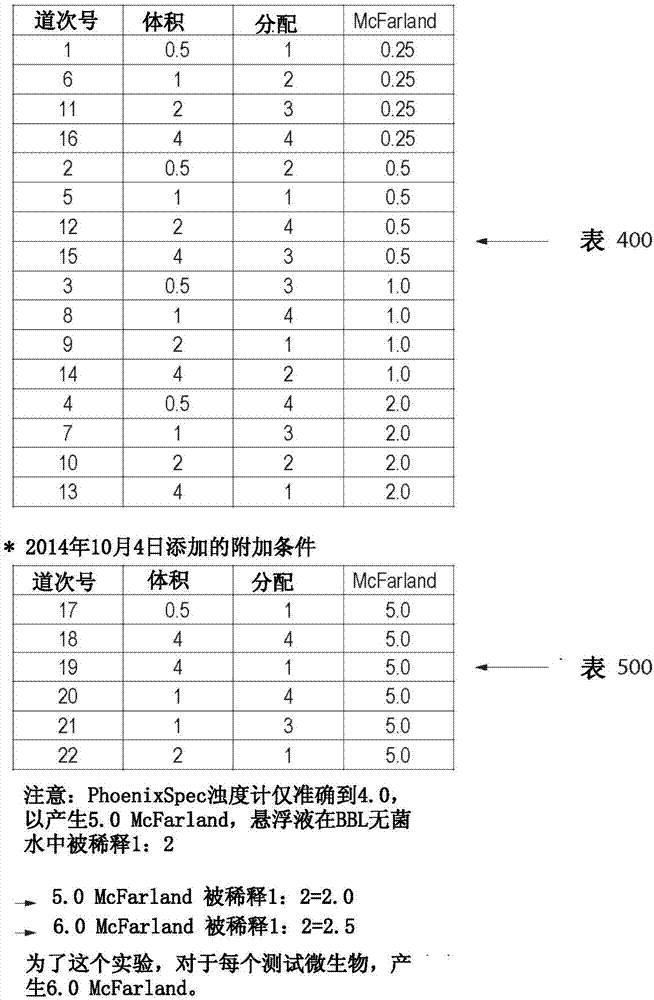
:作为医学诊断和治疗中的惯例,从患者获得诸如血液或尿液的生物学样品并分析微生物的存在。如果确定微生物存在,则进行医学和经济学两方面的论证以鉴别存在的具体微生物,并且为了促进治疗还鉴别出该微生物的抗生素抗性/易感性。通常必须快速进行这样的确定以确保尽可能快地开始正确的治疗。例如,败血症是由于宿主免疫系统对感染的极大响应而导致的严重医学病症。它能够触发大面积炎症,从而能够产生受损的血液流动。当败血症发作时,身体的器官会缺少氧气和营养,从而造成永久损伤和最终的衰竭。在不够恰当的诊断或未作治疗的情况下,心脏衰弱并且会发生感染性休克,从而导致多器官衰竭和死亡。需要血培养来检测败血症患者的血液内细菌或酵母菌的存在,以鉴别(一种或多种)微生物的存在并指导治疗。从血培养中进行(一种或多种)微生物的常规分离和鉴别花费至少24-48小时,这导致许多败血症患者刚开始是用不恰当的抗生素治疗的。因此希望的是快速从阳性培养(血液、脑脊髓液等等)中分离并鉴别微生物。近来,已经显示,某些蛋白质组学技术/工具,诸如基质辅助激光解吸离子化飞行时间质谱术(“maldi-tofms”)(下文中的“maldi”),提供了从阳性血培养(“pbc”)或从在诸如琼脂平板的基底上生长的细菌菌落中快速且准确地鉴别出细菌和/或真菌。在maldi过程中,来自在营养培养基中以常规方式培养的菌落的少量微生物被转移到被称为maldi板的质谱样品支撑板,并且然后直接进行质谱分析,一般是通过飞行时间(tof)进行。该质谱分析显示出不同的蛋白质,前提是它们在微生物中以足够的浓度存在。接着由微生物的蛋白质特征曲线、通过对包含数千个参考谱图的谱图库进行计算机检索来确定微生物的身份。如果在库中针对所检查的确切物种的微生物不存在参考质谱图,则具有更宽松的相似性要求的计算机库检索能够提供对于微生物的顺序、家族或属的至少某些指示,因为相关的微生物往往包含多种相同的蛋白质类型。在ulrichweller的、标题为“identificationofpathogensinbodilyfluids(体液中病原体鉴别)”的国际公开号wo-2009/065580a1中进一步详细地描述了maldi过程,该申请的全部内容在此被并入。可以使用多种质谱仪器用于鉴别。pbc样品中的微生物能够在maldi鉴别之前例如在琼脂平板上进行传代培养。在替代方案中,能够使用不同的样品制备方法将微生物从pbc样品中分离,而不需要进行传代培养。一般将微生物分离物直接涂到maldi板上以获得约70%-80%的鉴别准确性。对于未给出任何鉴别的分离物,典型地使用后续液体提取方法来从微生物中提取蛋白质以用于改善的maldi-tofms鉴别。虽然这些液体蛋白质提取方法通常给出了更好的鉴别准确性,但这样的方法不仅要求若干离心步骤而且还是费时的。schmidt,v等人“rapididentificationofbacteriainpositivebloodculturebymatrix-assistedlaserdesorptionionizationtime-of-flightmassspectrometry(通过基质辅助激光解吸离子化飞行时间质谱术快速鉴别阳性血培养中的细菌)”,eur.j.clin.microbiol.infectdis.第31卷第3期,第311-317页(2012年3月)(电子出版日2011年6月23日)公开了一种从阳性血培养中鉴别细菌的方法,该方法是将被隔离细菌的液体样品点到maldi板上并在所点的液体样品上直接覆盖25%的甲酸。因此,细菌样品中甲酸的最终浓度是小于25%。schmidt的方法对革兰氏阴性细菌得到了86.6%的鉴别准确性并且对革兰氏阳性细菌得到了60%的鉴别准确性。schmidt没有报告以酵母菌试验这种方法。hyman,j等人(美国专利公开号2010/0120085,公开日2010年5月13日)公开了与schmidt相似的方法,其中将完好的处于溶液中的被分离微生物直接涂到maldi板上。接着将该液体样品用大致相等体积的50%甲酸覆盖。因此,添加至样品中的甲酸的最终浓度是大致25%。在14个不同物种的细菌和酵母菌上试验了这种方法。虽然此方法获得了91.1%的鉴别率,但该数据没有指示此方法对革兰氏阳性细菌、革兰氏阴性细菌或酵母菌有多有效。haigh等人“improvedperformanceofbacteriumandyeastidentificationbyacommercialmatrix-assistedlaserdesorptionionisation-timeofflightmassspectrometrysystemintheclinicalmicrobiologylaboratory(在临床微生物学实验室中通过商用基质辅助激光解吸离子化飞行时间质谱术系统进行细菌和酵母菌鉴别的改进性能),”j.clin.microbiol.第49卷第9期,第3441页(2011年9月)描述了一种方法,其中使用无水甲酸来提取直接涂到maldi板上的微生物蛋白质。然而,这种方法不能成功地鉴别酵母菌和革兰氏阳性细菌的所有菌株。herendael等人“validationofamodifiedalgorithmfortheidentificationofyeastisolatesusingmatrix-assistedlaserdesorption/ionisationtime-of-flightmassspectrometry(maldi-tofms)(修正后算法在使用基质辅助激光解吸/离子化飞行时间质谱术(maldi-tofms)鉴别酵母菌分离物中的验证)”,eur.j.clin.microbiol.infectdis.第31卷第5期,第841-848页(2012年5月)(电子出版日2011年8月23日)描述了用于鉴别酵母菌的两种方法。herendael等人描述的标准提取方法是常规的液体提取方法。在herendael等人描述的短的提取方法中,从琼脂平板挑选出一个菌落并直接施加到目标maldi板上。将甲酸(1μl,浓度为70%)加入该样品中并允许该样品干燥。将干燥后的样品用maldi基质覆盖、允许其进一步干燥、并通过maldi-ms进行分析。该短的提取方法提供了与该标准提取方法相同的结果,但短的提取方法的maldi分数较低。用该短的提取方法可以鉴别几乎所有的分离物(97.6%);然而这些鉴别率中的17.1%低于1.7的可靠阈值水平。虽然该提取方法提供了准确的结果,但检测时间(ttd)远小于通过直接涂进行的检测。因此,寻求使用直接涂maldi改善了鉴别准确性的方法。技术实现要素:所公开的方法的各种实施例能够实现从阳性血培养(“pbc”)或在基底上培养的细菌菌落的纯分离物中通过使用maldi的质谱术来直接鉴别微生物。在本发明的一个实施例中,使用溶液分配/分层方法来制备用于maldi的样品。在本文描述的溶液分配/分层方法中,首先对将分配的细菌悬浮液进行评估以确定其浊度作为对该悬浮液中细菌浓度的指示。用于测量浊度的一种这样的标准方法是mcfarland浊度标准。mcfarland浊度标准是本领域技术人员公知的并且在此不详细说明。该细菌悬浮液可以使用诸如以下方法的一种方法来创建:在botma等人的标题为“automatedselectionofmicroorganismsandidentificationusingmaldi(自动选择微生物并使用maldi进行鉴别)”的wo2013147610中、以及在armstrong等人的标题为“methodandapparatusforidentificationofbacteria(鉴别细菌的方法和设备)”的美国专利公开2012/0009558中描述的方法,所述专利公开的全部公开内容通过引用在此被并入。该溶液分配分层方法如其名字所暗示的,要求形成两层或更多层溶液以用于maldi。将选定体积的样品施加在maldi板上并进行干燥。随后,施加至少第二层样品(优选与第一层体积相同)。将第二层干燥。任选地,能够沉积更多的层并干燥。在干燥了最后这两层或更多层之后,对样品进行处理以用于maldi(例如,如在此描述的通过添加甲酸并接着在样品上施加基质)。然后通过maldi来评估样品。已确定该溶液分配/分层方法以对液体样品提供可接受的maldi结果,其中革兰氏阳性和革兰氏阴性细菌二者的mcfarland浊度值显著小于2.0。例如,在一个实施例中,如果如以上提及的,该液体细菌悬浮液(由从琼脂平板挑选出的并且悬浮在水中的细菌菌落制备而成(质谱级别))具有0.5mcfarland的值,该值显著低于2.0mcfarland的值,这表明应该使用该溶液分配/分层样品制备来制备用于maldi的这个样品。在确定使用溶液分配/分层来制备用于maldi的样品之后,选择每层的样品量。在样品具有0.5mcfarland值的以上示例中,选择每层至少约3μl但不超过约4μl的体积。层数由浊度值和样品体积决定。一旦选择了层的体积并沉积在maldi板上,就将样品干燥。具体的干燥条件与设计选择有关并且被选择来提供快速干燥同时保留样品完整性以进行maldi测试。适当的干燥条件是本领域技术人员容易确定的。例如,干燥步骤能够在环境温度下或借助于热板(例如,约40℃至约45℃)完成。干燥之后,在该第一层上沉积第二层样品。第二层具有与第一层相同的体积。如果需要,则添加额外的层并将其干燥。由于该分层方法要求额外的时间和资源,因此层数局限于从maldi获得准确结果所需要的那个数。在该溶液分配/分层样品沉积之后,使用标准的maldi的程序(添加70%甲酸和基质)对样品目标孔进行处理。已经确定,用于maldi的样品制备过程取决于多个因素,但最显著的是:i)样品中微生物的浓度;ii)样品的体积;以及iii)如果适用,分配次数。微生物浓度是由样品的浊度来反映的。大致上,浊度越高,微生物浓度越高。在此描述的方法以样品浊度测量开始。使用技术人员公知的技术和仪器通过标准比浊法来测量浊度。在此不对比浊法进行详细说明。一旦估计出了浊度,则确定如何进行用于maldi的样品制备。此确定是通过评估浊度信息和样品体积作出的。在本发明的、考虑自动化评估和确定的那些实施例中,将样品信息录入数据库中。该数据库(预编程有关于最适合特定样品的样品制备的信息)输出maldi样品制备的推荐方法。在另一个实施例中,考虑了一种用于评估样品并确定适当maldi制备方案的系统。优选地,该系统是全自动化的。在该系统的自动化实施例中,处理器根据该处理器接收到的关于样品的信息来控制maldi制备方案。样品从pbc直接获得或是从平板培养中挑选出。在该自动化系统中,使用自动装置(robotics)获得样品。获得用于测试的生物学样品的自动机构是技术人员公知的并且在此不进行详细说明。在另一些实施例中,该系统是半自动化的。在半自动化的实施例中,样品手动地获得。在获得样品之后,将其稀释。在该自动化系统中,通过来自该处理器的指令来控制稀释。该系统使用如上所述的无菌水将样品稀释到预定体积(例如,4.5ml)。在半自动化的实施例中,稀释也能够手动地进行。一旦样品被稀释,则该系统就测量样品浊度。优选地,该系统采用自动化仪器来测量浊度。用于测量样品浊度的自动化仪器是本领域技术人员公知的并且在此不详细说明。在半自动化的实施例中,样品被手动地测量。该系统处理器将测量的浊度与预定的浊度阈值进行比较。如果该处理器确定样品浊度是在预定的浊度值范围内,则该处理器提供指令来将预定体积的被稀释样品传递至maldi板。该自动化系统基于来自处理器的指令来制备用于maldi的样品(即,添加甲酸以破坏微生物的细胞壁从而释放其蛋白质、之后在maldi之前在样品上施加maldi基质溶液,如本文其他地方所描述的)。在半自动化系统中,一旦接收到将该体积的样品沉积在maldi板上的指令,则手动地准备该maldi板。如果处理器确定浊度高于预定的范围,则该处理器提供指令来使用小于该标准体积(即,如果在maldi板上正常沉积0.5μl,则不同于高浊度样品,在maldi板上沉积仅0.25μl)制备maldi样品。如果处理器确定浊度低于预定的范围,则将该样品分层地沉积在maldi板上,在这些沉积之间干燥该样品。以上描述了在maldi板上沉积多层的样品。如上所述,在全自动化的实施例中,该系统基于来自处理器的指令自动地在maldi板上沉积样品。在半自动化的实施例中,操作者基于来自处理器的指令在maldi板上沉积样品。附图说明图1是用于建立在本文描述的方法的一个实施例中使用的统计模型的数据的图示,包括所使用的参数以及所使用的参数的值;图2图示了用于开发本文描述的统计模型的附加条件;图3a和图3b是用来试验本文描述的方法的微生物的列表;图4a到图4c是来自统计模型的表面响应曲线图,图示了哪些maldi样品制备参数获得可接受的maldi结果;图5描绘了针对不同的样品制备参数,来自maldi(物种鉴别)的(图3中列出的细菌的)正确鉴别数;图6a和图6b将多种不同微生物通过多次分配、进行和不进行干燥而制备的0.25mcfarland样品的maldi分数进行比较;图7a到图7c将多种不同微生物通过不同样品体积/分配次数而制备的0.25mcfarland样品的maldi分数进行比较;图8是本发明的实施例的流程图,其中样品制备基于所测量的样品浊度;以及图9是用于实施本文描述的方法的系统的示意图。具体实施方式本发明考虑使用溶液分配/分层技术来制备用于maldi的样品的方法,其中在maldi板上分配多层样品。在多次分配之间对所分配的样品进行干燥。在此图示了这样的一种方式以提供用于多种多样微生物的maldi分数的改善。本领域技术人员知晓,maldi鉴别结果受maldi板上沉积的细胞量的影响。标准化的微生物悬浮液提供了细胞的均匀分散,从而导致更精确且可复制的结果。在一个实施例中,该微生物悬浮液在沉积到固体表面之前被标准化,该固体表面被适配成将放入被配置为通过maldi质谱术确定微生物身份的设备中。该微生物悬浮液能够任选地被调节到某个mcfarland标准。该标准化的微生物悬浮液的创建能够通过本领域技术人员公知的各种方法来完成,例如使用接种环、微滴管或其他物理方法。在一个优选的实施例中,将微生物悬浮液在接种到maldi板上之前调节到至少0.25的mcfarland标准。对接种条件(即,分配体积和分配次数)进行选择以提供有可能给出可接受的高maldi分数——优选为至少约2或更高——的样品。在所描述的实施例中,制备了用于图3中列出的微生物的样品以进行maldi。下文描述了用于制备样品来进行maldi的若干不同方法。方法1:首先,制备图3a中列出的每种微生物在无菌稀释剂(例如,bbltm(bectondickinson))中的2.0mcfarland。在maldi目标板上形成三个点。每个点的体积为1μl。然后使用在约40℃至约45℃的热板将样品干燥。该maldi目标板从bruker获得。在样品被干燥之后,将1μl的70%甲酸施加在该点上。再次干燥样品。然后将1μl的d-氰基-羟基桂皮酸(hcca)基质布置在该点上,并且将样品干燥并在brukermaldi上使用仪器标准设置进行分析。maldi成功地鉴别图3a中列出的29种微生物中的28种的属和物种。方法2:首先,使用无菌稀释剂稀释样品来制备图3a中列出的每种微生物的1.0mcfarland。在maldi目标板上形成三个点。每个点的体积为2μl。然后使用在约40℃至约45℃的热板将样品干燥。该maldi目标板从bruker获得。在样品被干燥之后,将1μl的70%甲酸施加在该点上。再次干燥样品。然后将1μl的hcca基质布置在该点上,并且将样品干燥并在brukermaldi上使用仪器标准设置进行分析。maldi成功鉴别了图3a中列出的29种微生物中的26种的属和物种。方法3:首先使用无菌稀释剂制备图3a中列出的每种微生物的1.0mcfarland。在maldi目标板上形成三个点。每个点的体积为1μl。然后使用在约40℃至约45℃的热板将样品干燥。在经干燥的点上的每个上形成另一个1μl。然后将那些点干燥。该maldi目标板从bruker获得。在样品被干燥之后,将1μl的70%甲酸施加在该点上。再次干燥样品。然后将1μl的hcca基质布置在该点上,并且将样品干燥并在brukermaldi上使用标准设置进行分析。maldi成功地鉴别图3a中列出的29种微生物中的29种的属和物种。示例1制备具有0.5mcfarland值的样品并评估通过maldi正确鉴别出的微生物的数目。首先使用无菌稀释剂制备图3a中列出的每种微生物的0.5mcfarland样品。根据下面的表1在maldi板上形成样品:表1mcfarland分配体积分配次数阳性鉴别(总计29种)0.51μl129种中的7种0.51μl2(分配之间进行干燥)29种中的28种0.51μl3(分配之间进行干燥)29种中的29种0.51μl4(分配之间进行干燥)29种中的29种21μl129种中的28种为了创建统计模型,对于三个参数中的每一个选择四个值。这四个值和与那些值相关联的参数在图1中的表200中列出。然后利用designofexperiment(doe)taguchidesign(可商购的,为本领域技术人员所公知并且在此不详细说明)将这些值载入minitab16中。这个初始设计使用图1的表100中列出的参数矩阵创建了16个实验道次的一个系列。表100枚举了与表200中的参数相关联的整数。表300枚举了每个道次的实际参数。这些道次在十五(15)种最难的细菌上实施,以使用来自图3b中的挑战组中(的maldi鉴别进行检测(与图3a中所枚举的那些相比更具挑战性的微生物矩阵来检测)。使用statistica版本12(可商购的软件,为本领域技术人员所公知)对数据进行编译和分析。所有三个参数——mcfarland、分配体积和分配次数——对于确定样品是否具有可接受的、给出正确maldi分数的机会都是重要的。创建表面响应曲线图并研究相互影响。这些表面响应曲线图显示,可接受的maldi结果将根据mcfarland、分配次数和体积的值而改变。曲线图显示,较高的mcfarland并不总是所希望的maldi分数(2.0或更高,用于属和物种确认)的关键。例如,2.0mcfarland和较低的mcfarland(例如0.5)可以给出相同的正确maldi结果,其中到目标板的分配体积更高(图4b)和/或分配/干燥循环的次数更大(图4c)。表500列出了用于maldi样品制备的、用于补充该模型的附加样品参数。这些样品具有显著更高的mcfarland值(约5.0)以确定上限的相互影响。使用brukermaldibiotyperlt来获得样品的maldi值。所有样品都是使用以上方案制备的。mcfarland、分配体积和分配次数的值在图1和图2中列出。对于图3b中枚举的每种微生物,执行图5中列出的道次1-22。当样品沉积完成时,将样品干燥并用1μl的70%含水甲酸固定。将该样品再次干燥并用1μl的brukerhcca基质密封。为了制备样品以获得希望的mcfarland值,将样品用5ml的无菌样品稀释剂进行稀释。使用bdphoenixtmspec浊度计和bdphoenixtmspec校准试剂盒方法实现所希望的mcfarland值。如图1中的表200列出的,样品使用以下值来制备:i)mcfarland值:0.25,0.5,1.0,2.0;ii)样品体积:0.5μl,1.0μl,2.0μl,4.0μl;以及iii)分配次数:1,2,3和4。当样品沉积完成时,将样品干燥并用1μl的70%含水甲酸固定。将该样品再次干燥并用1μl的brukerhcca基质密封。使用50%乙腈、47.5%的水和2.5%tfa来制备基质溶液。溶剂从西格玛奥德里奇(sigmaaldrich)获得。由于在每个微生物的每个板上制备了三个点,所以对于每个微生物获得三个maldi分数。因此对于表300和500(图1和图2)中枚举的22个道次,对于每种微生物获得66个maldi分数。从图5中能够看见,对于各种各样不同的参数,获得最高百分比的正确maldi分数(正确的结果是maldi分数为2.0或更高)。一般地,对于较低mcfarland值的样品而言,分配体积和次数需要更高,以得到更高百分比的正确maldi分数。例如,对于0.25mcfarland样品而言,需要4μl的分配体积和4次分配且在分配之间进行干燥来实现84%的正确maldi分数。示例2制备样品(0.25mcfarland)并用图3b中枚举的微生物来刺入(spike)。样品使用以上一般性描述的程序来制备。在maldi目标板上形成三个点。每个点的体积为1μl。然后在40℃至45℃的热板上将样品干燥。对每个样品制备两个目标板。该maldi目标板从bruker获得。在第一个板上,对所沉积的样品进行干燥,此后在干燥后的第一点上布置另一个1μl的样品点。在第二个板上,在其上沉积第二点之前不对第一点进行干燥。在这些点完全沉积之后,对两个板上的点进行干燥。接着,在两个板上的干燥后的点上施加1μl的70%甲酸。再次干燥样品。然后将1μl的hcca基质布置在该点上,并且将样品干燥并在brukermaldi上进行分析。maldi成功地鉴别通过在maldi板上多次沉积点之间使用干燥步骤而制备的那些样品中被刺入的样品的45个点中的39个(在属水平下)。maldi成功地鉴别通过在maldi板上多次沉积点之间使用干燥步骤而制备的那些样品中被刺入的样品的45个点中的29个(在物种水平下)。由于样品被刺入15个微生物中的一个并且每个被刺入的样品具有三个点,因此通过maldi来评估总计45个样品点。maldi成功地鉴别通过在maldi板上多次沉积点之间未使用干燥步骤而制备的那些样品中被刺入的样品的45个点中的39个(在属水平下)。然而,maldi-tof成功地鉴别通过在maldi板上多次沉积点之间未使用干燥步骤而制备的那些样品中被刺入的样品的45个点中的仅24个(在物种水平下)。在下表2中列出了这些结果的概览。结果是以三个中最好的那个报告的,而不是所有阳性的集合体。由此可见,对于在沉积之间具有干燥步骤与不具有干燥步骤相比检测多一个微生物。表2所评估的每个微生物的maldi分数在图6中列出。注意,低于1.7的maldi分数被认为是“未鉴别出”。在1.7与小于2之间的maldi分数被认为是属水平而不是物种水平下的阳性鉴别。2或2以上的maldi分数被认为在属和物种水平下都是阳性鉴别。对于在第一次与第二次分配之间被干燥的样品,属和物种水平下的阳性鉴别的百分比是64%,相比之下当样品在多次分配之间未被干燥时此鉴别是53%。这表明,对于使用maldi-tof进行的“低mcfarland”样品测试,本文描述的溶液分配/分层(有干燥)方法提供了超过多次分配之间无干燥的情况的一个显著优点。示例3制备样品(0.25mcfarland)并用图3b中枚举的微生物来刺入。样品使用以上一般性描述的程序来制备。在每个maldi目标板上形成三个点。对每个样品制备三个目标板。maldi目标板从bruker获得。在第一个板上,分配各自具有1μl样品的三个点。在第二个板上,分配各自具有2μl样品的三个点。在第三个板上,分配、干燥各自具有1μl样品的三个点并在每个干燥后的点上形成另一个1μl的样品点。在点完全沉积之后,对板上的点进行干燥。接着在这两个板上的干燥后的点上施加1μl的70%甲酸。再次干燥样品。然后将1μl的hcca基质布置在该点上,并且将样品干燥并在brukermaldi上进行分析。maldi成功地鉴别通过0.25mcfarland样品的单次1μl分配而制备的那些样品中被刺入的样品的42个点中的31个(在属水平下)。maldi成功地鉴别通过0.25mcfarland样品的单次2μl分配而制备的那些样品中被刺入的样品的42个点中的33个(在属水平下)。maldi成功地鉴别通过0.25mcfarland样品的1μl分配之后干燥并进行第二次1μl分配而制备的那些样品中被刺入的样品的42个点和中的36个(在属类水平下)。在下表3中以及图7中报告了这些结果。当结果以“三个中最好的”来报告时,显然最好的结果(最大量的不同微生物的正确id)使用0.25mcfarland以1μl/1μl通过分层来获得。表3在物种水平下,使用两次1μl分配而其间具有干燥步骤的溶液分配/分层方法在物种水平下提供了24个正确鉴别(相比之下2μl单次分配为18,而1μl单次分配为10)。这个数据再次显示,对于具有较低mcfarland值的样品,该溶液分配/分层方法提供了比单次分配准确得多的maldi分数。在一个实施例中,来自纯分离物或pbc样品的微生物是通过以下方式鉴别的:i)从生长培养基中(即,从pbc或从琼脂平板上的传代培养中)获得怀疑含有至少一种微生物的样品;ii)确定该样品的接种参数,对于确定的接种物的mcfarland值,那些参数包括分配体积和分配次数;iii)将至少一部分的样品沉积在固体表面上,该固体表面被适配成将被放入被配置为通过maldi质谱术使用所规定的分配体积和分配次数来确定微生物身份的设备中;iv)用至少一种试剂处理该样品;此类试剂包括挥发性酸、有机溶剂、和/或有机溶剂与挥发性酸的组合;v)在处理后的样品上布置一种maldi基质溶液;以及vi)通过质谱术鉴别该微生物。在一个实施例中,该挥发性酸是至少70%的甲酸。在另一个实施例中,该挥发性酸是至少80%的甲酸。在另一个实施例中,该挥发性酸是至少90%的甲酸。除非本文中另有规定,否则甲酸溶液都是水溶液。在另一个实施例中,该挥发性酸是至少100%的甲酸(例如,纯的)。在另一个实施例中,在样品上布置maldi基质溶液之前,用至少70%的甲酸在有机溶剂例如乙腈、甲醇、乙醇、丙酮或乙酸乙酯中处理该样品。在另一个实施例中,在样品上布置maldi基质溶液之前,用至少80%的甲酸在有机溶剂例如乙腈、甲醇、乙醇、丙酮或乙酸乙酯中处理该样品。在另一个实施例中,在样品上布置maldi基质溶液之前,用至少90%的甲酸在有机溶剂例如乙腈、甲醇、乙醇、丙酮或乙酸乙酯中处理该样品。在一个实施例中,允许沉积在该固体表面上的样品在添加该挥发性酸之前干燥,以防止该样品稀释该挥发性酸。在另一个实施例中,在该样品上布置该maldi基质溶液之前使该挥发性酸干燥。在本发明的不同实施例中可以使用的挥发性酸的示例包括但不限于甲酸、乙酸、三氟乙酸以及盐酸。在使样品在maldi板上干燥并与仅仅挥发性酸合并或与挥发性酸与有机溶剂的组合合并之后,使样品与试剂的组合干燥。干燥被定义为允许液体充分蒸发从而不稀释随后添加的任何液体。虽然样品能够在环境空气中被干燥,但能够使用加热源例如加热块、热板、加热炉或红外加热灯来加速所合并的样品与试剂的液体部分的蒸发。这些干燥方法不改变通过maldi鉴别后样品的图谱。在干燥之后,将该maldi基质布置在用(一种或多种)试剂处理过的样品上。在所公开的方法中能够使用本领域技术人员已知的任何maldi基质溶液。这些基质溶液包括但不限于α-氰基-4-羟基桂皮酸(hcca)、2,5-二羟基苯甲酸(dhb)、3,5-二甲氧基-4-羟基桂皮酸(spa)、3-羟基吡啶甲酸(hpa)、3,4-二羟基桂皮酸、2-(4-羟基苯偶氮基)-苯甲酸、2-氨基-4-甲基-5-硝基吡啶、以及2,4,6-三羟基苯乙酮(thap)。在一个替代性实施例中,微生物通过以下方式鉴别:i)制备怀疑含有至少一种微生物的样品的微生物悬浮液;ii)确定该微生物悬浮液的浊度;iii)选择用于从微生物悬浮液中将至少一部分的该样品沉积在固体表面上的分配体积和分配次数,该固体表面被适配成要布置在被配置来通过maldi质谱术确定微生物身份的设备中;iv)使用所选的参数将该样品沉积在maldi板上;v)任选地,用有机溶剂例如乙醇、固定剂(例如甲醛)、或通过施加一般直至约37℃(即,大致为体温)的热量来固定该微生物;vi)用至少70%的甲酸覆盖该样品;v)干燥该样品;vi)将maldi基质溶液布置在处理过的样品上;vii)干燥该样品;以及viii)通过质谱术鉴别微生物。诸如甲醛的固定剂是本领域技术人员公知的并且在此不详细说明。参见图8,本发明的一个示例考虑获得生物学样品。将样品与适合将该样品递送至maldi板的稀释剂合并。测量样品/稀释剂混合物的浊度。如果测量的浊度是在预定的范围内,则将预定体积的等分部分沉积在该maldi板上。如果测量的浊度高于预定的范围,则将较小体积的样品沉积在该maldi板上。如果测量的浊度小于该预定的范围,则使用上述使用多次分配而在分配之间进行干燥的样品制备方案。在一个示例性实施例中,获得样品并制备悬浮液。测量浊度。如果浊度(以mcfarland计)是在约2与约6之间,则将约3μl沉积在maldi板上。如果样品浊度是高于约6,则将沉积在maldi板上的样品量减小到约1μl。如果样品浊度小于约2但在约1至约2的范围内,则将约3μl的样品沉积在maldi板上、干燥、并沉积第二个3μl样品并干燥。如果样品浊度为约0.5至约1,则沉积三“层”各自约3μl的样品并干燥。如果样品浊度为约0.25至约0.5,则沉积四“层”(各自3μl)的样品并干燥。在沉积并干燥样品之后,如本文描述的,对样品进行处理以进行maldi。还考虑了用于制备生物学样品以便通过基质辅助激光解吸离子化飞行时间质谱术进行评估的自动化系统。这样的系统具有与样品制备装置通信的可编程控制器(例如,处理器)。该可编程控制器发送指令给该样品制备装置来从平板培养基中挑选出菌落。此类装置的示例是从bdkiestratm可商购的inoqulatm。该处理器提供指令以在适当时向该样品添加一定量的稀释剂或样品处理试剂从而提供具有预定体积的样品溶液。将样品稀释到预定体积的自动化系统是技术人员公知的并且在此不详细说明。在样品稀释之后,测量该样品的浊度。浊度是通过各种技术包括吸光度、透光度和指南方法来测量的。该系统的实施例考虑使用比浊计来测量浊度。如本文所使用的,“比浊计”是能够测量悬浮液中固体颗粒的量的仪器。如本文所使用的,“比浊法”是指能够用来测量悬浮液中悬浮颗粒的量的方法。比浊计是技术人员公知的并且在此不详细说明。该处理器与测量样品浊度的仪器通信。该处理器具有存储可接受浊度的取值或取值范围的存储器。该处理器将测量值与存储值进行比较。如果样品浓度是在预定的范围内,则该处理器提供指令来将第一预定体积的样品施加到如上所述被适配成用于将样品递送到被配置来实施质谱术的装置的基底。如果该处理器确定所测量的样品浓度高于该预定的范围,则该处理器提供指令来将第二预定体积的样品施加到该被适配成用于将样品递送到被配置来实施质谱术的装置的基底。该第二预定体积小于该第一预定体积。如果该处理器确定所测量的样品浓度低于该预定的范围,则该处理器提供指令来:i)将第三预定体积的样品施加到被适配成用于将样品递送到被配置来实施质谱术的装置的基底;ii)干燥该样品;iii)在该基底上的干燥后样品上应用该第三预定体积的该样品的第二次施加;以及iv)根据在此描述的方法来干燥该样品。此后,该处理器指示该系统在沉积的样品上施加基质,该基质被适配成用于该质谱仪中。该系统还具有输送机构,以用于将所制备的样品放在该质谱装置中进行测试。图9示意性地示出根据本发明的用于自动制备微生物样品的悬浮液的系统1的实施例。所述系统1包括用于培养皿3的台面2,该培养皿3包含在营养层5例如一层琼脂凝胶上的微生物4。系统1具有第一挑选工具6和另一挑选工具7。定位装置8包括挑选工具夹持器9,用于在所示实施例中可释放地夹持挑选工具,在图1所示的实施例中该挑选工具夹持器9夹持第一挑选工具6。定位装置8被安排用于将第一挑选工具6定位在培养皿3上方的起始位置(在图9中以实线示出)并且被安排用于朝向或离开培养皿3自动地降低和升高第一挑选工具6,使得第一挑选工具6能够被定位在接触微生物4并挑选出微生物样品的位置(用虚线6’指示)中。在第一挑选工具6挑选出样品之后,定位装置8升高并将第一挑选工具6定位在转移位置中。在图9所示的实施例中,转移位置等同于起始位置。在另一些实施例中,起始位置和转移位置可以彼此不同。根据本发明的系统1进一步包括用于夹持悬浮液管11的悬浮液管夹持器10,该悬浮物管能够包含从自动悬浮液介质分配器12分配出的悬浮液介质,在所示实施例中该分配器具有分配喷嘴13,用于将悬浮液介质14自动分配到该悬浮液管夹持器10中所夹持的悬浮液管11中。在当前实施例中,悬浮液管夹持器10是用于使悬浮液管11围绕竖直轴线a旋转的可旋转的悬浮液管夹持器。转移装置15被包含在系统1中,用于将挑选工具从定位装置8的转移位置转移到悬浮液管夹持器10中所夹持的悬浮液管11上方的位置。在所示实施例中,转移装置15包括带有抓握工具17的转移夹持器16,用于可释放地夹持挑选工具。转移装置15被图示为采用转移轨道18,例如轨,用于在其上如箭头所示进行线性运动。然而,考虑了其他甲板安装式转移机构。以此方式,转移装置15可以移动到定位装置8,使得抓握工具17能够从定位装置8取下该挑选工具。此后,在抓握装置17已经抓握该挑选工具之后,挑选工具夹持器9释放该挑选工具。在图9所示的实施例中,先前已挑选出微生物4的样品19的第二挑选工具或另一挑选工具7被转移装置15定位在悬浮液管11上方的起始位置中,如实线所示。转移装置15被安排成用于将第二挑选工具7降低到悬浮物管11中所含的悬浮液介质14之中,在该位置中,带有样品19的第二挑选工具7’如图9中的虚线所示被浸入悬浮液介质14中。此后,转移装置15将第二挑选工具7定位在悬浮液管11上方的等待位置,该等待位置在图9所示的实施例中等同于起始位置。在其它实施例中,等待位置和起始位置可以彼此不同。该系统进一步配备有浊度计20,用于实施对悬浮液管夹持器10中夹持的悬浮液管11中所含的悬浮液介质14的浊度的测量。本领域普遍已知的是,浊度计能够提供测量物质浓度、在当前情况下测量悬浮液介质中悬浮的微生物的浓度的测量值。在图9所示的实施例中,浊度计20包括激光器21和传感器22,该激光器朝悬浮液介质发出激光并且该激光透过悬浮物介质,该传感器检测传输透过悬浮液介质的激光的量。此外,存在另一传感器(在图中未指出),该传感器是例如安排成垂直于激光路径以检测被悬浮液散射的激光的量。本发明的装置的运行由例如包括微处理器的控制器23控制,该控制器通信地连接(如由信号线所示)到定位装置8、转移装置15、自动悬浮液介质分配器12、以及浊度计20,用于分别自动控制该定位装置8的移动、转移装置15的移动、自动悬浮液介质分配器12的操作、以及浊度计20的操作。此外,控制器23可以直接通信连接到系统1的其他部分,诸如例如挑选工具夹持器9、转移夹持器16、激光器21和传感器22。在图9所示的实施例中,控制器23被安排成用于控制浊度计20,使得在第二挑选工具7被浸入悬浮液介质14中之前开始悬浮液介质14的浊度测量。此外,控制器23控制该可旋转的悬浮液管夹持器10以第二挑选工具7被浸入悬浮液介质14中之前开始被夹持在夹持器10中的悬浮液管11的旋转、并且在测量悬浮液介质14的浊度期间维持悬浮液管11的旋转。以此方式,浊度计20向控制器23提供在线测量值,该值指示测量的浊度,并且因此指示微生物的浓度。控制器23包括存储器,在该存储器中存储第一阈值和第二阈值,其中第一阈值等于或大于第二阈值。如果该浊度计所提供的浊度测量值等于第一阈值和第二阈值或在其之间,则该悬浮液介质中的微生物的浓度/量足以允许该带有悬浮液的悬浮液管被进一步处理。在此情况下,控制器23提供能够进一步处理悬浮液管的信号。此外,在此情形下,能够摒弃第二挑选工具7,例如通过将该转移装置转移到位置c,在该位置c中抓握装置17被启用以释放第二挑选工具7。如果该浊度计的最终测量值高于之前存储在控制器23的存储器中的第一阈值,则微生物的浓度太高而不允许该悬浮液管被进一步处理。在此情形下,控制器23控制该自动悬浮液介质分配器12来将额外量的悬浮液介质供应到悬浮液管11之中。这个额外量的悬浮液介质是基于悬浮液介质的初始量、最终测量值和第一阈值和/或第二阈值,使得向悬浮液管11中已经存在的悬浮液介质中添加该额外量的悬浮液介质将使得该悬浮液介质中的微生物浓度满足进一步处理的要求,这能够通过浊度计20进行额外的或进一步的浊度测量来确认。如果浊度计20的最终测量值低于第二阈值,意味着悬浮液介质中的微生物浓度太低,则控制器23控制该系统1,使得第一挑选装置6挑选出额外的微生物样品(替代性地,能够使用该第二挑选工具或另一挑选工具挑选额外样品)。在另一些实施例中(下文描述),如果悬浮液的浊度低于标准,则能够在同一点中沉积多次分配的悬浮液。因此,在此情况下,控制器23控制该转移装置15的定位,使得第二挑选工具7如上所述被摈弃。接着(或同时),将定位装置8的挑选工具夹持器9中的第一挑选工具6从培养皿3上方的起始位置朝培养皿降低并且与微生物4接触以挑选出该微生物的额外样品。此后,第一挑选装置6带着离开培养皿的微生物的额外样品自动升高到转移位置。接着,该转移装置将带着微生物的额外样品的第一挑选工具从定位装置8的转移位置转移到悬浮液管11上方的位置。带着微生物的额外样品的第一挑选装置6被降低到悬浮液介质14之中并且释放该微生物的额外样品到该悬浮液介质中。再次测量浊度,并且将测量值与存储在控制器23的存储器中的第一阈值和第二阈值进行比较。在此情况下,控制器23能够被安排成用于控制转移装置15的移动,使得如果浊度计20进行的在线浊度测量值等于或低于第一阈值并且等于或大于第二阈值,则第一挑选装置6被升高到等待位置。悬浮液管或者替代地在本发明的系统中特别有用的小瓶或比色杯的截面具有约2mm至约12mm、优选地约3mm的目标最大尺寸。在这些相对小的悬浮液管中,控制器23能够控制该自动悬浮液介质分配器12,使得所供应的悬浮液介质初始量是约0.1-5ml、优选地小于约1ml。在制备悬浮液之后,从悬浮液管11中自动吸取等分部分的悬浮液并沉积在maldi板100上。maldi板100被示意性地图示为搁置在支撑件105上。这个步骤在被标识为位置c的maldi板制备站处执行,该位置c与制备悬浮物的位置是分开的。在某些实施例中,悬浮物管11被移动到靠近maldi板的位置以进行如上所述的maldi板制备。在另一些实施例中,从悬浮液管11移除等分部分的悬浮液并将该等分部分用于maldi板制备。自动移液器在图9中被示意性地表示为110。自动移液器是公知的并且在此不详细说明。maldi板100被连接到被图示为加热器120的干燥设备。虽然本文已经参照具体实施例描述了本发明,但应理解的是,这些实施例仅是本发明的原理和应用的图示。因此应理解的是,可以对图示性实施例作出众多修改并且在不背离所附权利要求书限定的本发明的精神和范围的情况下得出其他的安排。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1