一种利用单个串联供体受体结构测量受体‑供体消光系数比值的方法与流程
本发明属于荧光共振能量转移检测
技术领域:
,具体涉及一种利用单个串联供体受体结构测量受体-供体消光系数比值(γ)的方法。
背景技术:
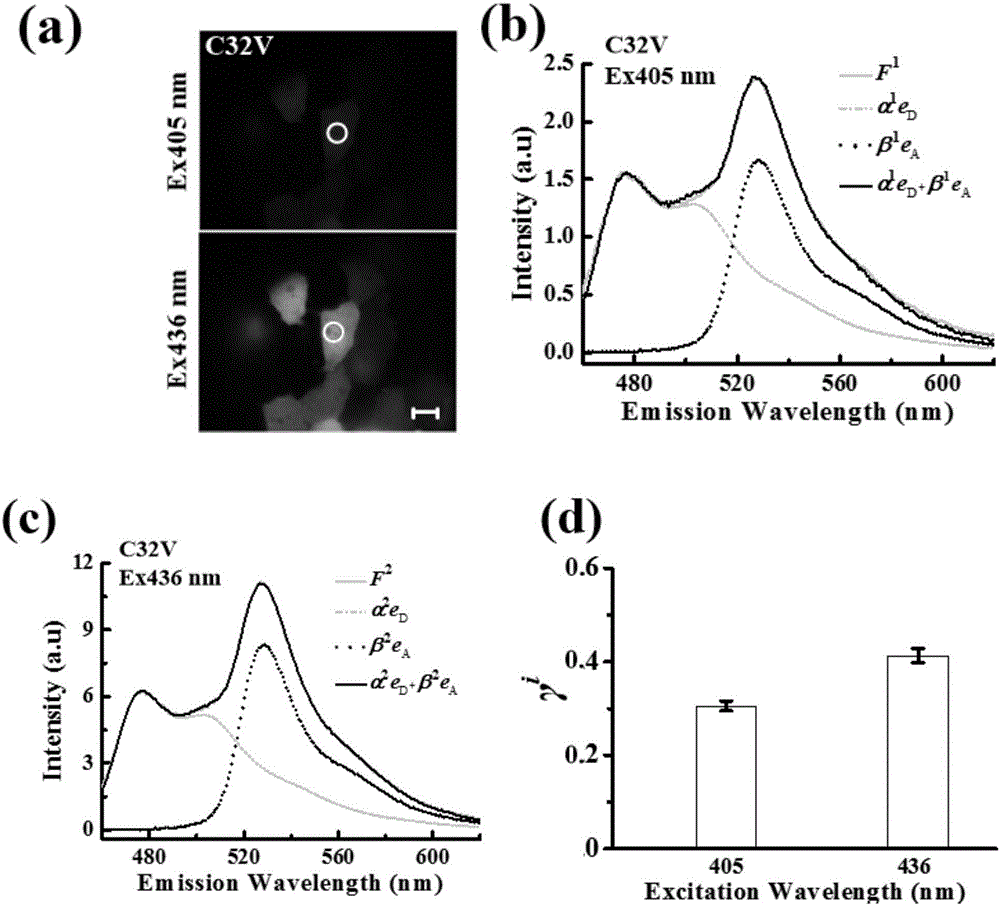
:基于受体敏化发射的光谱分离技术已经被广泛用于FRET定量检测,其中spFRET方法已经被用于研究活细胞中的动态生化事件。受体-供体消光系数比值(γ)的测定对于spFRET定量检测至关重要。Wlodarczyk[WlodarczykJ,WoehlerA,KobeF,etal.AnalysisofFRETsignalsinthepresenceoffreedonorsandacceptors[J].Biophysicaljournal,2008,94(3):986-1000]通过测量双波长激发时的激发比来得到受-供体消光系数比值,该方法要求所有FRET测量过程中系统设置保持不变。Zhang[ZhangJ,YangF,ChaiL,etal.Spectralmeasurementofacceptor-to-donorextinctioncoefficientratioinlivingcells[J].Micron,2015,68(1):98-106]提出的sp-ECR方法测量受体-供体消光系数比值时需要借助一个FRET效率(E)已知的固定FRET参照样本,对于E未知的参照样本则需要借助其它的FRET定量检测方法来测定。技术实现要素:为了克服现有测量技术的缺点与不足,本发明的目的在于提供一种利用单个串联供体受体结构测量受体-供体消光系数比值(γ)的方法。首次提出了两个激发波长处的受体-供体消光系数比的比值(ρ因子)的概念。对于一个给定的受体-供体对和光学检测系统,其ρ因子和γ是恒量。受体-供体消光系数比值的准确测量是spFRET定量检测的关键。本发明的目的通过下述技术方案实现:获得单转供体样本和单转受体样本以及一个FRET效率未知的FRET参照样本,分别使用两个波长为λ1和λ2的激发光激发,可以快速测定两个激发波长处的受体-供体消光系数比γ1和γ2,而且无须测量FRET参照样本的FRET效率。一种测量ρ因子的方法,包括如下步骤:获得单独表达供体荧光蛋白和单独表达受体荧光蛋白的活细胞样本,使用两个波长λ1和λ2的激发光分别激发供体样本和受体样本,同时测量它们的强度发射谱和上标i(i=1,2)表示激发光,下标D和A分别表示供体和受体:其中Ii,ref是激发光源的强度,和表示单转供体的样本和受体的样本的浓度,和表示供体和受体用激发光i激发时的消光系数,和表示供体和受体的量子产额,eD(λ)和eA(λ)表示按面积归一化的供体发射谱和受体发射谱;利用公式(1)得到单转供体样本和单转受体样本各自在两个波长激发时的发射光谱强度的比值νD和vA:vD=FD1,ref(λ)FD2,ref(λ)=I1,refϵD1I2,refϵD2vA=FA1,ref(λ)FA2,ref(λ)=I1,refϵA1I2,refϵA2---(2)]]>理论上,供体和受体的发射谱应选择相同的波段计算νD和vA,但实际中,供体和受体的发射谱允许各自选择不同的波段计算νD和vA;对于一个稳定的激发光源,I1,ref/I2,ref是常量;因此,一旦νD和vA被确定,就可以计算出双波长所对应的受体-供体消光系数比的比值ρ:ρ=γ2γ1=ϵD1ϵA2ϵD2ϵA1=vDvA---(3).]]>一种利用单个串联供体受体结构测量受体-供体消光系数比值(γ)的方法,包括以下具体步骤:(1)测量ρ因子:按照上述方法得到;(2)用受供体浓度比为n的串联质粒转染细胞,分别采用两个波长为λ1和λ2的激发光激发该FRET参照样本,测量得到其发射光谱并对其按照eD(λ)和eA(λ)进行光谱线性分离:FFRETi,ref(λ)=αieD(λ)+βieA(λ)---(4)]]>δi=αiβi---(5)]]>其中,αi和βi分别表示供体和受体的权重因子,δi表示供体和受体的权重因子的比值;(3)结合公式(3)计算受体-供体消光系数比γ1和γ2:γ2=ρ·γ1(7)其中,δ1和δ2是通过分离参照样本的发射谱得到的两个波长激发光激发时的权重比,n是FRET参照样本中的总受供体浓度比,n为0.02~50的有理数,优选为0.1~10的有理数,更优选为0.5~3的有理数。为了更好的阐述本发明,下面以一个测量的实例进行说明:供体和受体:供体为Cerulean(简称C),受体为Venus(简称V)。FRET参照样本C32V:由32个氨基酸的连接序列(TSGLETRDIRSENLYFQGPREFPGGTAGPVAT)将C和V链接组成的FRET串联质粒结构,可以未知其FRET效率。具体测量过程如下:(1)在人的肝癌细胞(HepG2细胞)中单独转染并表达供体C和受体V,以及C32V;(2)用宽场荧光显微镜和便携式光谱仪对上述细胞采集光谱。采用405±10nm、436±10nm的光作为激发光,采用长通455nm的通道作为探测通道,可以测得C、V以及C32V在两个激发波长激发时的发射谱。(3)计算两个激发波长激发时的受体-供体消光系数比值γ1和γ2:γ2=ρ·γ1其中δ1和δ2是通过分离C32V在两个波长激发时的发射谱得到的权重比,对于固定质粒C32V来说n=1。ρ因子可以通过C和V各自在两个激发波长激发时的发射光谱强度的比值测得。因此,我们通过测量两个波长激发时样本的发射谱,就能很快的得到ρ因子,进而求出受体-供体消光系数比值(γ)。本发明的基本原理如下:引入一个新的参量ρ因子,表示激发光λ1和λ2所对应的受体-供体消光系数比的比值:ρ=γ2γ1]]>γ1=(δ1-δ2)/nδ1δ2(ρ-1)φA/φD+δ2ρ-δ1]]>其中n是FRET对参照样本中的总受供体浓度比,如果选择质粒C32V作为参照样本的话,则n=1。ρ因子可以通过单转供体的样本和单转受体的样本各自在两个波长激发时的发射光谱强度的比值测得:ρ=γ2γ1=ϵD1ϵA2ϵD2ϵA1=FD1,ref(λ)FD2,ref(λ)/FA1,ref(λ)FA2,ref(λ)]]>对于一个给定的受体-供体对和光学检测系统,其ρ因子和γ是恒量,测定ρ因子之后可以很快得到受体-供体消光系数比值(γ)。本发明相对于现有技术,具有如下的优点及效果:本发明是一种利用单个串联供体受体结构测量受体-供体消光系数比值的方法,不需要依赖其他定量FRET检测方法,不需要保持所有待测FRET样本的成像条件相一致,可以根据样本的细胞表达亮度而相对灵活地调节仪器的参数,如激发光源的强度,也适用于由绿色荧光蛋白(GFP)和黄色荧光蛋白(YFP)构成的FRET结构。具有测量过程简单、测量时间短和测量结果准确稳定的优点。因此,本发明对于活细胞FRET定量检测具有重要的应用价值,必将极大地提高活细胞FRET检测的成功率,从而推动FRET定量检测技术在细胞生物学中的应用。附图说明图1是测量ρ因子的过程;其中,(a)是分别单转供体和受体的细胞荧光图,白色的圈表示光谱仪探测的区域;(b)是单转供体的样本在两个波长激发时的发射谱;(c)是单转受体的样本在两个波长激发时的发射谱。图2是利用受供体浓度为1的串联质粒C32V测量双波长处的受-供体消光系数比值;其中,(a)是转染质粒C32V的某个典型细胞的荧光图,白色的圈表示光谱仪探测的区域;(b)是C32V在405nm激发时的发射谱F1(λ);(c)是C32V在436nm激发时的发射谱F2(λ);(d)是统计14个细胞在双波长处的受-供体消光系数比值的结果。图3是利用受供体浓度为0.5的串联质粒CVC测量双波长处的受-供体消光系数比值;其中,(a)是转染质粒CVC的某个典型细胞的荧光图,白色的圈表示光谱仪探测的区域;(b)是CVC在405nm激发时的发射谱F1(λ);(c)是CVC在436nm激发时的发射谱F2(λ);(d)是统计17个细胞在双波长处的受-供体消光系数比值的结果。具体实施方式下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。实施例11、质粒来源供体质粒Cerulean(C)、受体质粒为Venus(V)和参照FRET质粒C32V(Cerulean-32-Venus)购于美国addgene质粒库。2、宽场荧光显微镜与便携式光谱仪系统该宽场荧光显微镜系统产自德国卡尔蔡司公司,型号为AxioObserver。光源是美国LumenDynamics公司的X-Cite120Q系列的金属卤化灯,物镜是放大倍数为40、数值孔径为1.3(40×1.3NA)的油镜,一个三孔的激发片拉板,一个衰减片转轮,一个cube(每个cube中可安装激发片、分光片、发射片各一个)转轮,外接一个CCD相机和一个便携式光谱仪。激发光波段通过推拉激发片拉板来进行选择。3、细胞培养以及质粒转染HepG2细胞来自中国广州暨南大学,用DMEM培养基加入10%的新生牛血清放在含有5%二氧化碳的37℃的培养箱中培养。细胞用胰蛋白酶消化,转到细胞培养皿中,培养24小时后,当细胞生长至70~90%时,用体外转染试剂TurbofectTM将质粒短暂转入细胞。转染的具体步骤:(1)取两只灭菌的EP管,每个EP管中先加入40μL无血清的DMEM,然后向一只EP管中加入1~2μL的转染试剂,另一只EP管中加入1~2μL(500~600ng/μL)的质粒,静置5分钟;(2)5分钟后,将两只EP管混匀,轻轻吹打6~8次后静置20分钟,(3)20分钟后,将420μL的无血清的DMEM加入到刚刚混匀的EP管中,轻轻混匀;(4)用无血清的DMEM培养基或PBS清洗培养皿中细胞2~3次,主要洗去死细胞等脏污,然后把上述的(3)中的混合物移到培养皿中,把培养皿重新放回培养箱中4~6小时;(5)4~6小时后,吸去转染液,然后用用无血清的DMEM培养基或PBS清洗培养皿中细胞2~3次,再往培养皿中加入含有新生牛血清的DMEM培养基,培养24~48小时即可用于实验。4、测量受体-供体消光系数比值(γ)将载有单独表达供体C和受体V以及C32V的HepG2细胞的培养皿置于宽场荧光显微镜40×1.3NA的油镜上进行荧光成像和发射谱采集。使用两个分别为405/20(表示的是以405nm为中心、带宽为20nm的激发光)和436/20(表示的是以436nm为中心、带宽为20nm的激发光)的波长激发样本,使用LP455(表示的是大于455nm的发射光)通道检测样本在双波长激发时的发射光谱。如图1(b)和(c)所示,对于某个典型细胞,我们测得νD(选择460~560nm波长范围计算)和vA(选择520~550nm波长范围计算),νD=0.2738和vA=0.2090。统计14个细胞的结果为νD=0.2773±0.0064和vA=0.2051±0.0322,进而得到受体-供体消光系数比的比值ρ=1.3520。我们用双波长激发时的供体和受体基矢对参照样本C32V进行发射光谱拟合,如图2(b)和(c)所示,对于某个典型细胞,得到两个激发波长处的权重比δ1=α1/β1=1.4168和δ2=α1/β1=1.1797。利用公式可以求出双波长处的γ1=0.3298和γ2=0.4459,统计14个细胞的结果为γ1=0.3055±0.0108和γ2=0.4130±0.0147,如图2(d)所示。实施例21、质粒来源质粒CVC(Cerulean-Venus-Cerulean)购于美国addgene质粒库。2、宽场荧光显微镜与便携式光谱仪系统,参照实施例1步骤2;细胞培养以及质粒转染,参照实施例1步骤3。3、测量受体-供体消光系数比值(γ)将载有单独表达供体C和受体V以及CVC的HepG2细胞的培养皿置于宽场荧光显微镜40×1.3NA的油镜上进行荧光成像和发射谱采集。使用两个分别为405/20(表示的是以405nm为中心、带宽为20nm的激发光)和436/20(表示的是以436nm为中心、带宽为20nm的激发光)的波长激发样本,使用LP455(表示的是大于455nm的发射光)通道检测样本在双波长激发时的发射光谱。如图1(b)和(c)所示,对于某个典型细胞,我们测得νD(选择460~560nm波长范围计算)和vA(选择520~550nm波长范围计算),νD=0.2738和vA=0.2090。统计14个细胞的结果为νD=0.2773±0.0064和vA=0.2051±0.0322,进而得到受-供体消光系数比的比值ρ=1.3520(测量ρ因子的过程和结果同实例1)。我们用双波长激发时的供体和受体基矢对参照样本CVC进行发射光谱拟合,如图3(b)和(c)所示,对于某个典型细胞,得到两个激发波长处的权重比δ1=α1/β1=0.9854和δ2=α1/β1=0.9137。利用公式可以求出双波长处的γ1=0.3159和γ2=0.4270,统计17个细胞的结果为γ1=0.3163±0.0150和γ2=0.4225±0.0198,如图3(d)所示。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1