一种基于EIS结构电化学生物传感器检测1,5‑脱水葡萄糖醇的方法与流程
本发明属于生物检测技术领域,具体涉及一种基于电化学生物传感器检测1,5-脱水葡萄糖醇的方法。
背景技术:
1,5-脱水葡萄糖醇(1,5-anhydroglµcitol,1,5-AG)是一种生理指标,检测方法主要有气相色谱法、全酶法、液质联用分析技术等。公开号为CN101522895发明专利,公开一种1,5-脱水葡萄糖醇的测定方法,使用由氨基酸形成具有山梨糖脱氢酶活性的蛋白质来检测1,5-AG。公开号CN101558296的发明专利,公开一种测定1,5-脱水葡萄糖醇的方法,使用少量全血测定1,5-脱水葡萄糖醇而无需借助于离心机等,包括预先消除或转化干扰1,5-脱水葡萄糖醇测定的葡萄糖和/或其衍生物;然后进行测定1,5-脱水葡萄糖醇,其中不进行血细胞分离而在原样全血中消除或转化这种葡萄糖和/或其衍生物,不进行血细胞分离而让用于测定1,5-脱水葡萄糖醇的酶发挥作用,以及电化学测定1,5-脱水葡萄糖醇。因此,这种测定方法能够用于在床边或医学检查室中1,5-脱水葡萄糖醇的快速测定或用于由患者在家中对其进行自测。公开号为CN102175670A的发明,公开一种新的血液1,5-脱水葡萄糖醇含量的方法,通过吡喃糖氧化酶催化1,5-脱水葡萄糖醇生成1,5-脱水果糖和H2O2;4-氨基安替比啉(4-AAP)、3-羟基-2,4,6-三羟基苯甲酸(HTIB)和H2O2在辣根过氧化物酶的催化作用下生成醌类化合物;利用比色分析原理确定血液中1,5-脱水葡萄糖醇水平。这些检测方法操作复杂,无法满足快速检测的需求。Fµkµmµra,Tajima,et,al. Fµlly enzymatic method for determining 1,5-anhydro-
D-glµcitol in serµm.clinciachemistry,1994,40(11):2013-2016.报道的全酶法虽然有抗干扰性强、灵敏度高、可靠等优点,但是这种方法需要在全自动生化分析仪上进行,成本较高,适用于医学的临床实验室,无法满足现场检测的需要。电解质-绝缘体-半导体(EIS)型化学传感器敏感单元结构为Si3N4/SiO2/Si,由于具有灵敏度高、选择性好、易于微型化和自动化等优点,对于发展快速简便、价廉、高灵敏度、便携化的医学检测仪器,具有十分广阔的应用前景。
技术实现要素:
本发明所要解决的技术问题是提供一种基于EIS结构电化学生物传感器检测1,5-AG的方法;利用电化学生物传感器,基于酶催化银沉积反应,建立一种基于EIS型电化学传感器检测1,5-AG的方法,检测限为40µg/mL。
本发明基于酶催化银沉积反应,所涉及到的主要方程式为:
本发明是在Labview测试系统上完成的,Labview测试系统提供EIS结构电容型电化学传感器偏置电压、驱动信号;并进一步采集EIS结构电容型电化学传感器的输出信号,对采集到的信号进行放大、滤波、转换处理,求光电流有效值,最后绘制I-V特性曲线,计算出ΔV,得出ΔV与所加1,5-AG浓度的线性关系,通过计算得到1,5-AG的浓度。
本发明所采用的技术方案是按照以下步骤进行:
步骤1:EIS结构传感器敏感单元的修饰
(1)将硅片依次在乙醇、丙酮、纯水中超声清洗;
(2)滴加NaOH溶液,静置、清洗;滴加巯丙基三乙氧基硅烷的乙醇溶液于硅片表面,静置,用清水冲洗干净,得到巯基硅烷化的敏感单元;
(3)在氯金酸溶液中,加入盐酸羟胺溶液,反应;
(4)用PEG-20000和纯水洗涤,得到纳米金溶液;
(5)滴加纳米金溶液于巯基硅烷化后的硅基表面,静置后用水清洗,得到修饰了纳米金粒子的硅片;
步骤2:EIS结构传感器生物传感界面的构建
(1)在修饰了纳米金粒子的硅片表面滴加吡喃糖氧化酶(PROD),孵育;
(2)孵育完成后用纯水将未固定的酶洗去,装配到检测仪器中去,完成EIS结构传感器生物传感界面的构建;
步骤3:1,5-AG的工作曲线绘制
(1)在固定了PROD的硅片表面滴加标准品进行孵育;
(2)在孵育得到的硅片表面滴加AgNO3的溶液,避光孵育得到沉积有单质银的敏感单元;
(3)将敏感单元装配到检测仪器中去,通过Labview测试系统提供EIS结构电容型电化学传感器的偏置电压、驱动信号;并进一步采集EIS结构电容型电化学传感器的输出信号,对采集到的信号进行放大、滤波、转换处理,求光电流有效值,最后绘制I-V特性曲线;
(4)得到不同浓度标准品的I-V曲线后,计算出ΔV,绘制1,5-AG工作曲线,计算相关性系数和检测限;
步骤4:待测样品的检测
(1)将待测样品滴加在固定了PROD的硅片表面,进行孵育;
(2)在孵育得到的硅片表面滴加用甘氨酸氢氧化钠缓冲液配制的AgNO3溶液,避光孵育得到沉积有单质银的敏感单元;
(3)将敏感单元装配到检测仪器中去,通过Labview测试系统提供EIS结构电化学生物传感器偏置电压、驱动信号;采集EIS结构电容型电化学传感器的输出信号,对采集到的信号进行放大、滤波、转换处理,求光电流有效值,最后绘制I-V特性曲线,计算出ΔV;
(4)根据步骤4所述工作曲线,得到所述待测样品溶液中1,5-AG的浓度。
进一步,步骤1中,所述氢氧化钠的浓度为1mol/L;
进一步,步骤1中,所述巯丙基三乙氧基硅烷与乙醇溶液的体积比为1:99;
进一步,步骤2中,所述氯金酸溶液中氯金酸与水的体积比为1:99;
进一步,步骤2中,所述PEG-2000的浓度为50g/L;
进一步,步骤3中,所述AgNO3浓度为10mM;
进一步,所述孵育温度为37℃;
其中,步骤1提供一个清洁的硅片表面,为形成完整、稳定、牢固、导电性好的高分子聚合膜提供条件。步骤1中高分子聚合膜的形成为步骤2中生物识别分子PROD的固定提供位点,从而构成特异性识别1,5-AG的生物传感界面,为步骤3中1,5-AG的电化学检测提供测试平台,实现1,5-AG的电化学检测。可见步骤1-3相互支撑,共同作用,才能利用酶催化银沉积反应实现电化学检测1,5-AG。
本发明与现有技术相比具有如下优点:
1.高分子聚合膜可为生物识别分子PROD酶的固定提供位点,并有利于电子的传递。
2.在金纳米材料表面进行的免疫反应是一种界面反应体系,可提高PROD与1,5-AG的反应效率。
3.本发明建立的检测1,5-AG方法的有益效果在于能实现实时在线检测。
附图说明
图1 EIS型电化学传感器检测系统示意图
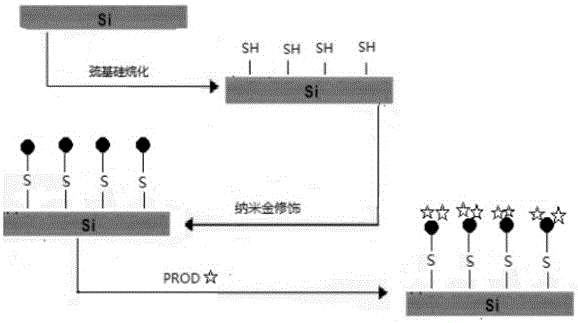
图2 EIS结构传感器生物传感界面的构建图
图3 不同浓度1,5-AG的I-V曲线图
图4 基于EIS电化学传感器方法检测1,5-AG工作曲线
具体实施方式
下面结合具体实施方式对本发明进行详细说明。该实施例仅是对本发明的较佳实施方式而已,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对以上实施方式所做的任何简单修改,等同变化与修饰,均属于本发明技术方案的范围内。
图1为EIS型电化学传感器检测系统示意图,检测原理为:当利用调制的激励光源照射硅片硅衬底部位时,会激发硅片产生电子-空穴对,电子空穴对在耗尽层电场作用下定向移动从而在外部回路中产生受调制的光电流,通过调节加在电解液与硅片衬底之间的直流偏置电压,可以获得每个敏感区的光电流随外加偏置电压变化的I-V响应曲线,不同浓度的电解液与固液界面间会产生相应大小的膜电位,膜电位与外加偏置电压一起作用于EIS型传感器的耗尽层,会使其I-V曲线沿偏置电压方向(X轴)发生一定程度的偏移。
对于整个检测系统而言,通过Labview测试系统提供EIS结构电容型电化学传感器的偏置电压、驱动信号;并进一步采集EIS结构电容型电化学传感器的输出信号,对采集到的信号进行放大、滤波、转换处理,求光电流有效值,最后绘制I-V特性曲线。
EIS结构传感器生物传感界面的构建,PROD在敏感单元上的固定方法如图2所示,采用硅烷/纳米金复合膜作为固定化生物活性物质的载体,利用静电吸附作用来实现吡喃糖氧化酶在EIS结构电化学传感器敏感单元上的固定。该载体具有低温制备、热稳定性、生物兼容性以及非水溶液中的几乎不溶胀性等,酶或蛋白质固定在硅基表面,可以同时保持它们原有的活性,特别适合用于制备生物传感器。
实施步骤如下:
1. EIS结构传感器敏感单元的修饰
将硅片依次在无水乙醇、丙酮和清水中,分别超声清洗5 min,然后用移液枪在硅片上滴加20µL 1mol/L的氢氧化钠溶液,静置30min,完成对硅片表面的活化;用清水冲洗3次,再用液枪滴加20µL 1%巯丙基三乙氧基硅烷的乙醇溶液,静置12 h,完成硅基表面的巯基硅烷化;取1mL 1.0%氯金酸溶液,加入5mL 80mmol/L盐酸羟胺溶液后,反应3h,依次用50g/L的PEG-20000和纯水洗涤,得到纳米金溶液。在巯基硅烷后的硅片上滴加20µL的纳米金溶液,在常温下静置8h,然后用纯水冲洗干净,即得到硅烷/纳米金复合膜修饰的EIS结构传感器基片。
2. EIS结构传感器生物传感界面的构建
在修饰了纳米金粒子的硅片表面滴加20 µL 1 mg/ml PROD,在常温下孵育3h,孵育完成后用纯水将未固定的酶洗去,完成将PROD酶在硅片上的固定;
3. 1,5-AG的标准曲线绘制
在固定了PROD的硅片表面滴加20μL 浓度分别为0 µg/ML,100 µg/mL,125 µg/mL,150 µg/mL,175 µg/mL的1,5-AG溶液,于37℃下孵育30min;免疫反应完成后,在电极表面滴加AgNO3溶液,于常温下孵育30min,得到沉积有单质银的敏感单元,通过Labview测试系统提供EIS结构电容型电化学传感器的偏置电压、驱动信号;并进一步采集EIS结构电容型电化学传感器的输出信号,对采集到的信号进行放大、滤波、转换处理,求光电流有效值,最后绘制I-V特性曲线,如图3所示;计算出ΔV,结果见表1所示;绘制出的1,5-AG标准曲线,工作曲线见图4,线性关系为:Y=0.00174X+0.00726,线性相关系数R2=0.9929。
表1 不同浓度1,5-AG 电压偏移量
4. 待测样品的检测:
测血清中1,5-AG的含量时首先要排除血清中葡萄糖的干扰,因此要用到葡萄糖激酶和葡萄糖-6-磷酸脱氢酶,影响准确性还会有抗坏血酸和胆红素的干扰,因为他们会消耗反应过程中的过氧化氢,因此还要用到抗坏血酸氧化酶和胆红素氧化酶,在排除以上因素的干扰后,在固定了PROD的硅片表面滴加20 μL浓度分别为200ug/mL,225ug/ml,300ug/ml,350ug/ml,400ug/ml,在37℃的条件下孵育30min,在孵育得到的硅片硅片表面滴加用甘氨酸氢氧化钠配制的AgNO3的溶液,避光孵育得到沉积有单质银的敏感单元,通过Labview测试系统提供EIS结构电容型电化学传感器的偏置电压、驱动信号;并进一步采集EIS结构电容型电化学传感器的输出信号,对采集到的信号进行放大、滤波、转换处理,求光电流有效值,最后绘制I-V特性曲线,算出ΔV,根据步骤3得到的工作曲线算出待测样品的浓度;结果见表2
表2 不同浓度1,5-AG样本的检测
- 还没有人留言评论。精彩留言会获得点赞!