一种高效液相色谱串联质谱法检测蚯蚓体内CYP2C9酶活力的方法与流程
本发明属于酶活力检测技术领域,具体涉及一种高效液相色谱串联质谱法检测蚯蚓体内CYP2C9酶活力的方法。
背景技术:
细胞色素P450(CYP)作为一个巨大的同工家族酶,是一类含有血红素的重要解毒酶。该家族酶通过非共价键结合的血红素中的铁离子传递电子氧化异源物,增强异源物质的水溶性,使他们更容易排出体外,从而起到解毒作用。目前,CYP亚酶作为环境毒理学指标已在陆生脊椎生物及水生生物中得到较多研究,相比在土壤无脊椎生物中的研究较少,如蚯蚓,但采用蚯蚓CYP亚酶诊断土壤环境污染的研究越来越广泛。CYP2C9是一个重要的CYP亚酶,蚯蚓体内CYP2C9能否作为标记物诊断土壤环境污染有待进一步研究,稳定、可靠的检测方法成为此研究的关键。目前研究中涉及CYP亚酶活力的报道,采用的测定方法多为探针底物法,即采用某一化合物为底物,该底物可被CYP亚酶代谢,利用荧光光度计或紫外分光光度计检测代谢产物的生成量,通过代谢产物的生成量来反映CYP亚酶的活力。但上述检测手段灵敏度差,也无法有效分离探针底物和代谢产物。另外,CYP酶本身是一类血红素酶,血红素的存在能严重干扰荧光光度计或紫外分光光度计的测定。再加之蚯蚓体内的CYP亚酶含量相对于哺乳动物较少,现有的文献中多有报道检测失败这一结果。
因此,急需一种可在较短时间内从复杂生物基质中以更高的特异性进行更低水平的定量检测蚯蚓体内CYP2C9活力的方法。
技术实现要素:
有鉴于此,本发明的目的在于提供一种高效液相色谱串联质谱法检测蚯蚓体内CYP2C9酶活力的方法。
为达到上述目的,本发明提供如下技术方案:
1、一种高效液相色谱串联质谱法检测蚯蚓体内CYP2C9酶活力的方法,包括如下步骤:
(1)制备蚯蚓微粒体蛋白悬浮液;
(2)将步骤(1)中制得的蚯蚓微粒体蛋白悬浮液加入含有探针底物的孵育体系中,升温启动酶促反应,待酶促反应终止后,利用高效液相色谱串联质谱联用仪检测经酶促反应终止后所产生的代谢产物,计算CYP2C9酶活力。
进一步,步骤(2)中,高效液相色谱条件为:
a)色谱柱:MS Luna C18柱,2.1mm×50mm,3.0μm,并配备相应的C18保护柱;
b)流动相由A相和B相组成,所述A相为水或含体积分数为0.1%甲酸的水的一种,所述B相为乙腈或含体积分数为0.1%甲酸的乙腈的一种;
c)梯度洗脱条件:0-4min,流动相B的比例由5%上升至95%;4-8min,流动相B的比例由95%下降至5%;8-10min,流动相B的比例为5%;
d)柱温:50℃;
e)流速:0.2ml/min;
f)自动进样室温度:4℃,进样体积为5μl。
进一步,步骤(2)中,质谱条件为:
a)离子源:电喷雾电离;
b)检测方式:正离子;
c)电喷雾电压:3kV;
d)离子源温度:350℃;
e)碰撞气体及气压:氩气,1.2mTorr;
f)扫描模式:多反应离子监测;
g)氮鞘、离子扫描、辅助气体:分别设置为40、0、10个单位。
进一步,步骤(2)中,所述探针底物为双氯芬酸钠;所述代谢产物为4′-羟基双氯芬酸。
进一步,步骤(2)中,所述蚯蚓微粒体蛋白悬浮液加入含有探针底物的孵育体系中至所述微粒体蛋白浓度为10-100μg/ml。
进一步,步骤(2)中,所述蚯蚓微粒体蛋白悬浮液加入含有探针底物的孵育体系中后,所述探针底物的浓度为100μM。
进一步,步骤(2)中,所述孵育体系包括以下成分:缓冲液和NADPH产生系统;所述缓冲液为pH=7.5,浓度为0.1M的Tris缓冲液;所述NADPH产生系统由A和B按体积比为5:1组成,所述A为葡萄糖-6-磷酸20mg/ml,NADP 20mg/ml,氯化镁13.3mg/ml;所述B为将葡萄糖-6-磷酸脱氢酶溶于5mM柠檬酸钠溶液中至葡萄糖-6-磷酸脱氢酶的终浓度为40U/ml。
进一步,步骤(2)中,所述升温为将温度升至37±0.2℃;所述酶促反应时间为5-60min;所述酶促反应终止通过加入200μl甲醇实现。
进一步,所述酶促反应时间为15min。
进一步,步骤(2)中,所述利用高效液相色谱串联质谱联用仪检测经酶促反应终止后所产生的代谢产物前还包括将酶促反应终止后的孵育混合物在离心力为15000×g下离心10min,取上清液用于检测。
本发明的有益效果在于:本发明成功地建立了LC-MS/MS分析检测蚯蚓体内CYP2C9酶活力的方法,该检测方法准确度、精确度及灵敏度高,稳定性强,可用于不同污染环境下蚯蚓体内CYP2C9活力的分析检测,进而为探索CYPC9作为生物标记物指示土壤污染的可能性提供了检测方法。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
图1为双氯芬酸钠经CYP2C9酶催化后生成4′-羟基双氯芬酸图;
图2为双氯芬酸钠与4′-羟基双氯芬酸的混合溶液的LC-PDA图与LC-MS/MS多反应监测图;
图3为添加双氯芬酸钠、4′-羟基双氯芬酸和孵育体系的混合溶液的LC-PDA图与LC-MS/MS多反应监测图;
图4为添加双氯芬酸钠、4′-羟基双氯芬酸、孵育体系和热失活蚯蚓微粒体蛋白溶液的LC-PDA图与LC-MS/MS多反应监测图;
图5为LC-MS/MS检测蚯蚓体内CYP2C9酶活力图;
图6为4′-羟基双氯芬酸生成量与微粒体蛋白浓度的相关性图;
图7为4′-羟基双氯芬酸生成量与孵育时间的相关性图;
图8为暴露于苯并[a]芘染毒土壤14天后,蚯蚓体内CYP2C9酶活力检测图。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。
材料及试剂:色谱纯乙腈、甲醇均购自Merck公司,色谱纯双氯芬酸钠、甲酸及Tris均购自中国上海Sigma-Aldrich公司,代谢产物4′-羟基双氯芬酸、孵育反应中NADPH反应系统均购自BD genetest,超纯水由德国Sartorius Arium 611DI超纯水系统过滤,C18质谱色谱柱来自美国Phenomenex公司,赤子爱胜蚓购自沈阳农业大学,并在(20±2)℃黑暗条件下保存于清洁土壤中。
方法原理:采用双氯芬酸钠(DF)作为探针底物,在蚯蚓CYP2C9酶存在条件下,可被催化转化为4′-羟基双氯芬酸(4′H-DF)(如图1),通过高效液相色谱串联质谱联用仪(LC-MS/MS)测定4′-羟基双氯芬酸的生成量来反映CYP2C9酶活力。
实施例1
流动相成分确定
考察三组流动相组成对检测灵敏度的影响:第一种是流动相中A为纯水,B为纯乙腈;第二种为A为水(含体积分数为0.1%的甲酸),B为纯乙腈;第三种为A为水(含体积分数为0.1%的甲酸),B为乙腈(含体积分数为0.1%的甲酸),结果表明最后一种流动相有效改善了色谱峰形及峰面积的稳定性,因此,确定以A为水(含体积分数为0.1%的甲酸),B为乙腈(含体积分数为0.1%的甲酸)作为最佳流动相。
实施例2
LC-MS/MS条件设置
LC-MS/MS为Thermo Fisher Scientific TSQ Quantum Max三重四级杆串联质谱-HPLC系统,其中,高效液相色谱条件为:
a)色谱柱:MS Luna C18柱,2.1mm×50mm,3.0μm,并配备相应的C18保护柱;b)流动相由A相和B相组成,所述A相为含体积分数为0.1%甲酸的水,所述B相为含体积分数为0.1%甲酸的乙腈;c)梯度洗脱条件:0-4min,流动相B的比例由5%上升至95%;4-8min,流动相B的比例由95%下降至5%;8-10min,流动相B的比例为5%;d)柱温:50℃;e)流速:0.2ml/min;f)自动进样室温度:4℃,进样体积为5μl。
质谱条件为:
a)离子源:电喷雾电离;b)检测方式:正离子;c)电喷雾电压:3kV;d)离子源温度:350℃;e)碰撞气体及气压:氩气,1.2mTorr;f)扫描模式:多反应离子监测;g)氮鞘、离子扫描、辅助气体:分别设置为40、0、10个单位。
由于底物双氯芬酸钠浓度较高,因此双氯芬酸钠的定量仍采用的紫外检测器二极管阵列(PDA)于280nm波长下定量,MS/MS用来检测代谢产物4′-羟基双氯芬酸。
每个化合物选取1对母离子/子离子对结合保留时间定性,各参数列于表1,数据处理采用LC-MS/MS自配的X-Calibur软件。
表1 双氯芬酸钠(DF)及4′-羟基双氯芬酸(4′H-DF)的MS/MS参数
实施例3
基质效应测试
(1)配置储备液:将甲醇与水按体积比1:1混合制得稀释液,将DF溶于所述稀释液至DF的终浓度为1.0mg/ml,制得DF储备液;将4′H-DF溶于甲醇至4′H-DF的终浓度为1.0mg/ml,制得4′H-DF储备液;
(2)配置工作液:将步骤(1)中4′H-DF储备液稀释为10ng/ml,制得4′H-DF工作液;DF储备液稀释为5μg/ml,制得DF工作液。
(3)将步骤(2)中4′H-DF工作液与DF工作液按体积比1:1混合,进行LC-MS/MS测定,其色质谱图如图2所示。
(4)取1ml 4′H-DF工作液于2ml试管中,在氮吹仪下吹干,添加250μl DF工作液,之后添加650μl孵育体系后升温至37℃,其中,孵育体系包括:590μl缓冲液(pH=7.5,0.1M的Tris),60μl NADPH产生系统(所述NADPH产生系统由A和B按体积比为5:1组成,所述A为葡萄糖-6-磷酸20mg/ml,NADP 20mg/ml,氯化镁13.3mg/ml;所述B为将葡萄糖-6-磷酸脱氢酶溶于5mM柠檬酸钠溶液中至葡萄糖-6-磷酸脱氢酶的终浓度为40U/ml),最后添加200μl甲醇,在离心力为15000×g下离心10min,取200μl上清液,用LC-MS/MS进行检测,其色质谱图如图3所示。
(5)取1ml 4′H-DF工作液于2ml试管中,在氮吹仪下吹干,添加250μl DF工作液,之后添加100μl失活酶液(将实施例6中制得的蚯蚓微粒体蛋白悬浮液进行失活处理)、650μl孵育体系后升温至37℃,其中,孵育体系包括:590μl缓冲液(pH=7.5,0.1M的Tris),60μl NADPH产生系统(所述NADPH产生系统由A和B按体积比为5:1组成,所述A为葡萄糖-6-磷酸20mg/ml,NADP 20mg/ml,氯化镁13.3mg/ml;所述B为将葡萄糖-6-磷酸脱氢酶溶于5mM柠檬酸钠溶液中至葡萄糖-6-磷酸脱氢酶的终浓度为40U/ml),最后添加200μl甲醇,在离心力为15000×g下离心10min,取200μl上清液,用LC-MS/MS进行检测,其色质谱图如图4所示。
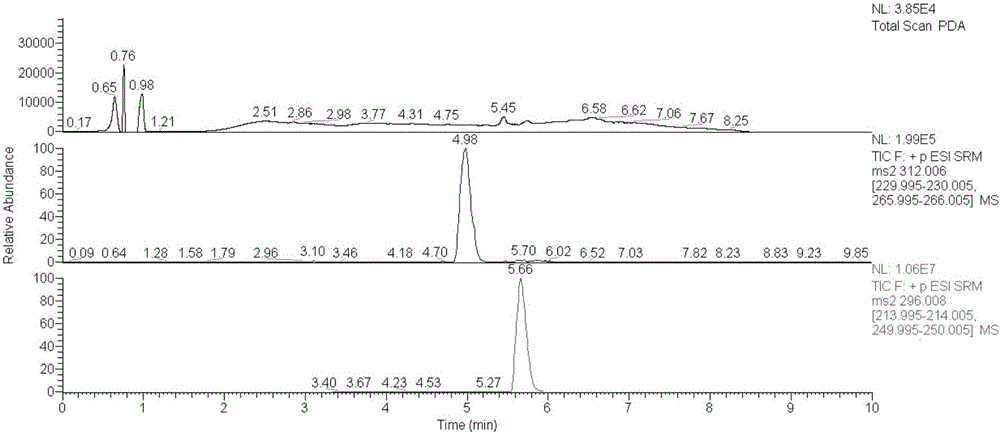
图2、图3、图4中均包含三个子图,从上到下依次为:LC-PDA色谱图、LC-MS/MS多反应监测模式下提取的色谱图:4′-羟基双氯芬酸(中间)、双氯芬酸钠(最下)。由图2可知,PDA仅能检测出双氯芬酸钠。相比PDA,MS/MS更为灵敏,采用保留时间(4.98min)并结合母离子/子离子对(312/230)能够定性4′-羟基双氯芬酸。因此,验证了此前文献报道的结论:紫外检测器无法检出代谢产物。另外,根据母离子/子离子对,推断4′-羟基双氯芬酸子离子(m/z为230)是由于母离子(m/z为312)丢失盐酸与甲酸所致,双氯芬酸钠子离子(m/z为250)是由于母离子(m/z为296)丢失甲酸所致。图3与图4的4′-羟基双氯芬酸的多反应监测模式提取图中,在保留时间约5.7min出现了副产物峰,显示了基质效应,初步判断该副产物为双氯芬酸钠与葡萄糖-6-磷酸形成的结合物。
实施例4
标准曲线的建立:
(1)将实施例3中步骤(1)中4′H-DF储备液分别稀释为10ng/ml、50ng/ml、250ng/ml、1000ng/ml、2500ng/ml、5000ng/ml,制得6个4′H-DF工作液;DF储备液分别稀释为5μg/ml、10μg/ml、20μg/ml、40μg/ml、80μg/ml、150μg/ml,制得6个DF工作液。从低到高分别取各浓度下的4′H-DF工作液1ml,置于2ml离心管中,在氮吹仪下吹干,然后分别对应加入250μl浓度为5μg/ml、10μg/ml、20μg/ml、40μg/ml、80μg/ml、150μg/ml的DF工作液,制得6个待测液。
(2)分别向步骤(1)中装有待测液的6个离心管中加入650μl孵育体系及100μl已经失活的酶溶液(将实施例6中制得的蚯蚓微粒体蛋白悬浮液进行失活处理)后升温至37℃,其中,孵育体系包括:590μl缓冲液(pH=7.5,0.1M的Tris),60μl NADPH产生系统(所述NADPH产生系统由A和B按体积比为5:1组成,所述A为葡萄糖-6-磷酸20mg/ml,NADP 20mg/ml,氯化镁13.3mg/ml;所述B为将葡萄糖-6-磷酸脱氢酶溶于5mM柠檬酸钠溶液中至葡萄糖-6-磷酸脱氢酶的终浓度为40U/ml)。再向离心管中加入200μl甲醇,在离心力为15000×g下离心10min,取200μl上清液,用LC-MS/MS进行检测,制得标准曲线,所得数据见表2。
表2 标准曲线数据表
由表2可知,待测化合物的线性关系良好,回归系数r2均大于0.99,4′H-DF的定量限为10ng/ml,DF的定量限为5μg/ml。
实施例5
LC-MS/MS方法学验证
1、样品制备
(1)将实施例3中步骤(1)中4′H-DF储备液分别稀释为30ng/ml、500ng/ml、4000ng/ml制得3个4′H-DF工作液;DF储备液分别稀释为9μg/ml、60μg/ml、120μg/ml,制得3个DF工作液。从低到高分别取各浓度下的4′H-DF工作液1ml,置于2ml离心管中,在氮吹仪下吹干,然后分别对应加入250μl浓度为9μg/ml、60μg/ml、120μg/ml的DF工作液,制得3个待测液,为纯样品。
(2)按照实施例4中步骤(2)所述方法,制得3个基质样品。
2、准确度与精密度
用LC-MS/MS分别对3个基质样品进行检测,其中,对于每一个基质样品,设置5个平行样品,每个样品重复测定4次,连续4天重复此过程,测试结果见表3。
表3 基质样品的准确度与精密度
由表3可知,所有基质样品准确度均大于85%,日内精密度范围为2.79-10.37%,日间精密度范围为2.21-10.25%,符合美国食品与药品管理局(FDA)关于方法验证中对精密度与准确度的要求。
3、提取回收率
用LC-MS/MS分别对纯样品和基质样品进行检测,通过比较纯样品与基质样品在LC-MS/MS上的响应,确定回收率,结果见表4。
表4 目标化合物的回收率((%,±SD,n=4))
由表4可知,基质样品中,4′H-DF的回收率为80-87%,DF的回收率约为80%,表明基质效应对于定量测定结果影响不大。
4、稳定性
将基质样品在分别在室温下放置10h、4℃存放24h、-30℃存放30天后,然后用LC-MS/MS分别对三种储存条件下的基质样品进行检测,结果见表5。
表5 不同储存条件下基质样品的稳定性(回收率,%,±SD,n=4),结果表示为添加浓度的百分比(分别在高、中、低浓度三个质控水平下)
由表5可知,基质样品的稳定性良好。
实施例6
制备蚯蚓微粒体蛋白悬浮液
将保存于4℃下20%(V/V)甘油溶液中的蚯蚓取出后,迅速解剖内脏,用0.15mol/L KCl溶液清洗内脏,随后转移到装有4ml匀浆缓冲液(蔗糖250mmol/L,Tris 50mmol/L,DTT 1mmol/L,EDTA 1mmol/L,pH=7.5)的玻璃组织研磨器中使其均匀破碎,并将最终匀浆体积定为6ml。
采用差速离心法提取微粒体:利用低温超速离心机,将匀浆液在4℃,离心力为15000×g条件下离心15min后,保留上清液,再将上清液在4℃,离心力为15000×g条件下离心90min,将所得沉淀用3ml保存缓冲液(蔗糖50mmol/L,Tris 50mmol/L,DTT 1mmol/L,EDTA 1mmol/L,pH=7.5,20%(V/V)甘油)重新悬浮,制得蚯蚓微粒体悬蛋白浮液,于-80℃下储存备用。
实施例7
LC-MS/MS检测蚯蚓体内CYP2C9酶活力
(1)取2ml的离心管,加入650μl孵育体系及250μl DF溶液,其中,孵育体系包括:590μl缓冲液(pH=7.5,0.1M的Tris),60μl NADPH产生系统(所述NADPH产生系统由A和B按体积比为5:1组成,所述A为葡萄糖-6-磷酸20mg/ml,NADP 20mg/ml,氯化镁13.3mg/ml;所述B为将葡萄糖-6-磷酸脱氢酶溶于5mM柠檬酸钠溶液中至葡萄糖-6-磷酸脱氢酶的终浓度为40U/ml)。此时,DF在混合溶液中的浓度为100μM。然后,将100μl蚯蚓微粒体蛋白悬浮液加离心管中至微粒体蛋白浓度为10μg/ml,升温至37℃,启动酶促反应,反应时间为15min,再向离心管中加入200μl甲醇,在离心力为15000×g下离心10min,取200μl上清液,以LC-MS/MS进行检测,检测结果如图5所示。与图4对比,图5仍能看出基质效应,不同的是由于酶具有活性,能催化双氯芬酸钠转化为4′-羟基双氯芬酸,基质效应减弱。CYP2C9酶活力的计算公式如下:
X=C4′H-DF/(M4′H-DF×Cprotein)
X–CYP2C9酶活力,单位nmol/mg·protein;
C4′H-DF–反应体系中4′-羟基双氯芬酸的浓度,单位ng/ml;
M4′H-DF–4′-羟基双氯芬酸的摩尔质量,单位g/mol;
Cprotein–反应体系中蛋白浓度,单位mg/ml。
(2)按照(1)中的方法,改变蚯蚓微粒体蛋白悬浮液加入孵育体系后微粒体蛋白的浓度,使其分别为20μg/ml、50μg/ml、100μg/ml、200μg/ml,进行测试,计算CYP2C9酶活力。结合(1)中的实验数据,得到代谢产物生成量与微粒体蛋白添加量的相关性,结果见图6,由图6可知,孵育体系中微粒体白浓度在10-100μg/ml范围内,代谢产物生成量(y)与微粒体蛋白浓度(x)呈现较好的线性关系,回归方程为y=8.273+0.436x,回归系数R2=0.996。
(3)按照(1)中的方法,改变蚯蚓微粒体蛋白悬浮液加入孵育体系后微粒体蛋白的浓度,使其分别为32μg/ml、64μg/ml,然后改变酶促反应时间,使时间分别为5min、15min、40min、60min,测试在不同浓度下经不同反应时间所得的样品,得到代谢产物生成量与孵育时间的相关性,结果见图7,由图7可知,孵育时间越长,代谢产物的生成量越多,但孵育时间超过15min,代谢产物的生成量增幅很小(<10%,相比孵育时间15min时的产物生成量)。因此,在酶促反应中,孵育时间15min最为适宜。
实施例8
暴露于低浓度苯并[a]芘污染土壤中蚯蚓CYP2C9活力的测定
取暴露于苯并[a]芘染毒的土壤中14天后的蚯蚓样品,按照实施例6中的方法制备蚯蚓微粒体蛋白悬浮液。其中,土壤中苯并[a]芘的染毒浓度梯度为:0.12、0.24、0.48、0.96mg/kg,每个暴露浓度设置6个平行,用LC-MS/MS进行测试,得到各染毒浓度下,蚯蚓CYP2C9酶活力的响应变化,如图8所示。由图8可知,低浓度苯并[a]芘(0.12、0.24mg/kg)显著诱导了蚯蚓CYP2C9酶活力,导致CYP2C9酶活力显著高于对照水平,其中在0.12mg/kg苯并[a]芘致使CYP2C9活力达到对照水平的1.43倍。随着暴露浓度的提高,蚯蚓CYP2C9酶活力被抑制,低于对照水平,在0.96mg/kg苯并[a]芘导致蚯蚓CYP2C9酶活力仅达到对照水平的78%。由此可见,蚯蚓CYP2C9酶活力可作为生物标记物来诊断土壤苯并[a]芘污染状况。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!