一种高直链淀粉各组分含量的分析方法与流程
本发明属于淀粉组分检测技术领域,具体涉及一种高直链淀粉各组分含量的分析方法。
背景技术:
淀粉主要由直链淀粉、中间组分和支链淀粉组成,其中中间组分主要存在于高直链淀粉中。直链淀粉主要是由α-1,4糖苷键相连的线性葡萄糖聚合物;支链淀粉除了α-1,4糖苷键外,还有α-1,6糖苷键形成的高度分支的葡萄糖聚合物;中间组分的分子量与直链淀粉相似,但有许多侧链,并且侧链长度比支链淀粉侧链长。淀粉各组分的含量和分子结构是评价淀粉品质的主要依据和重要指标,决定淀粉的用途。
直链淀粉含量的提高影响淀粉的特性和用途,如高直链淀粉的作物籽粒富含抗性淀粉,而抗性淀粉可以促进人体胆固醇和血脂质的代谢、控制膳后血糖值、减少肠机能失调及结肠癌发病率、控制体重和能量平衡、促进矿物质的吸收、增加营养,能降低一些慢性病(如糖尿病、大肠癌、肥胖等)的发病风险,具有提高人体健康功能的特性。另外,高直链淀粉由于拥有难糊化、易老化和成膜性高等特点,也具有特殊的工业用途。因此高直链淀粉的研究受到人们的普遍关注。
淀粉按各组分含量的不同分为糯性淀粉、普通淀粉和高直链淀粉,其中糯性淀粉主要含有支链淀粉组分;普通淀粉主要包含支链淀粉和直链淀粉,中间组分的含量较少;而高直链淀粉除了包含支链淀粉和直链淀粉外,还含有很高的中间组分,并且其含量和分子结构在不同来源的高直链淀粉中差异极大,对淀粉品质和用途也有显著影响。而目前现有的测定方法仅适用于对糯性淀粉和普通淀粉各组分的测定,而对高直链淀粉中的中间组分无法分析。鉴于高直链淀粉普遍受到人们的重视,因此亟需建立一种准确、快速,大多数实验室有能力完成的并且能够分离和分析高直链淀粉各组分含量的方法,为高直链淀粉各组分的含量测定和分子结构研究提供技术支持。
技术实现要素:
本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本申请的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
鉴于上述和/或现有高直链淀粉各组分测定的技术空白,提出了本发明。
因此,本发明目的是解决现有技术中的不足,提供一种高直链淀粉各组分含量的分析方法。
为解决上述技术问题,本发明提供了如下技术方案:一种高直链淀粉各组分含量的分析方法,将高直链淀粉制备成溶液并冷却,过滤后上样到琼脂糖凝胶层析柱,用淋洗液清洗后,恒流速通入淋洗液并接样,通过蒽酮-硫酸法和碘比色法测定样品,计算其中支链淀粉组分、中间组分及直链淀粉组分的含量;所述淋洗液包括24~26mmol/L NaCl与0.8~1.2mmol/L NaOH的混合液。
作为本发明所述高直链淀粉各组分含量的分析方法的一种优选方案,其中:所述高直链淀粉制备成溶液,其是取高直链淀粉向其中加入蛋白酶溶液,混匀后在35~40℃、300~400rpm条件下孵育25~35min,混匀离心,去除上清液后加入亚硫酸氢钠溶液,混匀后在37℃、300~400rpm条件下反应25~35min,混匀离心去除上清液,快速加入溴化锂/二甲基亚砜,混匀,在75~85℃、300~400rpm条件下8~10h,取出冷却至室温,离心8~12min,去除上清液加底物体积3~5倍的无水乙醇,离心8~12min后去除上清液,吸水纸干燥8~12min,用60~80℃的水溶解样品,制成0.1~0.3%浓度的溶液,沸水浴25~35min后,得到高直链淀粉溶液。
作为本发明所述高直链淀粉各组分含量的分析方法的一种优选方案,其中:所述琼脂糖凝胶层析柱,其是将琼脂糖CL-2B作为填料,装柱后用所述淋洗液冲洗柱子20~28h,淋洗速度为0.4~0.6mL/min。
作为本发明所述高直链淀粉各组分含量的分析方法的一种优选方案,其中:所述碘比色法,其中,淀粉的碘吸收光谱测定方法包括将样品、碘液及水混合,反应8~12min,用分光光度计测OD630nm处吸光度为淀粉碘吸收值,分析每管样品最大吸收峰的峰值对应的波长。
作为本发明所述高直链淀粉各组分含量的分析方法的一种优选方案,其中:所述蛋白酶溶液pH为7.0~8.0,酶活为2.0~3.0U/mL,其添加量为每毫克所述高直链淀粉添加0.04~0.06mL。
作为本发明所述高直链淀粉各组分含量的分析方法的一种优选方案,其中:所述蛋白酶溶液是用缓冲液溶解的,其中缓冲液的制作方法包括,将N-甘氨酸添加到水中,并将其pH调至7.0~8.0。
作为本发明所述高直链淀粉各组分含量的分析方法的一种优选方案,其中:所述亚硫酸氢钠溶液其添加量为每毫克所述高直链淀粉添加0.04~0.06mL,其中,亚硫酸氢钠与溶液的质量体积比为0.004~0.005:1。
作为本发明所述高直链淀粉各组分含量的分析方法的一种优选方案,其中:所述溴化锂/二甲基亚砜,其添加量为每毫克所述高直链淀粉添加0.12~0.18mL,其中,溴化锂占二甲基亚砜的质量分数为0.4~0.6%。
作为本发明所述高直链淀粉各组分含量的分析方法的一种优选方案,其中:所述琼脂糖凝胶层析柱,其柱长为50cm,柱内径为1.6cm。
作为本发明所述高直链淀粉各组分含量的分析方法的一种优选方案,其中:所述恒流速通入淋洗液,其通入流速为0.4~0.6mL/min。
本发明所具有的有益效果:
(1)整个操作和分析过程简单、方便,不需要复杂的仪器设备。
(2)成本低廉、分离效果好,测量结果较准确。
(3)所需样品量较小,比较适于微量样品的检测,结果重现性较好。
(4)能够测得淀粉中直链淀粉、支链淀粉和中间组分的含量,也可以满足对淀粉各组分的富集和研究,为淀粉各组分含量测定和分子结构的研究提供技术支持。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
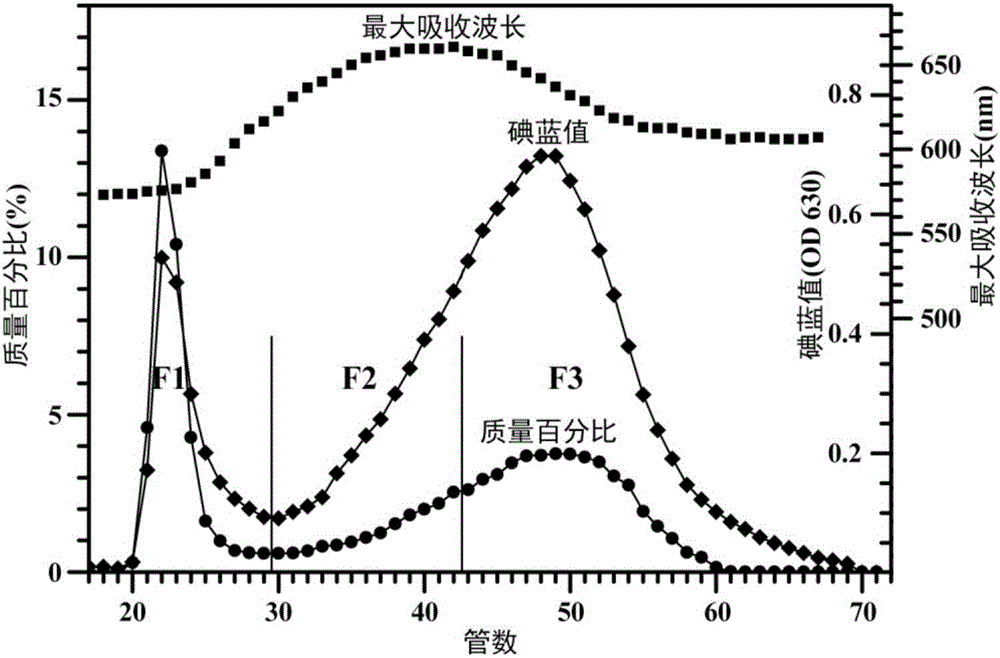
图1为实施例1中高直链玉米淀粉各组分分布。
图2为实施例4中高直链水稻淀粉各组分分布。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
实施例1
琼脂糖凝胶层析柱的制备,主要步骤为:
(1)填料的选取:选取琼脂糖CL-2B(Sigma公司CL2B300)做为填料。
(2)淋洗液的制备:称量2.925g NaCl和0.08g NaOH,用去离子水溶解并定容至2L,配成25mM NaCl和1mM NaOH的水溶液。
(3)装柱:按常规琼脂糖凝胶层析柱的装柱方法装柱,其柱长为50cm,柱内径为1.6cm。
(4)洗柱:淋洗液冲洗柱子24h(0.5mL/min),以达到稳定的柱子条件。
淀粉溶液的制备,主要步骤为:
(1)称取高直链玉米淀粉(Sigma公司产品S4180)10±0.03mg到2mL离心管;
(2)加入0.5mL蛋白酶溶液(pH 7.5,2.5U/mL,用缓冲液溶解)(蛋白酶为Sigma公司产品P5147),用涡旋混合器混匀,转移至恒温混匀仪,37℃350rpm孵育30min(蛋白酶储存于-20℃冰箱中;缓冲液保存于4℃冰箱);
缓冲液(250mM,pH 7.5)的配制:
a.加44.8g N-甘氨酸到1L去离子水;
b.配制1M NaOH:4g NaOH溶于100mL的去离子水;
c.用b调a的pH到7.5。
(3)涡旋混匀,4000g离心10min,用移液枪小心吸掉上清液;
(4)加入0.5mL亚硫酸氢钠溶液(0.45%,W/V),用涡旋混合器混匀,转移至恒温混匀仪,37℃350rpm反应30min(破坏二硫键);
(5)涡旋混匀,4000g离心10min,倒去上清液;
(6)快速加入1.5mL LiBr/DMSO(0.5%,W/W),颠倒混匀;
(7)转移至恒温混合仪,80℃350rpm过夜。
(8)取出冷却至室温,4000g离心10min,吸取上清加4倍无水酒精(6mL)沉淀淀粉,4000g,离心10min,去掉上清,沉淀再用酒精清洗一次,倒扣吸水纸上干燥10min。
(9)预先准备好热的去离子水,用5mL移液枪吸取5mL热水溶解样品,抽打至完全溶解,制备成0.2%浓度的溶液,沸水浴30min。
淀粉各组分琼脂糖凝胶层析柱的分离,主要步骤为:
(1)淀粉溶液冷却至室温,用5μm针式滤器过滤至10mL离心管。
(2)打开止水钳,待柱内淋洗液与柱面相切时,关闭止水钳,用移液枪吸取2mL样品沿着层析柱内壁缓缓加到柱面。
(3)打开止水钳,将下管口放到量筒内,待样品流至填料内(即与柱面相切时),用淋洗液清洗层析柱管口两次,每次200μL,沿着上样的部位清洗。
(4)等到量筒内淋洗液达到20mL时立刻启动全自动部分收集器,将管口转移至部分收集器的卡口,定时接样,将层析柱淋洗液洗脱下来的样品收集到2mL离心管,设定时间为3min,1.5mL/管(之前大量实验已确定前20mL不会有样品流出,证明外水体积大于20mL),每个样品另外接55管。
淀粉各组分的测定与分析,主要步骤为:
(1)将每管收集的样品颠倒混匀,其中的1mL用硫酸-蒽酮法来测定各管的淀粉含量;淀粉的碘吸收光谱测定如下:0.4mL样品+1.56mL去离子水+0.04mL碘液(0.2%I2和2%KI,W/V),将混合液颠倒摇匀,室温避光反应10min,用分光光度计测OD 630nm处吸光度为淀粉碘吸收值,分析每管样品最大吸收峰的峰值对应的波长(λmax)。
(2)通过蒽酮-硫酸法和碘比色法测得高直链玉米淀粉分子量分布如图1所示。630nm处的吸光度被称为碘蓝值,反应淀粉与碘的亲和力;最大吸收波长λmax反应淀粉的平均链长;F1(17~29管)为支链淀粉组分,F2(30~42管)为中间组分,F3(43~70管)为直链淀粉组分。图1高直链玉米淀粉中F1、F2和F3的含量分别为49.7%、12.1%和38.2%。
实施例2
琼脂糖凝胶层析柱的制备,主要步骤为:
(1)填料的选取:选取琼脂糖CL-2B(Sigma公司CL2B300)做为填料。
(2)淋洗液的制备:称量2.925g NaCl和0.08g NaOH,用去离子水溶解并定容至2L,配成25mM NaCl和1mM NaOH的水溶液。
(3)装柱:按常规琼脂糖凝胶层析柱的装柱方法装柱,其柱长为50cm,柱内径为1.6cm。
(4)洗柱:淋洗液冲洗柱子24h(0.5mL/min),以达到稳定的柱子条件。
淀粉溶液的制备,主要步骤为:
(1)称取高直链玉米淀粉(Sigma公司产品S4180)10±0.03mg到2mL离心管;
(2)加入0.5mL蛋白酶溶液(pH 7.5,2.5U/mL,用缓冲液溶解)(蛋白酶为Sigma公司产品P5147),用涡旋混合器混匀,转移至恒温混匀仪,37℃350rpm孵育30min(蛋白酶储存于-20℃冰箱中;缓冲液保存于4℃冰箱);
缓冲液(250mM,pH 7.5)的配制:
a.加44.8g N-甘氨酸到1L去离子水;
b.配制1M NaOH:4g NaOH溶于100mL的去离子水;
c.用b调a的pH到7.5。
(3)涡旋混匀,4000g离心10min,用移液枪小心吸掉上清液;
(4)加入0.5mL亚硫酸氢钠溶液(0.45%,W/V),用涡旋混合器混匀,转移至恒温混匀仪,37℃350rpm反应30min(破坏二硫键);
(5)涡旋混匀,4000g离心10min,倒去上清液;
(6)快速加入1.5mL LiBr/DMSO(0.5%,W/W),颠倒混匀;
(7)转移至恒温混合仪,80℃350rpm过夜。
(8)取出冷却至室温,4000g离心10min,吸取上清加4倍无水酒精(6mL)沉淀淀粉,4000g,离心10min,去掉上清,沉淀再用酒精清洗一次,倒扣吸水纸上干燥10min。
(9)预先准备好热的去离子水,用5mL移液枪吸取5mL热水溶解样品,抽打至完全溶解,制备成0.2%浓度的溶液,沸水浴30min。
淀粉各组分琼脂糖凝胶层析柱的分离,主要步骤为:
(1)淀粉溶液冷却至室温,用5μm针式滤器过滤至10mL离心管。
(2)打开止水钳,待柱内淋洗液与柱面相切时,关闭止水钳,用移液枪吸取2mL样品沿着层析柱内壁缓缓加到柱面。
(3)打开止水钳,将下管口放到量筒内,待样品流至填料内(即与柱面相切时),用淋洗液清洗层析柱管口两次,每次200μL,沿着上样的部位清洗。
(4)等到量筒内淋洗液达到20mL时立刻启动全自动部分收集器,将管口转移至部分收集器的卡口,定时接样,将层析柱淋洗液洗脱下来的样品收集到2mL离心管,设定时间为3min,1.5mL/管(之前大量实验已确定前20mL不会有样品流出,证明外水体积大于20mL),每个样品另外接55管。
淀粉各组分的测定与分析,主要步骤为:
(1)将每管收集的样品颠倒混匀,其中的1mL用硫酸-蒽酮法来测定各管的淀粉含量;淀粉的碘吸收光谱测定如下:0.4mL样品+1.56mL去离子水+0.04mL碘液(0.2%I2和2%KI,W/V),将混合液颠倒摇匀,室温避光反应10min,用分光光度计测OD 630nm处吸光度为淀粉碘吸收值,分析每管样品最大吸收峰的峰值对应的波长(λmax)。
(2)通过蒽酮-硫酸法和碘比色法测得高直链玉米淀粉分子量分布。630nm处的吸光度被称为碘蓝值,反应淀粉与碘的亲和力;最大吸收波长λmax反应淀粉的平均链长;F1(17~29管)为支链淀粉组分,F2(30~42管)为中间组分,F3(43~70管)为直链淀粉组分。实施例2中高直链玉米淀粉中F1、F2和F3的含量分别为50.5%、11.0%和38.5%。
实施例3
琼脂糖凝胶层析柱的制备,主要步骤为:
(1)填料的选取:选取琼脂糖CL-2B(Sigma公司CL2B300)做为填料。
(2)淋洗液的制备:称量2.925g NaCl和0.08g NaOH,用去离子水溶解并定容至2L,配成25mM NaCl和1mM NaOH的水溶液。
(3)装柱:按常规琼脂糖凝胶层析柱的装柱方法装柱,其柱长为50cm,柱内径为1.6cm。
(4)洗柱:淋洗液冲洗柱子24h(0.5mL/min),以达到稳定的柱子条件。
淀粉溶液的制备,主要步骤为:
(1)称取高直链玉米淀粉(Sigma公司产品S4180)10±0.03mg到2mL离心管;
(2)加入0.5mL蛋白酶溶液(pH 7.5,2.5U/mL,用缓冲液溶解)(蛋白酶为Sigma公司产品P5147),用涡旋混合器混匀,转移至恒温混匀仪,37℃350rpm孵育30min(蛋白酶储存于-20℃冰箱中;缓冲液保存于4℃冰箱);
缓冲液(250mM,pH 7.5)的配制:
a.加44.8g N-甘氨酸到1L去离子水;
b.配制1M NaOH:4g NaOH溶于100mL的去离子水;
c.用b调a的pH到7.5。
(3)涡旋混匀,4000g离心10min,用移液枪小心吸掉上清液;
(4)加入0.5mL亚硫酸氢钠溶液(0.45%,W/V),用涡旋混合器混匀,转移至恒温混匀仪,37℃350rpm反应30min(破坏二硫键);
(5)涡旋混匀,4000g离心10min,倒去上清液;
(6)快速加入1.5mL LiBr/DMSO(0.5%,W/W),颠倒混匀;
(7)转移至恒温混合仪,80℃350rpm过夜。
(8)取出冷却至室温,4000g离心10min,吸取上清加4倍无水酒精(6mL)沉淀淀粉,4000g,离心10min,去掉上清,沉淀再用酒精清洗一次,倒扣吸水纸上干燥10min。
(9)预先准备好热的去离子水,用5mL移液枪吸取5mL热水溶解样品,抽打至完全溶解,制备成0.2%浓度的溶液,沸水浴30min。
淀粉各组分琼脂糖凝胶层析柱的分离,主要步骤为:
(1)淀粉溶液冷却至室温,用5μm针式滤器过滤至10mL离心管。
(2)打开止水钳,待柱内淋洗液与柱面相切时,关闭止水钳,用移液枪吸取2mL样品沿着层析柱内壁缓缓加到柱面。
(3)打开止水钳,将下管口放到量筒内,待样品流至填料内(即与柱面相切时),用淋洗液清洗层析柱管口两次,每次200μL,沿着上样的部位清洗。
(4)等到量筒内淋洗液达到20mL时立刻启动全自动部分收集器,将管口转移至部分收集器的卡口,定时接样,将层析柱淋洗液洗脱下来的样品收集到2mL离心管,设定时间为3min,1.5mL/管(之前大量实验已确定前20mL不会有样品流出,证明外水体积大于20mL),每个样品另外接55管。
淀粉各组分的测定与分析,主要步骤为:
(1)将每管收集的样品颠倒混匀,其中的1mL用硫酸-蒽酮法来测定各管的淀粉含量;淀粉的碘吸收光谱测定如下:0.4mL样品+1.56mL去离子水+0.04mL碘液(0.2%I2和2%KI,W/V),将混合液颠倒摇匀,室温避光反应10min,用分光光度计测OD 630nm处吸光度为淀粉碘吸收值,分析每管样品最大吸收峰的峰值对应的波长(λmax)。
(2)通过蒽酮-硫酸法和碘比色法测得高直链玉米淀粉分子量分布。630nm处的吸光度被称为碘蓝值,反应淀粉与碘的亲和力;最大吸收波长λmax反应淀粉的平均链长;F1(17~29管)为支链淀粉组分,F2(30~42管)为中间组分,F3(43~70管)为直链淀粉组分。实施例3中高直链玉米淀粉中F1、F2和F3的含量分别为89.5%、12.7%和38.8%。
实施例4
琼脂糖凝胶层析柱的制备,主要步骤为:
(1)填料的选取:选取琼脂糖CL-2B(Sigma公司CL2B300)做为填料。
(2)淋洗液的制备:称量2.925g NaCl和0.08g NaOH,用去离子水溶解并定容至2L,配成25mM NaCl和1mM NaOH的水溶液。
(3)装柱:按常规琼脂糖凝胶层析柱的装柱方法装柱。
(4)洗柱:淋洗液冲洗柱子24h(0.5mL/min),以达到稳定的柱子条件。
淀粉溶液的制备,主要步骤为:
(1)称取高直链水稻淀粉(扬州大学农学院利用基因工程方法抑制淀粉分支酶1和3基因表达培育出的高直链淀粉水稻株系TRS)10±0.03mg到2mL离心管;
(2)加入0.5mL蛋白酶溶液(pH 7.5,2.5U/mL,用缓冲液溶解)(蛋白酶为Sigma公司产品P5147),用涡旋混合器混匀,转移至恒温混匀仪,37℃350rpm孵育30min(蛋白酶储存于-20℃冰箱中;缓冲液保存于4℃冰箱);
缓冲液(250mM,pH 7.5)的配制:
a.加44.8g N-甘氨酸到1L去离子水;
b.配制1M NaOH:4g NaOH溶于100mL的去离子水;
c.用b调a的pH到7.5。
(3)涡旋混匀,4000g离心10min,用移液枪小心吸掉上清液;
(4)加入0.5mL亚硫酸氢钠溶液(0.45%,W/V),用涡旋混合器混匀,转移至恒温混匀仪,37℃350rpm反应30min(破坏二硫键);
(5)涡旋混匀,4000g离心10min,倒去上清液;
(6)快速加入1.5mL LiBr/DMSO(0.5%,W/W),颠倒混匀;
(7)转移至恒温混合仪,80℃350rpm过夜。
(8)取出冷却至室温,4000g离心10min,吸取上清加4倍无水酒精(6mL)沉淀淀粉,4000g,离心10min,去掉上清,沉淀再用酒精清洗一次,倒扣吸水纸上干燥10min。
(9)预先准备好热的去离子水,用5mL移液枪吸取5mL热水溶解样品,抽打至完全溶解,制备成0.2%浓度的溶液,沸水浴30min。
淀粉各组分琼脂糖凝胶层析柱的分离,主要步骤为:
(1)淀粉溶液冷却至室温,用5μm针式滤器过滤至10mL离心管。
(2)打开止水钳,待柱内淋洗液与柱面相切时,关闭止水钳,用移液枪吸取2mL样品沿着层析柱内壁缓缓加到柱面。
(3)打开止水钳,将下管口放到量筒内,待样品流至填料内(即与柱面相切时),用淋洗液清洗层析柱管口两次,每次200μL,沿着上样的部位清洗。
(4)等到量筒内淋洗液达到20mL时立刻启动全自动部分收集器,将管口转移至部分收集器的卡口,定时接样,将层析柱淋洗液洗脱下来的样品收集到2mL离心管,设定时间为3min,1.5mL/管(之前大量实验已确定前20mL不会有样品流出,证明外水体积大于20mL),每个样品另外接55管。
淀粉各组分的测定与分析,主要步骤为:
(1)将每管收集的样品颠倒混匀,其中的1mL用硫酸-蒽酮法来测定各管的淀粉含量;淀粉的碘吸收光谱测定如下:0.4mL样品+1.56mL去离子水+0.04mL碘液(0.2%I2和2%KI,W/V),将混合液颠倒摇匀,室温避光反应10min,用分光光度计测OD 630nm处吸光度为淀粉碘吸收值,分析每管样品最大吸收峰的峰值对应的波长(λmax)。
(2)通过蒽酮-硫酸法和碘比色法测得高直链水稻淀粉分子量分布如图2所示。630nm处的吸光度被称为碘蓝值,反应淀粉与碘的亲和力;最大吸收波长λmax反应淀粉的平均链长;F1(17~29管)为支链淀粉组分,F2(30~42管)为中间组分,F3(43~70管)为直链淀粉组分。图2高直链水稻淀粉中F1、F2和F3的含量分别为33.7%、16.4%和49.9%。
实施例5
琼脂糖凝胶层析柱的制备,主要步骤为:
(1)填料的选取:选取琼脂糖CL-2B(Sigma公司CL2B300)做为填料。
(2)淋洗液的制备:称量2.925g NaCl和0.08g NaOH,用去离子水溶解并定容至2L,配成25mM NaCl和1mM NaOH的水溶液。
(3)装柱:按常规琼脂糖凝胶层析柱的装柱方法装柱。
(4)洗柱:淋洗液冲洗柱子24h(0.5mL/min),以达到稳定的柱子条件。
淀粉溶液的制备,主要步骤为:
(1)称取高直链玉米淀粉(Sigma公司产品S4180)10±0.03mg到2mL离心管;
(2)加入0.5mL蛋白酶溶液(pH 7.5,2.5U/mL,用缓冲液溶解)(蛋白酶为Sigma公司产品P5147),用涡旋混合器混匀,转移至恒温混匀仪,37℃350rpm孵育30min(蛋白酶储存于-20℃冰箱中;缓冲液保存于4℃冰箱);
缓冲液(250mM,pH 7.5)的配制:
a.加44.8g N-甘氨酸到1L去离子水;
b.配制1M NaOH:4g NaOH溶于100mL的去离子水;
c.用b调a的pH到7.5。
(3)涡旋混匀,4000g离心10min,用移液枪小心吸掉上清液;
(4)加入0.5mL亚硫酸氢钠溶液(0.45%,W/V),用涡旋混合器混匀,转移至恒温混匀仪,37℃350rpm反应30min(破坏二硫键);
(5)涡旋混匀,4000g离心10min,倒去上清液;
(6)快速加入1.5mL LiBr/DMSO(0.5%,W/W),颠倒混匀;
(7)转移至恒温混合仪,80℃350rpm过夜。
(8)取出冷却至室温,4000g离心10min,吸取上清加4倍无水酒精(6mL)沉淀淀粉,4000g,离心10min,去掉上清,沉淀再用酒精清洗一次,倒扣吸水纸上干燥10min。
(9)预先准备好热的去离子水,用5mL移液枪吸取5mL热水溶解样品,抽打至完全溶解,制备成0.2%浓度的溶液,沸水浴30min。
淀粉各组分琼脂糖凝胶层析柱的分离,主要步骤为:
(1)淀粉溶液冷却至室温,用5μm针式滤器过滤至10mL离心管。
(2)打开止水钳,待柱内淋洗液与柱面相切时,关闭止水钳,用移液枪吸取2mL样品沿着层析柱内壁缓缓加到柱面。
(3)打开止水钳,将下管口放到量筒内,待样品流至填料内(即与柱面相切时),用淋洗液清洗层析柱管口两次,每次200μL,沿着上样的部位清洗。
(4)等到量筒内淋洗液达到20mL时立刻启动全自动部分收集器,定时接样。
淀粉各组分的富集,主要步骤为:
(1)支链淀粉的富集:将管口立即转移到第一个500mL烧杯,将层析柱淋洗液洗脱下来的样品收集到500mL烧杯,设定时间为39min,体积约为19.5mL,为支链淀粉,加80mL无水乙醇,混匀静置15min以上。
(2)中间组分的富集:将管口立即转移到第二个500mL烧杯,将层析柱淋洗液洗脱下来的样品收集到500mL烧杯,设定时间为39min,体积约为19.5mL,为中间组分,加80mL无水乙醇,混匀静置15min以上。
(3)直链淀粉的富集:将管口立即转移到第三个500mL烧杯,将层析柱淋洗液洗脱下来的样品收集到500mL烧杯,设定时间为84min,体积约为42mL,为直链淀粉,加170mL无水乙醇,混匀静置15min以上。
(4)各组分的收集、保存:将烧杯中的淀粉悬液,6000g离心10min获得沉淀,将沉淀浸没于无水乙醇中进行脱水,用磁力搅拌器缓慢搅拌10min,脱水后6000g离心10min,倒去上清,沉淀40℃烘干,用研钵磨成淀粉粉末,过100目筛,称量其干重,干燥器保存备用。
实施例5中高直链玉米淀粉中支链淀粉、中间组分和直链淀粉的质量三次重复结果见表1。
表1高直链玉米淀粉各组分质量
实际应用中样品中的杂质容易对进液口以及凝胶孔径有堵塞作用,并且经研究发现,杂质与高直链淀粉中存在很大程度的交联,其中尤其是高直链淀粉中的支链结构与蛋白的交联。蛋白的空间构象主要靠静电作用、二硫键作用、氢键作用、疏水作用和偶极作用来维持,而支链结构末端与蛋白极性末端通过氢键来紧密连接,中性末端通过范德华力相互作用。同时这种交联将会给除杂过程带来问题,从而造成分离效率低、效果不好甚至将层析柱进液口及凝胶孔径堵塞。本发明通过优选优化预处理条件和处理试剂,将蛋白杂质完全去除,为后一步提高分离效率奠定良好基础。
注管内径多少会对层析分离的效果产生较大影响,内径太小,会发生管壁效应,即柱管中心部分的组分移动慢,而管壁周围的移动快。柱越长,分离效果越好,但柱过长,柱分离时间长,样品稀释度大,分离效果反而不好。同时作为琼脂糖凝胶柱,还必须满足层析柱要均匀,不能有断层、纹路或气泡。
综上可见,本发明提供的分离分析方法,能够实现高直链淀粉中组分的100%分离,分离效率极高。整个操作和分析过程简单、方便,不需要复杂的仪器设备;成本低廉、分离效果好,测量结果较准确;所需样品量较小,比较适于微量样品的检测,结果重现性较好;能够测得淀粉中直链淀粉、支链淀粉和中间组分的含量,也可以满足对淀粉各组分的富集和研究,为淀粉各组分含量测定和分子结构的研究提供技术支持。
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!