一种可溶性蛋白含量快速测定方法与流程
本发明涉及蛋白质含量检测领域,特别是指一种超声辅助蛋白提取过程中可溶性蛋白含量快速测定的方法。
背景技术:
超声作为一种非热物理加工技术,由于其存在操作简单,反应条件容易控制,并且能够实现产业放大化的优点,广泛应用于辅助提取蛋白的工艺中,以相同的提取率为衡量指标,超声与传统的提取工艺相比,大幅度地缩短了提取时间。
在超声辅助提取蛋白的工艺中,提取液中可溶性蛋白的含量对参数的优化及提取终点的控制至关重要。目前,可溶性蛋白的测定方法常用的有以下几种:凯氏定氮法、lowry法、双缩脲法等。
凯氏定氮法是将有机物与浓硫酸共热,有机物转变为氨,氨与硫酸作用生成硫酸铵,后者与强碱作用释放出氨,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量,即可计算出样品的含氮量,根据换算系数即可计算出蛋白质的量。该方法比较繁琐,但较准确。lowry法的原理是在碱性条件下,蛋白质与cu2+作用生成蛋白质-铜络合物。此络合物将试剂磷钼酸-磷钨酸(folin试剂)还原,混合物深蓝色(磷钼蓝和磷钨蓝混合物),颜色深浅与蛋白质含量成正比。灵敏度高,缺点是操作时间必须要精确控制。双缩脲法的原理为具有两个或两个以上肽键的化合物皆可与碱性高价铜呈颜色反应,在碱性溶液中蛋白质与cu2+形成紫色配合物,在540nm处有最大吸收峰。蛋白质浓度与双缩脲反应所呈的颜色深浅成正比,可用比色法定量测定。其优点为重复性、线性关系好,但灵敏度低,测定范围窄,并且测定时所需的样品量较大。lowry法相对于凯氏定氮法用时较短,相对于双缩脲法灵敏度高,因此是一种相对较好的测定可溶性蛋白质的方法。
然而上述这几种常用的测定方法在实际应用过程中都是以离线的形式测定,即在不同的反应时间取样后测定蛋白含量,对于生产实时监控测定耗时较长,通常需耗时1-6h,这种离线的方法获得蛋白含量存在严重的滞后性,无法实时监控生产。为了克服这种缺陷,急需一种快速、在线的检测蛋白含量的方法。
通常,原料中蛋白的溶出会引起溶液ph下降,采用超声辅助提取蛋白,可以加速这一变化,目前在超声提取过程中,利用维持ph稳定所消耗的碱量多少来检测可溶性蛋白的含量还未见报道。
技术实现要素:
本发明的目的是克服已有可溶性蛋白含量测定方法的缺点,为蛋白超声辅助提取技术,提供一种简单,有效的测定可溶性蛋白含量的方法。
为了实现上述发明目的,其具体的技术方案如下:一种可溶性蛋白含量快速测定方法,按照下述步骤进行:
(1)将蛋白原料放入烧杯中,按4-15%的料液比加入蒸馏水混合均匀,将超声波探头插入溶液中,超声反应一定时间,保持反应液中ph不变,通过加碱量与上清液中蛋白含量建立数学模型。
(2)根据建立的数学模型,并通过验证性试验分析数学模型的有效性。即可根据数学模型,通过超声过程中任意一点消耗碱的量预测相对应的蛋白含量,达到对溶液中可溶性蛋白的在线测定,并达到实时监测生产的目的。
上述的蛋白原料,可以为大米蛋白、大豆蛋白及一些水溶性蛋白含量高的蛋白原料。
上述的碱,可以为naoh、koh及氨水等。
本发明的优点在于:ph值降低所消耗的碱量与可溶性蛋白含量建立的数学模型存在很好的线性关系。反应过程中的加碱量可快速获得,蛋白的测定结果准确、可靠,相对离线的测定方法更加简便。
其中步骤(1)中的反应时间为41min。
其中步骤(1)中的反应ph为原料溶于水后的初始ph。
其中步骤(1)中的数学模型与蛋白浓度有关,根据不同蛋白浓度的不同超声时间上清液中的蛋白含量与耗碱量之间的关系建立。
附图说明
图1超声辅助提取蛋白示意图。
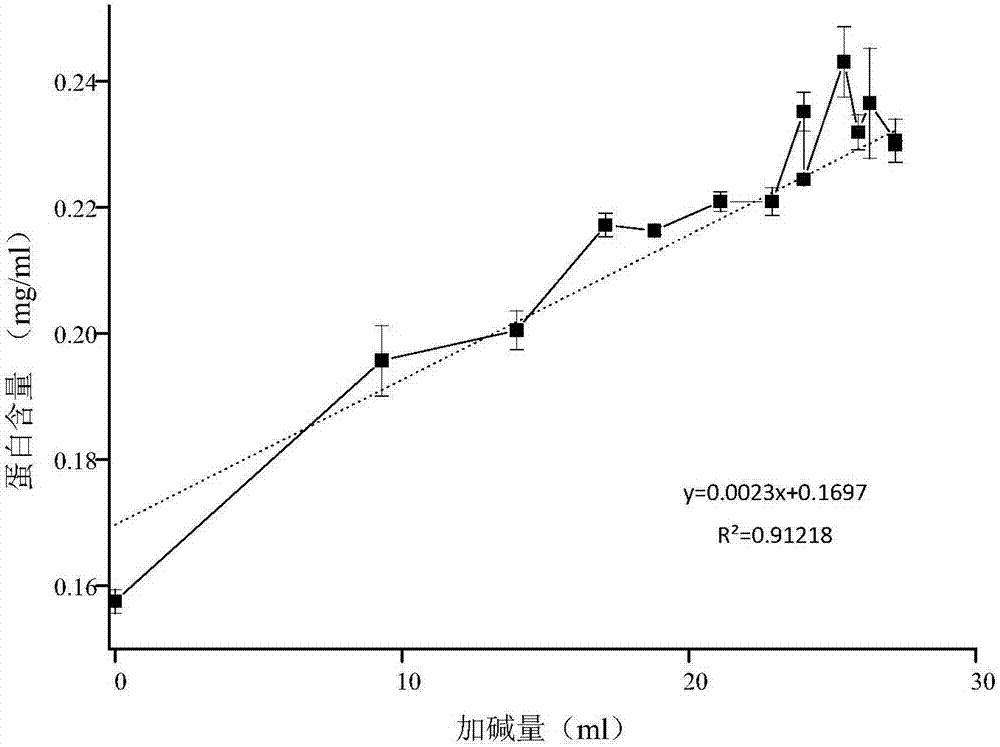
图2蛋白浓度4%时不同超声时间的上清液中蛋白含量与耗碱量的数学模型。
图3蛋白浓度15%时不同超声时间的上清液中蛋白含量与耗碱量的数学模型。
具体实施方式
在本发明中所使用的术语,除非有另外说明,一般具有本领域普通技术人员通常理解的含义。下面结合具体的实施例,并参照数据进一步详细地描述本发明。应理解,这些实施例只是,对本发明进行进一步说明,不能理解为对本发明保护范围的限定,该领域的技术工程师可根据上述发明的内容对本发明作出一些非本质的改进和调整。
在以下的实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。所用试剂的来源、商品名以及有必要列出其组成成分者,均在首次出现时标明,其后所用相同试剂如无特殊说明,均以首次标明的内容相同。
实施例1
(1)蛋白悬浊液配制:按4%料液比加入蒸馏水混合均匀,即称取120g大米蛋白,加入3l蒸馏水配成悬浊液。
(2)超声辅助提取蛋白:采用单频聚能式超声波设备辅助提取大米蛋白,将28khz超声波探头全部浸入大米蛋白溶液中,设置超声参数:功率密度60w/l,间歇比6:6s,温度30℃,时间41min。利用自动滴定仪滴加0.05mnaoh维持反应液中ph不变,分别在超声开始前,以及超声后第5min开始,每3min记录消耗的加碱量,同时取样1ml,于5000r/min条件下离心,上清液采用lowry法测定其中的蛋白含量。
(3)将上清液中蛋白含量与加碱量建立数学模型,见图2,所建立的数学模型为y=0.0023x+0.1697(r2=0.91218),其中y为蛋白含量(mg/ml),x为加碱量(ml)。
(4)对不同超声时间可溶性蛋白含量的预测:
蛋白悬浊液配制方法及超声波参数设定同上,分别在超声开始第7、21和39min,记录消耗的加碱量,同时取样1ml,于5000r/min条件下离心10min,上清液采用lowry法测定其中的蛋白含量。
三个点的耗碱量分别为12.9、23.3和27.2ml,根据上述数学模型预测出的上清液中蛋白含量为0.1994、0.2233和0.2323mg/ml。采用lowry法测定的真实值为0.2041、0.2229和0.2284mg/ml,误差分别为2.32%、0.17%和1.67%。预测结果与真实结果的误差在10%之内,可良好的预测超声过程中不同时间的可溶性蛋白含量,达到实时检测的目的。
实施例2
(1)蛋白悬浊液配制:按15%料液比加入蒸馏水混合均匀,即称取450g大米蛋白,加入3l蒸馏水配成悬浊液。
(2)超声辅助提取蛋白:采用单频聚能式超声波设备辅助提取大米蛋白,将28khz超声波探头全部浸入大米蛋白溶液中,设置超声参数:功率密度60w/l,间歇比6:6s,温度30℃,时间41min。利用自动滴定仪滴加0.06mnaoh保持反应液中ph不变,分别在超声开始前,以及超声后第5min开始,每3分钟记录消耗的加碱量,同时取样1ml,于5000r/min条件下离心,上清液采用lowry法测定其中的蛋白含量。
(3)将上清液中蛋白含量与加碱量建立数学模型,见图3,所建立的数学模型为y=0.0028x+0.63843(r2=0.87539),其中y为蛋白含量(mg/ml),x为加碱量(ml)。
(4)对不同超声时间可溶性蛋白含量的预测:
蛋白悬浊液配制方法及超声波参数设定同上,分别在超声开始第6、19和37min,记录消耗的加碱量,同时取样1ml,于5000r/min条件下离心,上清液采用lowry法测定其中的蛋白含量。
三个点的耗碱量分别为44.1、87.9和108.0ml,根据上述数学模型预测出的上清液中蛋白含量为0.7619、0.8846和1.1778mg/ml。采用lowry法测定的真实值为0.7808、0.8920和1.0919mg/ml,误差分别为2.42%、0.83%和7.87%。预测结果与真实结果的误差在10%之内,可良好的预测超声过程中不同时间的可溶性蛋白含量,达到实时检测的目的。
- 还没有人留言评论。精彩留言会获得点赞!