一种多肽探针及其在翻译后修饰的结合蛋白鉴定中的应用的制作方法
本发明涉及生物技术领域,尤其是涉及一种基于光交联和纳米金属颗粒自组装技术的多肽探针,其制备方法及其在翻译后修饰的结合蛋白鉴定、蛋白修饰间相互作用的鉴定、新的蛋白修饰结合蛋白的发现中的应用。
背景技术:
蛋白质翻译后修饰,是指在mrna被翻译成蛋白质后,对蛋白质上个别氨基酸残基进行共价修饰的过程。在真核动物细胞中目前已发现有400多种蛋白质翻译后修饰形式,其中最常见的有泛素化、磷酸化、糖基化、脂基化、甲基化和乙酰化等。蛋白质翻译后修饰在生命体中具有十分重要的作用。它使蛋白质的结构更为复杂,功能更为完善,调节更为精细,作用更为专一。细胞内许多蛋白质的功能,是通过动态的蛋白质翻译后修饰来调控的(蛋白质翻译后修饰研究进展,胡笳等,《科学通报》2005年6月第50卷第11期,1061-1072页)。
蛋白质的甲基化修饰是在甲基转移酶催化下,在赖氨酸或精氨酸侧链氨基上进行的甲基化。另外也有对天冬氨酸或谷氨酸侧链羧基进行甲基化形成甲酯的形式。赖氨酸残基可以发生单甲基化(kme1)、二甲基化(kme2)或三甲基化(kme3)修饰,而精氨酸残基则可以发生单甲基化修饰(rme1)、对称二甲基化修饰(rme2s)或非对称二甲基化(rme2a)修饰。组蛋白赖氨酸甲基化可以发生在h3-k4、h3-k9、h3-k27、h3-k36、h3-k79和h4-k20等上,还可发生于h1n端。h3-k9,h3-k27,h4-k20的甲基化与染色体的钝化过程有关,而h4-k9的甲基化可能与大范围的染色质水平的抑制有关。h3-k4,h3-k36,h3-k79位的甲基化与染色体转录激活过程有关,其中h3-k4的单甲基化修饰可以对抗h4-k9甲基化所导致的基因抑制。组蛋白精氨酸甲基化位点可以发生在h3-r2、h3-r4、h3-r17、h3-r26上。
乙酰化也是细胞内蛋白质翻译后修饰的一种重要形式。组蛋白等许多蛋白都可以发生乙酰化。组蛋白的乙酰化,是由组蛋白乙酰转移酶(hats)催化的,去乙酰化由组蛋白去乙酰酶(histonedeacetylases,hds或者hdacs)催化的。
泛素由76个氨基酸组成,高度保守,普遍存在于真核细胞内。共价结合泛素的蛋白质能被蛋白酶识别并降解,这是细胞内短寿命蛋白和一些异常蛋白降解的普遍途径。泛素-蛋白酶系统是存在于所有真核生物细胞的调控系统,降解过程中需要三种酶的参与:泛素激活酶(e1)、泛素结合酶(e2)和泛素蛋白质连接酶(e3)。泛素化降解蛋白的过程中对蛋白的特异性识别依赖e3。由e2s和e3s介导的泛素化过程可以被去泛素化酶(dubs)逆转。泛素化也是组蛋白修饰的一种重要形式,组蛋白的h2a和h2b是泛素化多发位点。已经找到了组蛋白h2b泛素化酶,并且发现组蛋白h2b泛素化和组蛋白甲基化存在关联。
磷酸化是通过蛋白质磷酸化激酶将atp的磷酸基转移到蛋白的特定位点上的过程。大部分细胞过程实际上是被可逆的蛋白磷酸化所调控的,至少有30%的蛋白被磷酸化修饰。磷酸化的作用位点为蛋白上的ser,thr,tyr残基。在磷酸化调节过程中,细胞的形态和功能都发生改变。可逆的磷酸化过程几乎涉及所有的生理及病理过程,如细胞信号转导、肿瘤发生、新陈代谢、神经活动、肌肉收缩以及细胞的增殖、发育和分化等。
蛋白质的糖基化是低聚糖以糖苷的形式与蛋白上特定的氨基酸残基共价结合的过程。蛋白质糖基化可以按照氨基酸和糖的连接方式分为四类:o位糖基化、n位糖基化、c位甘露糖化以及gpi(glycophosphatidlyinositol)锚定连接。
蛋白质脂基化为长脂肪链通过o或者s原子与蛋白质缀合得到蛋白缀合物的过程,通常是蛋白质分子中半胱氨酸残基的s键被棕榈酰基乙酰化。或者被法呢基烷基化。这两种脂肪链通常共同修饰同一个蛋白质分子,通过脂肪链与生物磷脂膜良好的相溶性,将蛋白质固定在细胞膜上。
在体内,各种翻译后修饰过程不是孤立存在的,在很多细胞活动中,需要各种翻译后修饰的蛋白共同作用。对于同一个蛋白可以拥有一种以上的后修饰过程,各种翻译后修饰形式相互影响、相互协调。磷酸化与糖基化在很多方面都具有相似性。组蛋白同时可以被甲基化和乙酰化共同修饰,组蛋白上乙酰化和甲基化的主要作用位点是组蛋白h3和h4末端保守的赖氨酸残基。组蛋白乙酰化修饰贯穿整个细胞周期,而甲基化修饰多发生在g2期以及异染色质组装过程。
以组蛋白翻译后修饰为例:真核生物中基因组dna以染色质形式存在,核小体是构成染色质的基本单位。核小体及高级染色质结构的形成,一方面有效储存和保护了dna序列所蕴含的遗传信息;另一方面作为基因组dna的具体存在方式,染色质结构也成为各种需要接触dna的细胞过程(如转录、复制、损伤修复等)的天然障碍,从而使染色质成为了一个重要的遗传信息表达调控平台。染色质凝聚、松弛结构的形成,以及开放、闭合等状态的转换提供了一种超越dna序列本身的调控机制,即表观遗传调控。
表观遗传调控机制涉及到组蛋白修饰、组蛋白变体、dna甲基化、非编码rna及染色质重塑等几个方面。其中组蛋白翻译后修饰(尤其在n端尾部)有很多类型,包括精氨酸甲基化(me、me2)、赖氨酸甲基化(me、me2、me3)、乙酰化(ac)、丙酰化(pr)、丁酰化(bt)、巴豆酰化(cr)、甲酰化(fo)、泛素化(ub)、sumo化、赖氨酸β-羟基丁酰化(3ohib)、2-羟基异丁酰化(hib)、琥珀酰化(succ)、丙二酰化、戊二酰化,以及磷酸化(ph),adp核糖化和生物素化(bio)等。上述种种修饰可以发生在组蛋白不同变体和组蛋白不同位点上,并可以成组或成簇地分布于染色质不同区段,被认为构成一类超越基因序列的“组蛋白密码”,控制着细胞内遗传信息的组织层次,在基因表达以及细胞分化与发育调控中发挥着重要的作用,与肿瘤等重大疾病的发生发展密切联系。
为了完成精密的表观遗传调控,围绕“组蛋白密码”,细胞进化出一系列修饰酶系统来完成特定组蛋白修饰的建立和消除。产生特定组蛋白修饰的酶称作“书写器”(writer),如组蛋白乙酰化酶(hat),甲基化酶(hkmt)等;把功能相反并特异性去除特定组蛋白修饰的酶称作“擦除器”(eraser)或“去修饰酶”,如各种组蛋白去乙酰化酶(hdac),去甲基化酶(hkdm)等;同样地,细胞内还存在一大类被称作“阅读器”(reader)的蛋白或结构域,可以特异地识别各种不同类型的组蛋白修饰,把特定组蛋白修饰与特定生物学功能后果偶联起来。以上组蛋白修饰调控因子的协同作用控制着诸如转录激活、转录沉默、dna复制和修复、有丝分裂等重要细胞生理学过程,是表观遗传调控的重要生化和物质基础。
组蛋白修饰间的“修饰对话”(modificationcrosstalk)对于了解组蛋白修饰介导的表观遗传调控也有着重要的意义。组蛋白“阅读器”元件可以同“擦除器”或“书写器”的催化结构域共存,这奠定了“修饰对话”的生化基础。例如,组蛋白赖氨酸去甲基化酶phf8和kiaa1718均含有一个phd锌指和jmic结构域。这两个蛋白的phd锌指均识别h3k4me3这一修饰且该修饰可以增强去甲基化酶的活性。
近年来,随着高分辨质谱以及特异性翻译后修饰抗体技术的发展,许多新型组蛋白修饰被相继发现。组蛋白阅读器蛋白通过识别组蛋白特定修饰调控基因表达,其功能紊乱与肿瘤等疾病发生密切相关。而组蛋白去修饰酶蛋白矫正和调节组蛋白特定修饰,其功能紊乱也同样被发现与一些疾病发生发展有着密切关联。因此,鉴定和发现新的组蛋白修饰阅读器蛋白和去修饰酶蛋白,对于理解疾病发生机理以及寻找药物靶标有着十分重要的意义。但是,相较于研究较为成熟的组蛋白翻译后修饰,其阅读器蛋白和去修饰酶蛋白的发现还相对滞后,这主要由于缺少可靠且高特异性与灵敏度的方法。其瓶颈在于翻译后修饰介导的蛋白作用力非常弱,且常常发生在瞬时,因此难以鉴定。
基于多肽探针与特定蛋白的亲和作用是发现结合蛋白的有效方法,传统的方法是选取目标蛋白的一段特定氨基酸序列(或者具有特定修饰的多肽),在多肽侧链或c端引入生物素标签,利用多肽识别结合蛋白之后,通过亲和素修饰的微球富集得到结合蛋白,最后通过质谱等技术手段对结合蛋白进行定性及定量分析。然而,多肽探针同目标蛋白主要通过静电作用和结构互补等弱相互作用力结合,容易发生脱离,而且这种结合是瞬间且动态变化的。因此,采用这种方法来鉴定和筛选组蛋白修饰阅读器蛋白或去修饰酶蛋白的效果不甚理想,这也成为该领域研究技术上的主要瓶颈。
目前,光化学交联剂(如叠氮苯、苯甲酮以及双吖丙啶等)的引入,将探针与蛋白之间的结合作用转化为共价结合。通过对多肽肽链骨架进行修饰和改造,引入光交联基团和亲和富集标签(如生物素),可实现多肽结合蛋白的标记与富集,有效改善了目标蛋白的富集效率。但是,这种多肽探针的合成步骤繁琐,并且将光交联基团引入到肽链骨架中间,会改变肽链的结构,进而影响组蛋白修饰与其阅读器蛋白或去修饰酶蛋白之间的识别与结合,导致光交联技术在蛋白结合作用研究中的应用受到限制。
技术实现要素:
本发明旨在针对目前多肽探针应用中存在的对蛋白翻译后修饰(包括组蛋白翻译后修饰和非组蛋白翻译后修饰)结合蛋白(包括阅读器蛋白及其复合物和去修饰酶蛋白及其复合物)难以识别和鉴定的问题,结合纳米金属颗粒自组装技术和亲和光交联技术,发展出新的多肽探针,建立该探针的制备方法,以及利用该探针进行高效、高灵敏、高选择性的蛋白翻译后修饰的结合蛋白的鉴定和分析方法。
本发明的第一个方面是提供一种多肽探针。
一种多肽探针,其特征在于,包括纳米金属颗粒、修饰在纳米金属颗粒表面的多肽、修饰在纳米金属颗粒表面的光交联基团。
根据本发明,所述纳米金属颗粒可以选自纳米金颗粒,纳米银颗粒,纳米铜颗粒,纳米铁颗粒,纳米镍颗粒和/或纳米铝颗粒。优选纳米金颗粒或/和纳米银颗粒。在本发明的一个具体实施方式中,为纳米金颗粒。
所述纳米金属颗粒的粒径为1-50nm。纳米金属颗粒的粒径越大,表面积越大,可修饰的多肽和光交联基团的数量就可以越多。综合多肽负载量、颗粒沉降以及后处理操作考虑,优选粒径为1-20nm,更优选为1-10nm,例如为4nm,5nm,7nm,8nm,10nm等。
根据本发明,所述多肽的氨基酸残基未发生蛋白翻译后修饰(即,未被修饰的多肽),或者,所述多肽的一个或多个氨基酸残基上具有蛋白翻译后修饰(即,被修饰了的多肽),所述多肽的c端为半胱酸残基。
所述多肽的序列可以是天然存在的多肽序列,也可以是人工拟合的多肽序列。所述多肽可以通过人工多肽合成技术制备合成,也可以通过基因工程技术由细菌或细胞表达生成。
优选所述多肽含有5-100个氨基酸残基。综合目前已研究发现的蛋白翻译后修饰结合蛋白的结构域,以及多肽合成技术的能力,优选所述多肽含有7-50个氨基酸残基,更优选含有10-30个氨基酸残基。
所述多肽的任一氨基酸残基上都可进行蛋白翻译后修饰,包括但不限于赖氨酸、精氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、酪氨酸等。
所述蛋白翻译后修饰是指在mrna被翻译成蛋白质后,对蛋白质上个别氨基酸残基进行的共价修饰,包括但不限于甲基化、甲酰化、乙酰化、泛素化、丙酰化、丁酰化、琥珀酰化、巴豆酰化、丙二酰化、2-羟基丁酰化、3-羟基丁酰化、戊二酰化、磷酸化、糖基化、脂基化、sumo化和生物素化等。
在一种实施方式中,所述多肽含有一个或多个赖氨酸残基,所述赖氨酸残基中的一个或多个上具有蛋白翻译后修饰。
所述赖氨酸残基上的蛋白翻译后修饰彼此独立地选自单甲基化(me1)、二甲基化(me2)、三甲基化(me3),乙酰化(ac)、丙酰化(pr)、丁酰化(bt)、巴豆酰化(cr)、甲酰化(fo)、泛素化(ub)、sumo化、β-羟基丁酰化(3ohib)、2-羟基异丁酰化(hib)、琥珀酰化(succ)、丙二酰化、戊二酰化等各种天然的和/或化学的赖氨酸修饰。
优选,所述多肽是组蛋白的氨基酸序列片段,包含可发生蛋白翻译后修饰的赖氨酸残基,以及该赖氨酸残基n端之前的2-50个氨基酸残基和该赖氨酸残基c端之后的2-50个氨基酸残基;优选,包含可发生蛋白翻译后修饰的赖氨酸残基,以及该赖氨酸残基n端之前的3-25个氨基酸残基和该赖氨酸残基c端之后的3-25个氨基酸残基;更优选,包含可发生蛋白翻译后修饰的赖氨酸残基,以及该赖氨酸残基n端之前的4-15个氨基酸残基和该赖氨酸残基c端之后的4-15个氨基酸残基。
优选,所述组蛋白上可发生蛋白翻译后修饰的赖氨酸残基选自:h3-k4、h3-k9、h3-k14、h3-k18、h3-k23、h3-k27、h3-k36、h3-k56、h3-k79、h4-k5、h4-k8、h4-k12、h4-k16、h4-k20、h4-k31、h4-k44、h4-k59、h4-k77、h4-k79、h4-k91、h2a-k5、h2a-k9、h2a-k13、h2a-k15、h2a-k63、h2a-k119、h2b-k5、h2b-k16、h2b-k17、h2b-k5、h2b-k34、h2b-k120、h1k26和/或h1n端的赖氨酸残基。
在本发明的一个具体实施方案中,所述多肽选自:artkqtarksc,artkqtarkstggkac,artk(me3)qtarksc(第四位赖氨酸上有三甲基化),artkqtark(cr)stggkac(第九位赖氨酸上有巴豆酰化),art(ph)k(me3)qtarksc(第三位苏氨酸上有磷酸化,第四位赖氨酸上有三甲基化)。
在另一种实施方式中,所述多肽含有一个或多个精氨酸残基,所述精氨酸残基中的一个或多个上具有蛋白翻译后修饰。
所述精氨酸残基上进行的蛋白翻译后修饰彼此独立地选自单甲基化修饰(me1)、对称二甲基化修饰(me2s)和非对称二甲基化(me2a)修饰。
携带发生了蛋白翻译后修饰的多肽的多肽探针,可以用于识别蛋白翻译后修饰的结合蛋白,而携带未发生修饰的多肽的多肽探针,可以作为识别和鉴定过程中的对照探针。
所述多肽可以通过c端的半胱酸残基的巯基-金自组装反应,修饰到纳米金属颗粒表面。
根据本发明,所述光交联基团为本领域已知的,可以在光作用下发生交联反应的基团,包括但不限于:叠氮苯、二苯甲酮以及双吖丙啶。
优选,所述光交联基团通过连接分子修饰到纳米金属颗粒表面。
所述连接分子可以是聚乙二醇、聚乙烯、聚丙烯等链状聚合物分子或者其他化学官能团支架分子,如烷烃支链。优选为聚乙二醇,分子量为200~1000,例如:聚乙二醇200、聚乙二醇400、聚乙二醇600等。连接分子的长度可以调节(如通过采用不同聚合度的聚乙二醇、聚乙烯、聚丙烯等来改变连接分子长度),从而可优化连接分子末端的光交联基团与结合蛋白的距离和位置,有利于提高对目标蛋白的光交联效率。
所述连接分子的一端与光交联基团共价连接,连接分子的另一端用巯基修饰,形成巯基-连接分子-光交联基团的共价化合物,通过巯基-金自组装反应,连接分子连接到纳米金属颗粒表面,从而将光交联基团修饰到纳米金属颗粒表面。可采用本领域已知的化学合成方法制备所述巯基-连接分子-光交联基团的共价化合物。
在本发明的一些实施方式中,所述巯基-连接分子-光交联基团的共价化合物为巯基-聚乙二醇-光交联基团,例如为:巯基-聚乙二醇-叠氮苯、巯基-聚乙二醇-二苯甲酮、巯基-聚乙二醇-双吖丙啶。
在多肽探针与待研究的蛋白混合液体系孵育时,连接分子尤其是以peg为成分的连接分子,可以有效减少非特异结合蛋白的吸附,从而提高目标蛋白鉴定的准确性。
纳米金属颗粒、纳米金属颗粒表面修饰的多肽和光交联基团的摩尔数比为1:(20-2000):(10-1000),优选为1:(50~1000):(20~500)。例如对于5nm粒径的纳米金属颗粒,所述三者的摩尔数比可以是1:(50~500):(20~300),或者1:(100~300):(50~150)等。
本发明的第二个方面是提供所述多肽探针的制备方法。
本发明多肽探针的制备方法,其特征在于,将纳米金属颗粒、多肽和光交联基团在溶液中反应,使多肽和光交联基团修饰到纳米金属颗粒表面。
优选所述溶液是0.1-5%柠檬酸盐水溶液,更优选为0.5-1.5%柠檬酸盐水溶液。所述柠檬酸盐可以是柠檬酸的钠盐、柠檬酸的钾盐、柠檬酸的铵盐,包括但不限于柠檬酸一钠、柠檬酸二钠、柠檬酸三钠、柠檬酸一钾、柠檬酸二钾、柠檬酸三钾、柠檬酸一铵、柠檬酸二铵、柠檬酸三铵。在本发明的一个具体实施方式中,所述溶液是1%的柠檬酸三钠水溶液。
根据本发明,所述反应在10-40℃,优选20-30℃,例如25℃下进行。
根据本发明,所述反应进行2-24小时,优先8-16小时,例如12小时。
根据本发明,加入溶液中的所述纳米金属颗粒:多肽:光交联基团的摩尔比为1:(50-5000):(25-2500),可以根据纳米金属颗粒的粒径进行选择,优选为1:(100-1000):(50-500)。在本发明的一个实施方式中,对于5nm的纳米金属颗粒而言,纳米金属颗粒:多肽:光交联基团的摩尔比为1:(400-600):(200-300),例如为1:500:250。
根据本发明,所述光交联基团共价结合在连接分子的一端,所述连接分子的另一端用巯基修饰,形成巯基-连接分子-光交联基团的共价化合物。所述连接分子可以是聚乙二醇、聚乙烯、聚丙烯等链状聚合物分子或者其它化学官能团支架分子,如烷烃支链。优选为聚乙二醇,分子量为200~1000,例如:聚乙二醇200、聚乙二醇400、聚乙二醇600等。连接分子的长度可以调节(如通过采用不同聚合度的聚乙二醇、聚乙烯、聚丙烯等来改变连接分子长度),从而可优化连接分子末端的光交联基团与结合蛋白的距离和位置,有利于提高对目标蛋白的光交联效率。可采用本领域常规和已知的化学合成方法,制备合成巯基-连接分子-光交联基团的共价化合物,例如本发明具体实施方式中的巯基聚乙二醇偶联二苯甲酮。
根据本发明,所述制备方法还包括多肽探针的后处理步骤,所述步骤包括洗涤多肽探针,用液体悬浮保存。所述液体可以是水或本领域常用的缓冲液,包括但不限于磷酸盐缓冲液、碳酸盐缓冲液、tris缓冲液、hepes缓冲液、pbs缓冲液等。
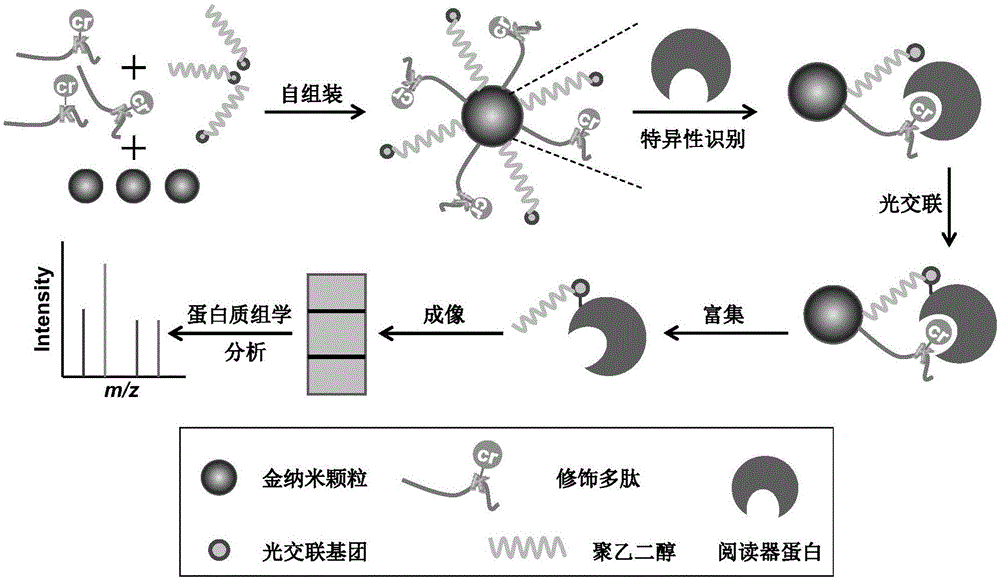
图1是本发明多肽探针制备及利用本发明多肽探针富集捕获蛋白翻译后修饰结合蛋白的流程示意图。结合图1,对本发明进行描述说明。以具有蛋白翻译后修饰的多肽为识别模板,以巯基修饰的连接分子偶联光交联基团(巯基-连接分子-光交联基团的共价化合物),以纳米金属颗粒作为载体,通过多肽、光交联基团和纳米金属颗粒的自组装,实现蛋白翻译后修饰的多肽与光交联基团功能化纳米金属多肽探针的制备。将该多肽探针与可能存在结合蛋白或其复合物的复杂蛋白体系进行孵育,多肽探针上的多肽和与其具有相互作用的结合蛋白或其复合物发生结合,此时,多肽探针上的光交联基团得以靠近目标蛋白,在光引发下,光交联基团发生反应而将多肽探针与目标蛋白共价连接。后续可以使用洗脱液对多肽探针上非特异性吸附的蛋白进行洗脱,减少非特异结合的蛋白对目标蛋白富集和纯化的干扰。通过离心操作或者磁吸附等手段,可以将交联了目标蛋白的多肽探针聚集下来,从而实现从复杂的蛋白体系中发现、富集以及分离出结合蛋白或其复合物的目的。最后,可以采用本领域常用的置换手段,例如利用含巯基的物质,将交联在多肽探针上的结合蛋白或其复合物置换下来,通过纯化等手段获得纯化的结合蛋白或其复合物。根据实验和研究的目的,后续可以对结合蛋白或其复合物进行定量或定性分析。
当采用未进行蛋白翻译后修饰的多肽为识别模板制备多肽探针时,所述多肽探针可以作为对照探针,用于对比研究结合蛋白与蛋白翻译后修饰的相互作用。如下文中实施例2中描述的那样。
由于一个多肽序列上可以发生至少一种蛋白翻译后修饰,所述修饰彼此之间会对不同结合蛋白与相应修饰的识别和结合能力产生影响,包括增强所述识别和结合的能力,减弱所述识别和结合的能力。因此,分别将具有一种蛋白翻译后修饰的多肽,具有至少两种蛋白翻译后修饰的多肽,制备成相应的多肽探针,可以进行不同蛋白翻译后修饰之间相互作用的对比研究和分析,如下文中实施例4中描述的那样。
因此,本发明的第三个方面是提供,识别或鉴定蛋白翻译后修饰结合蛋白或其复合物的方法,其特征在于,采用本发明的多肽探针,在0~8℃下,在适于多肽探针和结合蛋白或其复合物结合的溶液中,将多肽探针与结合蛋白或其复合物,或者可能含有所述结合蛋白或其复合物的蛋白质混合物接触,并孵育1~24小时,然后进行光照交联,并去除未交联的蛋白质。
根据本发明,所述适于多肽探针和结合蛋白或其复合物结合的溶液含有:25-100mmtris-hcl,100-400mm氯化钠,1-5mm氯化镁以及1-5mm氯化钾;优选含有:40-60mmtris-hcl,ph7-8,150-250mm氯化钠,2-3mm氯化镁以及2-3mm氯化钾。在本发明的一个具体实施方式中,所述溶液含有:50mmtris-hcl,ph7.8,200mm氯化钠,2.5mm氯化镁以及2.5mm氯化钾。
根据本发明,所述多肽探针在溶液中的用量根据蛋白质的量进行相应调整。一般而言,多肽探针在溶液中的总用量以纳米金属颗粒的摩尔数计,与接触的蛋白总量比例关系为:0.02pmol~1pmol/μg蛋白,可以为0.025pmol~0.5pmol/μg蛋白。例如,在本发明的一个实施方式中,对于10μg的结合蛋白,多肽探针在溶液中的用量为4pmol;对于600μg的蛋白质混合物,多肽探针在溶液中的用量为16pmol。
根据本发明,所述光照交联,根据所采用的光交联基团的化学结构选择所用的光波长,以使相应的光交联基团可发生光交联反应。为避免光热对蛋白质结构的影响,光照交联反应优选在0~8℃环境下进行,例如在冰水浴中或冰上进行。
根据本发明,可采用本领域已知的各种方法去除未交联的蛋白质,包括但不限于用适宜的溶液洗涤,所述适宜的溶液包括但不限于本领域各种常用的缓冲液。在本发明的一个实施方式中,所述缓冲液含有25-100mmtris-hcl,100-400mm氯化钠,1-5mm氯化镁以及1-5mm氯化钾;优选含有:40-60mmtris-hcl,ph7-8,150-250mm氯化钠,2-3mm氯化镁以及2-3mm氯化钾。在本发明的一个具体实施方式中,所述缓冲液含有:50mmtris-hcl,ph7.8,200mm氯化钠,2.5mm氯化镁以及2.5mm氯化钾。在本发明的另一个实施方式中,所述缓冲液为含有1-10m尿素的pbs缓冲液,优选为含有3-5m尿素的pbs缓冲液,在本发明的一个具体实施方式中,为含有4m尿素的50mmpbs缓冲液。
根据本发明,所述方法还进一步包括通过离心或磁选分离获得多肽探针,并将多肽探针上结合的蛋白从纳米金属颗粒上置换下来的步骤。
所述置换采用带有巯基的化合物,包括但不限于巯基乙醇。
根据本发明,所述方法还进一步包括对置换下来的结合蛋白或其复合物进行纯化的步骤。
根据本发明,所述结合蛋白或其复合物是蛋白翻译后修饰的阅读器蛋白或其复合物,或蛋白翻译后修饰的去修饰酶蛋白或其复合物。
根据本发明,可采用本领域的各种蛋白分析方法对获得的结合蛋白或其复合物进行后续的数量、结构或生物学功能研究分析,包括但不限于sds-page、液相色谱-质谱联用分析、western-blot、生物抗体检测、生物功能活性分析等。
在本发明的一个实施方式中,所述多肽探针中多肽为artk(me3)qtarksc;所述结合蛋白或其复合物是带有结构域wd40、pwwp、phd、tudor和/或choromo的蛋白,包括但不限于:wdr5、eed、ppwd1、wdr61、chaf1b、wdr46、brpf1、hdgf、pwwp2a、brd1、psip1、zmynd11、bptf、ing1、cxxc1、ing2、dido1、ing4、ing5、kdm2b、kdm5a、kdm5b、kdm5c、kmt2a、phf2、phf8、phf13、taf3、atrx、trim24、jade3、rsf1、sgf29、kdm4c、spin1、snd1、smndc1、tdrd3、chd1、cbx8、cdyl、chd9、suv39h1、orc1、kdm18、l3mbtl2、fam60a、pbrm1。
在本发明的一个实施方式中,所述多肽探针中多肽为artkqtark(cr)stggkac;所述结合蛋白或其复合物是带有结构域dpf和/或yeats的蛋白,包括但不限于:dpf2、kat6a、dpf1、kat6b、kmt2a、mtf2、nsd2、af9、enl、yeats4、yeats2、atad2、kat2a、kat7、smarca4。
本发明的第四个方面是提供,确定蛋白翻译后修饰与结合蛋白或其复合物之间相互作用的方法,其特征在于,在至少两个独立的反应体系的每一个中,采用本发明的一种多肽探针,在0~8℃下,在适于多肽探针和结合蛋白或其复合物结合的溶液中,将多肽探针与结合蛋白或其复合物,或者可能含有所述结合蛋白或其复合物的蛋白质混合物接触,并孵育1~24小时,然后进行光照交联,去除未交联的蛋白质。
所述蛋白翻译后修饰与结合蛋白或其复合物之间相互作用选自:单一修饰与单一结合蛋白或其复合物之间的相互作用;单一修饰与多个结合蛋白或其复合物之间的相互作用;多个修饰与单一结合蛋白或其复合物之间的相互作用;多种修饰与多种结合蛋白或其复合物之间的相互作用。
所述结合蛋白或其复合物是蛋白翻译后修饰的阅读器蛋白或其复合物,或蛋白翻译后修饰的去修饰酶蛋白或其复合物。
根据本发明,在确定单一修饰与单一结合蛋白或其复合物之间的相互作用时,独立反应体系中的一个体系采用的多肽探针携带的是未发生蛋白翻译后修饰的多肽,另一个体系采用的多肽探针携带的是相同多肽序列且其一个或多个氨基酸上具有蛋白翻译后修饰的多肽。在本发明的一个实施方式中,在确定h3k4me3修饰和其结合蛋白或其复合物之间的相互作用时,独立反应体系中的一个体系采用的多肽探针携带的是多肽artkqtarksc,另一个体系采用的多肽探针的多肽是artk(me3)qtarksc;在确定h3k9cr修饰和其结合蛋白或其复合物之间的相互作用时,独立反应体系中的一个体系采用的多肽探针携带的是多肽artkqtarkstggkac,另一个体系采用的多肽探针的多肽是artkqtark(cr)stggkac;
根据本发明,在确定单一修饰与多个结合蛋白或其复合物之间的相互作用时,独立反应体系的数量可以等于结合蛋白或其复合物的数量,每个反应体系中采用的多肽探针都相同,均携带的是具有蛋白翻译后修饰的多肽。为对照需要,可以再增加用作对照的独立反应体系,该体系中所采用的多肽探针携带的是未发生蛋白翻译后修饰的相应多肽。
根据本发明,在确定多个修饰与单一结合蛋白或其复合物之间的相互作用时,独立反应体系的数量等于或大于修饰的数量,每个体系中的多肽探针上的多肽携带至少一种蛋白翻译后修饰。例如,在本发明的一个实施方式中,确定发生在h3上的甲基化和磷酸化对h3k4me3修饰的结合蛋白或其复合物的相互作用时,独立反应体系中的一个体系采用的多肽探针携带的多肽是artk(me3)qtarksc,另一个体系采用的多肽探针携带的多肽是art(ph)k(me3)qtarksc。
按照类似的原则,在确定多个修饰与多个结合蛋白或其复合物之间的相互作用时,独立反应体系的数量根据修饰的数量和结合蛋白或其复合物的数量进行调整,每个体系中的多肽探针上的多肽携带至少一种蛋白翻译后修饰。
根据本发明,所述适于多肽探针和结合蛋白结合的溶液含有:25-100mmtris-hcl,100-400mm氯化钠,1-5mm氯化镁以及1-5mm氯化钾;优选含有:40-60mmtris-hcl,ph7-8,150-250mm氯化钠,2-3mm氯化镁以及2-3mm氯化钾。在本发明的一个具体实施方式中,所述溶液含有:50mmtris-hcl,ph7.8,200mm氯化钠,2.5mm氯化镁以及2.5mm氯化钾。
根据本发明,所述多肽探针在溶液中的用量根据蛋白质的量进行相应调整。一般而言,多肽探针在溶液中的总用量以纳米金属颗粒的摩尔数计,与接触的蛋白总量比例关系为:0.02pmol~1pmol/μg蛋白,可以为0.025pmol~0.5pmol/μg蛋白。例如,在本发明的一个实施方式中,对于10μg的结合蛋白,多肽探针在溶液中的用量为4pmol;对于600μg的蛋白质混合物,多肽探针在溶液中的用量为16pmol。
根据本发明,所述光照交联,根据所采用的光交联基团的化学结构选择所用的光波长,以使相应的光交联基团可发生光交联反应。为避免光热对蛋白质结构的影响,光照交联反应优选在0~8℃环境下进行,例如在冰水浴中或冰上进行。
根据本发明,可采用本领域已知的各种方法去除未交联的蛋白质,包括但不限于用适宜的溶液洗涤,所述适宜的溶液包括但不限于:本领域各种常用的缓冲液。在本发明的一个实施方式中,所述缓冲液含有25-100mmtris-hcl,100-400mm氯化钠,1-5mm氯化镁以及1-5mm氯化钾;优选含有:40-60mmtris-hcl,ph7-8,150-250mm氯化钠,2-3mm氯化镁以及2-3mm氯化钾。在本发明的一个具体实施方式中,所述缓冲液含有:50mmtris-hcl,ph7.8,200mm氯化钠,2.5mm氯化镁以及2.5mm氯化钾。在本发明的另一个实施方式中,所述缓冲液为含有1-10m尿素的pbs缓冲液,优选为含有3-5m尿素的pbs缓冲液,在本发明的一个具体实施方式中,为含有4m尿素的50mmpbs缓冲液。
根据本发明,所述方法还进一步包括通过离心或磁选分离获得多肽探针,并将多肽探针上结合的蛋白从纳米金属颗粒上置换下来的步骤。
所述置换采用带有巯基的化合物,包括但不限于巯基乙醇。
根据本发明,将每个独立分析体系获得的结合蛋白进行对比研究,例如对比每个独立分析体系获得的结合蛋白的量,可以了解增加或减少的修饰对结合蛋白相互作用的影响。
本发明的第五个方面是提供,所述多肽探针在识别或鉴定蛋白翻译后修饰结合蛋白或其复合物,或者确定蛋白翻译后修饰结合蛋白或其复合物与蛋白翻译后修饰间相互作用中的应用。
所述结合蛋白或其复合物是蛋白翻译后修饰的阅读器蛋白或其复合物。
所述结合蛋白或其复合物是蛋白翻译后修饰的去修饰酶蛋白或其复合物。
所述应用是非诊断或治疗目的的。
所述应用是在体外进行的。
本发明的第六个方面是提供,一种用于识别或鉴定蛋白翻译后修饰结合蛋白或其复合物,或者确定蛋白翻译后修饰结合蛋白或其复合物与蛋白翻译后修饰间相互作用的检测试剂,其特征在于,含有本发明所述的至少一种多肽探针,所述每种多肽探针存在于独立的液体体系中。
一种用于识别或鉴定蛋白翻译后修饰结合蛋白或其复合物,或者确定蛋白翻译后修饰结合蛋白或其复合物与蛋白翻译后修饰间相互作用的检测试剂盒,其特征在于,含有本发明所述的至少一种多肽探针,所述每种多肽探针存在于独立的液体体系中。
根据本发明,所述液体可以是水或本领域常用的缓冲液,包括但不限于磷酸盐缓冲液、碳酸盐缓冲液、tris缓冲液、hepes缓冲液、pbs缓冲液等。
根据本发明,所述多肽探针以纳米金属颗粒摩尔数计,在所述液体中的浓度为10nm~500nm,优选为50nm~150nm,更优选为70~100nm。
根据本发明,所述检测试剂盒中进一步包含用于识别、鉴定反应的溶液,所述溶液含有25-100mmtris-hcl,100-400mm氯化钠,1-5mm氯化镁以及1-5mm氯化钾;优选含有:40-60mmtris-hcl,ph7-8,150-250mm氯化钠,2-3mm氯化镁以及2-3mm氯化钾。在本发明的一个具体实施方式中,所述溶液含有:50mmtris-hcl,ph7.8,200mm氯化钠,2.5mm氯化镁以及2.5mm氯化钾。
根据本发明,所述检测试剂盒中进一步包含用于洗脱未交联蛋白的缓冲液。在本发明的一种实施方式中,所述缓冲液和用于识别、鉴定反应的溶液相同,例如含有25-100mmtris-hcl,100-400mm氯化钠,1-5mm氯化镁以及1-5mm氯化钾;优选含有:40-60mmtris-hcl,ph7-8,150-250mm氯化钠,2-3mm氯化镁以及2-3mm氯化钾。在本发明的一个具体实施方式中,所述缓冲液含有:50mmtris-hcl,ph7.8,200mm氯化钠,2.5mm氯化镁以及2.5mm氯化钾。在本发明的另一种实施方式中,所述缓冲液为含有1-10m尿素的pbs缓冲液,优选为含有3-5m尿素的pbs缓冲液,在本发明的一个具体实施方式中,为含有4m尿素的50mmpbs缓冲液。
在本发明中,采用本领域对蛋白翻译后修饰的通用描述方法进行定义和描述。将相应的修饰以英文小写缩写放在所修饰的氨基酸残基代号后,例如“h3k4me3”代表h3蛋白的第四位赖氨酸残基上有三甲基化,“artk(me3)qtarksc”的多肽序列中“(me3)”代表其所紧邻的前面“k”上的三甲基化修饰。另外,“修饰h3k4me3”和“h3k4me3修饰”含义相同,均表示h3蛋白的第四位赖氨酸残基上的三甲基化修饰;其他的修饰表示方式的解释方式相同。
本发明的有益效果:
本发明中所述的基于光交联技术和纳米金属自组装技术的多肽探针,由于采用了纳米金属颗粒为载体,使用光交联技术,从而将亲和识别与富集捕获过程一体化,使得对结合蛋白的识别和鉴定操作便捷高效。
本发明的多肽探针中引入光交联基团,使得多肽和结合蛋白之间的弱作用力转化为光交联基团形成的强共价键作用,因而可以承受较强烈的洗脱条件,同时使得多肽探针可以捕获较低丰度以及瞬态相互作用的蛋白。
与传统的方法相比,本发明将光交联基团连接到连接分子(例如peg)上再修饰到纳米金属颗粒上,巧妙地避免了光交联基团修饰对多肽骨架的影响,较好的保持了多肽骨架的原始结构和识别特性,大大降低了对相应结合蛋白结合特异性的影响。此外,由于连接分子的长度可以调节,进而可以优化光交联基团与目标结合蛋白的位置和距离,增加目标蛋白的交联效率。并且,以纳米颗粒为载体,实现了光交联剂和多肽在纳米金属上密集的排布方式,增加了探针与结合蛋白的作用和交联几率,提高了探针对目标蛋白的高效与高选择性富集。
此外,光交联基团修饰在纳米金属颗粒上而不是多肽上,在多肽识别并结合了目标蛋白后,光交联基团在目标蛋白上形成的共价连接点就会位于目标蛋白的非识别位点处,通常是在蛋白的表面,这样一方面使后续置换处理光交联位点的反应非常容易进行,另一方面使置换下来的目标蛋白的识别位点不发生任何化学反应和改变,从而有利于后续对目标蛋白的结构和功能研究。
在本发明优选的方案中,采用的巯基-连接分子-光交联基团共价化合物,尤其是巯基聚乙二醇偶联光交联基团,其化学结构简单、合成容易,相比本领域中其他带有硫原子结构的巯基化功能团合成容易,且与纳米金属颗粒的自组装反应条件简单温和,反应效率高。
附图说明
图1为基于自组装的多价光亲和多肽探针富集捕获组蛋白修饰结合蛋白流程图。
图2探针②的maldi质谱图。
图3探针②的透射电子显微镜表征图。
图4探针②的紫外可见光谱表征图。
图5探针②液相色谱图及其分析,其中(a)探针②液相色谱图,其中峰(1)是多肽②(以“h3k4me3”表示),峰(2)是peg600峰;(b)peg600浓度与其色谱峰面积的标准曲线;(c)多肽②浓度与其色谱峰面积的标准曲线。
图6bptf结构域蛋白的质谱表征结果。其中,(a)表达蛋白的sds-page图;(b)质谱鉴定的bptf结构域蛋白的序列覆盖率。
图7探针对目标蛋白的高效富集。其中(a)不同探针对目标蛋白富集后的sds-page图;和(b)不同探针富集效率的统计计算结果。图中,“h3k4me3”代表探针②,“h3k4”代表探针①。
图8探针在bsa和细胞裂解液为背景条件下,对目标蛋白的选择性富集。其中,(a)探针在牛血清白蛋白(bsa)背景下,(b)探针在细胞裂解液为背景下,对目标蛋白的选择性富集。图中,“h3k4me3”代表探针②。
图9探针对蛋白多修饰与结合蛋白相互作用的识别,以磷酸化对甲基化识别蛋白的影响为例。其中(a)磷酸化对甲基化识别蛋白影响的模式图;(b)两种探针②和⑤(图中分别用“h3k4me3”和“h3t3phk4me3”表示)对目标蛋白的富集比较。
图10探针对细胞核蛋白中组蛋白修饰h3k4me3结合蛋白-snd1的westernblot分析。
图11探针对细胞核蛋白中组蛋白修饰h3k9cr结合蛋白的富集与表征。其中,(a)探针富集的含有不同结构域的结合蛋白;(b)对鉴定的h3k9cr结合蛋白-kat6b的westernblot分析;和(c)结合蛋白kat6b与多肽④的结构对接分析。
具体实施方式
以下结合实施例对本发明做进一步描述。
以下实施例所用化学试剂都是常规试剂,均可商购获得。
实施例1多肽探针的制备
五条多肽,其编号和序列分别为:①:artkqtarksc,②:artk(me3)qtarksc,③:artkqtarkstggkac,④:artkqtark(cr)stggkac,⑤:art(ph)k(me3)qtarksc。所述各多肽由北京亚光生物科技有限公司合成。为表述方便,以下实施例中所用多肽探针的编号和其上携带的多肽编号一致,并沿用前述编号对应关系。
巯基聚乙二醇偶联二苯甲酮,分子式为hs-(ch2ch2o)13-c6h4coc6h5,由上海拓旸生物科技有限公司合成。
纳米金颗粒(粒径5nm)购买于bbi公司。
多肽探针的制备:将2μl(1mm)多肽与1μl(1mm)巯基聚乙二醇偶联二苯甲酮混合后加入到50μl(80nm)纳米金颗粒溶液中(1%柠檬酸三钠水溶液),室温下振荡混匀12小时;然后,将功能化修饰后的纳米金颗粒使用50μl去离子水洗涤两次,并置于4℃保存备用。采用相同制备方法,制备获得分别携带多肽序列①、②、③、④或⑤,以及巯基聚乙二醇偶联二苯甲酮的纳米金颗粒多肽探针,和仅携带了巯基聚乙二醇偶联二苯甲酮的纳米金颗粒探针。
对于探针的表征:使用maldi-tof质谱,透射电子显微镜以及紫外-可见光谱进行表征;并利用高效液相色谱对探针上修饰的多肽与光交联基团的数量进行计算。以携带序列②的多肽探针②为例,其表征结果见图2-5。
实施例2多肽探针对目标蛋白的识别以及高效富集
以bptf(具有phd结构域,已知该结构域能够结合修饰h3k4me3)作为目标蛋白,进行实施例1多肽探针使用效果的验证。bptf结构域蛋白参照文献(angewchemintedengl.2016jul4,55(28):7993-7)自行表达,鉴定结构见附图6。
实验组:将目标蛋白(10μg)与多肽探针②(4pmol)在结合缓冲溶液(50mmtris-hcl,ph7.8,200mm氯化钠,2.5mm氯化镁以及2.5mm氯化钾)中4℃孵育过夜。然后将样品管转移至冰上,在365nm紫外灯下光照15min,引发光交联反应。接下来使用结合缓冲溶液洗涤未交联的蛋白质。通过离心将捕获到的目标蛋白分离,并加入含有12%巯基乙醇的上样缓冲液(250mmtris-hclph6.8,10%sds,0.5%溴酚蓝,7.5%二硫苏糖醇)将目标蛋白从纳米金颗粒上竞争下来;最后将目标蛋白95℃加热30min后上样,sds-page表征。
同时进3个平行对照试验。对照试验1:除不进行紫外灯光照操作外,其余试验方法和操作与实验组相同。对照试验2:除多肽探针使用多肽探针①外,其余试验方法和操作与实验组相同。对照试验3:除多肽探针使用仅修饰了巯基聚乙二醇偶联二苯甲酮的纳米金颗粒探针外,其余试验方法和操作与实验组相同。
进行sds-page表征时,分别将实验组和3个对照试验的结果以及未处理的等量起始目标蛋白上样检测,凝胶进行银染显色以观察探针富集的效果,结果如图7a所示。泳道1为实验组,泳道2为对照试验1,泳道3为对照试验2,泳道4为对照试验3,泳道5为未处理的等量起始目标蛋白。泳道1与泳道3、泳道4相比,泳道1的目标蛋白量明显高于泳道3和泳道4的,说明多肽探针②特异性的结合目标蛋白。泳道1与泳道2相比,泳道1的目标蛋白量明显高于泳道2的,说明光照处理后,光交联剂通过将目标蛋白和多肽探针中的多肽进行共价结合,克服了蛋白间结合的弱作用力的缺点,能够耐受后续洗涤等操作。泳道1与泳道5相比,两者目标蛋白含量接近,说明多肽探针可以高效富集目标蛋白。泳道1-4各目标蛋白量与泳道5的比较计算结果如图7b所示。
从图7中可以看出,与对照探针(探针①和peg)以及没有光照条件相比,多肽探针②结合光照处理,实现了对目标蛋白的特异性结合以及高效富集。
实施例3:在细胞裂解液或bsa为背景条件下,多肽探针对目标蛋白的选择性富集。
同样以bptf为目标蛋白,对实施例1多肽探针②的使用效果进行验证。
实验组:将目标蛋白(10μg)与细胞裂解液(50μg)(或牛血清白蛋白(bsa),50μg)按一定的比例混合,然后与多肽探针(4pmol)在缓冲溶液(50mmtris-hcl,ph7.8,200mm氯化钠,2.5mm氯化镁以及2.5mm氯化钾)中4℃孵育过夜。然后将样品管转移至冰上,在365nm紫外灯下光照15min,引发光交联反应。接下来使用含有4m尿素的pbs缓冲溶液(50mm,ph7.4)洗涤未交联的蛋白质三次。通过离心将捕获到的蛋白质分离,并加入含有12%巯基乙醇的上样缓冲液(250mmtris-hclph6.8,10%sds,0.5%溴酚蓝,7.5%二硫苏糖醇)将目标蛋白从纳米金颗粒上竞争下来;最后将蛋白95℃加热30min后上样,sds-page表征。
同时进1个平行对照试验:除不进行紫外灯光照操作外,其余试验方法和操作与实验组相同。
进行sds-page表征时,分别将实验组、对照试验组、未处理的目标蛋白与bsa或细胞裂解液的混合物、等量起始目标蛋白上样检测,凝胶进行银染显色以观察多肽探针对目标蛋白富集的效果,结果如图8所示。
图8a中,以bsa为背景条件下,泳道1为实验组,泳道2为对照试验组,泳道3为未处理的目标蛋白与bsa的混合物,泳道4为未处理的等量起始目标蛋白。泳道1与泳道4相比,泳道1的目标蛋白量与泳道4的接近;泳道1与泳道3相比,泳道1仅在目标蛋白分子量处出现了条带,与泳道3对应位置处的条带颜色接近,说明多肽探针②特异性的结合目标蛋白。泳道1与泳道2相比,泳道1的目标蛋白量明显高于泳道2的,说明光照处理后,光交联剂通过将目标蛋白和多肽探针中的多肽进行共价结合,克服了蛋白间结合的弱作用力的缺点,能够耐受后续洗涤等操作。
类似的结果在以细胞裂解液为背景条件的实验中也观察到了,结果如图8b所示。
由此可见,多肽探针②对目标蛋白具有非常好特异性和富集能力,即使在复杂体系中,多肽探针②对目标蛋白仍然保持非常高的选择性和特异性。
实施例4:多肽探针对蛋白多修饰与结合蛋白相互作用的评价
实验条件同实施例2中实验组的条件。所使用的探针分别为②或⑤的探针。
如图9所示,泳道1为探针②与bptfphd的孵育,泳道2为探针⑤与bptfphd的孵育,泳道3为input对照。经过同实施例2的孵育、洗脱、富集和sds-page鉴定相同的操作,结果如图9所示:探针⑤与目标蛋白bptfphd的结合和富集,弱于探针②对目标蛋白bptfphd的结合和富集,说明当h3k4序列上的t3存在磷酸化修饰时,会影响目标蛋白bptfphd与修饰h3k4me3的结合,表明了t3ph对修饰k4me3识别过程的影响。这个结果与文献报道的一致(nucleicacidsresearch2016,44,6102-6112),证明了实施例1中的多肽探针还可以用来分析蛋白修饰间的相互作用。
实施例5:多肽探针对细胞核蛋白中组蛋白h3k4me3修饰结合蛋白的富集与表征。
利用hela细胞裂解液或核蛋白提取试剂盒(购买于上海生工生物工程有限公司)从hela细胞中提取核蛋白。将提取的核蛋白(0.6mg)与多肽探针②(16pmol)在缓冲溶液(50mmtris-hcl,ph7.8,200mm氯化钠,2.5mm氯化镁以及2.5mm氯化钾)中4℃孵育过夜。并进行后续的紫外照射与洗脱实验,对富集得到的蛋白进行sds-page分析以及液相色谱-质谱联用分析(nano-lc-q-exactive质谱)与鉴定。具体条件如下:液相梯度60分钟,流速300nl/min,一级质谱分辨率设置为70000,扫描范围为350-1750m/z,归一化能量为27%,二级质谱分辨率设置为17500。扫描窗口为1.6da。鉴定得到的所有富集蛋白的结果如下表1所示:
表1探针对h3k4m3结合蛋白的鉴定
利用生物信息数据库,对鉴定出的蛋白进行生物功能分类,发现富集到的48个蛋白中,11.9%的蛋白具有染色质结合活性,23.2%的蛋白具有转录活性,32.1%的蛋白具有dna结合活性,15.8%具有转录因子结合活性,5.8%的蛋白具有解旋酶活性,1.2%的蛋白具有去甲基化酶活性,1.9%的蛋白具有甲基转移酶活性,2.3%的蛋白具有乙酰基转移酶活性,5.8%的蛋白具有atp酶活性。
结合蛋白snd1与多肽②的westernblot验证结果见图10。
本实施中多肽探针②富集到了hela细胞中已经报道的h3k4me3结合蛋白35个中的23个,说明该探针具有很强的富集组蛋白修饰结合蛋白的能力。另外,还富集到了其他蛋白,这些蛋白可能也具有识别h3k4me3的结构域,存在相应的生物学功能,后续对这些蛋白进行结构和功能研究,将有利于发现新的功能性蛋白及其生物学功能。说明该探针在发现新的未知蛋白修饰结合蛋白上有重要的应用价值。
实施例6:多肽探针对细胞核蛋白中组蛋白h3k9cr修饰结合蛋白的富集与表征。
采用探针④,与实施例5相同的方法,获得h3k9cr的结合蛋白(表2),在富集并鉴定的蛋白中发现了目前已知的所有识别该修饰的结合蛋白,包括:af9,enlandyeats4(molcell2016,62,181-193;natchembiol2016,12,396-398;structure2017,25,571-573.)。同时发现一系列具有识别结构域未见报道的蛋白。
图11b是对结合蛋白kat6b与多肽④的westernblot验证,图11c是采用计算机对接分析对所述结合蛋白的进一步确认。
表2探针对h3k9cr结合蛋白的鉴定
- 还没有人留言评论。精彩留言会获得点赞!