05SAR-PAGE及其制备方法和应用与流程
本发明涉及一种凝胶电泳分离技术,尤其涉及一种05sar-page及其制备方法和应用。
背景技术:
蛋白质是生物体的重要组成成分,是生命活动的主要承担者。蛋白质行使生物学功能常以多聚状态,复合体状态或修饰态存在,目前对于准确鉴定蛋白质不同状态以及蛋白质的相互作用仍然具有挑战性。
sds-page与native-page是目前蛋白质研究领域中最常用的蛋白质鉴定方法。sds是一种强阴离子型去污剂,能够与蛋白质结合,破环球状蛋白质的结构,使蛋白质的分子量与蛋白质所带电荷量相关,因此蛋白质在电泳过程中的迁移速度仅取决于蛋白质分子量大小,并可以用蛋白质marker指示目的蛋白的分子量。由于sds-page破坏了蛋白质的天然构象,常应用于变性蛋白质的研究,因此在sds-page中几乎观测不到蛋白质的修饰态或复合体状态。
native-page是一种没有加sds的非变性凝胶电泳,在电泳过程中,蛋白质能够保持完整状态,由于蛋白质在native-page中的迁移速率同时受分子量大小,蛋白质形状及所带电荷影响,因此native-page没有统一的蛋白质marker定标,这对于分析蛋白质的分子量、多聚状态和复合体状态造成了困扰。同时,由于酸性蛋白和碱性蛋白带电量不同,给实验操作带来了不便。
sar-page是一种用月桂酰肌氨酸钠(sarkosyl,sar)取代sds制成的凝胶,sar是一种温和的阴离子型去污剂,由于其只与蛋白质结合而不与聚乙二醇结合,因此,0.1%w/vsar的sar-page近年来用于聚乙二醇化的蛋白质的免疫学研究。实验证明,0.1%w/vsar会破坏一部分常规蛋白质的结构,因此含0.1%w/vsar的sar-page不用于蛋白质聚集状态及蛋白质的酶活性分析。
技术实现要素:
本发明的目的在于克服了传统蛋白质凝胶电泳技术的缺陷,提供了一种05sar-page及其制备方法和应用;本发明既不破环蛋白质的二级结构,同时能够对电泳的目的蛋白质进行定标,半定量分析,操作简单,成本低廉,适用于最常用的tris-glycine电泳液系统。
本发明的目的是这样实现的:
本发明包括含有0.05%w/vsar的凝胶电泳体系,和0.1-0.5mm的蛋白质样液。
所述的0.05%sar的凝胶电泳体系包括含有05sar-page,含有0.05%w/vsar的loadingbuffer,含有0.05%w/vsar的runningbuffer,含有0.05%w/vsar的蛋白质marker。
一、05sar-page
用0.05%质量体积比(w/v)的月桂酰肌氨酸钠制备成的分离蛋白质的凝胶(简称05sar-page)
包括下层分离胶和上层浓缩胶:
下层分离胶和上层浓缩胶的长度和厚度相同;
下层分离胶高度:上层浓缩胶高度=2:1至8:1;
根据目的蛋白质分子量的大小,配制不同浓度丙烯酰胺的下层分离胶;下层分离胶由5种物质组成,包括30%丙烯酰胺溶液、1.5mol/ltrisph8.8、10%w/v过硫酸氨、5%w/vsar和四甲基乙二胺(temed),下层分离胶的配方包括5种:6%丙烯酰胺凝胶配方(表1)、8%丙烯酰胺凝胶配方(表2)、10%丙烯酰胺凝胶配方(表3)、12%丙烯酰胺凝胶配方(表4)、15%丙烯酰胺凝胶配方(表5);
上层分离胶的配方包括1种:5%丙烯酰胺凝胶(表6)。
二、05sar-page的制备方法
本方法包括下列步骤:
①凝胶板的制备
a、分离胶的制备
a、按表中用量配制分离胶,在干净的小烧杯中依次加入蒸馏水,30%丙烯酰胺溶液,1.5mol/ltris,ph8.8,10%w/v过硫酸氨,5%w/vsar,轻轻混匀,最后加入四甲基乙二胺(temed),再次轻轻混匀;
b、用1ml移液枪将上述混合液混匀后加入长短制胶板缝隙内,分离胶53-63mm高,用1ml注射器取少许蒸馏水,沿长玻璃板注满水封,15-30min后,用滤纸条吸去多余的水分;
b、浓缩胶的制备
a、按表中用量配制浓缩胶,在干净的小烧杯中依次加入蒸馏水,30%丙烯酰胺溶液,1.5mol/ltrisph8.8,10%w/v过硫酸氨,5%w/vsar,轻轻混匀,最后加入四甲基乙二胺(temed),再次轻轻混匀。
b、用1ml移液枪将上述混合液混匀后加入分离胶上层,迅速插入样品槽模板,放置20-60min,待浓缩胶完全凝固后,取出样品槽模板,放入4℃冰箱备用;
②上样缓冲液(loadingbuffer)的制备
a、配制50mmtris-hclph6.8,0.05%w/vsar,0.1%w/v溴酚蓝,10%v/v甘油;
b、加去离子水溶解后定容至5ml;
c、小份分装后室温保存;
③电泳缓冲液(runningbuffer)的制备:
a、配制25mmtris,0.25mm甘氨酸,0.05%w/vsar;
b、加去离子水溶解后定容至5ml;
④蛋白质marker的制备
蛋白质marker包含4-8个分子量梯度,且蛋白质分子量范围在5kda-300kda之间,将浓度为0.05-0.5mm的蛋白质marker溶解于上样缓冲溶液中;
⑤蛋白质样品的制备
将浓度为0.05-0.5mm的蛋白质样品与上样缓冲液按体积比1:1混合即得到最后样品。
本发明具有下列优点和积极效果:
①本发明在综合保留了传统sds-page和native-page可分离不同状态蛋白质,操作简单方便等特点外,克服了sds-page不能分析生理状态蛋白质修饰和native-page无法用蛋白质marker定标及不能直接用来分析酸性蛋白质和碱性蛋白之的缺点;
②实验结果证明,该方法具有普适性,操作简单,成本低廉;
③可广泛应用于分子动力学、酶学、医药等领域的基础和应用学研究,为广大实验人员的蛋白质科学分析带来广泛的便利。
附图说明
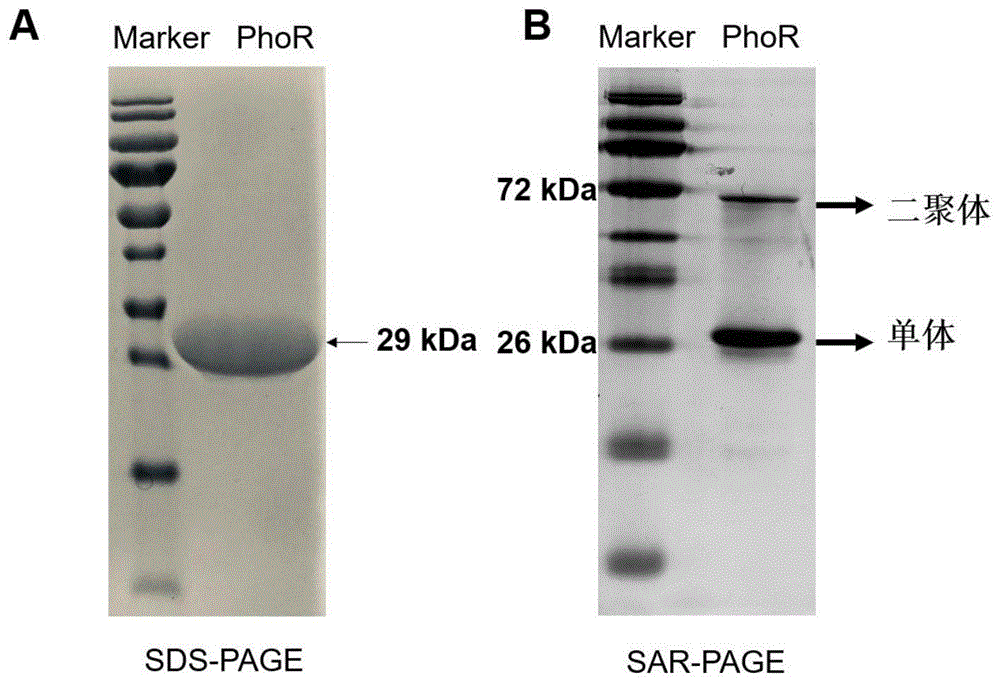
图1是电泳结果示意图,
a:传统的sds-page分析没有加热的胞内全长phor电泳结果示意图;
b:05sar-page分析没有加热的胞内全长phor电泳结果示意图;
第一个泳道为蛋白质marker的条带,第二个泳道为胞内全长phor的电泳条带。
图2是05sar-page电泳结果示意图,
a:为细胞色素c甲基化前后,05sar-page电泳图谱,第一个泳道为蛋白质marker的条带,第二个泳道和第三个泳道分别为细胞色素c甲基化前与甲基化后的电泳图;
b:为phob与乙酰磷酸二锂盐反应随时间变化的05sar-page图谱。
图3是phob在不同去污剂中的1h-15nhsqc谱图;
a:是0.2mmphob在无sar存在时(灰色)和有0.05%(w/v)sar(黑色)时的1h-15nhsqc谱图;
b:是0.2mmphob在无sds存在时(灰色)和有0.05%(w/v)sds(黑色)时的1h-15nhsqc谱图。
图4是不同浓度的phob在sar中的1h-15nhsqc谱图;
a:0.01mmphob在无sar存在时(灰色)和有0.05%(w/v)sar(黑色)时的1h-15nhsqc谱图;
b:0.mmphob在无sar存在时(灰色)和有0.05%(w/v)sar(黑色)时的1h-15nhsqc谱图;
c:1mmphob在无sar存在时(灰色)和有0.05%(w/v)sar(黑色)时的1h-15nhsqc谱图。
图5是为0.05mmphob的05sar-page图,
第一个泳道为蛋白质marker的条带,
第二条泳道为phob的条带;根据蛋白质marker的分子量可以分析出第二
条带为phob有单体和二聚存在。
具体实施方式
下面结合附图和实施例详细说明:
1、05sar-page
表1配制tris-甘氨酸6%05sar-page聚丙烯酰胺凝胶电泳分离胶所用溶液
表2配制tris-甘氨酸8%05sar-page聚丙烯酰胺凝胶电泳分离胶所用溶液
表3配制tris-甘氨酸10%05sar-page聚丙烯酰胺凝胶电泳分离胶所用溶液
表4配制tris-甘氨酸12%05sar-page聚丙烯酰胺凝胶电泳分离胶所用溶液
表5配制tris-甘氨酸15%05sar-page聚丙烯酰胺凝胶电泳分离胶所用溶液
表6配制tris-甘氨酸05sar-page聚丙烯酰胺凝胶电泳浓缩胶所用溶液
2、05sar-page的应用
ⅰ、用于直接分离并确定蛋白质的多聚状态,不受蛋白质pi的影响。如图1,胞内全长phor的预测等电点为8.86,相对分子质量为29kda,早期研究表明,该蛋白质在溶液中有二聚状态,由于其等电点大于7.0,常规的native-page技术操作繁琐,而传统的sds-page为变性凝胶,只能跑出phor蛋白的单体的条带(如图1a),05sar-page能够不受phor蛋白质等电点影响,克服传统native-page与sds-page的缺点,检测到了phor蛋白质二聚体和单体的条带(如图1b)。
ⅱ、用于观测蛋白质单体或多聚时的修饰状态。如图2,蛋白质的定向修饰对于蛋白质在生物体内发挥功能具有重要意义。由于0.05%w/vsar对蛋白质的结构影响温和,因此,05sar-page可以用来研究蛋白质的修饰。在实验中,用05sar-page观测到了细胞色素c的甲基化修饰和phob的磷酸化修饰。与常规的sds-page相比,我们看到了细胞色素c二聚状态的甲基化修饰。
ⅲ、用于观测不同蛋白质形成的复合物;05sar-page可用来检测蛋白质不同的聚集状态,说明0.05%w/vsar对蛋白质聚合界面破坏力小,因此也可以用来检测不同蛋白质形成的复合物。
ⅳ、用于对蛋白质纯度分析及蛋白质分子量测定;05sar-page保留了传统凝胶电泳的共性,可以对目的蛋白质进行纯度分析。
ⅴ、用于取代sds,用于westernbolt实验,检测细胞内蛋白质的多聚态。对于细胞内表达量高的蛋白质,05sar-page可以结合免疫杂交实验,检测细胞内的蛋白质的聚集状态。
3、本发明的创新点:
1、在实验中,发现了0.05%w/vsar可以与蛋白质结合并对蛋白质结构影响温和,且具有普适性。如图3,对比a和b可以看出,0.05%w/v的sar没有破坏phob的二级结构,而0.05%w/vsds破环了phob的二级结构;说明相对于sds而言,sar是极为温和的去污剂。
2、在实验中,确定了最适的蛋白质电泳浓度0.05-0.5mm。如图4,在0.05%w/v的sar中,当phob的浓度为0.01mm时,phob倾向于无结构态;当phob的浓度为0.1mm时,phob结构比较稳定,只有一部分氨基酸的化学位移发生了扰动;当phob的浓度为1mm时,phob结构更加稳定,只有极少数氨基酸的化学位移发生了扰动;实验说明,当sar的浓度为0.05%w/v时,phob的浓度越高,结构越稳定。
3、该二维凝胶电泳技术第一次实现了可以用蛋白质marker分析蛋白质不同的聚集状态。如图5,根据蛋白质marker指示的分子量,观测到phob蛋白质的二聚态和单体。在早期的研究中,用核磁方法也发现了phob在溶液中存在二聚和单体两态交换。
4、05sar-page使用方法
1)将0.05-0.5mm目的蛋白质与上样缓冲液按照体积比1:1混合;
2)将蛋白质样品上样至05sar-page中,用80v跑约15分钟;待样品进入分离胶后,改为120v;待蓝色的线接近凝胶板底部时,停止电泳,关闭电源。将凝胶取出,用传统方法对凝胶染色,脱色并分析。(电泳的电压可以根据蛋白质的稳定性加减)。
- 还没有人留言评论。精彩留言会获得点赞!