一种氧析出电极及其制备和应用的制作方法
本发明涉及一种氧析出电极材料、本发明还涉及该氧析出电极的制备方法和应用。
背景技术:
氧析出反应(Oxygen Evolution Reaction,OER)在电解水、可再生燃料电池、二次金属/空气电池中具有十分重要的地位,但由于氧析出反应动力学过程慢,需要较高的过电位,因此国内外研究者对氧析出反应的催化剂及电极进行了广泛的研究。
目前性能较高的氧析出反应的催化剂为Ir基与Ru基贵金属及其氧化物,但由于其储量低、价格高,因此近年来对非贵金属氧析出催化剂进行了广泛的探索。在各种非贵金属催化剂中,层状双氢氧化物类(Layered Double Hydroxides,LDHs)催化剂,尤其是NiFe基LDH催化剂具有较高的催化性能与稳定性,是一种具有广阔应用前景的非贵金属氧析出催化剂。但此类催化剂的制备过程较为复杂,一般可通过共沉淀法、水热法、电沉积法等制备,制备过程需要精细控制实验pH等条件、使用高压反应装置或昂贵的仪器等,限制了LDHs类催化剂的广泛应用。
技术实现要素:
本发明针对现有技术中层状双氢氧化物类催化剂制备过程复杂,难以应用的缺点,采用泡沫镍浸渍于Ni、Fe、Co等金属阳离子的溶液中通过水解沉淀制备得到微观上具有纳米片状的双金属氢氧化物或金属氧化物与金属氢氧化物的复合物自组装成的花状微米球催化剂。本发明采用以下方案来实现:
一种氧析出电极,其特征在于:所述氧析出电极以泡沫金属为电极支撑体及骨架,其上均匀负载有由纳米片状的催化剂自组装成的花状微米球,所述催化剂为双金属氢氧化物,或为第一金属氢氧化物与第二金属氢氧化物的复合物、或双金属氢氧化物与双金属中一种或二种相同金属的氢氧化物的复合物。
所述纳米片状催化剂厚度为10-100nm;所述花状微米球的直径为500nm-5μm。
所述纳米片状催化剂厚度较优为10-50nm;所述花状微米球的直径较优为500nm-2μm。
所述氧析出电极中双金属氢氧化物的载量为0.1-10mg/cm2;或所述氧析出电极中第一金属氢氧化物的载量为0.01-5mg/cm2;第二金属氢氧化物的载量为0.01-5mg/cm2。
所述泡沫金属支撑体的厚度为0.5-5mm;所述双金属氢氧化物为Ni、Fe、Co、Al、Zn、Mn中任一两种的氢氧化物,以金属计,其中一种金属为双金属总摩尔含量的1-99%;所述第一金属氢氧化物与第二金属氢氧化物的复合物中的第一和第二金属氢氧化物分别为Ni、Fe、Co、Al、Zn、Mn中的任一一种金属的氢氧化物;且第一和第二金属不同,第一金属氢氧化物为两种金属氢氧化物总摩尔含量的1-99%。
将泡沫镍支撑体浸渍于含有Ni、Fe、Co、Al、Zn、Mn中任一两种阳离子的盐溶液中1小时以上得到。
所述溶液温度范围为0-100℃,所述溶液温度范围较优为30-90℃;所述泡沫镍于盐溶液中的浸渍时间较优为3-15天之间。
所述两种金属阳离子开始水解沉淀的pH差小于2;pH差较优为小于0.2。
所述盐溶液中金属阳离子的浓度为0.0001-1mol/L,两种金属阳离子总浓度为0.1-2mol/L。
所述溶液pH范围为4-10;pH范围较优为6-8。
所述氧析出电极可用作电解水、光电解水、可再生燃料电池、或可充式金属空气电池中。
本发明的关键在于对两种金属阳离子的浓度的控制,使其开始水解沉淀的pH(开始水解沉淀的pH值可由相应的氢氧化物的溶度积计算,如Ni(OH)2溶度积为K=5.48×10-16,当Ni2+浓度c=0.1mol/L时,Ni2+开始沉淀的达到近似相等(小于0.2),此时两种金属阳离子同时在水溶液中进行水解沉淀,即两种金属能够均匀分散在整个催化剂中,从而使得制备出的催化剂具有较高的性能。
本发明专利提出通过将泡沫金属浸渍在金属盐的水溶液中,与常规浸渍法不同,常规浸渍仅起到将金属离子吸附到载体上的作用,仍需要后续的焙烧等步骤将金属盐从离子态转化成固态。而本发明的关键在于金属盐在水溶液中发生水解沉淀反应,产生的沉淀直接原位负载于载体泡沫金属上,无需后续的焙烧步骤。除此之外,由于水解产生的氢离子阻碍了水解反应的持续进行,如不添加泡沫镍等载体将无法得到沉淀,本发明提出采用泡沫镍、泡沫铁、泡沫铁镍、泡沫铜等金属,通过金属与水及溶解氧发生的腐蚀反应,消耗水解反应产生的H+,进一步促进了金属盐的水解沉淀。而泡沫银、碳纤维毡、碳布、碳纸等由于其在水溶液中无法发生腐蚀,也即无法消耗水解反应产生的H+,因此无法用作本发明的载体。而在常规浸渍法中,载体起到吸附金属离子的作用,因此只要具有较高的比表面积,如碳毡、碳纸、泡沫镍等,均能作为载体使用。
本发明将泡沫金属浸渍在反应液中的时间较长,原因是金属盐的水解反应速率较慢,需要较长时间进行缓慢地水解沉淀,另外两种氢氧化物沉淀在水中缓慢陈化,并经过晶型转变得到层状双氢氧化物或氢氧化物复合物。而常规浸渍法仅需要将金属盐吸附于载体上,时间较短,即使相关专利提出较长的浸渍时间,其目的也仅仅是让金属盐充分吸附到载体上,而不是等待金属盐的水解沉淀反应。
层状双氢氧化物常见的制备方法有共沉淀法、水热法等,均需要沉淀剂(如碱、尿素等可释放出氢氧根的化合物)使金属盐产生氢氧化物沉淀,并通过高温高压反应促使晶型转变。而在本发明中,水成为绿色的沉淀剂使得金属盐缓慢水解沉淀,并在常温常压下陈化进行晶型转变。
本发明的优点是不使用有机沉淀剂,避免对环境的污染;不使用强碱性沉淀剂,金属盐水解沉淀缓慢均匀,最终得到的催化剂金属分散均匀;不使用高温高压设备,安全廉价,易于放大与批量制备;催化剂原位负载在载体上,结合力强不易脱落,接触电阻小。本发明制备的氧析出电极过活性高电位低,电极内阻小,催化剂不易脱落,电极寿命长,成本低,易于工业化生产。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面对实施例所需使用的附图作简要的介绍。显然,下面描述中附图仅仅是本发明的一些实施例,对于本领域的普通技术人员,在不付出创造性劳动的前提下,还可以根据这些附图获得其他附图。
图1为实施例所使用的泡沫镍电极的照片。
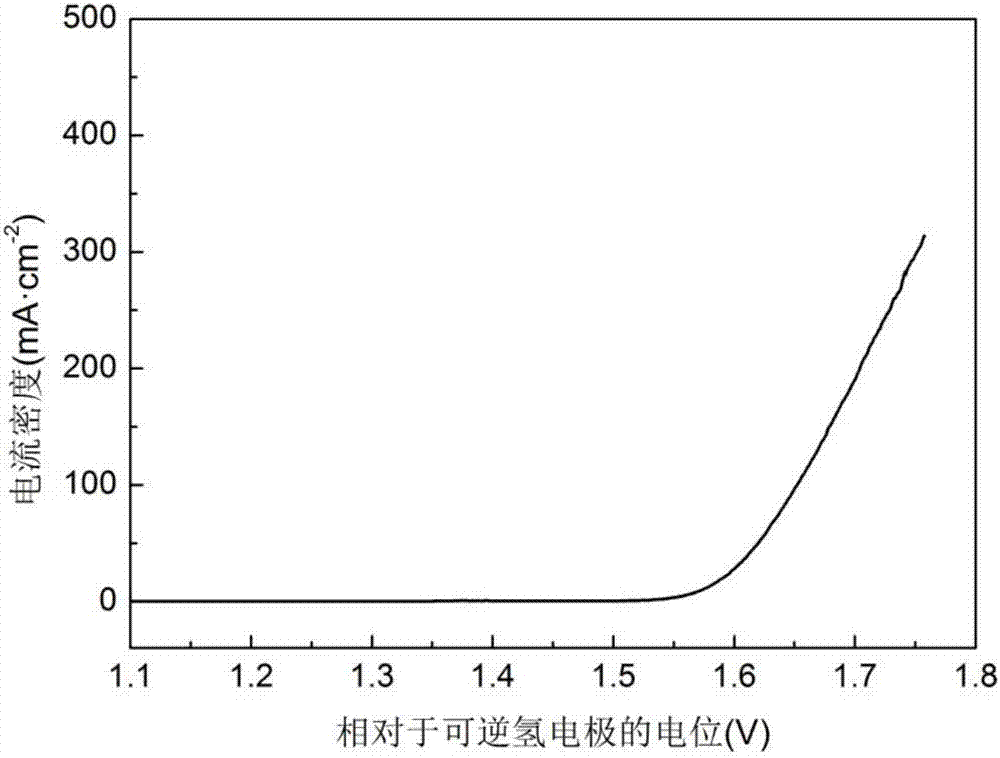
图2为实施例所使用的泡沫镍电极的催化性能。
图3为实施例1制备的氧析出电极的照片。
图4为实施例1制备的氧析出电极的微观形貌。
图5为实施例1制备的氧析出电极的X射线衍射谱图。
图6为实施例1制备的氧析出电极的催化性能。
图7为实施例2制备的氧析出电极的照片。
图8为实施例2制备的氧析出电极的催化性能。
图9为实施例3制备的氧析出电极的照片。
图10为实施例3制备的氧析出电极的催化性能。
图11为实施例4制备的氧析出电极的照片。
图12为实施例4制备的氧析出电极的催化性能。
图13为实施例5制备的氧析出电极的照片。
图14为实施例5制备的氧析出电极的催化性能。
图15为实施例6制备的氧析出电极的照片。
图16为实施例6制备的氧析出电极的催化性能。
图17为实施例7制备的氧析出电极的照片。
图18为实施例7制备的氧析出电极的催化性能。
图19为实施例1-7制备的氧析出电极在10mA·cm-2下的过电位对比图。
具体实施方式
下面结合本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明的实施例,本领域的普通技术人员在没有创造性劳动前提下所获得的所有其他实施例,都属于本发明的保护范围。
实施例1:配置含0.01mol/L FeCl2与0.1mol/LNiCl2的水溶液,加入一片1cm×2cm的泡沫镍,浸泡15天,取出电极后冲洗、干燥备用。图1为制备的氧析出电极的照片,图2为制备的氧析出电极微观形貌,图3为制备的氧析出电极的X射线衍射谱图,图4为制备的氧析出电极在1mol/L KOH溶液中催化氧析出的性能。
实施例2:配置含0.01mol/L FeCl3与0.1mol/L NiCl2的水溶液,加入一片1cm×2cm的泡沫镍,浸泡15天,取出电极后冲洗、干燥备用,图5为制备的氧析出电极的照片,图6为制备的氧析出电极在1mol/L KOH溶液中催化氧析出的性能。
实施例3:配置含0.1mol/L CoCl2与0.001mol/L NiCl2的水溶液,加入一片1cm×2cm的泡沫镍,浸泡15天,取出电极后冲洗、干燥备用,图7为制备的氧析出电极的照片,图8为制备的氧析出电极在1mol/L KOH溶液中催化氧析出的性能。
实施例4:配置含0.06mol/L ZnCl2与0.1mol/L FeCl2的水溶液,加入一片1cm×2cm的泡沫镍,浸泡15天,取出电极后冲洗、干燥备用,图9为制备的氧析出电极的照片,图10为制备的氧析出电极在1mol/L KOH溶液中催化氧析出的性能。
实施例5:配置含0.0005mol/L ZnCl2与0.1mol/L CoCl2的水溶液,加入一片1cm×2cm的泡沫镍,浸泡15天,取出电极后冲洗、干燥备用,图11为制备的氧析出电极的照片,图12为制备的氧析出电极在1mol/L KOH溶液中催化氧析出的性能。
实施例6:配置含0.0055mol/L ZnCl2与0.1mol/L NiCl2的水溶液,加入一片1cm×2cm的泡沫镍,浸泡15天,取出电极后冲洗、干燥备用,图13为制备的氧析出电极的照片,图14为制备的氧析出电极在1mol/L KOH溶液中催化氧析出的性能。
实施例7:配置含0.1mol/L MnCl2与0.0031mol/L CoCl2的水溶液,加入一片1cm×2cm的泡沫镍,浸泡15天,取出电极后冲洗、干燥备用,图15为制备的氧析出电极的照片,图16为制备的氧析出电极在1mol/L KOH溶液中催化氧析出的性能。
- 还没有人留言评论。精彩留言会获得点赞!