具有pH响应的多层复合双载药微球的制备方法及产品与流程
本发明涉及生物可降解载药微球,具体的是一种具有pH响应的多层复合壳聚糖基双药微球的制备方法及其产品。
背景技术:
癌症是危害人类健康的严重疾病之一,无时无处不在影响着人类的生活。癌症治疗通常有三种途径:手术切除、放射治疗和化疗,而局部和扩散型癌症的治疗主要依赖化疗。近年来化疗在癌症治疗中扮演着重要的角色,然而目前治疗癌症所用的化疗药物普遍存在如下局限:(1)缺少靶向性:通常使用的抗癌药物具有普遍的细胞毒性,缺乏对癌细胞的选择性和靶向性,导致正常细胞也存在非特异性内吞,损坏正常细胞的增殖,从而产生严重的副作用,因此药物表现出治疗指数低、疗效不明显等缺点;(2)多药耐药性:多药耐药性使进入癌细胞中的抗癌药物不断地泵出细胞,增加了泵出量,导致细胞内药物减少,降低了抗癌药物对癌细胞的作用;(3)水溶解性差:大部分抗癌药物表现为疏水性,需要添加额外的溶剂才能形成制剂,而这些溶剂往往有一定的毒副作用。
近年来,微球型药物输送体系作为新型的药物载体,由于具有特殊的尺寸和结构,能够靶向定位地将药物输送到病灶局部或专一性地作用于靶细胞,并且能够维持药物缓慢释放、延长药物半衰期和减少毒副作用等,目前已广泛应用于生物医药领域。然而大部分传统载药系统仅仅能够传递一种药物,近年来,尽管一些给药系统(如纳米粒、脂质体)已经可以成功地释放超过一种治疗药物,例如一些小分子药物,如siRNA,DNA和缩氨酸,但是由于制备过程中复杂助剂的存在并且吸附在表面的亲水性药物易于快速释放等缺点,维持这些药物的共同传递存在一些不足,很难满足临床的要求。
技术实现要素:
本发明的目的在于提供一种具有pH响应的多层复合双载药微球的制备方法及产品,具体地是一种生物可降解壳聚糖/阴离子电解质/壳聚糖载疏水性药物/亲水性药物双药微球的制备方法及制备得到的微球制剂。
本发明的技术方案如下:
一种具有pH响应的多层复合双载药微球的制备方法,主要包括以下步骤:
(1)自组装模板的制备:
步骤1:称取0.1-0.15g壳聚糖溶于0.5-2%(v/v)稀酸溶液,搅拌溶解得到壳聚糖稀酸溶液,将表面活性剂加入壳聚糖稀酸溶液中作为水相;取0.02-0.05g疏水性药物溶于有机溶剂中并将得到的药物溶液加入壳聚糖稀酸溶液中搅拌20-40min形成水包油(O/W)乳剂I;将0.05-0.15mL的戊二醛(浓度为25%)加入到液体石蜡中并滴加表面活性剂,搅拌20-40min形成油包水W/O乳剂II;
步骤2:乳剂I和乳剂II分别超声乳化1-4min后,两者混合搅拌20-40min后升高温度到35-45℃,交联固化1.5-2.5h后形成带正电荷的壳聚糖载疏水性药物微球,并将其作为下述自组装过程的模板;
(2)自组装多层载疏水性药物和亲水性药物的缓释微球制备:
步骤3:在壳聚糖载疏水性药物微球模板悬浮液中加入5-15mL阴离子电解质浓度为5-6mg/mL的阴离子电解质-氢氧化钠,其中氢氧化钠的浓度为5mg/ml,反应0.5-1h后形成双层阴离子电解质/壳聚糖载疏水性药物微球,利用两种带相反电荷的聚电解质物质间的静电引力作用自组装形成了该模板微球外的第一层膜;
步骤4:在1-10mL 1-8mg/mL壳聚糖溶液中加入10-40mg的所述亲水性药物,搅拌10-30min后加入到步骤3制备的阴离子电解质/壳聚糖载疏水性药物微球溶液中,搅拌如磁力搅拌0.5-3h后,进行洗涤如石油醚洗涤,之后再如3500rpm,10min条件下离心如三次,冷冻干燥后得到多层复合双载药微球,在此处具体为三层,即壳聚糖/阴离子电解质/壳聚糖载疏水性药物和亲水性药物复合微球,本步骤同样利用静电引力作用自组装形成模板微球外的第二层膜。
在本发明中优选还包括步骤5:将步骤3和步骤4重复至少一次。
在本发明中优选:所述疏水性药物选自紫杉醇、羟基喜树碱类、卡培他滨或多西他赛,或其它疏水性药物。
在本发明中优选:所述稀酸溶液选自冰乙酸、稀盐酸、乙二酸、柠檬酸、草酸,其浓度优选为1%(v/v)。
在本发明中优选:所述表面活性剂选自吐温80、吐温20、司盘80、司盘60中的一种。
在本发明中优选:所述有机溶剂选自二氯甲烷、丙酮、乙腈。
在本发明中优选:所述阴离子电解质选自:葡聚糖、海藻酸钠或羧甲基纤维素钠。
在本发明中优选:所述亲水性药物选自:5-氟尿嘧啶、阿霉素、表柔比星或拓扑益 康,或其它亲水性药物。
在本发明中,所述多层指三层以上。
一种壳聚糖/阴离子电解质/壳聚糖载疏水性药物/亲水性药物双药微球,该微球是根据上述任一的制备方法制备得到的。
优选地,该微球为壳聚糖/葡聚糖/壳聚糖载紫杉醇/5-氟尿嘧啶双药微球。
本发明中如无特殊说明,所有百分比均为重量百分比。
本发明制备得到的双药复合微球是在壳聚糖载药微球表面包覆了多层不同聚电解质材料外层,因此本发明的多层双药微球是一种壳聚糖基复合载药微球,其具有核壳复合结构。
本发明的自组装原理如下:由于壳聚糖是一种带正电的天然高分子多糖,本发明中利用壳聚糖与带相反电荷的阴离子电解质如葡聚糖之间的静电作用力,通过层层自组装作用在载药微球模板上形成多层聚电解质层,从而使吸附在微球表面的疏水性药物如紫杉醇进一步包覆,提高药物的载药率和包封率,降低药物的释放速率并且使微球具有不同pH响应。
本发明具有以下有益效果:
第一,本发明的制备方法由于采用双乳化-交联法,因此得到的微球粒径小,并具有规则的球形结构;
第二,本发明的制备方法采用层层自组装的方法制备多层复合微球,可以同时负载亲水性和亲脂性药物(疏水性药物),不受药物的溶解性以及性质的影响,具有较高的载药率和包封率;
第三,本发明制备得到的药物微球的体外释放试验表明其具有良好的缓释效果,而且在不同pH释放介质中具有不同的释放效果;同时,制备得到的药物微球的体外抗肿瘤细胞活力试验表明其对肝癌细胞具有良好的抑制作用;
第四,本发明的制备方法使用无毒性的生物高分子作为包覆材料,可以减少微球制剂的毒副作用,提高药物的使用安全性;并且本发明的制备方法同时包覆有两种药物,使两种药物协同治疗,进而提高药物的治疗效果;
第五,本发明的自组装过程中,步骤3和步骤4可以根据实际需要进行多层自组装,并且包裹不同的疏水性药物和亲水性药物以调节其释放速率,可以更方便的用于设计包载不同溶解性的药物,达到药物协同治疗效果
第六,本发明的多层复合双载药微球的制备工艺简单、成本低,易重复,可控性好,在肿瘤治疗领域具有很好地应用前景。
附图说明
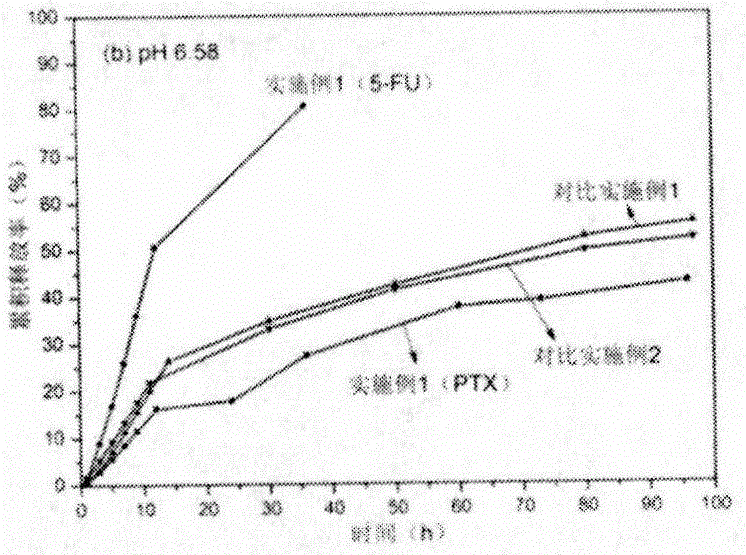
图1(a)、图1(b)、图1(c)是本发明实施例1、对比实施例1和对比实施例2的壳聚糖基复合载药微球在不同pH环境下的体外释放曲线;
图2是本发明实施例1、对比实施例1和对比实施例2的壳聚糖基复合载药微球的不同药物浓度和时间下对肝癌细胞的抑制率曲线。
具体实施方式
本发明提供一种具有pH响应的多层双载药复合微球的制备方法及其微球制剂。由于该多层聚合物微球内部可区分的特点,可以包裹不同的药物(在不同聚合物层间选择性包裹不同的药物)并且可以控制药物释放。
该载药微球的自组装模板为壳聚糖微球,壳聚糖微球因其具有靶向性、缓释性、生物可降解性和表面可修饰性等特点而成为载药微球制剂研究的热点,但由于壳聚糖是一种具有生物黏附性的天然可降解材料,传统的制备方法具有尺寸大、微球分散性差、包封率不高等缺陷,所以需要进一步改进,本发明采用了简单易操作的层层自组装技术,该技术是在可降解微米或纳米颗粒上逐层交替层积带相反电荷的聚电解质,构筑具有特定多层厚度的核-壳结构,这种方法用于制备载药微球的显著优越性在于能够在纳米尺寸上对微球的大小、组成、结构、形态和囊壁厚度进行精确的控制并且可以减少助剂的使用,减小毒性。
在优选实施例中,本发明将聚阴离子电解质葡聚糖吸附到壳聚糖微球表面,形成稳定的第二层聚电解质膜,增加不溶性药物的载药率和包封率,并可以对微球进行进一步的修饰,可替换地,聚阴离子电解质还可以使用海藻酸钠、羧甲基纤维素钠等;为了使微球具有pH响应性,应对人体复杂的pH环境,提高微球的缓释性能并且负载水溶性药物,再将含有水溶性抗肿瘤药物的壳聚糖溶液包裹在双层微球上,形成三层双载药微球。这种三层双载药微球具有多功能,它们能够同时负载疏水性药物和亲水性药物两种抗肿瘤药物并具有pH响应性,能够控制药物差异性释放,发挥药物协同增效作用,增强治疗效果、减小毒副作用。
下面结合实施例和对比实施例对本发明进行详细说明,下述实施例仅用来对说明书的详细解释,并不作为对本发明的限制。以下实施例中的紫杉醇还可以用其他水不溶性药物代替,例如羟基喜树碱类、卡培他滨、多西他赛等;以下实施例中的水溶性药物5-氟尿嘧啶还可以用其他水溶性药物替代,例如阿霉素、表柔比星、拓扑益康等。
实施例1
称取0.12g壳聚糖溶于1%(v/v)醋酸溶液,搅拌溶解得到壳聚糖醋酸溶液。将吐温-80加入壳聚糖醋酸溶液中作为水相。取50mg紫杉醇溶于二氯甲烷中并加入壳聚糖醋酸溶液中搅拌30min形成水包油(O/W)乳剂I。将0.1mL的戊二醛(浓度25%)加入到液体石蜡中并滴入司盘80,搅拌30min形成油包水W/O乳剂II。乳剂I和乳剂II分别超声乳化3min后,两者混合搅拌40min后升温到40℃交联固化2h。
将10mL葡聚糖浓度为6mg/mL的葡聚糖-氢氧化钠(氢氧化钠浓度5mg/mL)溶液滴加入上述壳聚糖微球悬浮液中,反应1h后形成葡聚糖/壳聚糖载紫杉醇微球溶液(DEX/CS-PTX NPs)。
然后,在5mL壳聚糖浓度为4mg/mL的壳聚糖溶液中加入40mg的5-氟尿嘧啶,搅拌10min后加入到上述葡聚糖/壳聚糖载紫杉醇微球溶液中,磁力搅拌2h后,石油醚洗涤,3500rpm,10min离心三次得到粗产物,冷冻干燥后得到最终产物,产物命名为壳聚糖/葡聚糖/壳聚糖载紫杉醇/5-氟尿嘧啶双药微球。所得产品的平均粒径、电荷大小、载药率及包封率见下表1。
实施例2
称取0.12g壳聚糖溶于1%(v/v)醋酸溶液,搅拌溶解得到壳聚糖醋酸溶液。将吐温-80加入壳聚糖醋酸溶液中作为水相。取适量40mg紫杉醇溶于二氯甲烷中并加入壳聚糖醋酸溶液中搅拌30min形成水包油(O/W)乳剂I。将0.1mL的戊二醛(浓度为25%)加入到液体石蜡中并滴入司盘80,搅拌30min形成油包水W/O乳剂II。乳剂I和乳剂II分别超声乳化3min后,两者混合搅拌40min后升温到40℃,交联固化2h。
将12mL葡聚糖浓度为6mg/mL的葡聚糖-氢氧化钠(氢氧化钠浓度5mg/mL)溶液滴加入上述壳聚糖微球悬浮液中,反应1h后形成葡聚糖/壳聚糖载紫杉醇微球溶液(DEX/CS-PTX NPs)。
然后,在5mL 4mg/mL壳聚糖溶液中加入40mg的5-氟尿嘧啶,搅拌10min后加入到葡聚糖/壳聚糖载紫杉醇微球溶液中,磁力搅拌2h后,石油醚洗涤,3500rpm,10min离心三次得到粗产物,冷冻干燥后得到最终产物,产物命名为壳聚糖/葡聚糖/壳聚糖载紫杉醇/5-氟尿嘧啶双药微球。所得产品的平均粒径、电荷大小、载药率及包封率见下表1。
实施例3
称取0.12g壳聚糖溶于1%(v/v)醋酸溶液,搅拌溶解得到壳聚糖醋酸溶液。将吐温-80加入壳聚糖醋酸溶液中作为水相。取20mg紫杉醇溶于二氯甲烷中并加入壳聚糖醋酸溶液中搅拌30min形成水包油(O/W)乳剂I。将0.1mL戊二醛(浓度为25%)加入 到液体石蜡中并滴入司盘80,搅拌30min形成油包水W/O乳剂II。乳剂I和乳剂II分别超声乳化3min后,两者混合搅拌40min后升温到40℃,交联固化2h。
将12mL葡聚糖浓度为6mg/mL的葡聚糖-氢氧化钠(氢氧化钠浓度5mg/mL)溶液滴加入上述壳聚糖微球悬浮液中,反应0.5h后形成葡聚糖/壳聚糖载紫杉醇微球溶液(DEX/CS-PTX NPs)。
然后,在5mL 1mg/mL壳聚糖溶液中加入10mg的5-氟尿嘧啶,搅拌10min后加入到葡聚糖/壳聚糖载紫杉醇微球溶液中,磁力搅拌2h后,石油醚洗涤,3500rpm,10min离心三次得到粗产物,冷冻干燥后得到最终产物,产物命名为壳聚糖/葡聚糖/壳聚糖载紫杉醇/5-氟尿嘧啶双药微球。所得产品的平均粒径、电荷大小、载药率及包封率见下表1。
实施例4
称取0.12g壳聚糖溶于1%(v/v)醋酸溶液,搅拌溶解得到壳聚糖醋酸溶液。将吐温-80加入壳聚糖醋酸溶液中作为水相。取40mg紫杉醇溶于二氯甲烷中并加入壳聚糖醋酸溶液中搅拌30min形成水包油(O/W)乳剂I。将0.1mL戊二醛(25%)加入到液体石蜡中并滴入司盘80,搅拌30min形成油包水W/O乳剂II。乳剂I和乳剂II分别超声乳化3min后,两者混合搅拌40min后升温到40℃,交联固化2h。
将12mL葡聚糖浓度为6mg/mL的葡聚糖-氢氧化钠(氢氧化钠浓度5mg/mL)溶液滴加入上述壳聚糖微球悬浮液中,反应1h后形成葡聚糖/壳聚糖载紫杉醇微球溶液(DEX/CS-PTX NPs)。
然后,在5mL 2mg/mL壳聚糖溶液中加入20mg的5-氟尿嘧啶,搅拌10min后加入到葡聚糖/壳聚糖载紫杉醇微球溶液中,磁力搅拌2h后,石油醚洗涤,3500rpm,10min离心三次得到粗产物,冷冻干燥后得到最终产物,产物命名为壳聚糖/葡聚糖/壳聚糖载紫杉醇/5-氟尿嘧啶双药微球。所得产品的平均粒径、电荷大小、载药率及包封率见下表1。
实施例5
称取0.12g壳聚糖溶于1%(v/v)醋酸溶液,搅拌溶解得到壳聚糖醋酸溶液。将吐温-80加入壳聚糖醋酸溶液中作为水相。取20mg紫杉醇溶于二氯甲烷中并加入壳聚糖醋酸溶液中搅拌30min形成水包油(O/W)乳剂I。将0.05mL戊二醛(25%)加入到液体石蜡中并滴入司盘80,搅拌30min形成油包水W/O乳剂II。乳剂I和乳剂II分别超声乳化3min后,两者混合搅拌40min后升温到40℃,交联固化2h。
将12mL葡聚糖浓度为6mg/mL的葡聚糖-氢氧化钠(氢氧化钠浓度5mg/mL)溶液 滴加入上述壳聚糖微球悬浮液中,反应0.5h后形成葡聚糖/壳聚糖载紫杉醇微球溶液(DEX/CS-PTX NPs)。
然后,在5mL 8mg/mL壳聚糖溶液中加入20mg的5-氟尿嘧啶,搅拌10min后加入到葡聚糖/壳聚糖载紫杉醇微球溶液中,磁力搅拌0.5h后,石油醚洗涤,3500rpm,10min离心三次得到粗产物,冷冻干燥后得到最终产物,产物命名为壳聚糖/葡聚糖/壳聚糖载紫杉醇/5-氟尿嘧啶双药微球。所得产品的平均粒径、电荷大小、载药率及包封率见下表1。
实施例6
称取0.12g壳聚糖溶于1%(v/v)醋酸溶液,搅拌溶解得到壳聚糖醋酸溶液。将吐温-80加入壳聚糖醋酸溶液中作为水相。取20mg紫杉醇溶于二氯甲烷中并加入壳聚糖醋酸溶液中搅拌30min形成水包油(O/W)乳剂1。将0.05mL戊二醛(25%)加入到液体石蜡中并滴入司盘80,搅拌30min形成油包水W/O乳剂II。乳剂I和乳剂II分别超声乳化3min后,两者混合搅拌40min后升温到40℃,交联固化2h。
将12mL葡聚糖浓度为6mg/mL的葡聚糖-氢氧化钠(氢氧化钠浓度5mg/mL)溶液滴加入上述壳聚糖微球悬浮液中,反应1h后形成葡聚糖/壳聚糖载紫杉醇微球溶液(DEX/CS-PTX NPs)。
然后,在5mL 8mg/mL壳聚糖溶液中加入10mg的5-氟尿嘧啶,搅拌10min后加入到葡聚糖/壳聚糖载紫杉醇微球溶液中,磁力搅拌3h后,石油醚洗涤,3500rpm,10min离心三次得到粗产物,冷冻干燥后得到最终产物,产物命名为壳聚糖/葡聚糖/壳聚糖载紫杉醇/5-氟尿嘧啶双药微球。所得产品的平均粒径、电荷大小、载药率及包封率见下表1。
对比实施例1:壳聚糖载紫杉醇微球自组装模板
采用双乳化交联法制备壳聚糖载药微球。称取0.12g壳聚糖溶于1%(v/v)醋酸溶液,搅拌溶解得到壳聚糖醋酸溶液。将吐温-80加入到壳聚糖醋酸溶液中作为水相。取50mg紫杉醇溶于二氯甲烷中并加入到壳聚糖醋酸溶液中搅拌30min形成水包油(O/W)乳剂I。将0.1mL的戊二醛(25%)加入到液体石蜡中并滴入司盘80,搅拌30min形成油包水W/O乳剂II。乳剂I和乳剂II分别超声乳化3min后,两者混合搅拌40min后升温到40℃,交联固化2h。所得粗产品离心分离,石油醚洗涤3~4次,-70℃冷冻干燥24h,即得黄色微球粉末。该产物命名为壳聚糖载紫杉醇微球(CS-PTX NPs)。所得产品的平均粒径、电荷大小、载药率及包封率见下表1。
对比实施例2:葡聚糖/壳聚糖载紫杉醇微球
称取0.12g壳聚糖溶于1%(v/v)醋酸溶液,搅拌溶解得到壳聚糖醋酸溶液。将吐温-80加入到壳聚糖醋酸溶液中作为水相。取50mg紫杉醇溶于二氯甲烷中并加入到壳聚糖醋酸溶液中搅拌30min形成水包油(O/W)乳剂I。将0.1mL的戊二醛(25%)加入到液体石蜡中并滴入司盘80,搅拌30min形成油包水W/O乳剂II。乳剂I和乳剂II分别超声乳化3min后,两者混合搅拌40min后升温到40℃,交联固化2h。所得粗产品离心分离,石油醚洗涤3~4次,-70℃冷冻干燥24h,即得黄色微球粉末。该产物命名为壳聚糖载紫杉醇微球(CS-PTX NPs)。将10mL葡聚糖浓度为6mg/mL的葡聚糖-氢氧化钠(氢氧化钠浓度5mg/mL)溶液滴加入上述壳聚糖微球悬浮液中,反应1h后停止搅拌。所得粗产品离心分离,石油醚洗涤3~4次,-70℃冷冻干燥24h。该产物命名为葡聚糖/壳聚糖载药微球(DEX/CS-PTX NPs)。所得产品的平均粒径、电荷大小、载药率及包封率见下表1。
对以上实施例1、对比实施例1和对比实施例2中的产品在不同pH环境下缓释性能及体外抗肿瘤细胞活性实验进行对比试验,具体如下:
称取相同质量的实施例1、对比实施例1和对比实施例2中的产品在不同pH环境下进行体外释放测试以及三种产品的体外抗肝癌细胞活性实验,结果如图1、图2所示。PTX表示药物紫杉醇,5-FU表示药物5-氟尿嘧啶通过图1和图2中的结果对比可以看出,本发明的实施例I的产品的药物释放过程具有pH响应,两种药物共同释放,可以延长药物释放时间。
表1
注:载药率1为紫杉醇药物的载药率,载药率2为药物5-氟尿嘧啶的载药率(同样适用于包封率)
上述仅对本发明中的几种具体实施例加以说明,但并不能作为本发明的保护范围,凡是依据本发明中的设计精神所作出的等效变化或修饰或等比例放大或缩小等,均应认为落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!