新型调节剂及使用方法与流程
交叉参考的专利申请
本专利申请根据35U.S.C.119(e)要求于2010年9月3日提交的系列号为No.61/380,181的美国临时专利申请的权益,将该专利申请以引用的方式全文并入本文。
技术领域
本申请案整体涉及组合物及其用于治疗或改善过度增殖障碍、它们的扩张、再发、复发或转移的方法。在一个广泛的方面,本发明涉及CD46调节剂(包括CD46拮抗剂和融合构建体)用于治疗或预防赘生性障碍的用途。在特别优选的实施例中,本发明提供抗CD46抗体用于对恶性肿瘤进行免疫治疗的用途,包括降低肿瘤起始细胞(tumor initiating cell)出现率。
背景技术:
干细胞和祖细胞分化及细胞增殖为一致发挥作用以支持器官发生期间的组织生长以及所有活生物体寿命期间大部分组织的细胞替换及修复的正常进程。分化和增殖决定通常受多种因素和信号控制,这些因素和信号达成平衡以维持细胞命运决定和组织架构。作为细胞对调节细胞分裂和组织成熟的微环境暗示作出响应的结果,正常组织架构得以维持。因此,细胞增殖和分化通常仅为替换受损或死亡细胞或为生长所需要而进行。遗憾的是,细胞增殖和/或分化的破坏可由多种因素引起,包括例如多种信号传导化学物质不足或过多、存在微环境改变、基因突变或它们的某种组合。当正常细胞增殖和/或分化受到扰乱或某种破坏时,其可引起多种疾病或障碍,包括癌症。
常规的癌症治疗包括化学疗法、放射疗法、手术、免疫疗法(例如生物响应修饰剂、疫苗或靶向治疗剂)或它们的组合。遗憾的是,太多癌症对这类常规治疗无响应或响应极小,从而留给患者极少的选择。例如,一些患者亚群表现出使他们无响应的基因突变(例如KRAS),尽管某些疗法具有普遍有效性。此外,取决于癌症的类型,一些可用的治疗(如手术)可能并非可行的备选方案。当试图护理先前已进行治疗而随后复发的患者时,当前的护理标准治疗剂所固有的局限性尤为明显。在这类情形中,失败的治疗方案和所导致的患者恶化可造成难治性肿瘤,其通常自身表现为更具侵袭性的疾病,最终证明不能治愈。尽管多年来癌症的诊断和治疗已有很大改进,但由于现有疗法无法预防复发、肿瘤再发和转移,许多实体瘤的总存活率仍基本保持不变。因此,开发更多靶向的且有效的疗法仍是一个挑战。
一个有前景的研究领域涉及使用靶向治疗剂来追逐似乎造成许多癌症的致瘤“种子”细胞。为此,现已知大部分实体组织含有组织固有的成人干细胞群体,其产生占该组织的大部分的分化细胞类型。在这些组织中产生的肿瘤类似地由也从干细胞产生、但其总体增殖和组织化明显不同的异源细胞群体组成。虽然日益认识到大多数肿瘤细胞具有有限的增殖能力,但少数癌细胞群体(通常称为癌症干细胞或CSc)具有专有的广泛自我更新能力,由此能使它们具有肿瘤重新起始能力。更具体地讲,癌症干细胞假说认为,每一肿瘤中存在独特的细胞子集(即CSC)(约0.1-10%),其能够无限自我更新并产生由于它们分化为肿瘤祖细胞且随后分化为最终分化的肿瘤细胞而复制能力逐渐受限的肿瘤细胞。
近年来,已变得更加明显的是,这些CSC(也称为肿瘤永续细胞(tumor perpetuating cell)或TPC)可能对传统的化学治疗剂或放射具有更大的抗性,因而在护理标准临床疗法后继续存在,随后刺激复发性肿瘤、继发性肿瘤和转移瘤的生长。此外,越来越多的证据表明,调节器官发生和/或正常组织固有干细胞自我更新的途径在CSC中失调或改变,从而导致自我更新癌细胞不断扩张和肿瘤形成。一般参见Al-Hajj等人,2004,PMID:15378087;和Dalerba等人,2007,PMID:17548814;将这些参考文献的每一者以引用的方式全文并入本文。因此,传统的以及较新的靶向治疗方法的有效性显然受抗性癌细胞的存在和/或出现所限制,这类抗性癌细胞即使面对这些各式各样的治疗方法仍能够延续癌症。Huff等人,European Journal of Cancer(《欧洲癌症杂志》)42:1293-1297(2006)以及Zhou等人,Nature Reviews Drug Discovery(《自然评论:药物发现》)8:806-823(2009),将这些参考文献每一者以引用的方式全文并入本文。这些观察结果由当患有实体肿瘤时传统减积剂(debulking agent)一直无法实质上提高患者存活率以及对肿瘤如何生长、复发和转移的了解逐渐深入得到证实。因此,治疗赘生性障碍的最新策略已认识到消除、消耗、沉默肿瘤永续细胞或促进其分化以降低肿瘤再发、转移或患者复发的可能性的重要性。
开发这类策略的努力已整合了涉及非传统异种移植(NTX)模型的最新工作,在所述模型中将原发性人实体肿瘤样本专门植入免疫功能降低的小鼠中并进行继代。这类技术证实存在具有产生异源肿瘤并无限刺激其生长的独特能力的细胞亚群。如先前所假设,在NTX模型中进行的工作已证实,所鉴别的肿瘤细胞CSC亚群表现出对诸如化学疗法和放射治疗的减积方案具有更大的抗性,这潜在地解释临床响应率与总存活率之间的不一致。此外,在CSC研究中使用NTX模型已引起了药物发现及候选药物临床前评价的根本变化,这个变化可产生对肿瘤再发和转移具有重大影响从而改善患者存活率的CSC靶向疗法。虽然已取得了进展,但与处理原发性和/或异种移植肿瘤组织相关的固有技术困难以及表征CSC特征及分化潜力的实验平台的缺乏构成重大的挑战。因此,仍十分需要选择性地靶向癌症干细胞并开发可用于治疗、预防和/或管理过度增殖障碍的诊断性、预防性或治疗性化合物或方法。
技术实现要素:
这些及其他目标由本发明提供,本发明在广泛意义上涉及可用于治疗CD46相关障碍(例如过度增殖障碍或赘生性障碍)的方法、化合物、组合物和制品。为此,本发明提供有效靶向癌症干细胞且可用于治疗患有各种恶性肿瘤的患者的新型CD46调节剂。在某些实施例中,所公开的CD46调节剂可包含任何识别CD46多肽、其配体或其基因、与它们竞争、对它们进行激动、拮抗、与它们相互作用、与它们结合或与它们缔合,并调节、调整、改动、改变或改善CD46蛋白对一个或多个生理学途径的影响的化合物。在本发明的所选的实施例中,CD46调节剂可包含CD46自身或其片段,所述CD46自身或其片段呈分离形式或与其他部分融合或缔合(例如Fc-CD46、PEG-CD46或与靶向部分缔合的CD46)。在其他所选的实施例中,CD46调节剂可包含CD46拮抗剂,出于本申请案的目的,CD46拮抗剂应视为意指任何识别CD46、与其竞争、与其相互作用、与其结合或与其缔合,并中和、消除、减少、敏化、重新程序化赘生性细胞(包括肿瘤起始细胞)、抑制或控制所述细胞生长的构建体或化合物。在优选的实施例中,本发明的CD46调节剂包含抗CD46抗体或其片段或衍生物,意外地发现其可沉默、中和、减少、降低、消耗、缓和、减弱、重新程序化、消除肿瘤起始细胞或者抑制其繁殖、维持、扩张、增殖赘生性细胞或以别的方式促进赘生性细胞存活、再发、再生和/或转移的能力。
在一个实施例中,CD46调节剂可包含人源化抗体,其中所述抗体包含SEQ ID NO:199中所示的重链可变区氨基酸序列和SEQ ID NO:201中所示的轻链可变区氨基酸序列。在其他优选的实施例中,本发明将为包含hSC1.N71抗体和可药用载体的组合物的形式。在另一个优选的实施例中,CD46调节剂可包含人源化抗体,其中所述抗体包含SEQ ID NO:203中所示的重链可变区氨基酸序列和SEQ ID NO:205中所示的轻链可变区氨基酸序列。在其他优选的实施例中,本发明将为包含hSC1.N149抗体和可药用载体的组合物的形式。
在某些其他实施例中,本发明将包含在施用给受试者后降低肿瘤起始细胞出现率的CD46调节剂。优选地,出现率的降低将使用体外或体内有限稀释分析来测定。在特别优选的实施例中,该分析可用体外有限稀释分析来进行,其包括将活人肿瘤细胞移植进免疫功能降低的小鼠中。或者,有限稀释分析可使用体外限制稀释分析来进行,其包括将活人肿瘤细胞限制稀释沉积于体外集落支持条件中。在任一种情况下,出现率降低的分析、计算或定量将优选包括使用泊松分布统计来提供精确计算。应当理解,虽然这类定量方法是优选的,但诸如流式细胞术或免疫组织化学之类的其他劳动密集度较小的方法也可用于提供所需的值,因此将它们明确地设想为处于本发明的范围内。在这类情况下,出现率的降低可使用流式细胞检测分析或对已知用于富集肿瘤起始细胞的肿瘤细胞表面标记物的免疫组织化学检测来测定。
因此,在本发明的另一个优选的实施例中,包含治疗CD46相关障碍的方法,该方法包括向有需要的受试者施用治疗有效量的CD46调节剂,由此降低肿瘤起始细胞的出现率。此外,肿瘤起始细胞出现率的降低将优选使用体外或体内有限稀释分析来测定。
就此而言,应当理解本发明至少部分基于如下发现:CD46多肽与涉及多种瘤形成(neoplasia)的病因的肿瘤永续细胞(即癌症干细胞)缔合。更具体地讲,本专利申请意外地证明,施用多种例示性CD46调节剂可减少、抑制或消除肿瘤起始细胞的致瘤信号传导(即降低肿瘤起始细胞出现率)。这种信号传导减少,无论是通过减少或消除或重新程序化或沉默肿瘤起始细胞还是通过修饰肿瘤细胞形态(例如,诱导的分化、小生境破坏)实现,均继而通过抑制致瘤、肿瘤维持、扩张和/或转移和再发而更有效地治疗CD46相关障碍。在其他实施例中,所公开的调节剂可干扰、抑制或以其他方式延缓CD46介导的可刺激肿瘤生长的信号传导。另外,如下文更详细论述的,CD46多肽密切涉及补体途径。使用本文所述的新型CD46调节剂干预该途径,可通过不止一种机制(即肿瘤起始细胞减少和补体破坏)进一步改善所述障碍以提供附加效应或协同增强效应。
因此,本发明的另一个优选的实施例包括治疗有需要的受试者中的CD46介导的障碍的方法,所述方法包括向该受试者施用CD46调节剂的步骤。在尤其优选的实施例中,CD46调节剂将与抗癌剂缔合(例如缀合)。此外,受试者肿瘤组织与正常的相邻组织相比较,无论是表现出CD46水平升高还是CD46水平降低或受到抑制,都可实现这种破坏和附带有益效果。
还应当理解,可以对本发明的CD46调节剂进行加工和选择以与CD46分子的单种同种型(isoform)或所选的一些同种型(即剪接变体)反应,或者相反,可包括泛CD46调节剂,所述泛CD46调节剂可与CD46同种型中的一些或全部反应或缔合。更具体地讲,如本文所公开的以及下面实例中所述的,可生成优选的调节剂如抗体并对其进行选择,使得它们可与单种剪接变体展现的结构域(例如,在特定的外显子接合点处)反应,或与多种或全部CD46同种型中保守的结构域(例如外显子1-6)反应。这对于本发明是重要的,因为如以下实例5中所示,某些剪接变体已被发现优选在TIC上表达,且可充当可提供致瘤细胞出现率的选择性降低和/或癌症干细胞群体的消耗的治疗标靶。
因此,在一个所选的实施例中,本发明包括泛CD46调节剂。在其他所选的实施例中,本发明包括可免疫特异性地与一种或多种剪接变体缔合的CD46调节剂。优选的是,所述剪接变体可选自CD46D、CD46F和CD46J。因此,在另外其他实施例中,本发明包括治疗有需要的受试者的方法,该方法包括施用治疗有效量的泛CD46调节剂。再其他的实施例包括治疗有需要的受试者的方法,该方法包括施用治疗有效量的可与一或多种剪接变体免疫特异性缔合的CD46调节剂。
本发明的其他方面利用到所公开的调节剂潜在破坏多个致癌存活途径而同时沉默肿瘤起始细胞的能力。这类多活性CD46调节剂(例如CD46拮抗剂)当与护理标准抗癌剂或减积剂组合使用时可证明尤其有效。另外,根据本发明教导,可组合使用两种或更多种CD46拮抗剂(例如特异性结合CD46上的两个分立表位的抗体)。此外,如下文相当详细论述的,本发明的CD46调节剂可在缀合或未缀合状态下且任选作为致敏剂与多种化学或生物学抗癌剂组合使用。
因此,本发明的另一优选的实施例包括敏化受试者的肿瘤以用抗癌剂进行治疗的方法,该方法包括向该受试者施用CD46调节剂的步骤。在本发明的一个特别优选的方面,CD46调节剂将特异性地引起肿瘤起始细胞出现率降低,如使用体外或体内有限稀释分析所测定的。
类似地,因为本发明的化合物可通过多种生理学机制发挥治疗有益效果,所以本发明还涉及所选的经特定加工以利用某些细胞过程的效应剂或调节剂。例如,在某些实施例中,可对优选的调节剂进行工程改造以与肿瘤起始细胞表面上或附近的CD46缔合并刺激受试者的免疫应答。在其它实施例中,调节剂可包含针对这样的表位的抗体,该表位可中和CD46活性并增加肿瘤微环境中可影响信号传导的CD46底物的浓度。在另外其他实施例中,所公开的调节剂可通过消耗或消除CD46相关细胞而起作用。因此,重要的是认识到,本发明并不限于任何特定作用模式,而是涵盖任何能实现所需结果的方法或CD46调节剂。
在该框架内,所公开的实施例的优选实施例是涉及治疗患有赘生性障碍的受试者的方法,该方法包括施用治疗有效量的至少一种中和性CD46调节剂的步骤。
其他实施例涉及治疗患有CD46相关障碍的受试者的方法,该方法包括施用治疗有效量的至少一种消耗性CD46调节剂的步骤。
在又另一个实施例中,本发明提供维持疗法的方法,其中在设计用于移除至少一部分肿瘤块的初始程序(例如化疗、放疗或手术)后施用所公开的效应剂一段时间。这类治疗方案可施用数周的时间、数月的时间或甚至数年的时间,其中CD46调节剂可预防性地起作用以抑制转移和/或肿瘤再发。在另外其他实施例中,所公开的调节剂可与已知的减积方案配合施用以预防或延缓转移。
除上述治疗性用途外,还应当理解本发明的调节剂可用于诊断CD46相关障碍,尤其是过度增殖障碍。因此,一个优选的实施例包括诊断有需要的受试者中的过度增殖障碍的方法,该方法包括如下步骤:
a.从所述受试者获得组织样品;
b.使该组织样品与至少一种CD46调节剂接触;以及
c.检测或定量与样品缔合的CD46调节剂。
结合本申请案可容易领悟这类方法,且容易使用诸如自动读板仪、专用报告系统等之类的一般可用的商业技术来进行这类方法。在其他优选的实施例中,该检测或定量步骤将包括肿瘤起始细胞出现率的降低以及对其的检测。此外,有限稀释分析可如先前上文所提及进行,且将优选使用泊松分布统计来提供关于出现率降低的精确计算。
类似地,本发明还提供可用于诊断和监测诸如癌症之类的CD46相关障碍的试剂盒。为此,本发明优选提供可用于诊断或治疗CD46相关障碍的制品,该制品包括含有CD46调节剂的容器和关于使用所述CD46调节剂治疗或诊断该CD46相关障碍的说明书。
本发明的其他优选的实施例也利用所公开的调节剂的性质,作为可用于通过诸如荧光激活细胞分选(FACS)或激光介导的分区(laser mediated sectioning)之类的方法对肿瘤起始细胞的群体或亚群进行鉴别、分离、分区或富集的手段。
因此,本发明的另一个优选的实施例涉及对肿瘤起始细胞群体进行鉴别、分离、分区或富集的方法,该方法包括使所述肿瘤起始细胞与CD46调节剂接触的步骤。
上文为概述,因此必然简化、概括和省略细节;因此,本领域技术人员应了解,该概述仅是示例性的而并非意图以任何方式限制。本文所述的方法、组合物和/或装置和/或其他主体的其他方面、特征和优点将在本文所述的教导中变得显而易见。提供该概述来以简化形式介绍下文在“具体实施方式”中进一步描述的一系列概念。该概述既无意于确定要求保护的主题的关键特征或基本特征,也无意于用于辅助判定要求保护的主题的范围。
附图说明
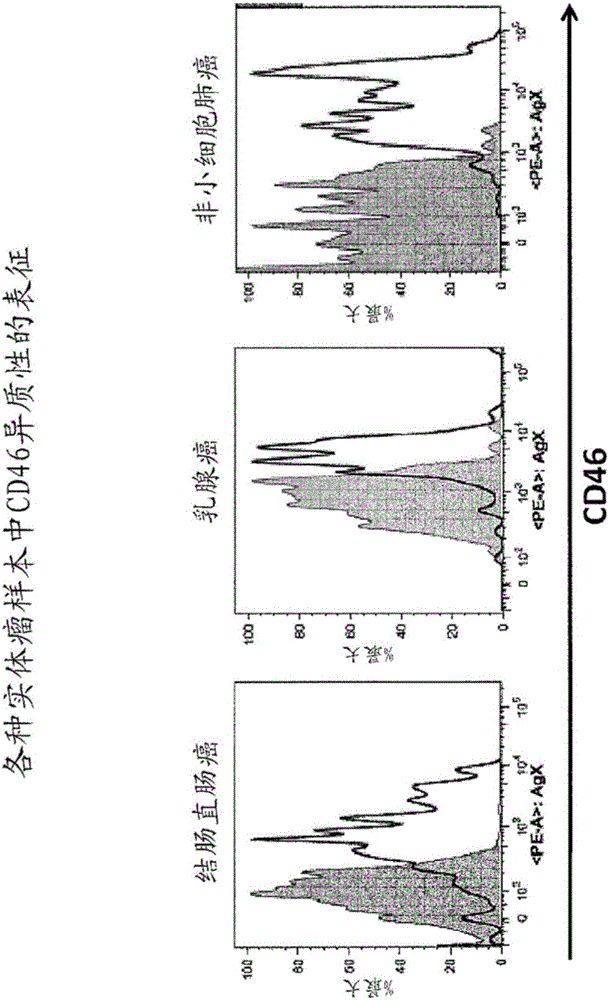
图1A和1B分别绘出了来自直肠结肠癌患者、乳腺癌患者或非小细胞肺癌患者的实体瘤样本上的CD46表达的流式细胞术数据(图1A)和来自结肠直肠癌细胞、胰腺癌细胞、乳腺癌细胞、非小细胞肺癌细胞、骨髓癌细胞、卵巢癌细胞和头颈部癌细胞的源于患者的非传统异种移植肿瘤样本上的CD46表达的流式细胞术数据(图1B)。
图2提供了散点图,示出了使用细胞表面标记CD46、上皮表面抗原(ESA)、CD66c和CD324对肿瘤起始细胞的流式细胞术富集;
图3A-C示出了流式细胞术和荧光激活细胞分选(FACS)数据,通过在非传统异种移植模型中进行系列继代证明了CD46hi细胞的肿瘤永续能力;
图4A-C图示了伊立替康对CD46hi肿瘤永续细胞在结肠直肠癌中的出现率的影响;
图5A-C示出了结肠直肠癌肿瘤永续细胞、肿瘤祖细胞和非致瘤细胞中的CD46剪接变体同种型表达;
图6示出了定量实时PCR数据,其说明了本体结肠直肠肿瘤细胞群体中的CD46外显子用法;
图7A-C是分别显示结肠直肠正常相邻细胞和肿瘤细胞中的CD46蛋白的表达(图7A)、神经内分泌亚型和非神经内分泌亚型的胰腺正常相邻细胞和肿瘤细胞中的CD46蛋白的表达(图7B)以及卵巢正常相邻细胞和肿瘤细胞中的CD46蛋白的表达(图7C);
图8A-C是示出了含有外显子10的CD46剪接变体分别在如下细胞中的表达的示意图:结肠直肠正常相邻细胞和肿瘤细胞(图8A)、神经内分泌亚型和非神经内分泌亚型的胰腺正常相邻细胞和肿瘤细胞(图8B)以及卵巢正常相邻细胞和肿瘤细胞(图8C);
图9A和9B示意图说明了CD46抗体内化进K562细胞中(图9A)并通过能够内化与皂草素毒素缀合的抗小鼠二抗的小鼠单克隆抗CD46抗体杀灭K562细胞(图9B);
图10A-R提供了十八种分立的抗CD46抗体的重链和轻链可变区的核酸和氨基酸序列,所述抗CD46抗体如本文实例中所描述进行分离和克隆;
图11A和11B是表格形式的图示,分别示出了如本文实例中描述分离和克隆的十八种分立CD46调节剂的遗传排列方式及如Chothia等人定义的重链和轻链CDR序列;
图12A和12B图示了ELISA数据,显示了抗CD46抗体SC1.N122和SC1.N29与CD46的各区域的结合(图12A)以及抗CD46抗体SC1.N29与各CD46外显子的结合(图12B);
图13A和13B分别示出了hSC1.N71的重链可变区的核酸和氨基酸序列(SEQ ID NO:198和SEQ ID NO:199)和轻链可变区的核酸和氨基酸序列(SEQ ID NO:200和SEQ ID NO:201)(图13A)以及hSC1.N149的重链可变区的核酸和氨基酸序列(SEQ ID NO:202和SEQ ID NO:203)和轻链可变区的核酸和氨基酸序列(SEQ ID NO:204和SEQ ID NO:205),其中如Kabat等人定义的CDR序列标有下划线;
图14以表格形式提供了十二种分立CD46调节剂的免疫化学特性;
图15A-15C示出了鼠抗体SC1.N71(图15A)和人源化抗体衍生物hSC1.N71(图15B)对四个不同浓度的抗原的亲和力测量结果,并提供了表格形式的总结,包括测量值(图15C);
图16A和16B分别示出了使用所公开的调节剂产生的标准曲线和在从健康受试者和患有各种瘤形成的患者获得的样品中测量并从标准曲线外推得到的可溶性CD46的血浆浓度;
图17是描绘所公开的CD46调节剂充当靶向剂的能力的图示,其通过使用与皂草素缀合的链霉亲和素介导细胞死亡。
图18A和18B示出了所公开的CD46调节剂与细胞表面上表达的CD46缔合的能力(图18A)以及介导CD46hi细胞的细胞死亡的能力,同时慢病毒诱导的CD46-/lo相对免疫(图18B);
图19A和19B显示本发明的CD46调节剂可介导链霉亲和素-ZAP缀合物的受体依赖的摄入和内化,其中在不存在调节剂时观察到相对低的杀灭(图19A),并且显示所公开的调节剂有效介导在不同肿瘤类型中的杀灭(图19B);以及
图20A和20B示出了CD46调节剂使癌症干细胞化学致敏的能力,其中图20A示出了所公开的调节剂与对照相比的效果,图20B证明与单独的化学疗法相比CD46调节剂可延缓肿瘤再发以及延长无进展生存期。
具体实施方式
I.引言
在广泛意义上,本发明的实施例涉及新型CD46调节剂及其在治疗、管理、改善过度增殖障碍(包括癌症)或预防过度增殖障碍(包括癌症)的发生中的用途。不希望受任何特定理论的束缚,已发现所公开的调节剂可有效减少或延缓肿瘤生长以及消除或中和致瘤细胞以及改变这类细胞对抗癌剂的敏感性。另外,还令人惊奇地发现,所选的肿瘤永续细胞(TPC)与称为CD46的蛋白质之间还存在迄今未知的表型关联。就这一点而言,已经发现,当与正常组织比较时以及当与一起构成实体瘤的大部分的肿瘤祖细胞(TProg)和非致瘤(NTG)细胞比较时,所选的TPC(即癌症干细胞或CSc)可表达升高水平的CD46,包括特异性剪接变体。因而,在所选的实施例中,CD46包含肿瘤相关标记物(或抗原)且已发现可提供这样的物质,该物质能有效用于检测、敏化和/或抑制TPC以及由与所选的细胞的表面相关的或肿瘤微环境中的该蛋白质水平升高所引起的相关瘤形成。更具体地讲,甚至更出人意料地,鉴于CD46被明显分泌(至少在一定程度上),已进一步发现CD46调节剂(包括Fc-CD46构建体和免疫反应性拮抗剂(如该蛋白质的抗体))可用于在患者中消耗、敏化、消除、减少、重新程序化这些肿瘤永续细胞、促进其分化或以别的方式阻止或限制其扩散和/或继续刺激肿瘤生长或再发的能力。
在优选的实施例中,本发明的CD46调节剂将包含核苷酸、寡核苷酸、多核苷酸、肽或多肽。如上文提及和下文更详细论述的,本文公开的所选的实施例将包含CD46的缀合或非缀合形式的抗体。CD46调节剂的其他实施例将优选包含CD46或其形式、变体、衍生物或片段,包括例如CD46融合构建体(如CD46-Fc、CD46-靶向部分等)或CD46-缀合物(如CD46-PEG、CD46-细胞毒性剂等)。在另外其他实施例中,调节剂可在遗传水平上起作用且可包含如反义构建体、siRNA、miRNA等之类的化合物。上述CD46调节剂可通过竞争机理、激动或拮抗所选的途径或者消除或消耗特定细胞(包括非TPC支持细胞)来削弱肿瘤永续细胞的生长、增殖或存活和/或相关瘤形成,这例如取决于CD46的形式或者给药形式(dosing)及递送方法。
根据这些发现,本领域的技术人员将理解,本发明特别优选的实施例很大程度上涉及CD46调节剂及它们在降低肿瘤起始细胞出现率中的用途。如本文中将充分论述的,与本发明相容的CD46调节剂广泛包括任何与CD46缔合、结合、复合或以别的方式反应或竞争且任选地导致肿瘤永续细胞出现率降低的化合物。本文所公开的例示性调节剂包含核苷酸、寡核苷酸、多核苷酸、肽或多肽。在某些优选的实施例中,所选的调节剂将包含CD46的抗体或其免疫反应性片段或衍生物。这种抗体可以是本质上是拮抗性的或激动性的。在其他优选的实施例中,与本发明相容的效应剂将包含CD46构建体,该构建体包含CD46本身或其反应性片段。应了解,这类CD46构建体可包含融合蛋白且可包括来自其他多肽(例如免疫球蛋白、钉肽(stapled peptide)或生物应答修饰剂)的反应性结构域。在另外其他的优选方面,CD46效应剂或调节剂将包含在基因组水平上发挥所需效应的核酸组件。与本发明教导相容的另外其他调节剂将在下文详细论述。
在一个相关方面,下文的论述是关于CD46调节剂、CD46拮抗剂和抗CD46抗体。虽然下文提供每个术语的更详细定义,但应当理解,这些术语对于本公开的目的在很大程度上是可互换的,而不应当狭义地解释,除非上下文中指明。例如,如果对CD46拮抗剂表达一种看法,则其也适用于本发明的那些恰巧是拮抗性的抗体。相似地,术语CD46调节剂明确包括所公开的CD46拮抗剂和抗CD46抗体,且对后者的提及也适用于调节剂,除非上下文排除这个适用。
II.CD46
CD46也称为膜辅因子蛋白或MCP。它是广泛表达的I型跨膜蛋白,但由于选择性外显子剪接和糖基化而具有多种同种型。最近Karosi等人,Laryngoscope(《喉镜》)118:1669-1676(2008年9月)报道检测了该分子的十四种同种型,将该文献以引用的方式全文并入本文。从位于染色体1q32的单个基因转录出mRNA并经历广泛的选择性剪接而产生编码多种蛋白质同种型的多个转录物。构成该基因的14个外显子中,看起来外显子1-6是所有CD46蛋白同种型中保守的,而外显子7至9编码以不同程度被利用的富含丝氨酸-苏氨酸-脯氨酸(“STP”)的区域,从而引起这些蛋白质同种型中的主要超可变性。外显子11和12编码CD46的跨膜区,而外显子13和14编码该蛋白质的胞质内尾部。最长的mRNA转录物即变体A(NM_002389)含有来自该基因全部十四个外显子的序列。据信外显子7、8、9和13的可变剪接产生CD46的十四种同种型中的大多数,其中主要观察到的66和56kDa的蛋白质同种型因选择性包括或不包括外显子8而形成。选择性地包括/不包括外显子13可导致该分子的胞质内尾部的编码序列的改变,这提示这些改变会影响该蛋白质的亚细胞运输、稳定性以及信号传导性质。
如Karosi等人中所述,CD46mRNA同种型D包含CD46基因的外显子1-6、8-12和14(等同于序列NM_153826,其编码蛋白质NP_722548),同种型F包含外显子1-6、9-12和14(等同于序列NM_172353,其编码NP_758863),同种型J包含外显子1-6、8、10-12和14(等同于序列NM_172356,其编码NP_758866)。更具体地讲,CD46分子包含四个N末端短共有重复序列(SCR)模块(“Sushi”结构域:4个半胱氨酸,呈1-3,2-4键拓扑结构),其中这些SCR结构域由该基因的前六个外显子编码。SCR2、3和4模块具有C3b/C4b结合和调节活性(下文中论述),而SCR1模块和SCR4末端序列对于补体调节功能不是必需的。由选择性利用的外显子7-9以及外显子10编码的近膜的细胞外序列被大量糖基化,主要通过O-连接碳水化合物糖基化。
为了本公开的目的,术语“CD46”应视为意指上文刚说明的任何蛋白质,包括任何剪接变体或其免疫反应性片段以及任何编码这类蛋白质、剪接变体或片段的核酸序列,除非上下文另外指出。因而,如本文中所论述的,“CD46标记物”应广泛地包括任何构成或编码CD46的可检测的蛋白质、肽或核酸序列。在优选的实施例中,CD46标记物将包含全长糖蛋白(变体a)或其剪接变体或免疫反应性片段。甚至更优选地,CD46蛋白标记物将存在于所选的致瘤细胞群体的细胞表面。在其他优选的实施例中,CD46标记物将包含编码全长CD46、其剪接变体或片段的核酸序列(如DNA或mRNa)。
就上述变体而言,还应当理解,可以对本发明的CD46调节剂进行加工和选择以与CD46分子的单种同种型(即剪接变体)或所选的一些同种型反应,或者相反,可包括泛CD46调节剂,所述泛CD46调节剂可与CD46同种型中的一些或全部反应或缔合。更具体地讲,如本文所公开的以及下面实例中所述的,可生成所公开的调节剂如抗体并对其进行选择,使得它们与单种剪接变体展现的结构域(例如,在特定的外显子接合点处)反应或与多种或全部CD46同种型中保守的结构域(例如外显子1-6)反应。这对于本发明是重要的,因为如以下实例5中所示,某些剪接变体已被发现优选在TIC上表达,且可充当可提供致瘤细胞出现率的选择性降低和/或癌症干细胞群体的消耗的治疗标靶。
在任何情况下,已将多种生物学功能归因于CD46,其中许多涉及免疫系统的调节。CD46的一个主要免疫调节功能涉及调节补体以保护宿主细胞免受作为高等真核生物先天性免疫应答的一部分的补体蛋白的损害。具体地讲,CD46是因子I所介导的补体蛋白C3b和C4b的蛋白水解切割的辅因子。已证实其可活化C3转化酶(将C3b切割成无活性片段的分子),从而防止不当的补体活化。除了其在先天性免疫中的作用外,CD46还调节获得性免疫应答。通过CD46进行的信号传导会引起T细胞的增殖,以及向特定类别的调节性T细胞(称为Tr1)的分化,以产生大量的IL-10(一种抗炎细胞因子)为特征。此外,由于精子表达高水平的CD46,已提出CD46参与繁殖,也许是参与精子与卵母细胞的融合。CD46还似乎在胎盘中高度表达,且可起到保护胎儿免受母体的免疫排斥的作用。
还进一步证实CD46在大多数正常人细胞上遍在表达,红细胞例外。例如,有报道称在上皮细胞中强表达,在淋巴细胞和内皮细胞中适度表达,在其他细胞如破骨细胞、骨细胞、间质细胞和肌肉细胞中弱表达。由于其普遍表达,多种人病原体已进化出策略来利用CD46作为受体或共受体用于与细胞结合作为感染的前体。这些病原体包括人疱疹病毒6、麻疹病毒、腺病毒的一些血清型和来自奈瑟氏菌属(Neisseria)家族的共生菌的致病种。某些逆转录病毒据信可通过在其表面上带有CD46模拟物来规避补体介导的免疫(Stoiber等人,Molecular Immunology(《分子免疫学》)2005;Saifuddin等人,J Gen Virol(《普通病毒学杂志》),1997)。
还已将CD46与多种疾病相关联,包括自体免疫障碍如多发性硬化症(MS)。MS是一种慢性炎性疾病,其中自体免疫应答攻击隔离神经元轴突的髓鞘蛋白,导致髓鞘脱失和随后这些细胞传导受损,结果是神经紊乱和缺陷。MS会导致脑和脊髓的白质的结疤(硬化)。它是一种复杂的疾病,病因错综复杂,由免疫、遗传和环境因素构成,尽管已探索了数种机理,但对MS发病机制的理解还远未完成。由于CD46在调节T细胞免疫和炎症中的作用,因此据信其参与MS发病机制。更具体地讲,最近的数据已证实,CD46在多发性硬化症中欠缺或受损,在这些患者中IL-10的产生受到严重削弱。这个L-10的产生的缺少可能参与在多发性硬化症患者中观察到的炎症(A.L.Astier,Immunology(《免疫学》),2008年6月;124(2):149–154,将其以引用的方式并入本文)。在一些情形中,有可能是自身反应性抗CD46抗体在损害该分子的正常功能。在这些抗体充当调节剂(如本发明描述的那些调节剂)的意义上,它们在本发明的范围内并因此可以使用。
CD46除了存在于正常细胞上以外,其在某些癌症中的表达水平可能升高。例如,已报道在如下癌症中CD46表达升高:乳腺癌(Thorsteinsson等人,APMIS 106:869-78(1998);Hofman等人,Breast Cancer Res.Treat.(《乳腺的研究和治疗》)32:213-9(1994));结肠/结肠直肠癌(Andrew等人,Cancer Res.(《癌症研究》)50:5225-30(1990);Koretz等人,Br.J.Cancer(《英国癌症杂志》)68:926-31(1993);Juhl等人,J.Surg.Oncol.(《外科肿瘤学杂志》)64:222-30(1997);Bjorge等人,Cancer Immunol.Immunother.(《癌症免疫学及免疫疗法》)42:185-92(1996));肺癌(Varsano等人,Clin.Exp.Immunol.(《临床和实验免疫学》)113:173-82(1998);Varsano等人,Am.J.Respir.Cell.Mol.Bioi.(《美国呼吸系统细胞和分子生物学杂志》)19:522-9(1998));卵巢癌(Bjorge等人,Int.J.Cancer(《国际癌症杂志》)70:14-25(1997));肾癌(Blok等人,Lab.Invest.(《实验室研究》)80:335-44(2000);Gorter等人,Lab.Invest.(《实验室研究》)74:1039-49(1996));胰腺癌(Juhl等人,J.Surg.Oncol.(《外科肿瘤学杂志》)64:222-30(1997));和前列腺癌(Jarvis等人,J.Allergy Clin.Immunol(《过敏症与临床免疫学杂志》)99(NO.I,PART 2):S215(1997);Liu,Cancer Res.(《癌症研究》)60:3429-3434(2000));还可参见PCT WO 02/18948;PCT WO 01/88537。
自从对该蛋白首次描述时,就已生产了CD46的多种抗体。这些抗体包括:E4.3(CD46-SCR1),Sparrow等人,Hum Immunol(《人类免疫学》)1983 7:1;M177(CD46-SCR2),Seya等人,J Immunol(《免疫学杂志》)1990 145:238;J4/48(CD46-SCR1),Pesando等人,J Immunol(《免疫学杂志》)1986 137:3689;GB24(CD46-SCR3/4),Hsi等人,Am J Reprod Immunol Microbiol(《美国生殖免疫学和微生物学杂志》)1988 18:21;H316(CD46-SCR1),Stern等人,J Immunol(《免疫学杂志》)1986 137:1604;MH61(CD46-SCR3),Okabe等人,Fertil Steril(《生育与不育》)1990 54:1121;TRA-2-10(CD46-SCR1),Cho等人,Clin Exp Immunol(《临床和实验免疫学》)1991 83:257;MCI20.6(CD46-SCR1),Naniche等人,J Virol(《病毒学杂志》)1993 67:6025;158.2A5,Vilella等人;197.2B1,Vilella等人;和MPA7,美国专利No.7,744,878,将上述参考文献每一者以引用方式并入本文。一般参见Loveland等人,Prot Rev,网址为:http://prow.nci.nih.gov/guide/2027814670_g.htm。对于上述列表中的许多抗体,提供了反应性短共同重复结构域(SCR)。
III.肿瘤起始细胞
与现有技术的任何教导形成对比的是,本发明提供尤其可用于靶向肿瘤起始细胞以及特别是肿瘤永续细胞,从而有利于治疗、管理或预防赘生性障碍的CD46调节剂。更具体而言,如先前所指出,已意外地发现,特定肿瘤细胞亚群表达CD46且很可能修改对癌症干细胞自我更新及细胞存活很重要的形态发生素信号传导的局部协调(localized coordination)。因此,在优选的实施例中,根据本发明的教导CD46的调节剂可用于降低肿瘤起始细胞出现率,从而有利于治疗或管理过度增殖性疾病。
如本文中所使用,术语肿瘤起始细胞(TIC)涵盖肿瘤永续细胞(TPC;即癌症干细胞或CSC)与高度增殖性肿瘤祖细胞(称为TProg)二者,其通常一起构成本体肿瘤或肿块的独特亚群(即0.1-40%)。出于本发明的目的,术语肿瘤永续细胞和癌症干细胞是等同的且可在本文中互换使用。另一方面,TPC与TProg不同,因为其可完全重演存在于肿瘤内的肿瘤细胞的组成,且如通过连续移植(经由小鼠继代两次或两次以上)低数目的分离细胞所证实的,具有无限制自我更新能力。如下文将更详细论述的,使用适当细胞表面标记物的荧光活化细胞分选(FACS)为一种分离高度富集细胞亚群(>99.5%纯度)的可靠方法,其至少部分归因于其区分单细胞与细胞团(即成对细胞等)的能力。使用这类技术已证实,当将低细胞数目的高度纯化TProg细胞移植进免疫功能降低小鼠中时,其可刺激初次移植物中肿瘤生长。然而,不同于经纯化的TPC亚群,TProg产生的肿瘤并不完全反映亲本肿瘤的表型细胞异质性且在重新起始后续移植物中的连续致瘤方面明确无效。相比的下,TPC亚群完全重构亲本肿瘤的细胞异质性且当连续分离和移植时可有效起始肿瘤。因此,本领域技术人员会认识到,尽管TPC与TProg二者均可在初次移植物中产生肿瘤,但二者之间的明确差异在于TPC具有在以低细胞数目连续移植后持久刺激异源肿瘤生长的独特能力。表征TPC的其他常见方法涉及形态、细胞表面标记物的检查、转录谱和药物反应,不过标记物表达可随培养条件和体外细胞系继代而变。
因此,出于本发明的目的,像支持正常组织中的细胞层次的正常干细胞一样,肿瘤永续细胞优选由其无限自我更新而同时维持多谱系分化潜能的能力来限定。因此,肿瘤永续细胞能够产生致瘤子代(即肿瘤起始细胞:TPC和TProg)和非致瘤(NGT)子代二者。如本文所使用,非致瘤细胞(NGT)是指由肿瘤起始细胞产生、但自身不能自我更新或产生构成肿瘤的肿瘤细胞异质谱系的肿瘤细胞。在实验上,NTG细胞不能在小鼠中可再现地形成肿瘤,即使是在以过量细胞数目移植时也不能。
如所指出,TProg由于其有限的在小鼠中产生肿瘤的能力而被归类为肿瘤起始细胞(或TIc)。TProg为TPC的子代且通常能够进行有限次数的非自我更新细胞分裂。此外,TProg细胞可进一步分裂成早期肿瘤祖细胞(ETP)和晚期肿瘤祖细胞(LTP),其每一者均可由表型(例如细胞表面标记物)和重演肿瘤细胞架构的不同能力来区分。尽管存在这类技术性差异,但ETP和LTP二者在功能上也与TPC不同,因为它们当以低细胞数目移植时其一般不太能够连续重构肿瘤,且它们通常不反映亲本肿瘤的异质性。虽然存在上述区别,但也已证实各种TProg群体在极少数情况下可获得通常归于干细胞的自我更新能力且自身变成TPC(或CSC)。在任何情况下,两种类型的肿瘤起始细胞均很可能在单个患者的典型肿瘤块中呈现,且用如本文所公开的调节剂进行治疗。也就是说,不管在肿瘤中所呈现的特定实施例或混合体(mix)如何,所公开的组合物一般可有效降低这类CD46阳性肿瘤起始细胞的出现率或改变其化学敏感性。
在本发明的上下文中,与构成肿瘤本体的TProg(ETP和LTP二者)、NTG细胞和浸润肿瘤的非TPC来源细胞(例如成纤维细胞/基质细胞、内皮细胞和造血细胞)相比,TPC更具致瘤性,相对更静止且通常更具化学抗性。鉴于常规疗法和方案在很大程度上已被设计成既使肿瘤减积又攻击快速增殖的细胞,TPC很可能比增殖较快的TProg和其他本体肿瘤细胞群体对常规疗法和方案更具抗性。此外,TPC常常表达使其对常规疗法具有相对化学抗性的其他特征,例如多重抗药性转运蛋白的表达增加、DNA修复机制增强和抗凋亡蛋白增强。这些性质(每一者均有助于TPC的耐药性)构成标准肿瘤学治疗方案无法确保大部分晚期瘤形成患者长期受益的关键原因;即无法充分地靶向以及去除那些刺激持续肿瘤生长和再发的细胞(即TPC或CSc)。
不同于许多上述现有技术的治疗方案,不管所选的调节剂的形式或特异性标靶(例如遗传物质、CD46或CD46配体)如何,本发明的新型组合物优选在施用给受试者后都降低肿瘤起始细胞的出现率。如上文所述,肿瘤起始细胞出现率的降低可因如下原因而发生:a)消除、消耗、敏化、沉默或抑制肿瘤起始细胞;b)控制肿瘤起始细胞的生长、扩张或再发;c)中断肿瘤起始细胞的起始、繁殖、维持或增殖;或d)以其他方式阻碍致瘤细胞的存活、再生和/或转移。在一些实施例中,肿瘤起始细胞出现率的降低因一个或多个生理学途径的变化而发生。途径的变化,无论是通过减少或消除肿瘤起始细胞还是通过修改其潜力(例如诱导的分化、小生境破坏)或以其他方式干扰其对肿瘤环境或其他细胞发挥影响的能力来实现的,均继而使得可以通过抑制致瘤、肿瘤维持和/或转移和再发而更有效地治疗CD46相关障碍。
可用于评估这种肿瘤起始细胞出现率降低的方法包括体外或体内有限稀释分析,优选随后使用泊松分布统计进行计算,或评估预定的明确事件(例如能否在体内产生肿瘤)的出现率。虽然这种有限稀释分析是计算肿瘤起始细胞出现率降低的优选方法,但其他要求较低的方法尽管精确度略小也可用于有效测定所需值,且完全与本文教导相符。因此,如本领域技术人员将理解的,通过熟知的流式细胞计数手段或免疫组织化学手段测定出现率值的降低也是可能的。对于所有上述方法,参见例如Dylla等人,2008,PMCID:PMC2413402&Hoey等人,2009,PMID:19664991;将上述参考文献每一者以引用方式全文并入本文。
关于有限稀释分析,肿瘤起始细胞出现率的体外计算可通过将分级分离或未分级分离的人肿瘤细胞(例如分别来自经处理和未经处理的肿瘤)沉积进能促进集落形成的体外生长条件中来完成。以此方式,集落形成细胞可通过对集落进行简单计数和表征来计算,或通过由例如将人类肿瘤细胞的连续稀释物沉积于板中并在平板接种后至少10天评定各孔是集落形成阳性还是阴性所组成的分析来计算。体内有限稀释实验或分析(一般而言其测定肿瘤起始细胞出现率的能力更精确)涵盖例如将来自未经处理的对照或经处理的条件的人肿瘤细胞的连续稀释物移植于免疫功能降低小鼠中,随后在移植后至少60天评定各小鼠是肿瘤形成阳性还是阴性。通过体外或体内有限稀释分析推导细胞出现率值,优选是通过将泊松分布统计应用于阳性和阴性事件的已知出现率,从而得出满足阳性事件(在这个情况下分别为集落或肿瘤形成)定义的事件的出现率来进行。
关于与本发明相容的可用于计算肿瘤起始细胞出现率的其他方法,最常见方法包括可定量流式细胞计数技术和免疫组织化学染色程序。尽管不如上文刚刚描述的有限稀释分析技术精确,但这些程序的劳动密集度小得多且可在相对短的时间范围内提供合理的值。因此,应当理解,技术人员可使用利用一或多种抗体或试剂的流式细胞术细胞表面标记物谱测定,从而测量多种样品的TIC水平,所述抗体或试剂可结合本领域公认的已知用于富集肿瘤起始细胞的细胞表面蛋白(例如下文实例1中所述的潜在相容的标记物)。在又一个相容的方法中,本领域技术人员可通过免疫组织化学计算原位(例如组织切片中)TIC出现率,其中所述免疫组织化学使用一种或多种能够结合据信可区分这些细胞的细胞表面蛋白的抗体或试剂。
使用任一上文提及的方法于是有可能对根据本文教导由所公开的CD46调节剂提供的TIC(或其中的TPC)出现率的降低进行定量。在一些情况下,本发明的化合物可使TIC出现率降低(通过上文所述的多种机制,包括消除、诱导的分化、小生境破坏、沉默等)10%、15%、20%、25%、30%或甚至35%。在其他实施例中,TIC出现率的降低可为约40%、45%、50%、55%、60%或65%。在某些实施例中,所公开的化合物可使TIC的出现率降低70%、75%、80%、85%、90%或甚至95%。当然,应当理解TIC出现率的任何降低很可能会导致瘤形成(neoplasia)的致瘤性、持续性、再发性和侵袭性相应降低。
IV.CD46调节剂
在任何情况下,本发明涉及CD46调节剂(包括CD46拮抗剂)用于诊断、治疗和/或预防多种CD46相关恶性肿瘤中的任一者的用途。所公开的调节剂可单独使用或与多种抗癌化合物(例如化学治疗剂或免疫治疗剂或生物响应修饰剂)结合使用。在其他所选的实施例中,可将两种或更多种分立的CD46调节剂组合使用以提供增强的抗赘生性作用或可用于制造多特异性构建体。
在某些实施例中,本发明的CD46调节剂将包含核苷酸、寡核苷酸、多核苷酸、肽或多肽。甚至更优选地,调节剂将包含可溶性CD46(sCD46)或其形式、变体、衍生物或片段,包括例如CD46融合构建体(如CD46-Fc、CD46靶向部分等)或CD46-缀合物(如CD46-PEG、CD46-细胞毒性剂、CD46-brm等)。还应当理解,在其他实施例中,CD46调节剂包含抗体(如抗CD46单克隆抗体)或其免疫反应性片段或衍生物。在尤其优选的实施例中,本发明的调节剂将包含中和抗体或其衍生物或片段。在其他实施例中,CD46调节剂可包含内化抗体。在另外其他实施例中,CD46调节剂可包含消耗性抗体。此外,与上述融合构建体一样,这些抗体调节剂可与所选的细胞毒性剂、聚合物、生物响应修饰剂(BRM)或其类似物缀合、键联或以其他方式缔合以,提供具有各种(以及任选多种)作用机制的定向免疫疗法。在另外其他实施例中,调节剂可在遗传水平上起作用且可包含如反义构建体、siRNA、微RNA等诸如此类的化合物。
还应当理解,所公开的CD46调节剂可通过多种机制消耗或消除或抑制肿瘤细胞(尤其是TPC)的生长、繁殖或存活和/或相关瘤形成,包括激动或拮抗所选的途径或消除特定细胞,这取决于例如CD46调节剂的形式、任何相关的有效负载或剂量和递送方法。因此,虽然本文所公开的优选的实施例涉及消耗、抑制或沉默特定肿瘤细胞亚群(例如肿瘤永续细胞),但必须强调这类实施例仅为示例性的而不在任何意义上具有限制性。相反,如随附权利要求书中所述的,本发明广义地涉及CD46调节剂及其用于治疗、管理或预防多种CD46介导的过度增殖性障碍的用途,不管任何具体机制或靶标肿瘤细胞群体。
在相同意义上,本发明所公开的实施例可包含一种或多种CD46拮抗剂。为此,应当理解,本发明的CD46拮抗剂可包含能识别CD46蛋白或其片段、与它们反应、与它们结合、与它们组合、与它们竞争、与它们缔合或以其他方式与它们相互作用,且消除、沉默、减少肿瘤起始细胞或其他赘生性细胞(包括本体肿瘤或NTG细胞)、抑制、阻碍、制止或控制它们的生长的任何配体、多肽、肽、融合蛋白、抗体或其免疫活性片段或衍生物。在所选的实施例中,CD46调节剂包含CD46拮抗剂。
如本文中所使用的,拮抗剂是指这样的分子,其能够中和、阻断、抑制、去除、降低或干扰特定或指定蛋白质的活性,包括受体与配体的结合或酶与底物的相互作用。更一般而言,本发明的拮抗剂可包含抗体及其抗原结合片段或衍生物、蛋白质、肽、糖蛋白、糖肽、糖脂、多糖、寡糖、核酸、反义构建体、siRNA、miRNA、生物有机分子、肽模拟物、药剂以及它们的代谢物、转录和翻译控制序列等等。拮抗剂也可包括小分子抑制剂、融合蛋白、受体分子及衍生物(它们特异性结合至蛋白质,从而隔离其与其底物标靶的结合)、蛋白质的拮抗性变体、针对蛋白质的反义分子、RNA适体以及针对蛋白质的核糖酶。
在本文所用且应用于两个或更多个分子或化合物的术语“识别”或“特异性识别”应认为意指分子的共价或非共价反应、结合、特异性结合、组合、缔合、相互作用、连接、键联、联合、聚结、合并或接合,从而一个分子对另一个分子施加影响。
此外,如本文实例中所证明的,人CD46的一些调节剂可在某些情况下与来自非人物种(如鼠类)的CD46发生交叉反应。在其他情况下,例示性的调节剂可对人CD46的一种或多种同种型具有特异性且不会表现出与来自其他物种的CD46直向同源物的交叉反应性。
在任何情况下,本领域的技术人员将理解,所公开的调节剂可以缀合或未缀合的形式使用。也就是说,调节剂可与药物活性化合物、生物响应修饰剂、细胞毒性剂或细胞生长抑制剂、诊断部分或生物相容修饰剂缔合或与它们缀合(例如以共价或非共价形式)。就此而言,应当理解这类缀合物可包含肽、多肽、蛋白质、融合蛋白、核酸分子、小分子、模拟剂、合成药物、无机分子、有机分子和放射性同位素。此外,如上文所指出的,所选的缀合物可以各种摩尔比共价或非共价键联至CD46调节剂,这至少部分取决于用来实现缀合的方法。
V.抗体
a.概述
如先前所提及的,本发明的尤其优选的实施例包括抗体形式的CD46调节剂。本文中的术语“抗体”以最广泛意义使用且具体涵盖合成抗体、单克隆抗体、寡克隆或多克隆抗体(polyclonal antibody)、多克隆抗体(multiclonal antibody)、重组产生的抗体、胞内抗体、多特异性抗体、双特异性抗体、单价抗体、多价抗体、人抗体、人源化抗体、嵌合抗体、灵长源化抗体、Fab片段、F(ab')片段、单链FvFc(scFvFc)、单链Fv(scFv)、抗独特型(抗-Id)抗体和任何其他免疫活性抗体片段,只要它们表现出所需生物活性(即CD46缔合或结合)即可。在更广泛意义上,本发明的抗体包括免疫球蛋白分子和免疫球蛋白分子的免疫活性片段,即含有抗原结合位点的分子,其中这些片段可与或不与另一免疫球蛋白结构域(包括但不限于Fc区或其片段)融合。此外,如本文更详细地叙述的,术语“抗体”具体包括如下文所述的Fc变体,包括全长抗体和包含Fc区的变体Fc融合物或其片段,任选包含至少一个氨基酸残基修饰且与免疫球蛋白的免疫活性片段融合。
如下文将更详细论述的,通用术语“抗体”或“免疫球蛋白”包含五种不同类别的抗体,它们可以生物化学方法进行区分,且根据它们的重链恒定域的氨基酸序列可容易归类为适当类别。出于历史原因,完整抗体的主要类别称为IgA、IgD、IgE、IgG和IgM。在人中,根据结构和某些生化性质,IgG类别和IgA类别可进一步分为公认的亚类(同种型),即IgG1、IgG2、IgG3、IgG4、IgA1和IgA2。应当理解,人中的IgG同种型按照其在血清中的丰度顺序来命名,其中IgG1最丰富。
虽然所有五种类别的抗体(即IgA、IgD、IgE、IgG和IgM)和所有同种型(即IgG1、IgG2、IgG3、IgG4、IgA1和IgA2)以及其变异形式均在本发明的范围内,但将仅出于示例的目的相当详细地论述包含IgG类免疫球蛋白的优选实施例。然而应当理解,该公开内容仅说明例示性组合物和实施本发明的方法,而不以任何方式限制本发明或随附权利要求书的范围。
就此而言,人IgG免疫球蛋白包含两条分子量为大约23,000道尔顿的相同多肽轻链和两条分子量为53,000-70,000(取决于同种型)的相同重链。对应于不同类别抗体的重链恒定域分别由相应小写希腊字母α、δ、ε、γ及μ表示。来自任何脊椎动物物种的抗体的轻链可根据其恒定域的氨基酸序列而归属于被称为κ和λ的两种明显不同类型之一。本领域技术人员应当理解,不同类别免疫球蛋白的亚基结构和三维构型是众所周知的。
该四条链以Y构型通过二硫键接合,其中轻链括住重链,重链在Y的开口开始且贯穿可变区到达Y的两个末端。每条轻链通过一个共价二硫键键与重链连接,而铰链区中的两个二硫键接合重链。各个重链和轻链也具有规则间隔的链内二硫桥,其数目可根据IgG的同种型而变。
每条重链在一端具有可变域(VH),随后是多个恒定域。每条轻链在一端具有可变域(VL)且在其另一端具有恒定域;轻链恒定域与重链的第一恒定域对齐,且轻链可变域与重链可变域对齐。就此而言,应当理解,轻链部分的可变域(VL)和重链部分的可变域(VH)二者决定抗原识别和特异性。相反,轻链恒定域(CL)和重链恒定域(CH1、CH2或CH3)赋予并调节重要的生物学性质,如分泌、经胎盘运动性(transplacental mobility)、循环半衰期、补体结合等等。按照惯例,恒定区结构域的编号随着其逐渐远离抗体的抗原结合位点或氨基末端而增加。因此,抗体的氨基末端或N端构成可变区,羧基末端或C端构成恒定区。因此,CH3域和CL域实际上分别包含重链和轻链的羧基末端。
术语“可变”是指这样的事实:在各种免疫球蛋白当中,可变域的某些部分在序列上相差很大,并且这些热点(hot spot)在很大程度上限定了特定抗体的结合和特异性特征。这些高变位点自身表现于分别在轻链和重链可变域二者中的三个称为互补决定区(CDR)的区段中。在CDR旁侧的可变域的更高保守性部分称为构架区(FR)。更具体地讲,在天然存在的单体IgG抗体中,抗体每个臂上存在的六个CDR为短的非邻接氨基酸序列,这些氨基酸在抗体在含水环境中呈现其三维构型时经专门定位而形成抗原结合位点。
构成重链和轻链可变域的其余部分的构架区在氨基酸序列方面显示较小的分子间可变性。相反,构架区主要采取β片层(β-sheet)构象,且CDR形成连接β片层结构并在一些情况下构成β片层结构的一部分的环(loop)。因此,这些构架区起到形成可使六个CDR通过链间非共价相互作用以正确取向进行定位的骨架(scaffold)的作用。由经定位的CDR形成的抗原结合位点限定与免疫反应性抗原(即CD46)上的表位互补的表面。这个互补表面能促进抗体与免疫反应性抗原表位的非共价结合。应当理解,CDR的位置可容易由本领域普通技术人员鉴别。
如下文更详细论述的,重链和轻链可变区的全部或部分可使用标准的重组和表达技术进行重组或工程改造以提供有效的抗体。也就是说,来自第一抗体的重链或轻链可变区(或其任何部分)可与来自第二抗体的重链或轻链可变区的任何选定部分混合和匹配。例如,在一个实施例中,包含第一抗体的三个轻链CDR的整个轻链可变区可与包含第二抗体的三个重链CDR的整个重链可变区配对以提供有效抗体(operative antibody)。此外,在其他实施例中,可将来源于各种抗体的单独重链和轻链CDR混合和匹配以提供具有优化的特征的所需抗体。因此,例示性抗体可包含来自第一抗体的三个轻链CDR、来源于第二抗体的两个重链CDR和来自第三抗体的第三重链CDR。
更具体地讲,在本发明的内容中,应当理解可根据本发明教导将图11B中所公开的重链和轻链CDR中的任一者以这个方式重新排列以提供优化的抗CD46(如抗CD46)抗体。
在任何情况下,互补决定区残基编号可定义为Kabat等人(1991,NIH出版号91-3242,弗吉尼亚州斯普林菲尔德的美国国家技术信息服务局(National Technical Information Service,Springfield,Va.))的那些编号,具体而言,轻链可变域中为残基24-34(CDR1)、50-56(CDR2)和89-97(CDR3),重链可变域中为31-35(CDR1)、50-65(CDR2)和95-102(CDR3)。注意,各CDR在抗体之间差别很大(且根据定义不会表现出与Kabat共有序列具有同源性)。构架残基的最大比对通常需要在编号系统中插入间隔残基才能用于Fv区。另外,任何给定的Kabat位点编号处的某些单独残基的种类(identity)可因物种间或等位基因分歧而在抗体链之间有差异。另参见Chothia等人,J.Mol.Biol.(《分子生物学杂志》)196:901-917(1987)以及MacCallum等人,J.Mol.Biol.(《分子生物学杂志》)262:732-745(1996),其中定义包括彼此比较时氨基酸残基的重叠或子集。上述参考文献中的每一者以引用的方式全文并入本文中,并且示出涵盖上面所引用的参考文献每一者所定义的CDR的氨基酸残基以供比较。
CDR定义
1残基编号是按照Kabat等人(出处同上)的命名法
2残基编号是按照Chothia等人(出处同上)的命名法
3残基编号是按照MacCallum等人(出处同上)的命名法
出于便利的目的,图11B中所示的CDR是使用Chothia等人的命名法定义,但根据本申请案的内容,本领域技术人员可容易鉴别和计算每一各别重链和轻链序列的由Kabat等人或MacCallum等人所定义的CDR。就此而言,将Kabat等人所定义的CDR用于实例16中所述的人源化分析,在描绘人源化抗体序列的图13A和13B中加下划线表示。因此,将包含由所有这类命名法定义的CDR的抗体明确地包括在本发明的范围内。更广泛而言,术语“可变区CDR氨基酸残基”包括用上述任何基于序列或结构的方法所鉴别的CDR中的氨基酸。
如本文所用的,术语“可变区构架(FR)氨基酸残基”是指Ig链的构架区中的那些氨基酸。如本文所用的,术语“构架区”或“FR区”包括作为可变区的一部分、但非CDR(如使用CDR的Kabat定义)的一部分的氨基酸残基。因此,可变区构架为长度在约100-120个氨基酸之间的非邻接序列,但仅包括CDR外的那些氨基酸。
对于重链可变区的特定实例和对于Kabat等人所定义的CDR,构架区1对应于可变区中包涵氨基酸1-30的结构域;构架区2对应于可变区中包涵氨基酸36-49的结构域;构架区3对应于可变区中包涵氨基酸66-94的结构域,而构架区4对应于可变区中自氨基酸103至可变区末端的结构域。轻链构架区类似地由各轻链可变区CDR分隔。类似地,使用Chothia等人或McCallum等人的CDR定义,构架区边界由上文所述的各自CDR末端分隔。
铭记上述结构考虑因素,本领域技术人员应当理解,本发明的抗体可包含多种功能实施例中的任一者。就此而言,相容性抗体可包含任何在受试者中提供所需生理学响应的免疫反应性抗体(该术语在本文中进行了定义)。虽然所公开抗体中的任一者可结合本发明教导来使用,但本发明的某些实施例将包含嵌合抗体、人源化抗体或人单克隆抗体或其免疫反应性片段。另外其他实施例可例如包含同源或异源多聚构建体、Fc变体和缀合的或经糖基化改变的抗体。此外,应当理解,这类构型并不互相排斥,且相容的独立抗体可包含本文所公开的一个或多个功能方面。例如,相容的抗体可包含具有人源化可变区的单链双体抗体(diabody)或具有能改变糖基化模式以调节血清半衰期的Fc修饰的完全人全长IgG3抗体。其他例示性实施例对本领域技术人员是显而易见的且可容易辨别出其在本发明的范围内。
b.抗体产生
众所周知,可对包括兔、小鼠、大鼠等在内的各种宿主动物进行接种并用于提供根据本文教导的抗体。取决于接种的物种,本领域已知的可用于增强免疫应答的佐剂包括(但不限于)弗氏佐剂(完全和不完全弗氏佐剂)、矿物凝胶(如氢氧化铝)、表面活性物质(如溶血卵磷脂)、普洛尼克多元醇(pluronic polyol)、聚阴离子、肽、油乳液、钥孔戚血蓝素、二硝基酚以及潜在可用的人佐剂如BCG(卡介苗(bacille Calmette-Guerin))和短棒状杆菌(corynebacterium parvum)。这类佐剂可通过将抗原隔离于局部沉积物中来防止该抗原快速分散,或它们可含有能刺激宿主分泌对巨噬细胞和免疫系统的其他组分具有趋化性的因子的物质。优选地,若施用多肽,则免疫接种时间表将涉及分两次或更多次施用多肽,为期数周。
在用CD46免疫原(包括所选的剪接变体和/或肽)免疫动物后,可用本领域已知的技术从该动物获得抗体和/或产抗体细胞。在一些实施例中,通过将动物放血或处死来获得含有多克隆抗CD46抗体的血清。血清可以以获自动物的形式用于研究目的,或在备选方案中,可将抗CD46抗体部分或完全纯化以提供免疫球蛋白级分或均质抗体制剂。
c.单克隆抗体
虽然多克隆抗体可结合本发明的某些方面来使用,但优选的实施例包括使用CD46反应性单克隆抗体。如本文中所用的,术语“单克隆抗体”或“mAb”是指从实质上均质的抗体群体获得的抗体,即构成该群体的各个抗体除可能少量存在的可能突变(如天然存在的突变)外均相同。因此,修饰语“单克隆”表示抗体不是分立的抗体的混合物的这种特征,且可以用在任何类型的抗体上。在某些实施例中,这类单克隆抗体包括包含与CD46结合或缔合的多肽序列的抗体,其中该结合CD46的多肽序列是通过包括从多条多肽序列中选择单一标靶结合多肽序列的方法来获得。
在优选的实施例中,产生抗体的细胞系从分离自经免疫的动物的细胞制备。免疫后,将动物处死并通过本领域熟知的手段使淋巴结和/或脾B细胞永生化。使细胞永生化的方法包括但不限于用致癌基因转染细胞、用致癌病毒感染细胞并在可选择永生化细胞的条件下培养细胞、使细胞经受致癌或突变化合物、使细胞与永生化细胞(如骨髓瘤细胞)融合以及使肿瘤抑制基因失活。若采用与骨髓瘤细胞融合,则骨髓瘤细胞优选不分泌免疫球蛋白多肽(非分泌性细胞系)。永生化细胞用CD46或其免疫反应性部分进行筛选。在一个优选的实施例中,使用酶联免疫测定法(ELISA)或放射免疫测定法来进行初始筛选。
更一般地说,可使用本领域已知的多种技术来制备符合本发明的分立的单克隆抗体,包括杂交瘤、重组技术、噬菌体展示技术、酵母文库、转基因动物(例如或HuMAb)或它们的一些组合。例如,单克隆抗体可使用诸如上文概述的以及在Harlow等人,Antibodies:A Laboratory Manual(《抗体:实验室手册》),(冷泉港实验室出版社(Cold Spring Harbor Laboratory Press),第二版,1988年);Hammerling等人,载于:Monoclonal Antibodies and T-Cell Hybridomas(《单克隆抗体和T细胞杂交瘤》)563-681(纽约爱思唯尔出版社(Elsevier,N.Y.),1981)中更详细教导的杂交瘤技术来产生。使用所公开的方案,优选通过多次皮下或腹膜内注射相关抗原和佐剂而在哺乳动物中产生抗体。如先前所论述的,这个免疫通常会引起免疫应答,免疫应答包括由活化的脾细胞或淋巴细胞产生抗原反应性抗体(若免疫的动物为转基因动物,则其可为完全人抗体)。虽然可从动物血清收获所得抗体以提供多克隆制剂,但一般更希望从脾、淋巴结或外周血液分离独立淋巴细胞以提供单克隆抗体的均质制剂。最通常,从脾获得淋巴细胞并使其永生化以提供杂交瘤。
例如,如上文所述,选择方法可为从多个克隆(例如杂交瘤克隆、噬菌体克隆或重组DNA克隆的库)中选择独特的克隆。应当理解,可进一步改变所选的CD46结合序列,例如以改善对标靶的亲和力、使标靶结合序列人源化、改善其在细胞培养物中的产生、降低其体内免疫原性、产生多特异性抗体等,并且包含改变的标靶结合序列的抗体也为本发明的单克隆抗体。与通常包括针对不同决定簇(表位)的分立抗体的多克隆抗体制剂相反,单克隆抗体制剂的每种单克隆抗体是针对抗原上的单一决定簇。除其特异性外,单克隆抗体制剂的有利之处在于其通常未受到可能具有交叉反应性的其他免疫球蛋白污染。
d.嵌合抗体
在另一实施例中,本发明的抗体可包含嵌合抗体,该嵌合抗体来源于共价接合的来自至少两种不同物种或类型的抗体的蛋白质区段。应当理解,如本文所用的,术语“嵌合抗体”涉及其中重链和/或轻链的一部分与来源于特定物种或属于特定抗体类别或亚类的抗体中的相应序列一致或同源,而所述链的其余部分与来源于另一物种或属于另一抗体类别或亚类的抗体中的相应序列一致或同源的构建体,以及这类抗体的片段,只要其表现出所需生物活性即可(美国专利No.4,816,567;Morrison等人,Proc.Natl.Acad.Sci.USA(《美国科学院院刊》),81:6851-6855(1984))。在一个例示性实施例中,根据本文教导的嵌合抗体可包含鼠VH和VL氨基酸序列以及来源于人来源的恒定区。在其他相容的实施例中,本发明的嵌合抗体可包含如下文所述的CDR移植抗体或人源化抗体。
一般来讲,制备嵌合抗体的目的在于产生其中来自预定受试物种的氨基酸的数目最大化的嵌合体。一个例子为CDR移植抗体,其中该抗体包含一个或多个来自特定物种或属于特定抗体类别或亚类的互补决定区(CDR),而该抗体链的其余部分与来源于另一物种或属于另一抗体类别或亚类的抗体中相应序列一致或同源。为在人类中使用,通常将来自啮齿动物抗体的可变区或所选的CDR移植到人抗体中,替换人抗体的天然存在的可变区或CDR。通常这些构建体的优点在于提供全强度调节剂功能(例如CDC、ADCC等),而同时减少受试者对抗体的非所需免疫应答。
e.人源化抗体
与CDR移植抗体类似的是人源化抗体。一般来讲,人源化抗体由最初在非人动物中产生的单克隆抗体制备。本文所用的非人(例如鼠类)抗体的人源化形式为含有极少的来源于非人免疫球蛋白的序列的嵌合抗体。在一个实施例中,人源化抗体为其中来自接受者的某个CDR的残基被具有所需特异性、亲和力和/或能力的非人物种(供体抗体)(例如小鼠、大鼠、兔或非人灵长类动物)的某个CDR的残基代替的人免疫球蛋白(接受者抗体)。
在所选的实施例中,接受者抗体可包含共有序列。为产生共有人构架,可将来自若干人重链或轻链氨基酸序列的构架进行比对以鉴别共有氨基酸序列。此外,在许多情况下,人免疫球蛋白的可变域中的一个或多个构架残基被来自供体抗体的相应非人残基代替。这些构架置换通过本领域熟知的方法来鉴别,例如通过将CDR与构架残基的相互作用建模以鉴别对抗原结合重要的构架残基以及进行序列比较以鉴别特定位置处的不寻常构架残基来进行鉴别。这类置换有助于维持移植的CDR的适当三维构型且通常相比于无构架置换的类似构建体可改善亲和力(infinity)。此外,人源化抗体可包含未存在于接受者抗体或供体抗体中的残基。可用熟知的技术作出这些修饰以进一步改进抗体性能。
CDR移植和人源化抗体例如描述于美国专利No.6,180,370、No.5,693,762、No.5,693,761、No.5,585,089和No.5,530,101中。一般而言,人源化抗体将实质上包含全部至少一个且通常两个可变域,其中全部或实质上全部CDR均对应于非人免疫球蛋白的CDR,并且全部或实质上全部构架区为人免疫球蛋白序列的构架区。人源化抗体任选还将包含免疫球蛋白恒定区(Fc)(通常为人免疫球蛋白的恒定区)的至少一部分。更多细节参见例如:Jones等人,Nature(《自然》)321:522-525(1986);Riechmann等人,Nature(《自然》)332:323-329(1988);和Presta,Curr.Op.Struct.Biol.(《结构生物学新见》)2:593-596(1992)。还可参见例如:Vaswani和Hamilton,Ann.Allergy,Asthma&Immunol.(《过敏、哮喘及免疫学年鉴》)1:105-115(1998);Harris,Biochem.Soc.Transactions(《生化学会会刊》)23:1035-1038(1995);Hurle和Gross,Curr.Op.Biotech.(《生物技术新见》)5:428-433(1994);和美国专利No.6,982,321和No.7,087,409。又一方法称为人化工程改造(humaneering),在例如U.S.2005/0008625中描述。出于本专利申请的目的,术语“人源化抗体”将视为明确包括无构架置换或构架置换极少的CDR移植抗体(即包含一个或多个移植的非人CDR的人抗体)。
另外,非人抗CD46抗体也可通过利用WO 98/52976和WO 00/34317中所公开的方法使人T细胞表位特定缺失或去免疫(deimmunization)来修饰。简而言之,可分析抗体的重链和轻链可变区寻找能结合II型MHC的肽;这些肽代表潜在的T细胞表位(如WO 98/52976和WO 00/34317中所定义)。为检测潜在的T细胞表位,可应用称为肽穿线(peptide threading)的计算机建模方法,并且另外可如WO 98/52976和WO 00/34317中所述搜索人II型MHC结合肽的数据库寻找VH序列和VL序列中存在的基序。这些基序可结合18种主要II型MHC DR同种异型(allotype)中的任一者,因而构成潜在的T细胞表位。检测到的潜在T细胞表位可通过取代可变区中的少数氨基酸残基或通过单一氨基酸置换来消除。尽可能作出保守置换。通常,但不唯独地,可使用对人种系抗体序列中的位置而言常见的氨基酸。在鉴别去免疫变化后,可通过诱变或其他合成方法(例如从头合成、盒置换(cassette replacement)等)来构建编码VH和VL的核酸。可任选将经诱变的可变序列与人恒定区融合。
在所选的实施例中,至少60%、65%、70%、75%或80%的人源化抗体可变区残基将对应于亲本构架区(FR)和CDR序列的残基。在其他实施例中,至少85%或90%的人源化抗体残基将对应于亲本构架区(FR)和CDR序列的残基。在另一优选的实施例中,大于95%的人源化抗体残基将对应于亲本构架区(FR)及CDR序列的残基。
人源化抗体可使用本文所述的常见分子生物学和生物分子工程改造技术来制造。这些方法包括分离、操纵和表达编码来自重链或轻链中至少一者的免疫球蛋白Fv可变区的全部或一部分的核酸序列。这类核酸的来源是本领域技术人员所熟知的,例如可获自如上文所述产生针对预定标靶的抗体或免疫反应性片段的杂交瘤、真核细胞或噬菌体、获自种系免疫球蛋白基因或获自合成的构建体。然后可将编码人源化抗体的重组DNA克隆进适当表达载体中。
人种系序列例如公开于如下文献中:Tomlinson,I.A.等人,(1992)J.Mol.Biol.(《分子生物学杂志》)227:776-798;Cook,G.P.等人,(1995)Immunol.Today(《当代免疫》)16:237-242;Chothia,D.等人,(1992)J.Mol.Bio.(《分子生物学杂志》)227:799-817;和Tomlinson等人,(1995)EMBO J(《欧洲分子生物学学会杂志》)14:4628-4638。V BASE目录提供人免疫球蛋白可变区序列的详尽目录(参见Retter等人,(2005)Nuc Acid Res(《核酸研究》)33:671-674)。这些序列可用作人序列的来源,例如用于构架区和CDR。如本文中所述,也可使用共有人构架区,例如如美国专利No.6,300,064中所述。
f.人抗体
除上述抗体外,本领域技术人员应当理解,本发明的抗体可包含完全人抗体。出于本申请案的目的,术语“人抗体”包含具有对应于由人产生的抗体的氨基酸序列的氨基酸序列的抗体,和/或使用如本文所公开的制备人抗体的任一技术所制备的抗体。人抗体的这个定义特地排除包含非人抗原结合残基的人源化抗体。
人抗体可使用本领域已知的各种技术来产生。如上文所提及的,可使用噬菌体展示技术来提供根据本发明教导的免疫活性结合区。因此,本发明的某些实施例提供产生抗CD46抗体或其抗原结合部分的方法,该方法包括如下步骤:在噬菌体上合成(优选人)抗体的文库;用CD46或其抗体结合部分筛选该文库;分离结合CD46的噬菌体;以及从该噬菌体获得免疫反应性片段。举例而言,一种制备用于噬菌体展示技术的抗体文库的方法包括如下步骤:用CD46或其抗原性部分免疫包含人或非人免疫球蛋白基因座的非人动物以产生免疫应答;从经免疫的动物提取产生抗体的细胞;从所提取的细胞分离编码本发明抗体的重链和轻链的RNA;反转录该RNA以产生cDNA;使用引物扩增该cDNA;以及将该cDNA插入噬菌体展示载体中以使得抗体在噬菌体上表达。更具体而言,通过PCR将编码VH域和VL域的DNA与scFv接头重组在一起并克隆进噬菌粒载体(如pCANTAB 6或pComb 3HSS)中。然后可将该载体电穿孔进大肠杆菌中,接着用辅助噬菌体感染该大肠杆菌。用于这些方法中的噬菌体通常为丝状噬菌体,包括fd和M13,并且通常将VH域和VL域与噬菌体基因III或基因VIII重组融合。
本发明的重组人抗CD46抗体可通过筛选如上所制备的重组组合抗体文库来分离。在一个优选的实施例中,该文库为scFv噬菌体展示文库,其使用由自B细胞分离的mRNA制备的人VL和VH cDNA来产生。制备和筛选这类文库的方法是本领域所熟知的,并且用于产生噬菌体展示文库的试剂盒可商购获得(例如Pharmacia Recombinant Phage Antibody System(Pharmacia重组噬菌体抗体系统),目录号为27-9400-01;以及Stratagene SurfZAPTM噬菌体展示试剂盒,目录号为240612)。也存在其他可用于产生和筛选抗体展示文库的方法和试剂(参见例如美国专利No.5,223,409;PCT公布No.WO 92/18619、No.WO 91/17271、No.WO 92/20791、No.WO 92/15679、No.WO 93/01288、No.WO 92/01047、No.WO 92/09690;Fuchs等人,Bio/Technology(《生物技术》)9:1370-1372(1991);Hay等人,Hum.Antibod.Hybridomas(《人抗体和杂交瘤》)3:81-85(1992);Huse等人,Science(《科学》)246:1275-1281(1989);McCafferty等人,Nature(《自然》)348:552-554(1990);Griffiths等人,EMBO J.(《欧洲分子生物学学会杂志》)12:725-734(1993);Hawkins等人,J.Mol.Biol.(《分子生物学杂志》)226:889-896(1992);Clackson等人,Nature(《自然》)352:624-628(1991);Gram等人,Proc.Natl.Acad.Sci.USA(《美国科学院院刊》)89:3576-3580(1992);Garrad等人,Bio/Technology(《生物技术》)9:1373-1377(1991);Hoogenboom等人,Nuc.Acid Res.(《核酸研究》)19:4133-4137(1991);和Barbas等人,Proc.Natl.Acad.Sci.USA(《美国科学院院刊》)88:7978-7982(1991)。
由原始文库(naive library)(天然的或合成的)产生的抗体可具有中等亲和力(Ka为约106至107M-1),但也可如本领域中所述通过构建次级文库(secondary library)并从其中再次选择来体外模拟亲和力成熟。例如,可通过使用Hawkins等人,J.Mol.Biol.(《分子生物学杂志》)226:889-896(1992)的方法中或Gram等人,Proc.Natl.Acad.Sci.USA(《美国科学院院刊》),89:3576-3580(1992)的方法中的易错聚合酶(报道于Leung等人,Technique(《技术》),1:11-15(1989)),来体外随机引入突变。另外,可通过例如利用PCR,使用带有跨越所关注CDR的随机序列的引物,在所选的单独FV克隆中使一个或多个CDR随机突变并筛选亲和力较高的克隆来进行亲和力成熟。WO 9607754描述了在免疫球蛋白轻链的互补决定区中诱导诱变以产生轻链基因的文库的方法。另一有效方法是,将通过噬菌体展示而选择的VH域或VL域与获自未经免疫的供体的天然V域变体组库(repertoire)进行重组并在数轮的链改组中针对较高亲和力进行筛选,如Marks等人,Biotechnol.(《生物技术》),10:779-783(1992)中所述。这个技术使得能产生解离常数Kd(koff/kon)为约10-9M或更小的抗体和抗体片段。
应进一步认识到,可采用使用包含在其表面上表达结合对的真核细胞(例如酵母)的文库的类似程序。如同噬菌体展示技术一般,针对所关注抗原(即CD46)对真核生物文库进行筛选并分离和克隆表达候选结合对的细胞。可进行使文库内含物优化以及反应性结合对亲和力成熟的步骤。参见例如美国专利No.7,700,302和美国系列号No.12/404,059。在一个实施例中,人抗体选自噬菌体文库,其中该噬菌体文库表达人抗体(Vaughan等人,Nature Biotechnology(《自然生物技术》)14:309-314(1996);Sheets等人,Proc.Natl.Acad.Sci.(《美国科学院院刊》)95:6157-6162(1998);Hoogenboom和Winter,J.Mol.Biol(《分子生物学杂志》),227:381(1991);Marks等人,J.MoI.Biol(《分子生物学杂志》),222:581(1991))。在其他实施例中,人结合对可分离自诸如酵母之类的真核细胞中所产生的组合抗体文库。参见例如美国专利No.7,700,302。这类技术有利地允许筛选大量候选调节剂并且可相对容易操纵候选序列(例如通过亲和力成熟或重组改组)。
人抗体也可通过将人免疫球蛋白基因座引入转基因动物(例如内源性免疫球蛋白基因已部分或完全失活的小鼠)中来制备。攻击后,观察人抗体的产生情况,其在全部方面均非常类似于在人中所见的,包括基因重排、组装和抗体组库(repertoire)。这个方法例如描述于关于技术的美国专利No.5,545,807、No.5,545,806、No.5,569,825、No.5,625,126、No.5,633,425、No.5,661,016以及美国专利No.6,075,181和No.6,150,584,以及如下科学出版物:Marks等人,Bio/Technology(《生物技术》)10:779-783(1992);Lonberg等人,Nature(《自然》)368:856-859(1994);Morrison,Nature(《自然》)368:812-13(1994);Fishwild等人,Nature Biotechnology(《自然生物技术》)14:845-51(1996);Neuberger,Nature Biotechnology(《自然生物技术》)14:826(1996);Lonberg和Huszar,Intern.Rev.Immunol.(《免疫学国际评论》)13:65-93(1995)。或者,人抗体可经由使产生针对标靶抗原的抗体的人B-淋巴细胞(这类B淋巴细胞可自患有赘生性障碍的个体回收或可在体外进行免疫)永生化来制备。参见例如Cole等人,Monoclonal Antibodies and Cancer Therapy(《单克隆抗体和癌症疗法》),Alan R.Liss,第77页(1985);Boerner等人,J.Immunol(《免疫学杂志》),147(l):86-95(1991);以及美国专利No.5,750,373。
VI.抗体特征
不管如何获得抗体调节剂或其采取上述何种形式(例如人源化抗体、人抗体等),所公开的调节剂的优选实施例都可表现出各种特征。就这一点而言,可对产生抗CD46抗体的细胞(例如杂交瘤或酵母菌落)进行选择、克隆,并针对所需特征(包括例如强盛生长、高抗体产率以及如下文更详细论述的所需抗体特征)进行进一步筛选。杂交瘤可在同系动物中、缺乏免疫系统的动物(例如裸小鼠)中体内扩增或在细胞培养物中体外扩增。选择、克隆和扩展杂交瘤和/或菌落的方法是本领域普通技术人员所熟知的,其中每一方法均产生分立的抗体种类。
a.中和抗体
在尤其优选的实施例中,本发明的调节剂将包含中和抗体或其衍生物或片段。术语“中和抗体”或“中和拮抗剂”是指这样的抗体或拮抗剂,它能与CD46或任何配体或酶结合或相互作用并防止该配体或酶与其结合伴侣(例如CD46)或底物结合,从而中断本来会由这类分子的相互作用引起的生物反应。在评估抗体或其免疫功能片段或衍生物的结合和特异性时,若过量抗体使结合于标靶分子的结合伴侣的量降低至少约20%、30%、40%、50%、60%、70%、80%、85%、90%、95%、97%、99%或更多(如在例如本文“实例”中所述的体外竞争性结合测定法中所测量),则抗体或片段将实质上抑制配体或酶与其结合伴侣或底物的结合。就CD46的抗体而言,中和抗体或拮抗剂将优选使CD46在通过血清因子I使补体组分C3b和C4b失活方面的能力降低至少约20%、30%、40%、50%、60%、70%、80%、85%、90%、95%、97%、99%或更多,从而降低游离磷脂酰肌醇蛋白聚糖(glypican)的浓度。应当理解,这个减少的活性可直接使用本领域公认的技术来测量,或可通过这个减少会对补体活性产生的影响来测量。
b.内化抗体
虽然证据表明CD46可被细胞分泌,但至少一些CD46很可能保持与细胞表面缔合,从而使得所公开的调节剂可以内化。因此,抗CD46抗体可至少在一定程度上被表达CD46的细胞内化。例如,结合至肿瘤起始细胞表面上的CD46的抗CD46抗体可被肿瘤起始细胞内化。在尤其优选的实施例中,可将这类抗CD46抗体与在内化后杀灭细胞的细胞毒性部分缔合或缀合。
本文所用的“内化的抗CD46抗体”为在结合至与哺乳动物细胞缔合的CD46后被该细胞吸收的抗体。内化抗体包括抗体片段、人或人源化抗体和抗体缀合物。内化可在体外或体内进行。对于治疗性应用,内化可在体内进行。内化的抗体分子的数目可足以或足够杀灭表达CD46的细胞,尤其是表达CD46的肿瘤起始细胞。取决于抗体或抗体缀合物的效价,在一些情况下,单一抗体分子摄入进细胞中就足以杀灭抗体结合的标靶细胞。例如,某些毒素杀灭效能很高,使得内化一分子与抗体缀合的毒素就足以杀灭肿瘤细胞。在结合哺乳动物细胞上的CD46后抗CD46抗体是否内化可通过包括下文“实例”中所述的测定法在内的各种分析来确定。检测抗体是否内化进细胞中的方法在美国专利No.7,619,068中进行了描述,将该专利以引用的方式全文并入本文。
c.消耗性抗体
在其他优选的实施例中,本发明的调节剂将包含消耗性抗体或其衍生物或片段。术语“消耗性抗体”是指与细胞表面上或其附近的CD46结合或缔合并且诱导、促进或引起细胞死亡或消除(例如,通过补体依赖性细胞毒性或抗体依赖性细胞毒性)的抗体或片段。在下文更全面论述的一些实施例中,所选的消耗性抗体将与细胞毒性剂缔合或缀合。优选地,消耗性抗体将能够移除、消除或杀灭确定的细胞群体中至少20%、30%、40%、50%、60%、70%、80%、85%、90%、95%、97%或99%的肿瘤永续细胞。在一些实施例中,该细胞群体可包含经富集、分区、纯化或分离的肿瘤永续细胞。在其他实施例中,细胞群体可包含含有肿瘤永续细胞的整个肿瘤样品或异质肿瘤提取物。本领域技术人员应当理解,下文“实例”中所述的标准生化技术可用于监测和定量根据本文教导的肿瘤永续细胞的消耗。
d.表位结合
将进一步理解,所公开的抗CD46抗体将与由所选的标靶递呈的分立表位或决定簇缔合或结合。本文所用的术语“表位”是指标靶抗原中能够被特定抗体识别和特异性结合的部分。当该抗原为多肽如CD46时,表位可由邻接氨基酸和通过蛋白质三级折叠而并置的非邻接氨基酸形成。由邻接氨基酸形成的表位通常在蛋白质变性后保留,而通过三级折叠形成的表位通常在蛋白质变性后丢失。表位通常包括至少3个且更通常至少5个或8-10个氨基酸,呈独特的空间构象。更具体地讲,本领域技术人员应当理解,术语“表位”包括任何能够特异性结合至免疫球蛋白或T细胞受体或者以别的方式与分子相互作用的蛋白质决定簇。抗原决定簇一般由诸如氨基酸或碳水化合物或糖侧链之类的分子的化学活性表面簇(grouping)组成,且一般具有特异性的三维结构特征以及特异性的电荷特征。另外,表位可为线性的或构象性的。在线性表位中,蛋白质与相互作用分子(例如抗体)之间的所有相互作用点均沿着该蛋白质的一级氨基酸序列线性存在。在构象表位中,相互作用点存在于蛋白质上在线性上彼此间隔开的氨基酸残基当中。
一旦确定抗原上的所需表位,则有可能例如使用本发明中所述的技术产生该表位的抗体。或者,在发现过程中,抗体的产生和表征可阐明有关所需表位的信息。根据该信息,则有可能以竞争方式筛选结合至相同表位的抗体。实现此举的方法是进行竞争研究以找到彼此竞争性结合的抗体,即抗体竞争与抗原的结合。根据它们的交叉竞争将抗体分类别(binning)的高通量方法描述于WO03/48731中。
如本文所用的术语“分类别”是指根据它们的抗原结合特征将抗体分组的方法。类别(bin)的归类有些武断,其取决于所测试抗体的所观察到的结合模式的差别。因此,虽然该技术是可用于将本发明的抗体分类的工具,但该类别并不始终直接与表位相关且这种初始的判定应通过其他本领域公认的方法进一步证实。
在此告诫下,可通过使用本领域已知的和本文“实例”中所述的方法确定所选的第一抗体(或其片段)与第二抗体是结合于同一表位还是交叉竞争结合。在一个实施例中,在饱和条件下让本发明的第一抗体结合至CD46,然后测量第二抗体与CD46结合的能力。若测试抗体能够与第一抗CD46抗体同时结合至CD46,则该第二抗体结合的表位与该第一抗体不同。然而,若该第二抗体不能够同时结合至CD46,则该第二抗体结合至同一表位、重叠表位或与该第一抗体所结合的表位极接近的表位。如本领域已知的以及下文“实例”中所详细描述的,所需数据可用固相直接或间接放射免疫测定法(RIA)、固相直接或间接酶免疫测定法(EIA)、夹心竞争测定法、BiacoreTM系统(即表面等离子共振–通用电气医疗公司(GE Healthcare))、Analyzer分析仪(即生物层干涉测量法,富迪生物有限公司(ForteBio,Inc.))或流式细胞法来获得。本文所用的术语“表面等离子共振”是指使得可以通过检测生物传感器基质中蛋白质浓度的变化来分析实时生物特异性相互作用的光学现象。在一个尤其优选的实施例中,如下文“实例”中所证实的,该分析用Biacore或ForteBio仪器来进行。
术语“竞争”在用于竞争同一表位的抗体的上下文中时意指抗体之间的竞争,其通过其中所测试的抗体或免疫功能片段防止或抑制参考抗体与共同抗原特异性结合的测定法来测定。通常,这种测定法涉及使用结合于带有未经标记的测试免疫球蛋白及经标记的参考免疫球蛋白中任一者的固体表面或细胞的纯化抗原。竞争性抑制是通过测定在测试免疫球蛋白的存在下结合至固体表面或细胞的标记的量来测量。测试免疫球蛋白通常过量存在。通过竞争测定法鉴别的抗体(竞争抗体)包括其所结合的表位与参考抗体所结合的表位相同的抗体以及结合至这样的相邻表位的抗体,该相邻表位与参考抗体所结合的表位足够接近以便发生空间位阻。关于测定竞争性结合的方法的其他细节在本文“实例”中提供。通常,当竞争抗体过量存在时,其将抑制参考抗体与共同抗原的特异性结合达至少40%、45%、50%、55%、60%、65%、70%或75%。在一些情况下,结合受抑制达至少80%、85%、90%、95%或97%或更多。
除了表位特异性,所公开的抗体还可用多种不同的物理特征来表征,包括例如结合亲和力、解折叠温度(melting temperature,Tm)和等电点。
e.结合亲和力
就这一点来说,本发明还涵盖具有高的CD46结合亲和力的抗体的用途。当解离常数Kd(koff/kon)≤10-8M时本发明的抗体可说成是特异性结合其靶标抗原。当Kd≤5×10-9M时,抗体以高的亲和力特异性结合抗原,当Kd≤5×10-10M时,抗体以十分高的亲和力特异性结合抗原。在本发明的一个实施例中,抗体的Kd≤10-9M且解离速率为约1×10-4/秒。在本发明的一个实施例中,解离速率<为1×10-5/秒。在本发明的其他实施例中,抗体将以约10-8M至10-10M的Kd结合至CD46,在又一个实施例中,其将以≤2×10-10M的Kd结合。本发明的另外其他所选的实施例包括解离常数或Kd(koff/kon)小于10-2M、小于5×10-2M、小于10-3M、小于5×10-3M、小于10-4M、小于5×10-4M、小于10-5M、小于5×10-5M、小于10-6M、小于5×10-6M、小于10-7M、小于5×10-7M、小于10-8M、小于5×10-8M、小于10-9M、小于5×10-9M、小于10-10M、小于5×10-10M、小于10-11M、小于5×10-11M、小于10-12M、小于5×10-12M、小于10-13M、小于5×10-13M、小于10-14M、小于5×10-14M、小于10-15M或小于5×10-15M的抗体。
在特定的实施例中,与CD46免疫特异性结合的本发明抗体的结合速率常数kon速率(CD46(Ab)+抗原(Ag)kon←Ab-Ag)为至少105M-1s-1、至少2×105M-1s-1、至少5×105M-1s-1、至少106M-1s-1、至少5×106M-1s-1、至少107M-1s-1、至少5×107M-1s-1或至少108M-1s-1。
在另一个实施例中,与CD46免疫特异性结合的本发明抗体的koff速率(CD46(Ab)+抗原(Ag)koff←Ab-Ag)小于10-1s-1、小于5×10-1s-1、小于10-2s-1、小于5×10-2s-1、小于10-3s-1、小于5×10-3s-1、小于10-4s-1、小于5×10-4s-1、小于10-5s-1、小于5×10-5s-1、小于10-6s-1、小于5×10-6s-1、小于10-7s-1、小于5×10-7s-1、小于10-8s-1、小于5×10-8s-1、小于10-9s-1、小于5×10-9s-1或小于10-10s-1。
在本发明的其他所选的实施例中,抗CD46抗体的亲和力常数或Ka(kon/koff)为至少102M-1、至少5×102M-1、至少103M-1、至少5×103M-1、至少104M-1、至少5×104M-1、至少105M-1、至少5×105M-1、至少106M-1、至少5×106M-1、至少107M-1、至少5×107M-1、至少108M-1、至少5×108M-1、至少109M-1、至少5×109M-1、至少1010M-1、至少5×1010M-1、至少1011M-1、至少5×1011M-1、至少1012M-1、至少5×1012M-1、至少1013M-1、至少5×1013M-1、至少1014M-1、至少5×1014M-1、至少1015M-1或至少5×1015M-1。
f.等电点
除上述结合性质外,像所有多肽一样,抗CD46抗体及其片段具有等电点(pI),一般定义为多肽不带净电荷时的pH。本领域已知道,当溶液的pH等于蛋白质的等电点(pI)时,蛋白质溶解度通常最低。因此,通过改变抗体中可电离残基的数目和位置以调节pI来优化溶解度是可能的。例如,可通过进行适当的氨基酸置换(例如通过用带电氨基酸如赖氨酸置换不带电残基如丙氨酸)来操纵多肽的pI。不希望受任何特定理论束缚,抗体中引起该抗体的pI改变的氨基酸置换可改善抗体的溶解度和/或稳定性。本领域技术人员将会理解哪些氨基酸置换将最适合于特定抗体实现所需的pI。
蛋白质的pI可通过多种方法来测定,包括但不限于等电聚焦和各种计算机算法(参见例如Bjellqvist等人,1993,Electrophoresis(《电泳》)14:1023)。在一个实施例中,本发明的抗CD46抗体的pI高于约6.5、约7.0、约7.5、约8.0、约8.5或约9.0。在另一实施例中,本发明的抗CD46抗体的pI高于6.5、7.0、7.5、8.0、8.5或9.0。在又另一个实施例中,引起本发明抗体的pI改变的置换将不会显著减弱其对CD46的结合亲和力。如下文更详细论述的,特别设想到引起FcγR结合改变的Fc区置换也可引起pI改变。在一个优选的实施例中,对Fc区置换进行专门选择以同时实现FcγR结合的所需变化和pI的任何所需改变。本文所用的pI值定义为主要电荷形式的pI。
g.热稳定性
还应该理解,抗体的Fab域的Tm可为抗体的热稳定性的良好指标且还可指示存放期。Tm仅为使给定结构域或序列50%解折叠时的温度。Tm较低指示聚集较多/稳定性较小,而较高Tm指示聚集较少/稳定性较高。因此,具有较高Tm的抗体或片段或衍生物是优选的。此外,使用本领域公认的技术,有可能改变抗CD46抗体或其结构域的组成以提高或优化分子稳定性。参见例如美国专利No.7,960,142。因此,在一个实施例中,所选的抗体的Fab域的Tm值高于至少50℃、55℃、60℃、65℃、70℃、75℃、80℃、85℃、90℃、95℃、100℃、105℃、110℃、115℃或120℃。在另一个实施例中,抗体的Fab域的Tm值高于至少约50℃、约55℃、约60℃、约65℃、约70℃、约75℃、约80℃、约85℃、约90℃、约95℃、约100℃、约105℃、约110℃、约115℃或约120℃。蛋白质域(例如Fab域)的热解折叠温度(Tm)可使用本领域已知的任何标准方法来测量,例如通过差示扫描量热法(参见例如Vermeer等人,2000,Biophys.J.(《生物物理杂志》)78:394-404;Vermeer等人,2000,Biophys.J.(《生物物理杂志》)79:2150-2154,将这两篇文献以引用的方式并入本文)。
VII.CD46调节剂片段和衍生物
无论本发明的作用剂(agent)包含完整的融合构建体、抗体、片段还是衍生物,所选的调节剂均将与CD46反应、结合、组合、复合、连接、附接、接合、相互作用或以其他方式缔合,从而提供所需的抗赘生性作用。本领域技术人员应当理解,包含抗CD46抗体的调节剂是通过在抗体上表达的一个或多个结合位点与CD46相互作用或缔合。更具体地讲,本文所用的术语“结合位点”包含多肽中负责选择性结合至所关注标靶分子(例如酶、抗原、配体、受体、底物或抑制剂)的区域。结合域包含至少一个结合位点(例如完整的IgG抗体将具有两个结合域和两个结合位点)。例示性的结合域包括抗体可变域、配体的受体结合域、受体的配体结合域或酶促域。出于本发明的目的,CD46的酶活性区域(例如作为Fc-CD46融合构建体的一部分)可包含底物(例如磷脂酰肌醇蛋白聚糖)的结合位点。
a.片段
不管选择何种形式的调节剂(例如嵌合的、人源化的等待)来实施本发明,应当理解根据本文教导可使用其免疫反应性片段。在最广泛意义上,术语“抗体片段”包含完整抗体(例如天然存在的免疫球蛋白)的至少一部分。更具体地讲,术语“片段”是指抗体或抗体链(或在Fc融合物的情况下为CD46分子)的一部分,其包含的氨基酸残基比完整的或完全的抗体或抗体链少。术语“抗原结合片段”是指免疫球蛋白或抗体中结合抗原或与完整抗体(即与其所来源的完整抗体)竞争抗原结合(即特异性结合)的多肽片段。本文所用的术语“抗体分子的片段”包括抗体的抗原结合片段,例如抗体轻链(VL)、抗体重链(VH)、单链抗体(scFv)、F(ab')2片段、Fab片段、Fd片段、Fv片段、单域抗体片段、双体抗体、线性抗体、单链抗体分子和由抗体片段形成的多特异性抗体。类似地,CD46的酶活性片段包含CD46分子中保留其与CD46底物相互作用且以类似于完整CD46的方式修饰该底物(例如将该底物剪短)的能力(不过效率可能略低)的部分。
本领域技术人员应当理解,片段可通过化学或酶处理完整的或完全的调节剂(例如抗体或抗体链)或通过重组手段来获得。就这一点而言,虽然各种抗体片段依据完整抗体的消化来定义,但本领域技术人员应当理解,这类片段可通过化学法或通过使用重组DNA方法从头合成。因此,本文所用的术语“抗体”明确地包括通过修饰整个抗体而产生的或使用重组DNA方法从头合成的抗体或其片段或衍生物。
更具体地讲,用木瓜蛋白酶消化抗体可产生两个相同的抗原结合片段(称为Fab片段,各具有单个抗原结合位点)和残余的Fc片段,其名称反映其容易结晶的能力。胃蛋白酶处理产生F(ab')2片段,其具有两个抗原结合位点且仍能够交联抗原。Fab片段还含有轻链的恒定域和重链的第一恒定域(CH1)。Fab'片段与Fab片段的不同在于重链CH1域的羧基末端添加少量残基,包括一个或多个来自抗体铰链区的半胱氨酸在内。Fab'-SH在本文中为其中恒定域的半胱氨酸残基带有至少一个游离巯基的Fab'的名称。F(ab')2抗体片段最初以Fab'片段对的形式产生,该两个片段之间具有铰链半胱氨酸。抗体片段的其他化学偶联也是已知的。关于其他抗体片段的更详细描述,参见例如Fundamental Immunology(《基础免疫学》),W.E.Paul编辑,Raven Press,N.Y.(1999)。
将进一步理解,Fv片段为含有完整抗原识别和结合位点的抗体片段。这个区域由一个重链可变域和一个轻链可变域紧密缔合的二聚体组成,该紧密缔合在性质上可以是共价缔合,例如在scFv中。各可变域的三个CDR正是以这个构造发生相互作用而限定VH-VL二聚体的表面上的抗原结合位点。六个CDR或其子集共同地赋予抗体对抗原的结合特异性。然而,甚至单个可变域(或Fv的一半,其仅包含三个对抗原有特异性的CDR)也具有识别和结合抗原的能力,不过其亲和力通常低于完整结合位点的亲和力。
在另一个实施例中,抗体片段例如为包含Fc区、保留当存在于完整抗体中时通常与Fc区相关的至少一种生物学功能(例如FcRn结合、抗体半衰期调节、ADCC功能和补体结合)的片段。在一个实施例中,抗体片段为具有实质上类似于完整抗体的体内半衰期的单价抗体。例如,这种抗体片段可包含连接于Fc序列的抗原结合臂,其能够赋予该片段体内稳定性。
b.衍生物
在另一个实施例中,将进一步理解,本发明的调节剂可为单价或多价(例如二价、三价等)。本文所用的术语“效价”是指抗体所具有的潜在标靶(即CD46)结合位点的数目。每一标靶结合位点可特异性结合一个标靶分子或标靶分子上的特定位置或座位。当本发明的抗体包含不止一个标靶结合位点(多价)时,每个标靶结合位点可特异性结合相同或不同分子(例如可结合于不同配体或不同抗原,或同一抗原上的不同表位或位置)。出于本发明的目的,本发明的抗体将优选具有至少一个对人CD46具有特异性的结合位点。在一个实施例中,本发明的抗体将为单价抗体,因为该分子的每个结合位点将特异性结合单一CD46位置或表位。在其他实施例中,抗体将为多价抗体,因为其包含不止一个结合位点并且这些不同结合位点与不止一个的单一位置或表位特异性缔合。在这类情况下,多个表位可存在于所选的CD46多肽或剪接变体上,或者某单一表位可存在于CD46上,同时第二不同表位可存在于另一分子或表面上。参见例如美国专利No.2009/0130105。
如上文所提及的,多价抗体可免疫特异性地结合至所需标靶分子的不同表位或者可免疫特异性地结合至标靶分子以及异源表位(例如异源多肽或固体载体材料)二者。虽然抗CD46抗体的优选实施例仅结合两种抗原(即双特异性抗体),但本发明也涵盖具有额外的特异性的抗体(例如三特异性抗体)。双特异性抗体的例子包括但不限于哪些具有一个针对CD46的臂和另一个针对任何其他抗原(例如调节剂细胞标记物)的臂的抗体。制备双特异性抗体的方法是本领域已知的。传统上全长双特异性抗体的产生是基于两个免疫球蛋白重链-轻链对的共表达,其中两条链具有不同特异性(Millstein等人,1983,Nature(《自然》),305:537-539)。其他更复杂的相容性多特异性构建体及其制造方法描述于美国专利No.2009/0155255中。
在另外其他实施例中,具有所需结合特异性的抗体可变域(抗体-抗原组合位点)与免疫球蛋白恒定域序列融合。该融合优选为与包含铰链区、CH2区和/或CH3区的至少一部分的免疫球蛋白重链恒定域的融合。在一个例子中,含有轻链结合所需的位点的第一重链恒定区(CH1)存在于这类融合物的至少一者中。将编码免疫球蛋白重链融合物和(在需要时)免疫球蛋白轻链的DNA插入单独的表达载体中,并共转染至适合的宿主生物体中。在当用于构建的不等比率的三条多肽链提供最佳产率时的实施例中,这为调整三个多肽片段的相互比例提供极大灵活性。然而,当等比率的至少两条多肽链的表达产生高产率时或当该比率并不特别重要时,可以将两条或全部三条多肽链的编码序列插入一个表达载体中。
在这个方法的一个实施例中,双特异性抗体由一个臂中具有第一结合特异性(例如CD46)的杂交免疫球蛋白重链与另一个臂中杂交免疫球蛋白重链-轻链对(提供第二结合特异性)构成。发现这个不对称结构有助于所需双特异性化合物与非所需免疫球蛋白链组合的分离,因为免疫球蛋白轻链仅存在于双特异性分子的一半中可提供一种简便的分离方式。这个方法公开于WO 94/04690中。关于产生双特异性抗体的更多细节,参见例如Suresh等人,1986,Methods in Enzymology(《酶学方法》)121:210。根据WO96/27011中所述的另一方法,一对抗体分子可经工程改造而使自重组细胞培养物回收的异型二聚体的百分比最大化。优选的界面包含抗体恒定域的CH3域的至少一部分。在这个方法中,用较大侧链(例如酪氨酸或色氨酸)置换来自第一抗体分子界面的一个或多个小氨基酸侧链。通过用较小氨基酸侧链(例如丙氨酸或苏氨酸)置换大氨基酸侧链,在第二抗体分子界面上产生尺寸与大侧链相同或类似的补偿腔。这可提供使异型二聚体的产率提高超过其他非所需最终产物(例如同型二聚体)的机制。
双特异性抗体还包括交联抗体或杂缀合抗体(heteroconjugate antibody)。例如,杂缀合物(heteroconjugate)中的抗体中的一者可与抗生物素蛋白偶联,另一者与生物素偶联。例如,已提出将这种抗体用于使免疫系统细胞靶向非所需细胞(美国专利No.4,676,980)并用于治疗HIV感染(WO 91/00360、WO 92/200373和EP 03089)。杂缀合抗体可用任何便利的交联方法来制备。合适的交联剂是本领域所熟知的,并且与多种交联技术一起公开于美国专利No.4,676,980中。
VIII.CD46调节剂-恒定区修饰
a.Fc区和Fc受体
除上文所述的所公开调节剂(例如Fc-CD46或抗CD46抗体)的可变区或结合区的各种修饰、置换、添加或缺失外,本领域技术人员应当理解,本发明的所选的实施例也可包含恒定区(即Fc区)的置换或修饰。更具体地讲,设想到本发明的CD46调节剂可特别是含有一个或多个另外的氨基酸残基置换、突变和/或修饰,其产生具有优选的特征的化合物,这类特征包括但不限于:药物动力学改变、血清半衰期增加、结合亲和力增加、免疫原性降低、产量增加、Fc配体结合改变、ADCC或CDC活性增强或降低、糖基化和/或二硫键改变以及结合特异性修饰。就这一点而言,应当理解这些Fc变体可有利地用于增强所公开的调节剂的有效抗赘生性性质。
本文中的术语“Fc区”用于限定免疫球蛋白重链的C端区域,包括天然序列Fc区和变体Fc区在内。尽管免疫球蛋白重链的Fc区的边界可变化,但人IgG重链Fc区通常定义为自位置Cys226的氨基酸残基或自Pro230延伸至其羧基末端。Fc区的C端赖氨酸(残基447,根据EU编号系统)可例如在产生或纯化抗体期间或通过对编码抗体重链的核酸进行重组工程改造来移除。因此,完整抗体的组成可包含移除了所有K447残基的抗体群体、未移除K447残基的抗体群体和具有有和无K447残基的抗体的混合物的抗体群体。功能Fc区具有天然序列Fc区的效应子功能。例示性的效应子功能包括C1q结合;CDC;Fc受体结合;ADCC;吞噬作用;下调细胞表面受体(例如B细胞受体;BCR)等。这类效应子功能一般需要Fc区与结合域(例如抗体可变域)组合且可使用如例如本文定义中所公开的各种测定法来评估。
Fc受体或FcR描述与抗体的Fc区结合的受体。在一些实施例中,FcR为天然人FcR。在一些实施例中,FcR为结合IgG抗体的FcR(γ受体)并且包括FcγRI、FcγRII及FcγRIII亚类的受体,包括那些受体的等位基因变体和选择性剪接形式在内。FcγRII受体包括FcγRIIA(活化性受体)和FcγRIIB(抑制性受体),其具有类似氨基酸序列,主要不同之处为其细胞质结构域。活化性受体FcγRIIA在其细胞质结构域中含有基于免疫受体酪氨酸的活化基序(ITAM)。抑制性受体FcγRIIB在其细胞质结构域中含有基于免疫受体酪氨酸的抑制基序(ITIM)。(参见例如Daeron,Annu.Rev.Immunol.(《免疫学年度评论》)15:203-234(1997))。FcR例如在Ravetch和Kinet,Annu.Rev.Immunol(《免疫学年度评论》)9:457-92(1991);Capel等人,Immunomethods(《免疫方法》)4:25-34(1994);以及de Haas等人,J.Lab.Clin.Med.(《实验和临床医学杂志》)126:330-41(1995)中进行了综述。本文中的术语“FcR”涵盖其他FcR,包括有待将来鉴别的FcR。术语“Fc受体”或“FcR”也包括新生儿受体FcRn,其在某些情况下负责母体IgG向胎儿的转移(Guyer等人,J.Immunol.(《免疫学杂志》)117:587(1976)以及Kim等人,J.Immunol.(《免疫学杂志》)24:249(1994))和免疫球蛋白的稳态的调节。测量与FcRn的结合的方法是已知的(参见例如Ghetie和Ward.,Immunol.Today(《当代免疫学》)18(12):592-598(1997);Ghetie等人,Nature Biotechnology(《自然生物技术》),15(7):637-640(1997);Hinton等人,J.Biol.Chem.(《生物化学杂志》)279(8):6213-6216(2004);WO 2004/92219(Hinton等人))。
b.Fc功能
如本文中所使用,补体依赖性细胞毒性及CDC是指标靶细胞在补体存在下溶解。补体活化途径是通过补体系统的第一组分(C1q)与分子(例如与同源(cognate)抗原复合的抗体)的结合来起始。为评估补体活化,可进行CDC测定法,例如如Gazzano-Santoro等人,1996,J.Immunol.Methods(免疫学方法杂志),202:163中所述。
此外,抗体依赖性细胞介导的细胞毒性或ADCC是指这样的细胞毒性形式,即结合于某些细胞毒性细胞(例如天然杀伤(NK)细胞、中性粒细胞和巨噬细胞)上存在的Fc受体(FcR)上的分泌性Ig使得这些细胞毒性效应细胞能够特异性结合于带有抗原的标靶细胞并随后用细胞毒素杀灭该标靶细胞。针对标靶的特异性高亲和力IgG抗体武装细胞毒性细胞并且绝对是这种杀灭所需的。标靶细胞的溶解是在细胞外发生的,需要细胞与细胞直接接触,不涉及补体。
FcR结合亲和力或ADCC活性改变的CD46调节剂变体,是与亲本或未经修饰的抗体或与包含天然序列Fc区的调节剂相比FcR结合活性和/或ADCC活性增强或减弱的调节剂。展示出FcR结合增加的调节剂变体,其结合至少一个FcR的亲和力好于亲本或未经修饰的抗体或包含天然序列Fc区的调节剂。展示出FcR结合降低的变体,其结合至少一个FcR的亲和力差于亲本或未经修饰的抗体或包含天然序列Fc区的调节剂。展示出FcR结合降低的这类变体可具有极少的或没有明显的FcR结合,例如与天然序列IgG Fc区相比FcR结合为0-20%,例如由本领域熟知的技术所测定的。
关于FcRn,本发明的抗体也包含或涵盖具有这样的恒定区修饰的Fc变体,所述修饰在哺乳动物(优选人)中提供大于5天、大于10天、大于15天、优选大于20天、大于25天、大于30天、大于35天、大于40天、大于45天、大于2个月、大于3个月、大于4个月或大于5个月的半衰期。本发明的抗体(或含有Fc的分子)在哺乳动物(优选人)中的半衰期增加导致所述抗体或抗体片段在哺乳动物中的血清滴度较高,因此降低施用所述抗体或抗体片段的频率和/或降低要施用的所述抗体或抗体片段的浓度。体内半衰期增加的抗体可通过本领域技术人员已知的技术来产生。例如,体内半衰期增加的抗体可通过修饰(例如置换、缺失或添加)被鉴别为涉及Fc域与FcRn受体之间的相互作用的氨基酸残基来产生(参见例如国际公开No.WO 97/34631号;No.WO 04/029207;美国专利No.6,737,056和美国专利No.2003/0190311)。人FcRn高亲和力结合多肽与人FcRn的体内结合以及其血清半衰期,可例如在表达人FcRn的转基因小鼠或经转染的人细胞系中或在施用具有变体Fc区的多肽的灵长类动物中进行测定。WO 2000/42072描述了与FcRn结合改善或减弱的抗体变体。还可参见例如Shields等人,J.Biol.Chem.(《生物化学杂志》)9(2):6591-6604(2001)。
c.糖基化修饰
在另外其他实施例中,本发明抗体的糖基化模式或组成是经改良的。更具体而言,本发明的优选实施例可包含一种或多种经工程改造的糖型(glycoform),即糖基化模式改变或共价连接至包含Fc区的分子的碳水化合物组成改变。经工程改造的糖型可用于多种目的,包括但不限于增强或降低效应子功能、增加抗体对标靶抗原的亲和力或促进抗体产生。在需要降低效应子功能的情况下,应当理解,分子可经工程改造以呈非糖基化形式表达。这类碳水化合物修饰可通过例如改变抗体序列内的一个或多个糖基化位点来实现。即,可进行一个或多个氨基酸置换,使一个或多个可变区构架糖基化位点消除,从而消除该位点的糖基化(参见例如美国专利No.5,714,350和6,350,861)。相反,可通过在一个或多个另外的糖基化位点进行工程改造来给含有Fc的分子赋予增强的效应子功能或改善的结合。
另外或者作为另一种选择,可制备糖基化组成改变的Fc变体,例如岩藻糖基残基量减少的低岩藻糖基化抗体或对分GlcNAc结构增加的抗体。已证明这些及类似的经改变的糖基化模式可增加抗体的ADCC能力。经工程改造的糖型可通过本领域技术人员已知的任何方法来产生,例如通过使用经工程改造的或变体表达株、通过与一种或多种酶(例如N-乙酰葡糖胺基转移酶III(GnTI 11))共表达、通过在多种生物体或来自多种生物体的细胞系中表达包含Fc区的分子或通过在已表达包含Fc区的分子后修饰碳水化合物来产生。参见例如Shields,R.L.等人,(2002)J.Biol.Chem.(《生物化学杂志》)277:26733-26740;Umana等人,(1999)Nat.Biotech.(《自然生物技术》)17:176-1以及欧洲专利No:EP 1,176,195;PCT公开WO 03/035835;WO 99/54342;Umana等人,1999,Nat.Biotechnol.(《自然生物技术》)17:176-180;Davies等人,20017Biotechnol Bioeng(《生物技术和生物工程》)74:288-294;Shields等人,2002,J Biol Chem(《生物化学杂志》)277:26733-26740;Shinkawa等人,2003,J Biol Chem(《生物化学杂志》)278:3466-3473);美国专利No.6,602,684;美国专利No.10/277,370;10/113,929;PCT WO 00/61739A1;PCT WO 01/292246A1;PCT WO 02/311140A1;PCT WO 02/30954A1;PotillegentTM技术(Biowa,Inc.);GlycoMAbTM糖基化工程改造技术(GLYCART biotechnology AG);WO 00061739;EA01229125;美国专利No.2003/0115614;Okazaki等人,2004,JMB,336:1239-49。
IX.调节剂表达
a.概述
编码所需CD46调节剂的DNA容易使用常规程序(例如通过使用能够特异性结合至编码抗体重链和轻链的基因的寡核苷酸探针)进行分离和测序。如果调节剂为抗体,则经分离和亚克隆的杂交瘤细胞(或来源于噬菌体或酵母的集落)可用作该DNA的优选来源。如果需要,可进一步如本文所述操纵核酸以产生包括融合蛋白或嵌合抗体、人源化抗体或全人抗体的作用剂(agent)。更具体而言,分离的DNA(其可经修饰)可用于克隆恒定区和可变区序列以用于如美国专利No.7,709,611中所述的抗体制造。
该例示性方法需要从所选的细胞提取RNA、转化成cDNA以及使用抗体特异性引物通过PCR扩增。合适的引物是本领域所熟知的并且如本文所例示的,容易从多种商业来源商购获得。应当理解,为表达通过筛选组合文库分离的重组人或非人抗体,将编码抗体的DNA克隆进重组表达载体中并引入宿主细胞中,包括哺乳动物细胞、昆虫细胞、植物细胞、酵母和细菌。在另外其他实施例中,将调节剂引入原本不产生所需构建体的猿COS细胞、NS0细胞、中国仓鼠卵巢(CHO)细胞或骨髓瘤细胞中并由其表达。如下文将更详细论述的,表达所需调节剂的转化细胞可相对大量地生长以提供融合构建体或免疫球蛋白的临床和商业供应。
无论编码CD46调节剂的所需部分的核酸是以合成方式获自或来源于噬菌体展示技术、酵母文库、基于杂交瘤的技术还是获自商业来源,应当了解本发明明确涵盖编码CD46调节剂(包括融合蛋白和抗CD46抗体或其抗原结合片段或衍生物)的核酸分子和序列。本发明进一步涵盖在高严格杂交条件下或者在中等或较低严格杂交条件下(例如如下文所定义的),与互补于具有编码本发明调节剂或其片段或变体的多核苷酸序列的核酸的多核苷酸杂交的核酸或核酸分子(例如多核苷酸)。本文所用的术语“核酸分子”或“分离的核酸分子”意在包括至少DNA分子和RNA分子。核酸分子可为单链或双链,但优选为双链DNA。此外,本发明包括任何掺有该编码调节剂的多核苷酸的载体或构建体,包括但不限于载体、质粒、宿主细胞、粘粒或病毒构建体。
术语“分离的核酸”意指该核酸(i)例如通过聚合酶链反应(PCR)体外扩增,(ii)通过克隆重组产生,(iii)例如通过裂解和胶凝-电泳分级分离而纯化,或(iv)例如通过化学合成而合成。分离的核酸为可用于通过重组DNA技术操纵的核酸。
更具体而言,还提供编码调节剂(包括本发明抗体的一条或两条链)或其片段、衍生物、突变蛋白或变体的核酸、足以用作杂交探针的多核苷酸、用于鉴别、分析、突变或扩增编码多肽的多核苷酸的PCR引物或测序引物、用于抑制多核苷酸表达的反义核酸和上述各者的互补序列。核酸可为任何长度。其长度可为例如5、10、15、20、25、30、35、40、45、50、75、100、125、150、175、200、250、300、350、400、450、500、750、1,000、1,500、3,000、5,000个或更多个核苷酸,和/或其可包含一条或多条其他序列(例如调节序列)和/或为较大核酸(例如载体)的一部分。这些核酸可为单链或双链且可包含RNA和/或DNA核苷酸以及其人造变体(例如肽核酸)。编码本发明的调节剂(包括抗体或其免疫反应性片段或衍生物)的核酸优选已如上文所述分离。
b.杂交和同一性
如所指出,本发明还提供在特定杂交条件下与其他核酸杂交的核酸。使核酸杂交的方法是本领域所熟知的。参见例如Current Protocols in Molecular Biology(《现代分子生物学实验技术》),纽约约翰父子出版社(John Wiley&Sons,N.Y.)(1989),6.3.1-6.3.6。出于本申请案的目的,中等严格杂交条件使用含有5×氯化钠/柠檬酸钠(SSC)、0.5%SDS、1.0mM EDTA(pH8.0)的预洗涤溶液,含有约50%甲酰胺、6×SSC的杂交缓冲液和55℃的杂交温度(或其他类似杂交溶液,例如含有约50%甲酰胺的溶液,使用42℃的杂交温度),以及60℃、在0.5×SSC、0.1%SDS中的洗涤条件。严格杂交条件在45℃下在6×SSC中进行杂交,随后在68℃下在0.1×SSC、0.2%SDS中洗涤一次或多次。此外,本领域技术人员可操纵杂交和/或洗涤条件以提高或降低杂交严格性,使得包含彼此具有至少65%、70%、75%、80%、85%、90%、95%、98%或99%同一性的核苷酸序列的核酸通常仍保持彼此杂交。更一般而言,出于本公开的目的,关于核酸序列的术语“与...实质相同”可视为核苷酸序列展现与参考核酸序列具有至少约85%或90%或95%或97%序列同一性。
影响杂交条件的选择的基本参数以及设计合适条件的指导例如由Sambrook,Fritsch和Maniatis(1989,Molecular Cloning:A Laboratory Manual(《分子克隆:实验室手册》),纽约冷泉港的冷泉港实验室出版社(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.),第9章和第11章;以及Current Protocols in Molecular Biology(《现代分子生物学实验室方法》),1995,Ausubel等人编辑,约翰父子公司(John Wiley&Sons,Inc.),章节2.10和6.3-6.4)描述,并且容易由本领域一般技术人员根据例如核酸的长度和/或碱基组成来确定。
应进一步理解,根据本发明,核酸可单独存在或与可能同源或异源的其他核酸组合存在。在优选的实施例中,核酸与相对于所述核酸而言可能同源或异源的表达控制序列功能性连接。就此而论,术语“同源”意指核酸也天然地与该表达控制序列功能性连接,术语“异源”意指核酸并非天然地与该表达控制序列功能性连接。
c.表达
若核酸(例如表达RNA和/或蛋白质或肽的核酸)与表达控制序列以使得所述核酸的表达或转录受所述表达控制序列控制或影响的方式彼此共价连接,则它们彼此功能性连接。若核酸待翻译成功能性蛋白质,则在表达控制序列与编码序列功能性连接下,诱导所述表达控制序列可使所述核酸转录,而不会引起所述编码序列的移码或所述编码序列不能够被翻译成所需蛋白质或肽。
根据本发明,术语“表达控制序列”包含启动子、核糖体结合位点、增强子和调节基因转录或mRNA翻译的其他控制元件。在本发明的特定实施例中,表达控制序列可经调节。表达控制序列的确切结构可随物种或细胞类型而异,但一般包含分别涉及转录和翻译的起始的5'非转录序列与5'-和3'-非翻译序列,例如TATA盒、加帽序列、CAAT序列等等。更具体而言,5'-非转录表达控制序列包含包括用于对功能性连接的核酸进行转录控制的启动子序列的启动子区。表达控制序列还可包含增强子序列或上游激活序列(upstream activator sequence)。
根据本发明,术语“启动子”或“启动子区”是指位于所表达的核酸序列的上游(5')且通过提供RNA聚合酶的识别和结合位点来控制该序列的表达的核酸序列。启动子区可包括针对涉及调节基因转录的其他因子的其他识别和结合位点。启动子可控制原核或真核基因的转录。此外,启动子可为诱导型的且可响应诱导剂而起始转录,或者如果转录不受诱导剂控制,则可为组成型的。如果不存在诱导剂,则受诱导型启动子控制的基因不表达或仅以很小程度表达。在诱导剂的存在下,该基因被打开或转录水平增加。这一般通过特定转录因子的结合来介导。
根据本发明的优选启动子包括SP6、T3和T7聚合酶的启动子、人U6RNA启动子、CMV启动子和它们的人造杂交启动子(例如CMV)(其中一部分或一些部分与其他细胞蛋白质例如人GAPDH(甘油醛-3-磷酸脱氢酶)的基因的启动子的一部分或一些部分融合),并且包括或不包括额外内含子。
根据本发明,术语“表达”以其最一般含义使用,包含RNA的产生或RNA和蛋白质/肽的产生。其也包括核酸的部分表达。此外,表达可短暂或稳定进行。
在一个优选的实施例中,根据本发明,核酸分子存在于适当时具有控制该核酸的表达的启动子的载体中。术语“载体”在本文中以其最一般的含义使用,包含任何用于核酸而使所述核酸例如能够引入原核和/或真核细胞中以及适当时整合进基因组中的中间载体。这类载体优选在细胞中复制和/或表达。载体可包含质粒、噬菌粒、噬菌体或病毒基因组。本文所用的术语“质粒”一般是指染色体外遗传物质的构建体,通常为环状DNA双链体,其可独立于染色体DNA进行复制。
在实施本发明时,应当理解可任选使用分子生物学、微生物学和重组DNA技术中的许多常规技术。这类常规技术与本文所定义的载体、宿主细胞和重组方法相关。这些技术是众所周知的并且例如在如下文献中进行说明:Berger和Kimmel,Guide to Molecular Cloning Techniques(《分子克隆技术指南》),Methods in Enzymology(《酶学方法》),第152卷,学术出版社,加州圣地亚哥(Academic Press,Inc.,San Diego,Calif.);Sambrook等人,Molecular Cloning-A Laboratory Manual(《分子克隆-实验室手册》)(第3版),第1-3卷,纽约冷泉港的冷泉港实验室出版社(Cold Spring Harbor Laboratory,Cold Spring Harbor,N.Y.),2000年以及Current Protocols in Molecular Biology(《现代分子生物学实验方法》),F.M.Ausubel等人编辑(出处同上)。其他有用的参考文献,例如关于细胞分离和培养(例如关于后续核酸或蛋白质分离)包括:Freshney(1994)Culture of Animal Cells,a Manual of Basic Technique(《动物细胞的培养:基础技术手册》),第三版,纽约Wiley-Liss出版社,以及其中引用的文献;Payne等人,(1992)Plant Cell and Tissue Culture in Liquid Systems(《液体系统中的植物细胞和组织培养》),纽约约翰·威利父子出版公司(John Wiley&Sons,Inc.New York,N.Y.);Gamborg和Phillips(编辑)(1995)Plant Cell,Tissue and Organ Culture;Fundamental Methods Springer Lab Manual(《植物细胞、组织和器官培养:基本方法-斯普林格实验室手册》),施普林格出版社(Springer-Verlag)(柏林、海德尔堡、纽约);以及Atlas和Parks(编辑)The Handbook of Microbiological Media(《微生物培养基手册》)(1993)弗罗里达州伯克莱屯的CRC出版社(CRC Press,Boca Raton,Fla)。制备核酸的方法(例如通过体外扩增、从细胞纯化或化学合成)、操纵核酸的方法(例如定点诱变、通过限制酶消化、连接等)以及各种可用于操纵和制备核酸的载体、细胞系等等在如上参考文献中进行了描述。另外,基本上任何多核苷酸(包括例如,经标记或生物素化的多核苷酸)均可从多个商业来源中的任一个定制或标准订购。
因此,在一个方面中,本发明提供使本发明的抗体或其部分可以重组表达的重组宿主细胞。通过在这类重组宿主细胞中表达而产生的抗体在本文中称为重组抗体。本发明还提供这类宿主细胞的子代细胞,以及由其产生的抗体。
本文所用的术语“重组宿主细胞”(或简称为宿主细胞)意指已引入重组表达载体的细胞。应当理解,重组宿主细胞和宿主细胞不仅意指特定受试细胞,而是还意指这种细胞的子代。因为某些修饰可能因突变或环境影响而在后续各代中发生,所以这种子代实际上可能与亲本细胞不相同,但其仍包括在本文所用的术语宿主细胞的范畴内。这类细胞可包含如上文所述的根据本发明的载体。
在另一个方面中,本发明提供制备如本文所述的抗体或其一部分的方法。根据一个实施例,所述方法包括培养用如上文所述的载体转染或转化的细胞,以及回收该抗体或其部分。
如上文所指出,本发明的抗体(或其片段或变体)的表达优选包括含有编码所需抗CD46抗体的多核苷酸的表达载体。本领域技术人员熟知的方法可用于构建包含抗体编码序列和适当的转录及翻译控制信号的表达载体。这些方法包括例如体外重组DNA技术、合成技术和体内遗传重组。因此,本发明的实施例提供可复制载体,该载体包含与启动子有效连接的编码本发明抗CD46抗体(例如完全抗体、抗体的重链或轻链、抗体的重链或轻链可变域或它们的部分,或者重链或轻链CDR、单链Fv或它们的片段或变体)的核苷酸序列。在优选的实施例中,这类载体可包括编码抗体分子的重链(或其片段)的核苷酸序列、编码抗体的轻链(或其片段)或重链与轻链二者的核苷酸序列。
一旦本发明的核苷酸已根据本文教导分离和修饰,则可将其用于产生包括抗CD46抗体或其片段的所选的调节剂。
X.调节剂产生和纯化
使用本领域公认的分子生物学技术和当前蛋白质表达方法,可产生相当大数量的所需调节剂。更具体而言,可将编码调节剂(例如如上文所述获得以及经工程改造的抗体)的核酸分子整合到所熟知的以及市售的蛋白质产生系统(包含各种类型的宿主细胞)中以提供临床前、临床或商业数量的所需医药产品。应当理解,在优选的实施例中,将编码调节剂的核酸分子工程改造进载体或表达载体中,所述载体或表达载体使其有效整合进所选的宿主细胞中并随后提供高表达水平的所需CD46调节剂。
优选地,编码CD46调节剂的核酸分子和包含这些核酸分子的载体可用于转染合适的哺乳动物、植物、细菌或酵母宿主细胞,但应当理解,可使用原核系统产生调节剂。转染可通过任何将多核苷酸引入宿主细胞中的已知方法来进行。将异源多核苷酸引入哺乳动物细胞中的方法是本领域所熟知的,包括葡聚糖介导的转染、磷酸钙沉淀、聚凝胺(polybrene)介导的转染、原生质体融合、电穿孔、多核苷酸封装于脂质体以及DNA直接显微注射进细胞核中。另外,核酸分子可通过病毒载体引入哺乳动物细胞中。转化哺乳动物细胞的方法是本领域所熟知的。参见例如美国专利No.4,399,216、No.4,912,040、No.4,740,461和No.4,959,455。此外,转化植物细胞的方法是本领域所熟知的,包括例如农杆菌(Agrobacterium)介导的转化、生物射弹转化、直接注射、电穿孔以及病毒转化。转化细菌和酵母细胞的方法也是本领域所熟知的。
此外,可将宿主细胞用两种本发明的表达载体(例如编码衍自重链的多肽的第一载体和编码衍自轻链的多肽的第二载体)共转染。两种载体可含有使得能够实质上同等表达重链和轻链多肽的相同选择性标记。或者,可使用编码且能够表达重链和轻链多肽二者的单一载体。在这种情况下,优选将轻链置于重链之前以避免过量的毒性游离重链。重链和轻链的编码序列可包含cDNA或基因组DNA。
a.宿主表达系统
多种宿主表达载体系统(许多可商购获得)与本文的教导相容且可用于表达本发明的调节剂。这类宿主表达系统代表可使所关注的编码序列被表达且随后纯化的载体,也代表当用适当核苷酸编码序列转化或转染时可原位表达本发明的分子的细胞。这类系统包括但不限于:转染有含有调节剂编码序列的重组噬菌体DNA、质粒DNA或粘粒DNA表达载体的微生物如细菌(例如大肠杆菌、枯草芽孢杆菌(B.subtilis)、链霉菌属(streptomyces));转染有含有调节剂编码序列的重组酵母表达载体的酵母(例如酵母属(Saccharomyces)、毕赤酵母属(Pichia));转染有含有调节剂编码序列的重组病毒表达载体(例如杆状病毒)的昆虫细胞系统;感染有含有调节剂编码序列的重组病毒表达载体(例如花椰菜花叶病毒,CaMV;烟草花叶病毒,TMV)或转染有含有调节剂编码序列的重组质粒表达载体(例如Ti质粒)的植物细胞系统(例如烟草属(Nicotiana)、拟南芥属(Arabidopsis)、浮萍、玉米、小麦、马铃薯等);或具有含有衍自哺乳动物细胞基因组的启动子(例如金属硫蛋白启动子)或衍自哺乳动物病毒的启动子(例如腺病毒晚期启动子;牛痘病毒7.5K启动子)的重组表达构建体的哺乳动物细胞系统(例如COS、CHO、BHK、293、3T3细胞)。
在细菌系统中,可根据所表达分子的预定用途有利地选择多种表达载体。例如,当要产生大量的该蛋白质时,为了产生调节剂的药物组合物,引导易于纯化的融合蛋白产物的高水平表达的载体可能是合乎需要的。这类载体包括但不限于:大肠杆菌表达载体pUR278(Ruther等人,EMBO 1.2:1791(1983)),其中编码序列可单独地连接进该载体中与lac Z编码区同框,使得融合蛋白得以产生;pIN载体(Inouye&Inouye,Nucleic Acids Res.(《核酸研究》)13:3101-3109(1985);Van Heeke&Schuster,J.Biol.Chem.(《生物化学杂志》)24:5503-5509(1989))等等。pGEX载体也可用于将外来多肽表达为具有谷胱甘肽5-转移酶(GST)的融合蛋白。一般而言,这类融合蛋白为可溶性的,可通过吸附及结合至基质谷胱甘肽琼脂糖珠然后在游离谷胱甘肽存在下洗脱,来容易地从裂解的细胞纯化。pGEX载体设计成包括凝血酶或因子Xa蛋白酶切割位点,使得所克隆的标靶基因产物可从GST部分释放出来。
在昆虫系统中,苜蓿银纹夜蛾(Autographa californica)核型多角体病毒(AcNPV)可用作表达外来基因的载体。这种病毒在草地贪夜蛾(Spodoptera frugiperda)细胞中生长。可将编码序列单独地克隆进该病毒的非必需区(例如多角体蛋白基因)中并置于AcNPV启动子(例如多角体蛋白启动子)的控制下。
在哺乳动物宿主细胞中,可将多种基于病毒的表达系统用于引入所需核苷酸序列。在使用腺病毒作为表达载体的情形中,可将所关注的编码序列连接至腺病毒转录/翻译控制复合物,例如晚期启动子和三联前导序列。然后可通过体外或体内重组,将该嵌合基因插入在腺病毒基因组中。插入在病毒基因组的非必需区(例如区域E1或E3)中将产生在受感染宿主中有活力且能够表达该分子的重组病毒(例如参见Logan和Shenk,Proc.Natl.Acad.Sci.USA(《美国科学院院刊》)8 1:355-359(1984))。所插入的编码序列的有效翻译也可能需要特定的起始信号。这些信号包括ATG起始密码子和相邻序列。此外,该起始密码子必须与所需的编码序列的阅读框架同相(in phase),以确保整个插入物的翻译。这些外源的翻译控制信号和起始密码子可具有多种来源(天然来源和合成来源二者)。表达效率可通过包括适当的转录增强子元件、转录终止子等来提高(参见例如Bittner等人,Methods in Enzymol.(《酶学方法》)153:51-544(1987))。因而,可用作表达宿主的相容的哺乳动物细胞系是本领域所熟知的且包括可得自美国典型培养物保藏中心(American Type Culture Collection,ATCC)的许多永生化细胞系。这些细胞尤其包括中国仓鼠卵巢(CHO)细胞、NS0细胞、SP2细胞、HEK-293T细胞、293Freestyle细胞(美国生命科技公司(Life Technologies))、NIH-3T3细胞、海拉细胞(HeLa cell)、幼仓鼠肾(BHK)细胞、非洲绿猴肾细胞(COS)、人肝细胞癌细胞(例如Hep G2)、A549细胞以及多种其他细胞系。
为长期高收率产生重组蛋白质,稳定表达是优选的。因此,可用本领域公认的标准技术来工程改造出稳定表达所选的调节剂的细胞系。可用受适当的表达控制元件(例如启动子、增强子、序列、转录终止子、多腺苷酸化位点等)控制的DNA和用选择性标记转化宿主细胞,而非使用含有病毒复制起点的表达载体。引入外来DNA后,可让经工程改造的细胞在富集培养基中生长1-2天,然后转入选择培养基中。重组质粒中的选择性标记赋予对选择的抗性并且让细胞将质粒稳定整合进其染色体中并生长至形成转化灶(foci),转化灶继而可进行克隆并扩增成细胞系。这个方法可有利地用于对表达该分子的细胞系进行工程改造。这类经工程改造的细胞系尤其可用于筛选和评价与该分子直接或间接相互作用的组合物。
多种选择系统是本领域所熟知的且可以使用,包括但不限于:单纯疱疹病毒胸苷激酶(Wigler等人,Cell(《细胞》)11:223(1977))、次黄嘌呤鸟嘌呤磷酸核糖转移酶(Szybalska&Szybalski,Proc.Natl.Acad.Sci.USA(《美国科学院院刊》)48:202(1992))和腺嘌呤磷酸核糖转移酶(Lowy等人,Cell(《细胞》)22:8 17(1980))基因,它们分别可用于tk细胞、hgprt细胞或aprt细胞中。此外,抗代谢物抗性可用作选择以下基因的基础:dhfr,其赋予对甲氨喋呤的抗性(Wigler等人,Natl.Acad.Sci.USA(《美国科学院院刊》)77:357(1980);O'Hare等人,Proc.Natl.Acad.Sci.USA(《美国科学院院刊》)78:1527(1981));gpt,其赋予对霉酚酸的抗性(Mulligan和Berg,Proc.Natl.Acad.Sci.USA(《美国科学院院刊》)78:2072(1981));neo,其赋予对氨基糖苷G-418的抗性(Clinical Pharmacy(《临床药学》)12:488-505;Wu和Wu,Biotherapy(《生物疗法》)3:87-95(1991);Tolstoshev,Ann.Rev.Pharmacol.Toxicol.(《药理学与毒理学年度评论》)32:573-596(1993);Mulligan,Science(《科学》)260:926-932(1993);以及Morgan和Anderson,Ann.Rev.Biochem.(《生物化学年度评论》)62:191-217(1993);TIB TECH 11(5):155-2 15(1993年5月));和hygro,其赋予对潮霉素的抗性(Santerre等人,Gene(《基因》)30:147(1984))。可按常规将重组DNA技术领域通常已知的方法应用于选择所需的重组克隆,这类方法例如描述于如下文献中:Ausubel等人(编辑),Current Protocols in Molecular Biology(《现代分子生物学实验方法》),纽约约翰·威利父子出版公司(John Wiley&Sons,NY)(1993);Kriegler,Gene Transfer and Expression,A Laboratory Manual(《基因转移和表达-实验室手册》),Stockton Press,NY(1990);以及第12章和第13章,Dracopoli等人(编辑),Current Protocols in Human Genetics(《当代人类遗传学实验方法》),纽约约翰·威利父子出版公司(1994);Colberre-Garapin等人,J.Mol.Biol.(《分子生物学杂志》)150:1(1981)。应当理解,一种尤其优选的确立稳定高收率细胞系的方法包括谷氨酰胺合成酶基因表达系统(GS系统),其提供在某些条件下增强表达的有效方法。该GS系统在EP专利0 216 846、0 256 055、0 323 997和0 338 841中完整或部分地进行了论述,将这些专利每一者以引用的方式并入本文。
另外,可选择调节所插入序列的表达或以所需的特定方式修饰和加工基因产物的宿主细胞株。蛋白质产物的这类修饰(例如糖基化)和加工(例如切割)对于蛋白质的功能和/或纯化可能是重要的。不同宿主细胞具有用于蛋白质及基因产物的翻译后加工和修饰的特征性和特异性机制。如本领域已知的,可选择适当细胞系或宿主系统以确保对所表达的多肽进行所需的修饰和加工。为此,具有用于初级转录物的适当加工、基因产物的糖基化和磷酸化的细胞机构的真核宿主细胞可尤其有效用于本发明。因此,尤其优选的哺乳动物宿主细胞包括但不限于CHO、VERY、BHK、HeLa、COS、NS0、MDCK、293、3T3、W138以及乳腺癌细胞系(例如BT483、Hs578T、HTB2、BT2O和T47D)以及正常乳腺细胞系(例如CRL7O3O和HsS78Bst)。根据调节剂和所选的产生系统,本领域技术人员可容易地选择和优化适当的宿主细胞以有效表达该调节剂。
b.化学合成
除了上述宿主细胞系统外,应当理解本发明的调节剂可用本领域已知的技术以化学方法合成(例如参见Creighton,1983,Proteins:Structures and Molecular Principles(《蛋白质:结构和分子原理》),W.H.Freeman&Co.,N.Y.,以及Hunkapiller,M.等人,1984,Nature(《自然》)310:105-111)。例如,对应于本发明多肽片段的肽可通过使用肽合成仪来合成。此外,如果需要,非经典氨基酸或化学氨基酸类似物可作为置换或添加引入多肽序列中。非经典氨基酸包括但不限于:常见氨基酸的D-异构体、2,4-二氨基丁酸、a-氨基异丁酸、4-氨基丁酸、Abu、2-氨基丁酸、g-Abu、e-Ahx、6-氨基己酸、Aib、2-氨基异丁酸、3-氨基丙酸、鸟氨酸、正亮氨酸、正缬氨酸、羟脯氨酸、肌氨酸、瓜氨酸、高瓜氨酸、磺丙氨酸、叔丁基甘氨酸、叔丁基丙氨酸、苯基甘氨酸、环己基丙氨酸、b-丙氨酸、氟代氨基酸、设计氨基酸(designer amino acid)(例如b-甲基氨基酸、Ca-甲基氨基酸、Na-甲基氨基酸)以及一般氨基酸类似物。此外,氨基酸可以是D型(右旋)或L型(“左旋”)的。
c.转基因系统
还可通过产生对所关注免疫球蛋白重链和轻链序列(或其片段或衍生物或变体)而言是转基因的哺乳动物或植物以及以可回收形式产生所需化合物,来以转基因方式产生本发明的CD46调节剂。关于在哺乳动物中的转基因生产,例如,抗CD46抗体可在山羊、奶牛或其他哺乳动物的乳汁中产生并从其中回收。参见例如美国专利No.5,827,690、No.5,756,687、No.5,750,172和No.5,741,957。在一些实施例中,用如上文所述的CD46或其免疫原性部分免疫包含人免疫球蛋白基因座的非人转基因动物。在植物中制备抗体的方法例如描述于美国专利No.6,046,037和5,959,177中。
根据本文的教导,非人转基因动物或植物可通过使用标准转基因技术将一个或多个编码本发明的CD46调节剂的核酸分子引入动物或植物中来产生。参见Hogan以及美国专利No.6,417,429。用于制备转基因动物的转基因细胞可为胚胎干细胞或体细胞或受精卵。转基因非人生物体可为嵌合、非嵌合杂合子以及非嵌合纯合子。参见例如Hogan等人,Manipulating the Mouse Embryo:A Laboratory Manual 2nd ed.(《操纵小鼠胚:实验室手册-第2版》),冷泉港实验室出版社(Cold Spring Harbor Press)(1999);Jackson等人,Mouse Genetics and Transgenics:A Practical Approach(《小鼠遗传学和转基因:实用手册》),牛津大学出版社(Oxford University Press)(2000);以及Pinkert,Transgenic Animal Technology:A Laboratory Handbook(《转基因动物技术:实验室手册》),美国学术出版社(Academic Press)(1999)。在一些实施例中,转基因非人动物具有由编码例如所关注的重链和/或轻链的靶向构建体作出的定向破坏和替换。在一个实施例中,转基因动物包含并表达编码与CD46的重链和轻链特异性结合的核酸分子。虽然抗CD46抗体可在任何转基因动物中制备,但在尤其优选的实施例中,非人动物为小鼠、大鼠、绵羊、猪、山羊、牛或马。在另外的实施例中,非人转基因动物在血液、乳汁、尿、唾液、眼泪、粘液及其他体液中表达所需医药产物,该产物容易使用本领域公认的纯化技术从这类体液中获得。
由不同细胞系表达或在转基因动物中表达的调节剂(包括抗体)很可能会具有彼此不同的糖基化模式。然而,由本文所提供的核酸分子编码或包含本文所提供的氨基酸序列的所有调节剂均为本发明的一部分,而不管分子的糖基化状态如何,且更一般地说,不管翻译后修饰存在与否。另外,本发明涵盖在翻译期间或之后,例如通过糖基化、乙酰化、磷酸化、酰胺化、由已知保护基/封闭基团衍生、蛋白水解切割、与抗体分子或其他细胞配体键合等进行差异修饰的调节剂。多种化学修饰中的任一种可通过已知技术进行,包括但不限于:通过溴化氰、胰蛋白酶、胰凝乳蛋白酶、木瓜蛋白酶、V8蛋白酶、NaBH4进行的特定化学切割,乙酰化,甲酰化,氧化,还原,在衣霉素(tunicamycin)存在下的代谢合成等。本发明还涵盖各种翻译后修饰,包括例如N-连接或O-连接碳水化合物链、N末端或C末端加工、化学部分附接于氨基酸主链、N-连接或O-连接碳水化合物链的化学修饰以及由原核宿主细胞表达引起的N末端甲硫氨酸残基的添加或缺失。此外,如正文和下文的“实例”中所述,多肽也可用可检测标记如酶标记、荧光标记、放射性同位素标记或亲和标记进行修饰,以便调节剂的检测和分离。
d.纯化
一旦本发明的调节剂通过重组表达或本文所公开的其他技术中的任一者产生,其可通过本领域已知的任何用于纯化免疫球蛋白的方法纯化,或更一般地通过任何其他用于纯化蛋白质的标准技术纯化。就此而言,可分离调节剂。如本文所用,分离的CD46调节剂为已被鉴别和分离和/或从其自然环境的组分回收的调节剂。其自然环境的污染物组分为将会干扰该多肽的诊断或治疗用途的物质,且可包括酶、激素及其他蛋白质或非蛋白质溶质。分离的调节剂包括原位处于重组细胞内的调节剂,因为该多肽自然环境的至少一种组分将不存在。
当使用重组技术时,CD46调节剂(例如抗CD46抗体或其衍生物或片段)可在细胞内、在周质间隙中产生或直接分泌到培养基中。如果所需分子在细胞内产生,则作为第一步骤,微粒碎片(宿主细胞或溶解的片段)可例如通过离心或超滤移除。例如,Carter等人,Bio/Technology(《生物技术》)10:163(1992)描述了分离被分泌至大肠杆菌周质间隙中的抗体的程序。简而言之,在乙酸钠(pH 3.5)、EDTA和苯基甲基磺酰氟(PMSF)的存在下经约30分钟使细胞糊状物(cell paste)解冻。可通过离心移除细胞碎片。当抗体分泌到培养基中时,通常首先使用市售蛋白质浓缩过滤器(例如Amicon或Millipore Pellicon超滤装置)浓缩得自这类表达系统的上清液。可在任何上述步骤中包括蛋白酶抑制剂如PMSF以抑制蛋白水解,并且可包括抗生素以防止外来污染物生长。
从细胞制备的调节剂(例如fc-CD46或抗CD46抗体)组合物可使用例如羟基磷灰石色谱、凝胶电泳、透析和亲和色谱来纯化,其中亲和色谱是优选的纯化技术。A蛋白作为亲和配体的适合性取决于物种和存在于所选的构建体中的任何免疫球蛋白Fc域的同种型。A蛋白可用于纯化基于人IgG1、IgG2或IgG4重链的抗体(Lindmark等人,J Immunol Meth(《免疫学方法杂志》)62:1(1983))。对于所有小鼠同种型以及对于人IgG3均推荐使用G蛋白(Guss等人,EMBO J 5:1567(1986))。亲和配体所附接的基质最常为琼脂糖,不过也可利用其他基质。与用琼脂糖可实现的流动速率和加工时间相比,机械稳定的基质(例如可控孔度玻璃或聚(苯乙烯二乙烯基)苯)使流动速率更快且加工时间更短。在该抗体包含CH3域的情况中,Bakerbond ABXTM树脂(新泽西州菲利普斯堡的J.T.Baker公司(J.T.Baker;Phillipsburg,N.J.))可用于纯化。取决于待回收的抗体,也可利用其他蛋白质纯化技术,例如离子交换柱分级分离、乙醇沉淀、反相HPLC、二氧化硅色谱、肝素色谱、阴离子或阳离子交换树脂(例如聚天冬氨酸柱)琼脂糖色谱、色谱聚焦、SDS-PAGE和硫酸铵沉淀。在尤其优选的实施例中,本发明的调节剂将至少部分使用A蛋白或G蛋白亲和色谱来纯化。
XI.缀合的CD46调节剂
一旦本发明的调节剂已根据本文教导纯化,其即可与药物活性部分或诊断性部分或生物相容性修饰剂连接、融合、缀合(例如以共价或非共价方式)或以别的方式缔合。本文所用的术语“缀合物”将以广义使用且认为意指任何与所公开的调节剂缔合的分子,而无论缔合方法如何。就此而言,应当理解这类缀合物可包含肽、多肽、蛋白质、聚合物、核酸分子、小分子、模拟剂、合成药物、无机分子、有机分子和放射性同位素。此外,如上文所指出,所选的缀合物可共价或非共价连接至调节剂且展现出各种摩尔比,这至少部分取决于用于实现缀合的方法。
在优选的实施例中,显而易见,本发明的调节剂可与赋予所选的特征的蛋白质、多肽或肽(例如生物毒素、生物标记物、纯化标签等)缀合或缔合。更一般地说,在所选的实施例中,本发明涵盖与异源蛋白质或多肽重组融合或化学缀合(包括共价和非共价缀合二者)的调节剂或其片段的用途,其中该多肽包含至少10个、至少20个、至少30个、至少40个、至少50个、至少60个、至少70个、至少80个、至少90个或至少100个氨基酸。该构建体不一定需要直接连接,而可通过接头序列进行。例如,通过将本发明的调节剂与对特定细胞表面受体具有特异性的抗体融合或缀合,抗体可用来在体外或体内使异源多肽靶向表达CD46的特定细胞类型。此外,与异源多肽融合或缀合的调节剂还可用于体外免疫测定法且可与本领域已知的纯化方法相容。参见例如国际专利公开No.WO 93/21232;欧洲专利No.EP 439,095;Naramura等人,1994,Immunol.Lett.(《免疫学快讯》)39:91-99;美国专利No.5,474,981;Gillies等人,1992,PNAS 89:1428-1432;以及Fell等人,1991,J.Immunol.(《免疫学杂志》)146:2446-2452。
a.生物相容性修饰剂
在一个优选的实施例中,本发明的调节剂可视需要与可用于调节、改变、改善或缓和调节剂特征的生物相容性修饰剂缀合或以别的方式缔合。例如,体内半衰期延长的抗体或融合构建体可通过附接诸如市售聚乙二醇(PEG)或类似生物相容性聚合物之类的相对高分子量聚合物分子来产生。本领域技术人员应当理解,PEG可以许多不同分子量及分子构型获得,可选择这些分子量和分子构型以赋予抗体特定性质(例如可定制半衰期)。PEG可在有或无多官能接头的情况下附接至调节剂或抗体片段或衍生物,该附接是通过PEG与所述抗体或抗体片段的N末端或C末端的位点特异性缀合进行,或经由赖氨酸残基上存在的ε-氨基进行。可使用使生物活性损失最小的线型或分支聚合物衍生(derivatization)。缀合程度可通过SDS-PAGE和质谱法来密切监测以确保PEG分子与抗体分子的最佳缀合。未反应的PEG可通过例如分子排阻色谱或离子交换色谱与抗体-PEG缀合物分离。以类似方式,所公开的调节剂可与白蛋白缀合以使抗体或抗体片段在体内更稳定或具有更长的体内半衰期。这类技术是本领域所熟知的,参见例如国际专利公开No.WO 93/15199、NO.WO 93/15200和No.WO 01/77137;以及欧洲专利No.0 413,622。其他生物相容性缀合物对于本领域普通技术人员而言是显而易见的且容易根据本文教导鉴别。
b.诊断剂或检测剂
在其他优选的实施例中,将本发明的调节剂或其片段或衍生物与可为生物分子(例如肽或核苷酸)或小分子或放射性同位素的诊断剂或可检测剂缀合。这类调节剂可用于监测过度增殖障碍的发展或进展或者作为临床测试程序的一部分来测定包括所公开的调节剂的特定疗法的功效。这类标记物也可用于纯化所选的调节剂、分离或离析TIC或可用于临床前程序或毒物学研究。
这种诊断和检测可通过将调节剂与可检测物质偶联来完成,这类可检测物质包括但不限于:各种酶,包含例如辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶或乙酰胆碱酯酶;辅基,例如但不限于链霉亲和素/生物素和抗生物素蛋白/生物素;荧光物质,例如但不限于伞形酮、荧光素、异硫氰酸荧光素、罗丹明、二氯三嗪基胺荧光素、丹磺酰氯或藻红蛋白;发光物质,例如但不限于鲁米诺(luminol);生物发光物质,例如但不限于萤光素酶、萤光素和水母素(aequorin);放射性物质,例如但不限于碘(131I、125I、123I、121I)、碳(14C)、硫(35S)、氚(3H)、铟(115In、113In、112In、111In)和锝(99Tc)、铊(201Ti)、镓(68Ga、67Ga)、钯(103Pd)、钼(99Mo)、氙(133Xe)、氟(18F)、153Sm、177Lu、159Gd、149Pm、140La、175Yb、166Ho、90Y、47Sc、186Re、188Re、142Pr、105Rh、97Ru、68Ge、57Co、65Zn、85Sr、32P、153Gd、169Yb、51Cr、54Mn、75Se、113Sn和117Tin;使用各种正电子发射断层摄影术的正电子发射金属、非放射性顺磁性金属离子以及经放射性标记或与特定放射性同位素缀合的分子。在这类实施例中,适当的检测方法是本领域所熟知的且容易从多种商业来源获得。
如上文所指出,在其他实施例中,可将调节剂或其片段与标记序列如肽或荧光团融合,以便利纯化或诊断程序(如免疫组织化学或FAC)。在优选的实施例中,标记氨基酸序列为六组氨酸肽,例如pQE载体(Qiagen)中提供的标签等等,其中许多可商购获得。例如,如Gentz等人,1989,Proc.Natl.Acad.Sci.USA(《美国科学院院刊》)86:821-824中所述,六组氨酸可便利融合蛋白的纯化。其他可用于纯化的肽标签包括但不限于血凝素“HA”标签(其对应于衍自流感血凝素蛋白的表位(Wilson等人,1984,Cell(《细胞》)37:767))和“flag”标签(美国专利No.4,703,004)。
c.治疗部分
如先前所提及的,调节剂或其片段或衍生物也可与治疗部分缀合、连接或融合或以别的方式缔合,该治疗部分为例如细胞毒素或细胞毒性剂(例如细胞生长抑制剂或杀细胞剂)、治疗剂或放射性金属离子(例如α或β发射体)。如本文所用,细胞毒素或细胞毒性剂包括任何对细胞有害且可抑制细胞生长或存活的作用剂或治疗部分。例子包括紫杉醇、细胞松弛素B、短杆菌肽D、溴化乙锭、吐根碱、丝裂霉素、依托泊苷、替尼泊苷(tenoposide)、长春新碱、长春碱、秋水仙碱、多柔比星、柔红霉素、二羟基炭疽菌素、美登木素类(例如DM-1和DM-4(Immunogen,Inc.)、二酮、米托蒽醌、光辉霉素、放线菌素D、1-去氢睾酮、糖皮质素类、普鲁卡因、丁卡因、利多卡因、普萘洛尔、嘌呤霉素、表柔比星和环磷酰胺以及它们的类似物或同系物。其他细胞毒素包括奥瑞他汀(auristatins),包括单甲基奥瑞他汀E(MMAE)和单甲基奥瑞他汀F(MMAF)(西雅图遗传公司(Seattle Genetics,Inc.))在内;鹅膏蕈碱(amanitin),例如α-鹅膏蕈碱、β-鹅膏蕈碱、γ-鹅膏蕈碱或ε-鹅膏蕈碱(海德尔堡制药股份公司(HeidelbergPharma AG));DNA小沟结合剂,例如倍癌霉素(duocarmycin)衍生物(Syntarga,B.V.);以及经修饰的吡咯并苯并二氮杂(艹卓)二聚体(PBD,Spirogen有限公司(Spirogen,Ltd))。此外,在一个实施例中,本发明的CD46调节剂可与抗CD3结合分子缔合以募集细胞毒性T细胞并且使其靶向肿瘤起始细胞(BiTE技术;参见例如Fuhrmann,S.等人,Annual Meeting of AACR Abstract(《AACR年会摘要》)No.5625(2010),将其以引用的方式并入本文中)。
另外的相容性治疗部分包含:细胞毒性剂,包括但不限于抗代谢物(例如甲氨喋呤、6-巯基嘌呤、6-硫鸟嘌呤、阿糖胞苷、5-氟尿嘧啶、达卡巴嗪(decarbazine))、烷基化剂(例如氮芥、噻替哌(thioepa)、苯丁酸氮芥、美法仑、卡莫司汀(BCNU)和洛莫司汀(CCNU)、环磷酰胺、白消安、二溴甘露糖醇、链脲菌素、丝裂霉素C和顺二氯二氨铂(II)(DDP)、顺铂)、蒽环类抗生素(例如柔红霉素(以前称为道诺霉素(daunomycin))和多柔比星)、抗生素(例如更生霉素(以前称为放线菌素)、博来霉素、光辉霉素和氨茴霉素(AMC))以及抗有丝分裂剂(例如长春新碱和长春碱)。治疗部分的更详尽列表可见于PCT专利公布WO 03/075957和美国专利No.2009/0155255,将它们每一者以引用的方式并入本文。
还可将所选的调节剂与治疗部分如放射性物质或可用于缀合放射金属离子(参见上文放射性物质的例子)的大环螯合剂缀合。在某些实施例中,大环螯合剂为1,4,7,10-四氮杂环十二烷-N,N',N”,N”-四乙酸(DOTA),其可经由接头分子附接至抗体。这类接头分子是本领域众所周知的,在Denardo等人,1998,Clin Cancer Res.(《临床癌症研究》)4:2483;Peterson等人,1999,Bioconjug.Chem.(《生物缀合物化学》)10:553;以及Zimmerman等人,1999,Nucl.Med.Biol.(《核医学和生物学》)26:943中有描述。
可与本发明的这个方面相容的示例性放射性同位素包括但不限于:碘(131I、125I、123I、121I)、碳(14C)、铜(62Cu、64Cu、67Cu)、硫(35S)、氚(3H)、铟(115In、113In、112In、111In)、铋(212Bi、213Bi)、锝(99Tc)、铊(201Ti)、镓(68Ga、67Ga)、钯(103Pd)、钼(99Mo)、氙(133Xe)、氟(18F)、153Sm、177Lu、159Gd、149Pm、140La、175Yb、166Ho、90Y、47Sc、186Re、188Re、142Pr、105Rh、97Ru、68Ge、57Co、65Zn、85Sr、32P、153Gd、169Yb、51Cr、54Mn、75Se、113Sn、117Tin、225Ac、76Br和211At。其他放射性核素也可用作诊断剂和治疗剂,尤其是那些能量范围在60至4,000keV的放射性核素。取决于待治疗的病症以及所需治疗概况,本领域技术人员可容易选择适合与所公开的调节剂一起使用的放射性同位素。
本发明的CD46调节剂也可与改变给定生物学响应的治疗部分或药物缀合。也就是说,与本发明相容的治疗剂或治疗部分不应理解为限于经典的化学治疗剂。例如,在尤其优选的实施例中,药物部分可以是具有所需生物活性的蛋白质或多肽或其片段。这类蛋白质可包括例如:毒素,例如相思豆毒素、蓖麻毒素A、豹蛙酶(Onconase)(或另一细胞毒性RNA酶)、假单胞菌(pseudomonas)外毒素、霍乱毒素或白喉毒素;蛋白质,例如肿瘤坏死因子、α-干扰素、β-干扰素、神经生长因子、血小板衍生生长因子、组织纤溶酶原激活物、凋亡剂(例如TNF-α、TNF-β、AIM I(参见国际专利公开No.WO97/33899)、AIM II(参见国际公开No.WO97/34911)、Fas配体(Takahashi等人,1994,J.Immunol.(《免疫学杂志》),6:1567)和VEGI(参见国际公开No.WO99/23105))、血栓形成剂或抗血管生成剂(例如血管抑素或内皮抑素);或生物响应修饰剂,例如淋巴因子(例如白介素-1(“IL-1”)、白介素-2(“IL-2”)、白介素-6(“IL-6”)、粒细胞巨噬细胞集落刺激因子(“GM-CSF”)及粒细胞集落刺激因子(“G-CSF”))或生长因子(例如生长激素(“GH”))。如上文所述,使调节剂与多肽部分融合或缀合的方法是本领域已知的。除先前所公开的本发明参考文献外,参见例如美国专利No.5,336,603;No.5,622,929;No.5,359,046;No.5,349,053;No.5,447,851和No.5,112,946;EP 307,434;EP 367,166;PCT专利公开WO 96/04388和WO 91/06570;Ashkenazi等人,1991,PNAS USA 88:10535;Zheng等人,1995,J Immunol(《免疫学杂志》)154:5590;以及Vil等人,1992,PNAS USA 89:11337,将其中的每一者以引用的方式并入本文。调节剂与部分不一定需要直接缔合,而可经由接头序列缔合。这类接头分子是本领域众所周知的,在Denardo等人,1998,Clin Cancer Res(《临床癌症研究》)4:2483;Peterson等人,1999,Bioconjug Chem(《生物缀合物化学》)10:553;Zimmerman等人,1999,Nucl Med Biol(《核医学和生物学》)26:943;Garnett,2002,Adv Drug Deliv Rev(《先进药物递送评论》)53:171中有描述,将其中的每一者以引用的方式并入本文。
更一般而言,使治疗部分或细胞毒性剂与调节剂缀合的技术是众所周知的。部分可通过任何本领域公认的方法与调节剂缀合,包括但不限于:醛/席夫键、巯基键、酸不稳定键、顺乌头基键、腙键、酶可降解键(一般参见Garnett,2002,Adv Drug Deliv Rev(《先进药物递送评论》)53:171)。还可参见Amon等人,“Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy(癌症疗法中用于药物的免疫靶向的单克隆抗体)”,载于:Monoclonal Antibodies And Cancer Therapy(《单克隆抗体和癌症疗法》),Reisfeld等人(编辑),第243-56页(Alan R.Liss,Inc.1985);Hellstrom等人,“Antibodies For Drug Delivery(药物递送用抗体)”,载于:Controlled Drug Delivery(《受控药物递送》)(第2版),Robinson等人(编辑),第623-53页(马塞尔·德克尔公司(Marcel Dekker,Inc.)1987);Thorpe,“Antibody Carriers Of Cytotoxic Agents In Cancer Therapy:A Review(《癌症疗法中的细胞毒性剂的抗体载体:综述》)”,载于:Monoclonal Antibodies'84:Biological And Clinical Applications(《单克隆抗体'84:生物及临床应用》),Pinchera等人(编辑),第475-506页(1985);“Analysis,Results,And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy(《癌症疗法中放射标记抗体治疗用途的分析、结果和未来展望》)”,载于:Monoclonal Antibodies For Cancer Detection And Therapy(《用于癌症检测和疗法的单克隆抗体》),Baldwin等人(编辑),第303-16页(美国学术出版社(Academic Press)1985)以及Thorpe等人,1982,Immunol.Rev.(《免疫学评论》)62:119。在优选的实施例中,与治疗部分或细胞毒性剂缀合的CD46调节剂可在结合至与细胞表面缔合的CD46分子后被细胞内化,从而递送该治疗有效载荷。
XII.诊断和筛选
如所指出,本发明提供检测或诊断过度增殖障碍的方法以及从患者筛选细胞以鉴别肿瘤起始细胞的方法。这类方法包括鉴别患有癌症的个体以治疗癌症或监测其进展,该鉴别包括使从患者获得的样品与如本文所述的CD46调节剂接触以及检测该调节剂与该样品中结合的或游离的CD46缔合的存在与否或水平。当该调节剂包含抗体或其免疫活性片段时,与样品中的CD46缔合指示该样品可能含有肿瘤永续细胞(例如癌症干细胞),从而指示该患有癌症的个体可用如本文所述的CD46调节剂有效治疗。该方法可还包括比较与对照的结合水平的步骤。相反,当所选的调节剂是Fc-CD46时,可监测(直接或间接)当与样品接触时本文所述的分子的酶学性质以提供所需的信息。其他与本文教导相容的诊断方法是本领域所熟知的并且可使用商业材料如专用报道系统(dedicated reporting systems)来实施。
示例性的相容测定方法包括放射性免疫测定法、酶免疫测定法、竞争性结合测定法、荧光免疫测定法、免疫印迹测定法、蛋白质印迹分析、流式细胞测定法和ELISA测定法。更一般地讲,检测生物样品中的CD46或测量CD46酶活性(或其抑制)可用任何本领域已知的测定法来完成。
在另一方面,如下文更详细论述的,本发明提供用于检测、监控或诊断过度增殖障碍、鉴别患有这种障碍的个体(为了可能的治疗)或监测患者中该障碍的进展(或退化)的试剂盒,其中该试剂盒包含如本文所述的调节剂以及用于检测该调节剂对样品的影响的试剂。
CD46调节剂和包含CD46调节剂的细胞、培养物、群体以及组合物(包括它们的子代)也可用于筛选或鉴别通过与CD46(例如多肽或其遗传组分)相互作用而影响肿瘤起始细胞或其子代的功能或活性的化合物或作用剂(例如药物)。因此,本发明还提供用于评价或鉴别可通过与CD46或其底物缔合而影响肿瘤起始细胞或其子代的功能或活性的化合物或作用剂的系统和方法。这类化合物和作用剂可以是药物候选物,例如对其进行筛选以治疗过度增殖障碍。在一个实施例中,系统或方法包括展示CD46的肿瘤起始细胞和化合物或作用剂(例如药物),其中所述细胞与化合物或作用剂(例如药物)彼此接触。
本发明还提供筛选和鉴别用于改变肿瘤起始细胞或子代细胞的活性或功能的CD46调节剂或作用剂以及化合物的方法。在一个实施例中,方法包括使肿瘤起始细胞或其子代与试验作用剂或化合物接触;以及确定该试验作用剂或化合物是否调节CD46hi肿瘤起始细胞的活性或功能。
试验作用剂或化合物调节群体中这类肿瘤起始细胞或其子代的CD46相关活性或功能则鉴定该试验作用剂或化合物为活性剂。可调节的示例性性活性或功能包括细胞形态改变、标记物表达改变、分化或去分化改变、成熟改变、增殖改变、生活力改变、凋亡或细胞死亡神经元祖细胞或其子代改变。
当关于细胞或细胞培养物或方法步骤或治疗而使用时,“接触”意指组合物(例如CD46hi细胞或细胞培养物)与另一提及的实体之间的直接或间接相互作用。直接相互作用的一个具体例子为物理相互作用。间接相互作用的一个具体例子为组合物作用于中间分子,后者继而又作用于所提及的实体(例如细胞或细胞培养物)。
在本发明的这个方面中,调节指示以与检测对已被确定与本发明肿瘤起始细胞或子代细胞的特定方面(例如转移或增殖)相关的细胞活性或功能的作用相容的方式影响肿瘤起始细胞或子代细胞的活性或功能。示例性的活性和功能包括但不限于:测量形态、发育标记物、分化、增殖、生活力、细胞呼吸、粒线体活性、膜完整性或与某些病症相关的标记物的表达。因此,可通过使肿瘤起始细胞或子代细胞与化合物或作用剂(例如药物候选物)接触,并测量任何对如本文所公开的或本领域技术人员将会知道的肿瘤起始细胞或子代细胞活性或功能的调节,来评价该化合物或作用剂对这类细胞或子代细胞的作用。
筛选和鉴别作用剂和化合物的方法包括那些适合于高通量筛选的方法,所述方法包括定位或放置(任选地)于预定位置或位址的细胞阵列(例如微阵列)。高通量机器人或人工处理方法可在短时间内探测许多基因的化学相互作用以及测定其表达水平。已开发了利用分子信号(例如荧光团)和自动分析(以极快速率处理信息)的技术(参见例如Pinhasov等人,Comb.Chem.High Throughput Screen.(《组合化学和高通量筛选》)7:133(2004))。例如,微阵列技术已广泛用于即刻探测数千基因的相互作用,同时提供关于特定基因的信息(参见例如Mocellin和Rossi,Adv.Exp.Med.Biol.(《实验医学和生物学进展》)593:19(2007))。
这类筛选方法(例如高通量筛选方法)可快速有效地鉴别活性剂和化合物。例如,可将细胞定位或置放(预接种)于培养皿、管、烧瓶、滚瓶或板(例如单一多孔板或盘,例如8、16、32、64、96、384和1536多孔板或盘)上,任选处于规定位置,以用于鉴别潜在的治疗性分子。可筛选的文库包括例如小分子文库、噬菌体展示文库、完全人抗体酵母展示文库(Adimab,LLC)、siRNA文库和腺病毒转染载体。
XIII.药物制备和治疗用途
a.配制和施用途径
取决于调节剂的形式以及任何任选的缀合物、预定递送模式、所治疗或监测的疾病以及多种其他变量,本发明的组合物可根据需要使用本领域公认的技术来配制。也就是说,在本发明的多个实施例中,将包含CD46调节剂的组合物与多种可药用载体一起配制(参见例如Gennaro,Remington:The Science and Practice of Pharmacy with Facts and Comparisons:Drugfacts Plus,第20版(2003);Ansel等人,Pharmaceutical Dosage Forms and Drug Delivery Systems(《药物剂型和药物递送系统》),第7版,Lippencott Williams和Wilkins(2004);Kibbe等人,Handbook of Pharmaceutical Excipients(《药物赋形剂手册》),第3版,医药出版社(Pharmaceutical Press)(2000))。各种可药用载体(包括介质、佐剂和稀释剂)容易购自多个商业来源。此外,多种可药用辅助物质(例如pH值调节剂和缓冲剂、张度调节剂、稳定剂、湿润剂等等)也可获得。某些非限制性的示例性载体包括盐水、缓冲盐水、右旋糖、水、甘油、乙醇以及它们的组合。
更具体而言,应当理解,在一些实施例中,本发明的治疗组合物可以纯形式施用或以含有极微量另外的组分的形式施用。反之,本发明的CD46调节剂可任选配制成含有本领域所熟知并且为相对惰性物质的适合可药用载体(包含赋形剂和助剂),所述相对惰性物质便于施用该调节剂或有助于将活性化合物加工成在药学上对于递送至作用部位而言最佳的制剂。例如,赋形剂可赋予形状或稠度或者充当改善该调节剂的药物动力学的稀释剂。合适的赋形剂包括但不限于:稳定剂、湿润剂和乳化剂、改变渗透性的盐、包囊剂、缓冲剂和皮肤渗透增强剂。
用于全身性施用的所公开的调节剂可配制用于肠内、肠胃外或局部施用。实际上,所有三种类型的调制剂可同时使用以实现活性成分的全身性施用。用于肠胃外和非肠胃外药物递送的赋形剂以及制剂在Remington,The Science and Practice of Pharmacy(《雷明顿:药学科学与实践》)第20版,Mack出版公司(Mack Publishing)(2000)中进行了描述。适合于肠胃外施用的制剂包括水溶性形式的活性化合物(例如水溶性盐)的水溶液。另外,可施用适于油性注射混悬剂的活性化合物的混悬剂。合适的亲脂性溶剂或介质包括脂肪油例如芝麻油或合成的脂肪酸酯(例如油酸乙酯或三甘油酯)。水性注射混悬剂可含有增加混悬剂粘度的物质,这种物质包括例如羧甲基纤维素钠、山梨糖醇和/或葡聚糖。任选地,混悬剂还可含有稳定剂。也可使用脂质体封装作用剂以递送到细胞中。
适合于肠内施用的制剂包括硬或软明胶胶囊、丸剂、片剂(包括包衣片剂)、酏剂、混悬剂、糖浆剂或吸入剂以及它们的控释形式。
一般而言,包含CD46调节剂的本发明化合物和组合物可通过多种途径体内施用给有需要的受试者,这类途径包括但不限于:经口、静脉内、动脉内、皮下、肠胃外、鼻内、肌肉内、心内、心室内、气管内、口腔内、直肠、腹膜内、皮内、局部、透皮以及鞘内,或者通过植入或吸入。本发明的组合物可配制成固体、半固体、液体或气体形式的制剂;包括但不限于:片剂、胶囊剂、散剂、颗粒剂、软膏剂、溶液剂、栓剂、灌肠剂、注射剂、吸入剂和气溶胶。适当的制剂和施用途径可根据预定的应用和治疗方案来选择。
b.剂量
类似地,特定给药方案(即剂量、时间设置和重复)将取决于特定个体和个体的病史。诸如半衰期之类的经验性考虑因素一般将有助于确定剂量。施用频率可在治疗过程中确定和调整,并且是基于减少过度增殖性或赘生性细胞(包括肿瘤起始细胞)的数目、维持这类赘生性细胞的减少、减少赘生性细胞的增殖或延迟转移的发展。或者,本发明的治疗组合物的持续连续释放制剂可能是适当的。如上文所提及的,各种用于实现持续释放的制剂和装置是本领域已知的。
从治疗的观点来看,药物组合物以有效治疗或预防特定适应症的量施用。治疗有效量通常取决于所治疗受试者的体重、其身体或健康状况、待治疗病症的广泛性或所治疗受试者的年龄。一般而言,本发明的CD46调节剂可以以每剂约10μg/kg体重至约100mg/kg体重的范围内的量施用。在某些实施例中,本发明的CD46调节剂可以以每剂约50μg/kg体重至约5mg/kg体重的范围内的量施用。在某些其他实施例中,本发明的CD46调节剂可以以每剂约100μg/kg体重至约10mg/kg体重的范围内的量施用。任选,本发明的CD46调节剂可以以每剂约100μg/kg体重至约20mg/kg体重的范围内的量施用。还任选地,本发明的CD46调节剂可以以每剂约0.5mg/kg体重至约20mg/kg体重的范围内的量施用。在某些实施例中,给予剂量为至少约100μg/kg体重、至少约250μg/kg体重、至少约750μg/kg体重、至少约3mg/kg体重、至少约5mg/kg体重、至少约10mg/kg体重的本发明化合物。
其他给药方案可基于如美国专利No.7,744,877(将其以全文引用的方式并入本文)中所公开的体表面积(BSA)计算法。如本领域所熟知的,BSA用患者的身高和体重来计算,并且提供受试者的由其身体表面积来表示的大小的量度。在本发明的使用BSA的所选的实施例中,调节剂可以10mg/m2至800mg/m2的剂量施用。在其他优选的实施例中,调节剂将以50mg/m2至500mg/m2的剂量,并且甚至更优选以100mg/m2、150mg/m2、200mg/m2、250mg/m2、300mg/m2、350mg/m2、400mg/m2或450mg/m2的剂量施用。当然,应当理解,不管剂量如何计算,可在所选的时段内施用多个剂量以提供实质上高于个别施用的绝对剂量。
在任何情况下,CD46调节剂优选按需施用给有需要的受试者。施用频率可由本领域技术人员(例如主治医师)根据所治疗的病症、所治疗的受试者的年龄、所治疗的病症的严重程度、所治疗的受试者的一般健康状况等等的考虑因素来确定。一般来讲,给受试者施用有效剂量的CD46调节剂一次或多次。更具体地讲,给受试者施用有效剂量的调节剂一月一次、一月一次以上或少于一月一次。在某些实施例中,可施用有效剂量的CD46调节剂多次,包括持续至少一个月、至少六个月或至少一年的时间。
对于已给予一次或多次施用的个体,用于所公开的治疗组合物的剂量和方案也可凭经验确定。例如,可给予个体递增剂量的如本文所述制备的治疗组合物。为评估所选的组合物的功效,可跟踪特定疾病、障碍或病症的标志。在其中个体患有癌症的实施例中,这些标志包括经由触诊或目测观察直接测量肿瘤大小、通过x射线或其他成像技术间接测量肿瘤大小;通过直接肿瘤活组织检查和肿瘤样品的显微镜检查来评估的改善;测量间接肿瘤标记物(例如对于前列腺癌为PSA)或根据本文所述的方法鉴别的抗原、疼痛或麻痺减少;说话、视力、呼吸或其他与肿瘤相关的失能得到改善;食欲增加;或如通过认可的测试所测量的生活品质提高,或存活时间延长。对本领域技术人员将显而易见的是,取决于个体、赘生性病症的类型、赘生性病症的阶段、赘生性病症是否已开始转移至个体的其他部位以及所使用的过往及同期治疗,剂量将有所变化。
c.组合疗法
本发明设想的组合疗法可尤其适用于减少或抑制非所需的赘生性细胞增殖(例如内皮细胞)、减少癌症发生、减少或防止癌症再发或减少或防止癌症扩散或转移。在这类情况下,本发明的化合物可通过移除支撑及维持肿块的TPC(例如NTG细胞)来充当敏化剂或化学敏化剂,并使得当前护理标准减积剂或抗癌剂更有效地使用。也就是说,包含CD46调节剂和一种或多种抗癌剂的组合疗法可用于减弱已确立的癌症,例如减少所存在的癌细胞的数目和/或降低肿瘤负荷,或改善癌症的至少一种表现或副作用。因此,组合疗法是指施用CD46调节剂和一种或多种抗癌剂,这类抗癌剂包括但不限于:细胞毒性剂、细胞生长抑制剂、化学治疗剂、靶向抗癌剂、生物响应调节剂、免疫治疗剂、癌症疫苗、抗血管生成剂、细胞因子、激素疗法、放射疗法和抗转移剂。
根据本发明的方法,并不要求组合结果为分开进行各治疗(例如抗CD46抗体和抗癌剂)时所观察到的效果的累加。尽管至少累加效果一般而言是所需的,但任何超过单一疗法其中一者的抗肿瘤效果增加也是有益的。此外,本发明不需要组合治疗展现出协同效应。然而,本领域技术人员应当理解,在构成优选的实施例的某些所选的组合下可观察到协同作用。
为实施本发明的组合疗法,可将与一种或多种抗癌剂组合的CD46调节剂(例如抗CD46抗体)以在受试者中有效产生抗癌活性的方式施用给有需要的受试者。CD46调节剂和抗癌剂可根据需要以在肿瘤环境中有效产生它们的组合存在及它们的组合作用的量和时间段提供。为实现该目标,CD46调节剂和抗癌剂可以单一组合物形式或以两种或更多种不同组合物形式,使用相同或不同施用途径同时施用受试者。
或者,调节剂可在抗癌剂治疗之前或之后,例如间隔数分钟至数周的时间。在其中抗癌剂与抗体分开施用给受试者的某些实施例中,各递送时间之间的时段将使得抗癌剂和调节剂能够对肿瘤发挥组合效果。在一个特定的实施例中,设想到抗癌剂与CD46调节剂在彼此间隔约5分钟至约2周内施用。
在另外其他实施例中,调节剂与抗癌剂的施用之间可间隔数天(2、3、4、5、6或7天)、数周(1、2、3、4、5、6、7或8周)或数月(1、2、3、4、5、6、7或8个月)。CD46调节剂与一种或多种抗癌剂(组合疗法)可施用一次、两次或至少一段时间,直至病症得到治疗、减轻或治愈。优选地,组合疗法施用多次。组合疗法可每天施用三次至每六个月施用一次。可根据诸如每天三次、每天两次、每天一次、每两天一次、每三天一次、每周一次、每两周一次、每月一次、每两个月一次、每三个月一次、每六个月一次之类的时间表进行施用,或可经由微型泵连续施用。如先前所指出,组合疗法可经由经口、粘膜、口腔、鼻内、可吸入、静脉内、皮下、肌肉内、肠胃外、肿瘤内或局部途径来施用。可在远离肿瘤部位的部位施用组合疗法。通常在肿瘤存在的时间内都将施用组合疗法,前提条件是该组合疗法使肿瘤或癌停止生长或减小重量或体积。
在一个实施例中,将CD46调节剂与一种或多种抗癌剂组合施用给癌症患者持续较短治疗周期以治疗癌症。用抗体治疗的持续时间可根据所用特定抗癌剂而变。本发明还设想到不连续的施用或分成若干次部分施用的日剂量。本领域技术人员应当理解适合于特定抗癌剂的治疗时间,且本发明设想到对各抗癌剂的最佳治疗时间表的持续评估。
本发明设想到至少一个施用组合疗法的周期,优选超过一个周期。本领域技术人员应当理解适合于一个周期的时段,也应当了解周期总数及各周期之间的时间间隔。本发明设想到对各调节剂和抗癌剂的最佳治疗时间表的持续评估。此外,本发明还提供一次以上的抗CD46抗体或抗癌剂施用。调节剂和抗癌剂可隔天或隔周交替施用;或可给予一系列抗体治疗,然后给予一次或多次抗癌剂疗法的治疗。在任何情况下,如本领域一般技术人员会认识到,化学治疗剂的适当剂量一般将约为已在其中该化学治疗剂单独施用或与其他化学治疗剂组合施用的临床疗法中应用的剂量。
在另一个优选的实施例中,本发明的CD46调节剂可用于维持疗法中以在疾病最初呈现后降低或消除肿瘤再发的机会。优选地,障碍将得到治疗且初始肿瘤块得以消除、减小或者以别的方式改善,因此患者无症状或得到缓解。此时,可施用给受试者药学有效量的所公开的效应物一次或多次,即使使用标准诊断程序几乎没有或者没有指示有疾病。在一些实施例中,效应物将在一段时间里定期施用。例如,可每周、每两周、每月、每六周、每两个月、每三个月、每六个月或每年施用CD46调节剂。根据本文教导,本领域技术人员可容易地确定有利于降低疾病再发的可能性的剂量和给药方案。此外,这类治疗可持续数周、数月、数年的时间或甚至无限期地持续,这取决于患者响应和临床与诊断参数。
在又另一个优选的实施例中,本发明的效应物可用于预防性地防止或降低减积手术后肿瘤转移的可能性。如本发明所用,减积手术以广义定义且应意指任何消除、减少、治疗或改善肿瘤或肿瘤增生的手术、技术或方法。示例性的减积手术包括但不限于外科手术、辐射治疗(即射束辐射)、化学疗法或切除。在容易由本领域技术人员根据本发明确定的适当时间,CD46调节剂可如临床和诊断程序所建议进行施用以减少肿瘤转移。效应物可以如使用标准技术所确定的药学有效剂量施用一次或多次。优选地,给药方案将伴随适当的诊断或监测技术以便视需要对该方案进行修改。
d.抗癌剂
本文所用的术语“抗癌剂”意指任何可用于治疗细胞增殖性障碍如癌症的作用剂,包括细胞毒性剂、细胞生长抑制剂、抗血管生成剂、减积剂、化学治疗剂、放射疗法和放射治疗剂、靶向抗癌剂、生物响应调节剂、抗体和免疫治疗剂。应当理解,在如上文所论述的所选的实施例中,抗癌剂可包含缀合物且在施用之前可与调节剂缔合。
术语“细胞毒性剂”意指降低或抑制细胞功能和/或引起细胞破坏的物质,即该物质对细胞具有毒性。通常,该物质为衍自活生物体的天然存在的分子。细胞毒性剂的例子包括但不限于以下各者的小分子毒素或酶活性毒素:细菌(例如白喉毒素、假单胞菌内毒素和外毒素、葡萄球菌肠毒素A)、真菌(例如α-帚曲菌素、局限曲菌素)、植物(例如相思豆毒素、蓖麻毒素、蒴莲根毒素、槲寄生凝集素(viscumin)、商陆抗病毒蛋白、皂草素、白树毒素、momoridin、天花粉蛋白、大麦毒素、油桐(Aleurites fordii)蛋白、石竹素蛋白、美洲商陆(Phytolacca mericana)蛋白(PAPI、PAPII和PAP-S)、苦瓜(Momordica charantia)抑制剂、麻风树毒素、巴豆毒素、石碱草(saponaria officinalis)抑制剂、白树毒素、mitegellin、局限曲菌素、酚霉素、新霉素以及单端孢霉烯族毒素类(tricothecenes))或动物(例如细胞毒性RNA酶、DNA酶I,包括其片段和/或变体)。
化学治疗剂意指非特异性降低或抑制癌细胞的生长、增殖和/或存活的化合物(例如细胞毒性剂或细胞生长抑制剂)。这类化学剂通常针对细胞生长或分裂所必需的细胞内过程,因此尤其有效对抗通常快速生长和分裂的癌细胞。例如,长春新碱使微管解聚,从而抑制细胞进入有丝分裂。一般而言,化学治疗剂可包括任何抑制或被设计成抑制癌细胞或可能变成癌细胞或产生致瘤子代的细胞(例如TIC)的化学剂。这类药剂通常以组合形式施用,且通常以组合形式为最有效,例如在制剂CHOP中。
可与本发明的调节剂组合使用(或缀合)的抗癌剂的例子包括但不限于:烷基化剂、烷基磺酸盐、氮丙啶、乙烯亚氨和甲基三聚氰胺(methylamelamine)、多聚乙酰、喜树碱、苔藓虫素、callystatin、CC-1065、念珠藻环肽(cryptophycin)、多拉司他汀(dolastatin)、倍癌霉素、艾榴塞洛素(eleutherobin)、pancratistatin、sarcodictyin、海绵抑素、氮芥、抗生素、烯二炔抗生素、达内霉素(dynemicin)、双膦酸盐、埃斯培拉霉素(esperamicin)、色蛋白烯二炔抗生素发色团、阿克拉霉素、放线菌素、authramycin、重氮丝氨酸、博来霉素、放线菌素C、carabicin、洋红霉素、嗜癌霉素、色霉素、更生霉素、柔红霉素、地托比星、6-重氮-5-氧代-L-正亮氨酸、多柔比星、表柔比星、依索比星、伊达比星、麻西罗霉素、丝裂霉素、霉酚酸、诺加霉素、橄榄霉素、培洛霉素、potfiromycin、嘌呤霉素、三铁阿霉素、罗多比星、链黑菌素、链脲菌素、杀结核菌素、乌苯美司、净司他丁、佐柔比星;抗代谢物、叶酸类似物、嘌呤类似物、雄激素、抗肾上腺剂、叶酸补充剂(例如frolinic acid)、醋葡醛内酯、醛磷酰胺糖苷、氨基乙酰丙酸、恩尿嘧啶、安吖啶、bestrabucil、比生群、依达曲沙、defofamine、地美可辛、地吖醌、依氟鸟氨酸、依利醋铵、埃博霉素、依托格鲁、硝酸镓、羟基脲、香菇多糖、lonidainine、类美登素(maytansinoids)、米托胍腙、米托蒽醌、mopidanmol、nitraerine、喷司他丁、蛋氨氮芥、吡柔比星、洛索蒽醌、鬼臼酸、2-乙肼、丙卡巴肼、多糖复合物(俄勒冈州尤金的JHS天然产物公司(JHS Natural Products,Eugene,OR))、雷佐生;根霉素;西佐喃;锗螺胺;细交链孢菌酮酸;三亚胺醌;2,2',2"-三氯三乙胺;单端孢霉烯族毒素(尤其是T-2毒素、verracurin A、杆孢菌素A和anguidine);乌拉坦;长春地辛;达卡巴嗪;甘露醇氮芥;二溴甘露醇;二溴卫矛醇;哌泊溴烷;gacytosine;阿拉伯糖苷(“Ara-C”);环磷酰胺;噻替哌;紫杉烷类、苯丁酸氮芥;吉西他滨;6-硫鸟嘌呤;巯嘌呤;甲氨喋呤;铂类似物、长春碱;铂;依托泊苷(VP-16);异环磷酰胺;米托蒽醌;长春新碱;长春瑞宾;米托蒽醌;替尼泊苷;依达曲沙;道诺霉素;氨基蝶呤;希罗达;伊班膦酸盐;伊立替康(Camptosar,CPT-11)、拓扑异构酶抑制剂RFS 2000;二氟甲基鸟氨酸(DMFO);类视黄醇;卡培他滨;考布他汀;甲酰四氢叶酸(LV);奥沙利铂;减少细胞增殖的PKC-α、Raf、H-Ras、EGFR和VEGF-A的抑制剂,以及以上任一者的可药用的盐、酸或衍生物。该定义中还包括用于调节或抑制激素对肿瘤的作用的抗激素剂,例如抗雌激素剂和选择性雌激素受体调节剂(SERM)、抑制调节肾上腺中的雌激素产生的芳香酶的芳香酶抑制剂、抗雄激素剂;以及曲沙他滨(1,3-二氧戊环核苷胞嘧啶类似物);反义寡核苷酸;核酶如VEGF表达抑制剂和HER2表达抑制剂;疫苗、rIL-2;拓扑异构酶1抑制剂;rmRH;长春瑞滨和埃斯波霉素以及上述任一者的可药用盐、酸或衍生物。其他实施例包括使用批准用于癌症疗法的抗体,包括但不限于:利妥昔单抗、曲妥单抗、吉妥单抗、阿仑单抗、替伊莫单抗、托西莫单抗、贝伐单抗、西妥昔单抗、帕尼单抗、奥伐木单抗(ofatumumab)、伊匹单抗和贝伦妥单抗-维多汀(brentuximab vedotin)。本领域技术人员将能够容易鉴别与本文教导相容的其他抗癌剂。
e.放射疗法
本发明还提供CD46调节剂与放射疗法(即任何用于诱导肿瘤细胞中局部DNA损伤的机制,例如γ-照射、X射线、UV照射、微波、电子发射等等)的组合。还设想到使用将放射性同位素定向递送至肿瘤细胞的组合疗法,并且其可结合靶向抗癌剂或其他靶向手段使用。通常,放射疗法在约1周至约2周的时间里以脉冲形式施用。放射疗法可施用给患有头颈部癌的受试者持续约6周至7周。任选地,放射疗法可以单次剂量或以多次连续剂量进行施用。
f.赘生性病症
无论单独施用还是与抗癌剂或放射疗法组合施用,本发明的CD46调节剂尤其可用于总体治疗患者或受试者的赘生性病症,这类病症可包括:良性或恶性肿瘤(例如肾癌、肝癌、肾脏癌、膀胱癌、乳腺癌、胃癌、卵巢癌、结肠直肠癌、前列腺癌、胰腺癌、肺癌、甲状腺癌、肝癌;肉瘤;胶质母细胞瘤;及各种头颈部肿瘤);白血病和淋巴恶性肿瘤;其他障碍,例如神经元障碍、神经胶质障碍、星形细胞障碍、下丘脑和其他腺体障碍、巨噬细胞障碍、上皮障碍、基质障碍和囊胚腔障碍;以及炎性障碍、血管生成障碍、免疫障碍和由病原体引起的障碍。用本发明的治疗组合物和方法治疗的尤其优选的标靶为赘生性病症,包含实体肿瘤。在其他优选的实施例中,本发明的调节剂可用于诊断、预防或治疗血液恶性肿瘤。优选地,待治疗的受试者或患者将为人,不过如本文所用,该术语明确地被认为包括任何哺乳动物物种。
更具体而言,根据本发明进行治疗的赘生性病症可选自包括但不限于:肾上腺肿瘤、AIDS相关的癌症、腺泡状软组织肉瘤、星形细胞肿瘤、膀胱癌(鳞状细胞癌和移行细胞癌)、骨癌(釉质瘤、动脉瘤样骨囊肿、骨软骨瘤、骨肉瘤)、脑癌和脊髓癌、转移性脑肿瘤、乳腺癌、颈动脉体瘤、子宫颈癌、软骨肉瘤、脊索瘤、嫌色细胞型肾细胞癌、透明细胞癌、结肠癌、结肠直肠癌、皮肤良性纤维性组织细胞瘤、结缔组织增生性小圆细胞肿瘤、室管膜瘤、尤因氏瘤、骨外粘液样软骨肉瘤、骨纤维生成不良、骨纤维性结构不良、胆囊癌和胆管癌、妊娠性滋养层疾病、生殖细胞肿瘤、头颈部癌、胰岛细胞瘤、卡波西氏肉瘤、肾癌(肾胚细胞瘤、乳头状肾细胞癌)、白血病、脂肪瘤/良性脂肪瘤性肿瘤、脂肪肉瘤/恶性脂肪瘤性肿瘤、肝癌(肝母细胞瘤、肝细胞癌)、淋巴瘤、肺癌(小细胞癌、腺癌、鳞状细胞癌、大细胞癌等)、髓母细胞瘤、黑素瘤、脑膜瘤、多发性内分泌瘤、多发性骨髓瘤、骨髓发育不良综合征、成神经细胞瘤、神经内分泌肿瘤、卵巢癌、胰腺癌、乳头状甲状腺癌、甲状旁腺肿瘤、儿童癌症、周围神经鞘肿瘤、嗜铬细胞瘤、垂体瘤、前列腺癌、后葡萄膜黑素瘤(posterious unveal melanoma)、罕见血液障碍、肾转移癌、横纹肌样瘤、横纹肌肉瘤、肉瘤、皮肤癌、软组织肉瘤、鳞状细胞癌、胃癌、滑膜肉瘤、睾丸癌、胸腺癌、胸腺瘤、甲状腺转移癌和子宫癌(子宫颈癌、子宫内膜癌及和滑肌瘤)。在某些优选的实施例中,癌细胞是选自包括但不限于如下的实体肿瘤:乳腺癌、非小细胞肺癌(NSCLC)、小细胞肺癌、胰腺癌、结肠癌、前列腺癌、肉瘤、肾转移癌、甲状腺转移癌和透明细胞癌。
关于血液恶性肿瘤,应进一步理解,本发明的化合物和方法可尤其有效治疗多种B细胞淋巴瘤,包括低度/NHL滤泡细胞淋巴瘤(FCC)、套细胞淋巴瘤(MCL)、弥漫性大细胞淋巴瘤(DLCL)、小淋巴细胞性(SL)NHL、中度/滤泡性NHL、中度弥漫性NHL、高度免疫母细胞性NHL、高度淋巴母细胞性NHL、高度小无核裂细胞NHL、巨瘤性NHL、华氏巨球蛋白血症、淋巴浆细胞样淋巴瘤(LPL)、套细胞淋巴瘤(MCL)、滤泡性淋巴瘤(FL)、弥漫性大细胞淋巴瘤(DLCL)、伯基特淋巴瘤(BL)、AIDS相关的淋巴瘤、单核细胞性B细胞淋巴瘤、血管免疫母细胞性淋巴结病;小淋巴细胞性、滤泡性、弥漫性大细胞、弥漫性小核裂细胞、大细胞免疫母细胞性淋巴母细胞瘤;小无核裂性伯基特与非伯基特滤泡性、主要大细胞淋巴瘤;滤泡性、主要小核裂细胞淋巴瘤;以及滤泡性、混合小核裂细胞与大细胞淋巴瘤。参见Gaidono等人,“Lymphomas(淋巴瘤)”,载于:CANCER:PRINCIPLES&PRACTICE OF ONCOLOGY(《癌症:肿瘤学原理与实践》),第2卷:2131-2145(DeVita等人编辑,第5版1997)。本领域技术人员应清楚,由于改变分类系统,故这些淋巴瘤通常将具有不同名称,且具有归类为不同名称的淋巴瘤的患者也可受益于本发明的组合治疗方案。
在另外其他优选的实施例中,CD46调节剂可用于有效地治疗某些骨髓和血液恶性肿瘤,包括白血病,例如慢性淋巴细胞性白血病(CLL或B-CLL)。CLL主要为老年人疾病,其在五十岁后发病率开始增加且在年近七旬时达到峰值。其一般涉及赘生性外周血淋巴细胞的增殖。CLL的临床表现涉及淋巴细胞增多症、淋巴结病、脾肿大、贫血和血小板减少症。CLL的典型特征是单克隆B细胞增殖和停滞于分化中间状态的B淋巴细胞的积聚,在该状态下这类B细胞表达表面IgM(sIgM)或者sIgM与sIgD二者,且单一轻链的密度低于在正常B细胞上的密度。然而,如上文所论述以及随附“实例”中所示的,所选的CD46表达(例如CD46)在B-CLL细胞上被上调,从而提供所公开的调节剂的引人关注的标靶。
本发明也为具有良性肿瘤或癌前肿瘤的受试者提供防治性或预防性治疗。据信不应将任何特定类型的肿瘤或赘生性障碍排除在使用本发明的治疗之外。然而,肿瘤细胞的类型可与本发明与第二治疗剂、尤其化学治疗剂及靶向抗癌剂的组合使用有关。
本发明的另外其他优选的实施例包括使用CD46调节剂治疗患有实体肿瘤的受试者。在这类受试者中,这些实体肿瘤中的多者包含展现各种遗传突变的组织,这类遗传突变可使其尤其易于用所公开的效应物治疗。例如,KRAS、APC和CTNNB1突变在结肠直肠癌患者中相对常见。此外,患有具有这些突变的肿瘤的患者通常用当前疗法最难治愈;尤其是那些具有KRAS突变的患者。通常导致单一氨基酸置换的KRAS激活突变也与其他难以治疗的恶性肿瘤有关,包括肺腺癌、粘蛋白腺瘤以及胰腺的导管癌。
目前,例如,结肠直肠癌患者是否会响应EGFR抑制性药物或VEGF抑制性药物的最可靠预测是测试某些KRAS“激活”突变。KRAS在35-45%的结肠直肠癌中发生突变,且其肿瘤表达突变型KRAS的患者不会对这些药物产生良好应答。例如,在结肠直肠癌中,KRAS突变预示缺乏对帕尼单抗及西妥昔单抗疗法的响应(Lievre等人,Cancer Res(《癌症研究》)66:3992–5;Karapetis等人,NEJM 359:1757-1765)。大约85%的结肠直肠癌患者在APC基因中具有突变(Markowitz和Bertagnolli.NEJM361:2449-60),且超过800个APC突变已在家族性腺瘤性息肉病和结肠直肠癌患者中表征。这些突变中的大部分会导致截短型APC蛋白,其介导β-联蛋白破坏的功能性能力降低。β-联蛋白基因CTNNB1的突变也可导致该蛋白的稳定增强,从而引起核输入以及随后激活若干致瘤转录程序,其也是突变型APC无法适当地介导为保持正常细胞增殖和分化程序受控制所需的β-联蛋白破坏而引起的瘤形成的机制。
XIV.制品
还提供包括一个或多个容器、包括一个或多个剂量的CD46调节剂的药物包装和试剂盒。在某些实施例中,提供单位剂量,其中该单位剂量含有预定量的包含例如抗CD46抗体且有或无一种或多种另外的作用剂的组合物。对于其他实施例,该单位剂量在用于注射的一次性预充式注射器中提供。在另外其他实施例中,单位剂量中所含的组合物可包含盐水、蔗糖等;缓冲液,例如磷酸盐等;和/或在稳定且有效的pH范围内配制。或者,在某些实施例中,组合物可以冻干粉形式提供,其可在添加适当液体(例如无菌水)后复原。在某些优选的实施例中,组合物包含一种或多种抑制蛋白质聚集的物质,其包括但不限于蔗糖和精氨酸。容器上或与容器相关的任何标签指示所密封的组合物是用于诊断或治疗所选的疾病病症。
本发明还提供用于产生CD46调节剂和任选的一种或多种抗癌剂的单次剂量或多次剂量施用单元的试剂盒。该试剂盒包括容器和容器上或与容器相关的标签或包装插页。合适的容器包括例如瓶子、小瓶、注射器等。容器可由各种材料如玻璃或塑料形成。容器容纳可有效治疗病症的组合物并且可具有无菌进入孔(例如该容器可为具有皮下注射针可刺穿的塞子的静脉注射溶液袋或小瓶)。这类试剂盒一般在合适容器中装有可药用的CD46调节剂制剂以及任选地在同一或不同容器中装有一种或多种抗癌剂。试剂盒还可装有用于诊断或组合疗法的其他可药用制剂。例如,除本发明的CD46调节剂外,这类试剂盒可装有多种抗癌剂中的任一者或多者,例如化学治疗或放射治疗药物;抗血管生成剂;抗转移剂;靶向抗癌剂;细胞毒性剂;和/或其他抗癌剂。这类试剂盒也可提供使CD46调节剂与抗癌剂或诊断剂缀合的适当试剂(例如参见美国专利No.7,422,739,将其以全文引用的方式并入本文)。
更具体而言,试剂盒可具有装有CD46调节剂且有或无另外的组分的单一容器,或其可具有用于每一所需作用剂的不同容器。在提供组合治疗剂进行缀合的情况中,可将单一溶液以摩尔当量组合的形式或以一种组分超过其他组分的形式进行预先混合。或者,在施用给患者之前,试剂盒的CD46调节剂和任何任选的抗癌剂可分开保持在不同容器中。试剂盒也可包括用于容纳无菌可药用的缓冲液或其他稀释剂(例如抑菌性注射用水(BWFI)、磷酸盐缓冲盐水(PBS)、林格氏溶液和右旋糖溶液)的第二/第三容器装置。
当试剂盒的组分以一种或多种液体溶液提供时,该液体溶液优选为水溶液,其中无菌水溶液是尤其优选的。然而,试剂盒的组分可以干粉形式提供。当试剂或组分以干粉形式提供时,该粉末可通过添加合适的溶剂来复原。预想到该溶剂也可提供于另一容器中。
如上文简单地指出,试剂盒也可装有用来向动物或患者施用抗体和任何任选的组分的装置,例如一个或多个针或注射器,或甚至滴眼管、吸管或其他这类类似设备,制剂可从该装置注射或引入到动物中或施用于身体患病区域。本发明的试剂盒也将通常包括用于容纳小瓶或像这类东西的装置,以及用于商业销售的其他密闭组件,例如置放和保存所需小瓶和其他设备的注塑成型或吹塑成型塑料容器。任何标签或包装插页均指示CD46调节剂组合物是用于治疗癌症,例如结肠直肠癌。
XV.研究试剂
本发明的其他优选的实施例也利用所公开的调节剂的性质,作为可用于通过诸如荧光激活细胞分选(FACS)、磁性激活细胞分选(MACS)或激光介导的分区这类的方法对肿瘤起始细胞的群体或亚群进行鉴别、分离、分区或富集的工具。本领域技术人员应当理解,调节剂可用于若干相容的表征和操纵TIC(包括癌症干细胞)的技术中(例如参见美国专利No.12/686,359、No.12/669,136和No.12/757,649,将它们每一者以引用的方式全文并入本文)。
XVI.其他内容
除非本文另有限定,否则与本发明关联使用的科学和技术术语应具有本领域一般技术人员通常所理解的含义。此外,除非上下文另有要求,否则单数术语应包括复数且复数术语应包括单数。更具体而言,除非上下文另外明确指示,否则如本说明书和随附权利要求书中所用,单数形式“一个”、“一种”和“该”包括多个指代物。因此,例如,提及“蛋白质”包括多个蛋白质;提及“细胞”包括细胞混合物等等。另外,说明书和随附的权利要求书中所提供的范围包括端点和端点之间的所有点。因此,2.0至3.0的范围包括2.0、3.0以及2.0与3.0之间的所有点。
一般来讲,与本文所述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学和蛋白质以及核酸化学及杂交关联使用的命名法及其技术,是本领域所熟知且常用的命名法和技术。除非另外指明,否则本发明的方法和技术一般根据本领域所熟知的常规方法且如本说明书中通篇引用和论述的各种一般和更特定的参考文献中所述来进行。参见例如,Sambrook J.和Russell D.Molecular Cloning:A Laboratory Manual(《分子克隆:实验室手册》),第3版,纽约冷泉港的冷泉港实验室出版社(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.)(2000);Ausubel等人,Short Protocols in Molecular Biology:A Compendium of Methods from Current Protocols in Molecular Biology(《分子生物学简明实验技术:现代分子生物学实验技术的方法概要》),约翰威立父子出版公司(Wiley,John&Sons,Inc.)(2002);Harlow和Lane,Using Antibodies:A Laboratory Manual (《使用抗体:实验室手册》),纽约冷泉港的冷泉港实验室出版社(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.)(1998);以及Coligan等人,Short Protocols in Protein Science(《蛋白质科学的简明实验技术》),约翰威立父子出版公司(Wiley,John&Sons,Inc.)(2003)。酶促反应和纯化技术是根据制造商的说明书,如本领域中通常所实现或如本文中所述来进行。与本文所述的分析化学、合成有机化学以及药物化学和药物化学关联使用的命名法及其实验室程序和技术,是本领域中熟知且常用的命名法及实验室程序和技术。
本说明书中公开或引用的所有参考文献或文件均不加限制地以引用的方式全文并入本文。此外,本文中所使用的任何章节标题仅用于篇章组织目的,而不应理解为限制所描述的主题。
实例
参考以下实例将更容易了解如此大致描述的本发明,这类实例是以说明的方式提供且无意于限制本发明。所述实例无意表示如下实验为所进行的全部或唯一实验。除非另外指示,否则份数为重量份,分子量为重量平均分子量,温度以摄氏度计,压力为大气压或近大气压。
实例1
肿瘤起始细胞群体中的CD46表达
为表征实体肿瘤在其存在于癌症患者中时的细胞异质性,使用特定表型标记物阐明肿瘤永续细胞(TPC;即癌症干细胞:CSC)的种类(identity),并鉴别临床相关的治疗标靶,使用了本领域公认的技术开发并维持了大的非传统异种移植物(NTX)肿瘤库。通过将最初获自患有各种实体瘤恶性肿瘤的许多癌症患者的异质肿瘤细胞多次继代,在免疫功能降低的小鼠中增殖了包含大量分立的肿瘤细胞系的NTX肿瘤库。具有明确谱系的大量分立的早期继代NTX肿瘤细胞系的持续可获得性能极大便利对TPC的鉴别和分离,因为它们使得可以可再现地和重复地表征从这些细胞系纯化的细胞。更具体地讲,根据分离或纯化的TPC在重演所述细胞所来源的患者肿瘤样品的小鼠中产生表型上以及形态上异质的肿瘤的能力,分离或纯化的TPC得到最准确的回顾性定义。因此,使用小的分离细胞群体在小鼠中产生完全异质肿瘤的能力可有力指示所述分离细胞包含TPC的事实。在该工作中,使用继代最少的NTX细胞系可大大简化体内实验并提供可容易验证的结果。此外,早期继代NTX肿瘤也响应诸如伊立替康(即)之类的治疗剂,这提供对于驱动肿瘤生长的潜在机制、对当前疗法的耐受性以及肿瘤再发的临床相关洞察。
当建立NTX肿瘤细胞系时,使用流式细胞术分析组分肿瘤细胞表型以鉴别可用于表征、分离、纯化或富集肿瘤起始细胞(TIC)并分离或分析该群体内的TPC和TProg细胞的分立标记物。就此而言,本发明人使用了基于蛋白组的专有平台(即PhenoPrintTm阵列),其提供基于蛋白质表达的细胞快速表征以及伴随的对潜在有用的标记物的鉴别。PhenoPrint阵列是一种专有蛋白组平台,其包含数百种排列于96孔板中的分立结合分子,其中许多分子获自商业来源,其中每个孔含有在藻红蛋白荧光通道中的独特抗体以及在排列于整个板每个孔中的不同荧光染料中的多种另外的抗体。这使得可以通过快速包括相关细胞或经由非藻红蛋白通道消除非相关细胞来测定所选的肿瘤细胞亚群中所关注抗原的表达水平。当PhenoPrint阵列与本领域熟知的组织解离、移植和干细胞技术(Al-Hajj等人,2004;Dalerba等人,2007;以及Dylla等人,2008(全部出处同上),将这些文献每一者以引用的方式全文并入本文)联合使用时,有可能有效鉴别相关标记物以及随后高效分离和移植特定人肿瘤细胞亚群。
因此,在建立各种NTX肿瘤细胞系时,如对于严重免疫功能降低的小鼠中的人肿瘤通常所进行的,肿瘤在达到800-2,000mm3后将其从小鼠切除并用本领域公认的酶消化技术(参见例如美国专利No.2007/0292414,将其并入本文)将细胞解离为单细胞悬浮液。用PhenoPrint阵列从这些悬浮液获得的数据提供了逐个细胞的绝对(每个细胞)和相对(相对于群体中的其他细胞)表面蛋白质表达,从而实现细胞群体的更复杂表征和分层(stratification)。更具体而言,PhenoPrint阵列的使用使得可以快速鉴别有望将TIC或TPC与NTG本体肿瘤细胞和肿瘤基质区分开来的蛋白质或标记物,并且当从NTX肿瘤模型分离时,提供对表达不同水平的特定细胞表面蛋白质的肿瘤细胞亚群的相对快速的表征。具体地讲,在肿瘤细胞群体中具有异质表达的蛋白质使得可以分离表达高和低水平的特定蛋白质或标记物的独特且高度纯化的肿瘤细胞亚群并将其移植进免疫功能降低的小鼠中,从而有助于评估TPC富集于一个亚群还是另一个亚群中。
术语“富集”与分离细胞同义使用,意指与初始或起始细胞群体相比,一种类型的细胞的收率(比率)相对于其他类型的细胞的比率增加。优选地,富集是指与初始细胞群体相比,细胞群体中一种类型的细胞的百分数增加约10%、约20%、约30%、约40%、约50%或大于50%。
如本文所用,在细胞或组织的情形中,标记物意指与特定细胞、细胞群体或组织以可鉴别方式相关联或在特定细胞、细胞群体或组织中或其上特异性存在的任何化学或生物学实体形式的特征,包括那些在受疾病或障碍影响的组织或细胞群体中或其上所鉴别的特征。如所指明的,标记物在性质上可以是形态标记物、功能标记物或生物化学标记物。在优选的实施例中,标记物为由特定细胞类型(例如TPC)或由细胞在某些条件下(例如在细胞生命周期的特定时间点期间或处于特定小生境中的细胞)差异或优先表达的细胞表面抗原。优选地,这类标记物是蛋白质,更优选地,具有本领域所知的抗体、适体或其他结合分子的表位。然而,标记物可由存在于表面上或细胞中的任何分子组成,包括但不限于蛋白质(肽和多肽)、脂质、多糖、核酸和类固醇。形态标记物特征或性状的例子包括但不限于形状、大小和核质比。功能标记物特征或性状的例子包括但不限于附着于特定基底的能力、掺入或排斥特定染料(例如但不限于排斥亲脂性染料)的能力、在特定条件下迁移的能力以及沿特定谱系分化的能力。标记物也可为从报告基因表达的蛋白质,例如报告基因由于编码报告基因的核酸序列向细胞中的引入及其转录而由细胞表达,从而产生可用作标记物的报告蛋白。可用作标记物的这类报告基因是例如但不限于荧光蛋白酶、染色粒蛋白、抗性基因等等。
在相关意义上,在组织、细胞或细胞群体的情形中,术语“标记物表型”(例如稳定的TPC表型)意指任何可用于表征、鉴别、分开、分离或富集特定细胞或细胞群体的标记物或标记物组合。在特定实施例中,标记物表型是可通过检测或鉴别细胞表面标记物的组合的表达来确定的细胞表面表型。
本领域技术人员应了解,已将多种标记物(或其不存在)与各种癌症干细胞群体相关联并用于分离或表征肿瘤细胞亚群。就此而言,示例性的癌症干细胞标记物包含OCT4、Nanog、STAT3、EPCAM、CD24、CD34、NB84、TrkA、GD2、CD133、CD20、CD56、CD29、B7H3、CD46、转铁蛋白受体、JAM3、羧肽酶M、ADAM9、抑癌蛋白M、Lgr5、Lgr6、CD324、CD325、巢蛋白、Sox1、Bmi-1、eed、easyh1、easyh2、mf2、yy1、smarcA3、smarckA5、smarcD3、smarcE1、mllt3、FZD1、FZD2、FZD3、FZD4、FZD6、FZD7、FZD8、FZD9、FZD10、WNT2、WNT2B、WNT3、WNT5A、WNT10B、WNT16、AXIN1、BCL9、MYC、(TCF4)SLC7A8、IL1RAP、TEM8、TMPRSS4、MUC16、GPRC5B、SLC6A14、SLC4A11、PPAP2C、CAV1、CAV2、PTPN3、EPHA1、EPHA2、SLC1A1、CX3CL1、ADORA2A、MPZL1、FLJ10052、C4.4A、EDG3、RARRES1、TMEPAI、PTS、CEACAM6、NID2、STEAP、ABCA3、CRIM1、IL1R1、OPN3、DAF、MUC1、MCP、CPD、NMA、ADAM9、GJA1、SLC19A2、ABCA1、PCDH7、ADCY9、SLC39A1、NPC1、ENPP1、N33、GPNMB、LY6E、CELSR1、LRP3、C20orf52、TMEPAI、FLVCR、PCDHA10、GPR54、TGFBR3、SEMA4B、PCDHB2、ABCG2、CD166、AFP、BMP-4、β-联蛋白、CD2、CD3、CD9、CD14、CD31、CD38、CD44、CD45、CD74、CD90、CXCR4、饰胶蛋白聚糖、EGFR、CD105、CD64、CD16、CD16a、CD16b、GLI1、GLI2、CD49b和CD49f。参见例如Schulenburg等人,2010,PMID:20185329;美国专利No.7,632,678和美国专利No.2007/0292414、No.2008/0175870、No.2010/0275280、No.2010/0162416和No.2011/0020221,将上述参考文献和专利中的每一者以引用的方式并入本文。应当理解,许多这些标记物包括在上述PhenoPrint阵列中。
类似地,与某些肿瘤类型的癌症干细胞相关联的细胞表面表型的非限制性例子包括:CD44hiCD24low、ALDH+、CD133+、CD123+、CD34+CD38-、CD44+CD24-、CD46hiCD324+CD66c-、CD133+CD34+CD10-CD19-、CD138-CD34-CD19+、CD133+RC2+、CD44+α2β1hiCD133+、CD44+CD24+ESA+、CD271+、ABCB5+以及本领域已知的其他癌症干细胞表面表型。参见例如Schulenburg等人,2010(出处同上);Visvader等人,2008,PMID:18784658;以及美国专利No.2008/0138313,将上述参考文献和专利的每一者以引用的方式全文并入本文。本领域技术人员应当理解,诸如上文刚刚示例的那些之类的标记物表型可结合标准的流式细胞检测分析以及细胞分选技术来使用,以表征、分离、纯化或富集TIC和/或TPC细胞或细胞群体以供进一步分析。对本发明有意义的是,CD46、CD324以及任选的CD66c在许多人结肠直肠癌(“CR”)、乳腺癌(“BR”)、非小细胞肺癌(NSCLC)、小细胞肺癌(SCLC)、胰腺癌(“PA”)、黑素瘤(“Mel”)、卵巢癌(“OV”)以及头颈部癌(“HN”)肿瘤细胞的表面上高度或异质表达,不管所分析的肿瘤样本是原发性患者肿瘤样本(图1A)还是来源于患者的NTX肿瘤(图1B)。
图1A和B中示出的数据是基于流式细胞术的蛋白质表达数据,其用FACSCanto II(BD生物科学公司(BD Biosciences))根据生产商的说明书产生。数据示出了以直方图显示的各个肿瘤细胞,其中同种型对照抗体的背景染色显示为灰色的填充直方图,用MEM-258抗体(BioLegend公司(BioLegend Inc.))测定的CD46表达用加粗黑线条显示。
阴性表达(即“-”)的细胞在本文中定义为在对另外的荧光发射通道中其他所关注蛋白质进行标记的完整抗体染色混合物的存在下,那些表达小于或等于用荧光通道中的同种型对照抗体所观察到的表达的95%的细胞。本领域技术人员应理解,该定义阴性事件的程序称为“荧光扣除对照(fluorescence minus one)”或“FMO”染色。表达大于使用上述FMO染色程序用同种型对照抗体所观察到的表达的95%的细胞在本文中定义为“阳性”(即“+”)。如本文所定义的,存在广义定义为“阳性”的各种细胞群体。首先,低表达(即“lo”)细胞一般定义为那些观察到表达超过使用FMO染色用同种型对照抗体所测定的表达的95%,且在使用上述FMO染色程序用同种型对照抗体所观察到的表达的95%的一个标准偏差内的细胞。“高”表达(即“hi”)细胞可定义为那些观察到表达超过使用FMO染色用同种型对照抗体所测定的表达的95%,且超过使用上述FMO染色程序用同种型对照抗体所观察到的表达的95%一个标准偏差以上的细胞。在其他实施例中,99%可优选用作阴性与阳性FMO染色之间的分界点,在尤其优选的实施例中该百分位数可大于99%。
CD46表达在患有实体瘤的各患者中是可变的;然而,表达通常高于用同种型对照抗体所测定的背景染色(图1A和1B)。CD46表达在来源于大多数结肠直肠癌和胰腺癌患者的肿瘤中是尤其异质的,其中独特的细胞亚群通常分别展示出阴性、低和高的CD46表达(图1B)。
实例2
通过FACS和移植富集肿瘤起始细胞群体的示范
在其中存在所关注的特定蛋白质的异质表达的肿瘤中,根据这些蛋白质的高表达或不表达/低表达对细胞进行分离,然后将细胞移植进免疫功能降低的小鼠中。出人意料的是,据观察,大多数用专有PhenoPrint阵列鉴别为异质表达的独特标记物未展示出在富集肿瘤起始细胞富集方面的实用性。为了分别确定具有高或低的CD46细胞表面表达的结肠直肠肿瘤细胞和胰腺肿瘤细胞是否在免疫功能降低的小鼠中富集致瘤活性,利用本领域技术人员所熟知的细胞解离和FACS技术从NTX肿瘤分离了独特的细胞群体,然后以每只小鼠1,000至3个细胞移植。当肿瘤达到800-2,000mm3时,对小鼠实施安乐死,移出肿瘤并用酶消化解离为单细胞悬浮液用于进行表型表征,以确定所产生的肿瘤是否代表最初从中分离所述移植细胞的亲本肿瘤。
表1示出了这些实验的结果。空白表示所指示的实验未进行。从上皮特异性抗原(ESA)-阳性CD46hi细胞产生的肿瘤一致地产生异质肿瘤,尽管在移植细胞数目低于200个细胞/小鼠时需要另外的标记物(即结肠直肠癌:CD324+CD66c-;胰腺癌:CD324+)来有效地实现这一点。
表1
通过FACS富集结肠直肠和胰腺肿瘤起始细胞群体并移植进免疫功能降低的小鼠中的示范
实例3
通过在NTX模型中进行系列继代CD46hi肿瘤起始细胞亚群展示出肿瘤永续能力
虽然大部分肿瘤细胞缺少肿瘤形成能力并因而可表征为非致瘤(NTG),但在正常胚胎发育和造血肿瘤二者中高度增殖性细胞在移植后能够重新构建肿瘤和/或组织方面存在先例,不过其不具有自我更新能力(即有限的寿命)并因而被称为短期重构细胞或祖细胞。
为了确定CD46hi细胞亚群是否比其他亚群致瘤性更强或更弱,将CD46与另外的标记物标记物系统地组合来进行细胞分离和移植。这个工作导致鉴别了结肠直肠癌的两个另外的细胞表面标记物(CD324和CD66c)和胰腺癌的一个另外的标记物(CD324),它们能够有助于根据各抗原的高表达或阴性表达/低表达对肿瘤起始细胞进行富集。作为这些标记物在结肠直肠癌中的实用性的证明,例如由ESA+CD46hi CD324+CD66c-细胞移植产生的肿瘤(即p1,第1代)是完全异质性的且反映它们所来源的亲本肿瘤(图2;p1肿瘤对比亲本肿瘤)。相比之下,用小数目的ESA+CD46hi CD324+CD66c+细胞移植未产生完全异质性的肿瘤,因为存在显著较少的CD66c-细胞,这表明ESA+CD46hi CD324+CD66c+细胞是具有显著增殖能力的肿瘤祖细胞(TProg),但缺乏自我更新性质。对预期的TPC(ESA+CD46hi CD324+CD66c-细胞)和TProg(ESA+CD46hi CD324+CD66c+细胞)进行系列移植证实了这些肿瘤细胞亚群的种类,因为在系列移植50个细胞时由ESA+CD46hi CD324+CD66c-细胞产生的ESA+CD46hi CD324+CD66c-细胞子集有效产生了肿瘤(图2;p2对比p1肿瘤),而由ESA+CD46hi CD324+ CD66c+细胞产生的肿瘤中的细胞在系列移植后不能有效重新起始肿瘤。更清楚地说,从分别由仅200个CD66c-或CD66c+细胞产生的肿瘤分离的50个ESA+CD46hi CD324+CD66c+细胞是很少致瘤的:尤其是从CD66c+衍生的肿瘤获得的那些细胞。令人惊奇的是,这些数据证明了关于实体瘤的一个开创性观察结果,即ESA+CD46hi CD324+CD66c-细胞是TPC而ESA+ CD46hi CD324+CD66c+细胞是TProg细胞。
为了确定上述TPC表型在结肠直肠癌中的准确性,通过如上所述的FACS分离ESA+CD46hi CD324+CD66c-细胞(图3A;FACS后对比FACS前)并分别以有限稀释度:每只小鼠50、20、8和3个细胞进行移植。基于阳性事件定义为成功致瘤而使用泊松分布统计(见图3B和3C)得到了计算结果,ESA+CD46hi CD324+CD66c-TPC当中真正的肿瘤起始细胞出现率大约为7±3个细胞中有1个。
还不知道组合用于富集结肠直肠肿瘤中上文所定义的TPC和TProg细胞群体的每种蛋白质与任何组织或赘生物中含有该活性的细胞有关联,不过其他人已定义了可类似地用于富集致瘤细胞的细胞表面标记物或酶活性(Dylla等人,2008(出处同上))。这个工作代表该方法的解决方案的重大改进,可进一步改善用于鉴别、分离和表征独特的、高度富集的在移植后专有地含有肿瘤产生能力的实体瘤细胞亚群的技术,并可区分具有或不具有自我更新能力的致瘤细胞亚群(即TProg和TPC)。然而,TPC和高度增殖性TProg亚群二者均在细胞表面上表达CD46,从而表明CD46靶向调节剂将通过消除高度增殖性细胞(即TProg)和那些负责肿瘤生长和再发的细胞(即TPC)而有益于癌症患者。
虽然使用标准的FACS方案观察到使用PhenoPrint阵列鉴别的大部分细胞标记物未表现出富集结肠直肠肿瘤中的肿瘤起始细胞群体的能力,但可使用独特的标记物组合来鉴别两个肿瘤起始细胞亚群:TPC和TProg。
实例4
用伊立替康治疗可增加CD46hi肿瘤永续细胞的出现率
癌症干细胞范例的中心原则是CSC(即TPC)相对耐受化学治疗剂,如伊立替康。为了确定CD46hi TPC是否耐受化学疗法,用SCRx-CR4和CR14结肠直肠肿瘤对小鼠进行初始处理。一旦平均肿瘤负荷达到约300mm3,将小鼠随机化并用15mg/kg伊立替康或介质对照(PBS)处理,每周两次,为期二十天,届时对小鼠实施安乐死(图4A)。在肿瘤收获时,介质处理的对照小鼠携带的肿瘤约700mm3,而用伊立替康处理的小鼠的肿瘤接近该尺寸的一半(约388mm3)。来自各处理组的肿瘤内的TPC出现率(如用上文定义的ESA+CD46hi CD324+CD66c-表型所定义)在来自用伊立替康处理的小鼠的肿瘤中相对于介质对照富集了2.5倍(n=7;P<0.0001;图4B)。TPC频率的富集未受肿瘤尺寸的影响,因为当单独与介质处理小鼠比较时伊立替康处理组中的小肿瘤明显TPC富集(图4C)。
TPC和高度增殖性TProg细胞群体二者均表达CD46以及TPC在处理后的残留肿瘤中显著富集的上述观察结果,证明CD46hi细胞很大程度上促成肿瘤生长、再发和对疗法耐受两者。因此,从若干结肠直肠起源和胰腺起源的实体瘤分离了CD46hi细胞,使得它们的蛋白质和基因表达可通过使用SOLiD3新一代测序平台对各肿瘤细胞亚群的整个转录组进行测序来进行更密切的研究。
实例5
SOLiD全转录组测序揭示肿瘤永续细胞群体中的CD46剪接变体
将如实例1中所述产生和继代的若干结肠直肠癌NTX细胞系(SCRx-CR2、CR4、CR11和CR14)和胰腺癌NTX细胞系(SCRx-PA3和PA6)用于在免疫功能降低的小鼠中起始肿瘤。移出由这些NTX系产生的肿瘤,如实例1中所述使用FACS从新鲜切除的NTX肿瘤分别分离TPC、TProg和NTG细胞。更具体地讲,使用CD46、CD324和CD66c标记物通过荧光激活细胞分选(FACS)分离细胞群体,立即离心得到离心沉淀物并在Qiagen RLTPlus RNA裂解缓冲液(凯杰公司(Qiagen,Inc.))中裂解。然后将裂解物保存于-80℃下直至使用。解冻后,按照供应商的说明书,使用Qiagen RNeasy分离试剂盒(凯杰公司)提取总RNA,并再次使用供应商的方案及所推荐的仪器设置,在Nanodrop(赛默飞世尔公司(Thermo Scientific))和Bioanalyzer 2100(安捷伦公司(Agilent))上定量。所得总RNA制备物适合于基因测序和分析。
制备获自如上文所述自介质或伊立替康处理的小鼠分离的TPC、TProg和NTG细胞群体的RNA样品,以使用Applied Biosystems SOLiD3.0(Sequencing by Oligo Ligation/Detection(通过寡聚物连接/检测测序))新一代测序平台(美国生命科技公司(Life Technologies)),由每份样品至少5ng总RNA开始,进行全转录组测序。由SOLiD平台产生的映射至来自人基因组的34,609个基因的数据能够检测CD46并提供全部样品中的CD46水平的可检验测量。
总体上,SOLiD3新一代测序平台使得能够对连接至小珠的克隆扩增RNA/DNA片段进行平行测序。然后将通过与染料标记的寡核苷酸连接进行的测序用于产生存在于样品中的每个片段的50个碱基读数,总共超过5千万个读数,从而精确表示了基因组中蛋白质的mRNA转录水平表达。SOLiD3平台不仅能够捕捉表达,而且还能捕捉SNP、已知和未知的选择性剪接事件,并且潜在地仅基于读数范围(独特映射至基因组位置的读数)捕捉到新外显子发现。因此,该新一代平台的使用使得可以测定转录水平表达的差异以及那些表达的mRNA转录物的特定剪接变体的差异或偏好。此外,用SOLiD3平台使用来自应用生物系统公司(Applied Biosystems)的改进的全转录组方案进行分析仅需要大约5ng的起始物质预扩增。这与从分选细胞群体提取总RNA一样重要,在所述细胞群体中TPC细胞子集例如在数目上与NTG或本体肿瘤相比极少,因此导致可使用起始物质的数量极小。将来自SOLiD3平台的一式两份操作得到的测序数据进行归一化和转换并按标准行业规范计算倍率。令人惊奇的是,如在结肠直肠或胰腺NTX肿瘤系中所测量的,CD46基因表达在CD46hi或CD46-/lo细胞群体中并不明显不同,尽管这两种细胞群体在很大程度上是基于CD46蛋白的差异表面表达来分离的。
高等哺乳动物中蛋白质多样性的一个重大来源是由翻译期间信使RNA(mRNA)所编码的外显子的差异包含或切除(即选择性剪接)而引起。通过对转录组(即mRNA转录物)进行测序,可以有意义地洞察特定细胞群体中所编码的蛋白质,而其他测量mRNA用法和/或基因表达的技术分别地需要明显更多的工作(靶向重测序)或不能测定外显子-外显子连接区的用法(微阵列)。如表2中所见的,通过使用mRNA扩增方案和在ABI SOLiD3平台上进行的新一代测序对全转录组进行测序而获得的对CD46转录物数据的分析显示,在来自数份患者样品的TPC上表达的CD46的第一变体(primary variant)包括使用外显子1-6、8-12和14,在外显子7和13附近剪接并因而不包括这两个外显子(变体D;NM_153826)(表2)。在大多数TPC中表达的第二变体(secondary variant)也忽略掉外显子8,从而导致CD46蛋白质改变,在其中包括外显子1-6、9-12和14(变体F;NM_172353)。概括地说,结肠直肠和胰腺TPC中表达的所有变体均利用外显子1-6和10-14,但绝大多数转录物还忽略掉编码该蛋白质的细胞内部分的外显子13。结肠直肠和胰腺TPC中所表达的CD46转录物的主要多样性因而来源于外显子8的包括或切除。与其他结肠直肠肿瘤相反,CD46外显子7在来自SCRx-CR14NTX肿瘤的转录物中被利用,虽然这些CD46变体J(NM_172356)转录物仍次于CD46变体D表达(表2)。外显子13的使用在来自结肠直肠或胰腺肿瘤细胞亚群的转录物中极少观察到。
表2
通过SOLiD全转录组测序鉴定结肠直肠和胰腺肿瘤永续细胞中的选择性剪接CD46同种型
对来自独特NTX肿瘤细胞亚群的mRNA的全转录组测序看起来能够精确鉴定转录后的CD46外显子用法。令人惊奇的是,TPC亚群不总是呈现出编码和或利用与它们更分化的子代(TPro和NTG细胞)相同的CD46转录物。然而,关于在各肿瘤细胞亚群中编码何种转录物的知识可有助于开发靶向TIC群体上表达的CD46蛋白的疗法。
实例6
RT-PCR验证肿瘤起始细胞富集的细胞群体中的CD46剪接变体种类
为了确定通过SOLiD全转录组测序观察到的CD46剪接形式的种类是否实际上在通过FACS从NTX肿瘤分离的独特细胞群体中表达,使用RNeasy Plus Micro试剂盒(凯杰公司)在-70℃下保存于含有1%β-巯基乙醇的RLT-Plus缓冲液(由该生产商提供)后从裂解物分离总RNA。具体而言,将解冻的裂解物用QIAshredder离心柱(凯杰公司)均质化并用gDNA Eliminator柱消除基因组DNA,然后施加至RNeasy MiniElute离心柱来捕获总RNA。洗涤后,用无RNA酶水洗脱总RNA。使用RNA 6000Pico试剂盒根据制造商的方案,用NanoDrop 1000分光光度计或Agilent 2100生物分析仪对分离的总RNA进行定量。接着,将20ng总RNA用Quanta qScript cDNA SuperMix进行逆转录,并用AmpliTaqGold DNA聚合酶,采用图5A中所列的e6正向引物和e14反向引物进行PCR扩增(54℃退火以及72℃延伸1分钟,进行40个循环)。使用集成DNA技术公司(Integrated DNA Technologies)的PrimerQuest和OligoAnalyzer 3.0程序,将引物(SEQ ID NO:1和SEQ ID NO:2)设计为利用所观察到的变体中的保守外显子(外显子6和14)。在具有100bp DNA分子量标准(DNA ladder)的2%E-gel上分析扩增子(图5B)。扩增后,用QIAGEN QIAquick PCR纯化试剂盒纯化PCR产物,并克隆进pCR4-TOPO载体中。然后使用TOP10细胞(TOPO TA测序用克隆试剂盒(TOPO TA Cloning Kit for Sequencing),英杰公司)进行该载体的转化,通过PCR针对插入物的存在对集落进行筛选。用EZNA Plasmid MiniPrep试剂盒I(Omega Bio-Tek公司)分离含有正确插入物的质粒并用T3和T4测序引物进行测序。
显示来自从SCRx-CR5和SCRx-CR11NTX肿瘤分离的CD46hi细胞的CD46外显子6至14扩增产物的溴化乙锭染色凝胶在图5B泳道1(CR5)和泳道2(CR11)中示出。100碱基对分子量标准在泳道L中绘出,在第4泳道加载了无模板对照。在分离目视观察到的条带后,纯化cDNA,然后克隆进表达载体和细菌中。挑选单个集落并如上所述用T3和T4引物将插入物进行测序。具体而言,从CR5肿瘤细胞扩增的初级转录物含有外显子6、9、10、11、12和14(代表变体F的323bp扩增子;vF),而在CR11肿瘤细胞中确认的初级转录物含有外显子6、8、9、10、11、12和14(代表变体D的368bp扩增子;vD)(图5C)。检测到次级转录物并确认存在(在图5C中的表中指出),尽管肉眼几乎不可见到条带(数据未示出)。还扩增了来自SCRx-CR4NTX肿瘤系的TPC、TProg和NTG细胞群体的mRNA并测序,证明在各种肿瘤细胞亚群中变体D和F的利用更不确定(图5C);尽管如此,变体用法确认了上述全转录组SOLiD3测序工作中的观察结果。
实例7
用剪接变体特异性引物/探针组的qRT-PCR来测定本体肿瘤和富集的细胞群体中的CD46剪接变体表达
为了更快速地确定给定细胞群体和/或全组织样本中的CD46剪接变体(具体而言,外显子6至12的用法)的表达水平,设计了将会与ABI7900HT实时定量PCR仪相容的定制qRT-PCR引物和FAM探针(图6)。各FAM探针的每一者被设计用于检测特定剪接变体所独有的特异性CD46外显子-外显子连接区,并在384孔板中的至少重复孔中用标准的qRT-PCR方案进行PCR。例如,FAM标记探针被设计为包含外显子8-9连接区,其能区分利用外显子6、8、9和10的转录物用法(CD46变体C、D和M)与利用外显子6、7、8、9和10的转录物用法(CD46变体A和B)。类似地,FAM标记的探针被设计用于分别捕获外显子6-9对和8-10对的用法,使得利用外显子6、9和10的转录物(CD46变体E和F)和利用外显子6、8和10的转录物(CD46变体I和J)也可以通过qRT-PCR快速区分和定量。
与前面的实例中描述的数据类似,来自12个结肠直肠NTX肿瘤的代表性数据表明,包括CD46外显子6、8、9和10或CD46外显子6、7、8、9和10的转录物是大多数结肠直肠肿瘤中所用的第一剪接变体(图6)。如上面实例中所述,全转录组测序和捕获转录物的靶向重新测序二者证实,第一转录物用法是6、8、9和10并且这些通常不包括外显子7,因而表明大多数结肠直肠肿瘤中的初级转录物是CD46变体D。利用外显子6、9和10的转录物(变体F)和利用外显子6、8和10的转录物(变体J)也分别在大多数患者中存在,但程度逐渐减小(图6)。用这些外显子-外显子连接区特异性引物(SEQ ID NO:3-8)筛选的十二个样品之一表明,表达外显子6、9和10的变体是NTX肿瘤系SCRx-CR15中的初级CD46转录物,而编码CD46外显子6、8、9和10的转录物表达程度较低。令人惊奇的是,这些数据和上面实例中描述的数据表明,结肠直肠肿瘤起始细胞中的第一CD46剪接变体利用外显子6、8、9和10(变体D)或外显子6、9和10(变体F)。因为CD46总是与结肠直肠肿瘤和胰腺肿瘤二者中的肿瘤起始能力相关并且这些特异性的外显子-外显子连接区通常用于编码在这些细胞表面上表达的CD46蛋白,外显子连接区6-8、6-9以及在较低程度上外显子连接区8-10和9-10(当外显子13也被剪掉时存在于变体B、D和F中)是强化抗体(empowered antibody)的靶标,该抗体可例如递送毒素或募集细胞毒T细胞至肿瘤起始细胞并因而消除肿瘤起始细胞。
实例8
CD46在示例性肿瘤样品中的蛋白质表达
在证明CD46在TIC表面上的表达增强并表征这些细胞和肿瘤中用于编码CD46的外显子连接区后,如前面实例中所描述的,就寻找相似肿瘤样品中CD46蛋白的相应增加的证据。就此而言,提供包含来自11种肿瘤类型或它们各自的正常相邻组织的432份组织裂解物的4种稀释液的反相癌症蛋白质裂解物阵列(ProteoScanTM阵列;傲锐基因科技有限公司(OriGene Technologies)),以及由无或有由外源性启动子驱动的TP53过表达的HEK-293细胞组成的对照。使用针对人CD46而产生的兔多克隆抗体(HPA;西格玛奥德里奇公司(Sigma Aldrich))或针对编码CD46外显子6、8、9和10的蛋白质构建体而产生的小鼠单克隆抗体(来自下面实例10的SC1.N29)检测该阵列上裂解物中的CD46蛋白表达。比色检测试剂和方案由ProteoScan阵列的生产商提供。使用BZScan2 java软件(http://tagc.univ-mrs.fr/ComputationalBiology/bzscan/)用平板扫描仪将该制造的阵列上的光点转换为数据图像以对光点强度进行定量。
这些阵列的结果在图7A-7C和图8A-C中示出,并表明在数种不同的肿瘤类型中CD46蛋白的表达上调。更具体而言,图7A-C采用泛CD46抗体来显示来自从患有不同肿瘤类型的、处于疾病的多个阶段的患者获得的样本(即原发性肿瘤样品)的正常相邻组织或肿瘤组织中的人CD46表达水平。类似地,图8A-C使用与CD46的外显子10反应的抗体来显示各种肿瘤样品中的表达水平。如上文所述产生数据并以每个光点的平均像素强度(光点强度)表示。对每个数据集所绘的线条表示每一类别中的样本的平均值。
使用识别所有已知CD46剪接变体上存在的由外显子1-6编码的区域内的区域的泛CD46抗体(HPA)所检测到的CD46蛋白表达,看起来在结肠直肠肿瘤样本的子集中(尤其是在IV期疾病患者中)显著升高(图7A)。图7B示出了来自患有胰腺癌的神经内分泌形式和非神经内分泌形式的患者的肿瘤样品上的表达水平,而图7C示出了来自患有不同阶段的卵巢癌的患者的样品上的表达水平。类似地,识别全部14种CD46转录物所利用的CD46外显子10的选择性更强的抗体(SC1.N29;特异性在下面实例15中表征)看起来与晚期结肠直肠肿瘤(图8A)、卵巢肿瘤(图8B)和胰腺肿瘤的神经内分泌亚型(图8C)的裂解物的反应特异性比与正常相邻组织的裂解物的反应特异性更强。此外,与多克隆的泛抗CD46抗体相反,当用CD46外显子10特异性抗体SC1.N29探测时,正常相邻组织样品中的光点强度和标准偏差显著较低。这些结果表明,上述肿瘤中的CD46蛋白表达在癌症中上调,但在正常组织中极微。
这些数据支持上面实例中的观察结果,即CD46过表达可能涉及肿瘤起始细胞和/或TPC增殖和存活。鉴于上面实例显示CD46表达可至少部分地区分结肠直肠肿瘤和胰腺肿瘤中的TPC富集细胞群体以及CD46表面表达与致瘤性和肿瘤传播相关,决定构建可用于产生抗CD46抗体的CD46免疫原。
实例9
可溶性CD46构建体的制造和表达
使用D、F和J同种型制备三种可溶性CD46构建体,以用于产生CD46调节剂和表征该调节剂。
将CD46同种型D的全长开放阅读框(包含CD46基因的外显子1-6、8-12和14;等同于NM_153826的编码序列)和同种型F的全长开放阅读框(包含外显子1-6、9-12和14;等同于NM_172353的编码序列)从获自肿瘤样品Cd4p2的cDNA通过PCR克隆进pENTR载体(美国生命科技公司(Life Technologies))中。DNA测序证实同种型F克隆相对于NCBI参考序列(NM_172353)无突变,而同种型D克隆在开放阅读框内在核苷酸+822处含有单个C->T沉默突变(其中+1=野生型CD46开放阅读框的起始ATG中的“A”)。CD46同种型J的全长开放阅读框(包含外显子1-6、8、10-12和14;等同于NM_172356的编码序列(cds))用剪接重叠延伸PCR使用CD46同种型D cDNA作为模板产生。DNA测序用于确认在同种型J克隆中除了上述沉默突变外没有另外的突变。
将编码这三个CD46变体每一者的细胞外结构域(ECD)的序列与鼠Igκ-链引导序列和8X His标签通过PCR同框克隆进pSec-2-Hygro载体(美国生命科技公司)中。所有三种CD46ECD cDNA均编码CD46蛋白,这种蛋白以成熟N末端残基(Cys35)开始直至每种同种型的跨膜结构域(对应于变体a同种型中的残基343)。所有cDNA构建体使用高保真AccuPrimeTMTaq DNA聚合酶(美国生命科技公司)通过PCR产生并克隆进pSec-Tag(美国生命科技公司)的独特SfiI-PmeI位点中。用编码不同CD46剪接变体的质粒瞬时转染HEK-293T细胞。使用镍亲和柱从瞬时转染的细胞培养物上清液纯化可溶性的分泌的与组氨酸标签融合的CD46ECD蛋白。在磷酸盐缓冲盐水(PBS)(pH 7.2)中,使用Superdex200柱(通用电气医疗公司(GE Healthcare))通过尺寸排阻色谱进一步纯化蛋白质。
在下面列出所得构建体的氨基酸序列:CD46D-His(SEQ ID NO:9)、CD46F-His(SEQ ID NO:10)和CD46J-His(SEQ ID NO:11)。
CD46D-His(SEQ ID NO:9)
CD46F-His(SEQ ID NO:10)
CD46J-His(SEQ ID NO:11)
实例10
CD46调节剂的产生
根据本文教导通过用CD46D-His接种来产生鼠抗体形式的CD46调节剂。就这一点而言,将三个小鼠品系用于产生高亲和力鼠单克隆抗体,所述抗体可在治疗上用于抑制CD46的作用以治疗过度增殖障碍。具体而言,如下将Balb/c、CD-1和FVB小鼠品系用人重组CD46进行免疫并用于产生杂交瘤。
抗原
用来自实例9的包含CD46-D-His的细胞外部分的重组融合蛋白和源于CD46蛋白质序列且位于外显子6-8和6-9的外显子-外显子连接区内的两种合成肽免疫小鼠。
两种肽(长21–22个氨基酸)用固相合成法合成(AnaSpec公司(AnaSpec,Inc.))。基于CD46蛋白的肽的氨基酸序列如下:
外显子6-8连接区:CVPKSLKVSTSSTTKSPASSAS(SEQ ID NO:12)
外显子6-9连接区PVPKSLKGPRPTYKPPVSNYPG(SEQ ID NO:13)
免疫
用三个雌性小鼠品系Balb/c、CD-1和FVB制备CD46的小鼠单克隆抗体。用十个剂量的合成CD46肽1和2的混合物(每次免疫每只小鼠50μg)联合重组CD46D-His(每只小鼠10μg)通过足垫注射免疫小鼠。在注射之前,将该免疫原混合物用等体积的TITERMAX或明矾佐剂乳化。
产小鼠单克隆抗CD46抗体的杂交瘤的产生
处死血清阳性的免疫小鼠,解剖出引流淋巴结(如果增大,则是腿弯部和腹股沟的淋巴结)并用作产抗体细胞的来源。通过电融合将B细胞的单细胞悬浮液(6.35×107个细胞)与非分泌型P3x63Ag8.653骨髓瘤细胞(ATCC#CRL-1580)以1:1的比率融合。使用ECM2001型融合产生器(Genetronic公司(Genetronic,Inc.))进行细胞电融合。将细胞重新悬浮于补加有HAT(Sigma#A9666)的杂交瘤选择培养基(DMEM(Cellgro目录号为15-017-CM)培养基,含有15%Fetal Clone I血清(Hyclone公司)、1mM丙酮酸钠、4mM L-谷氨酰胺、10μg/mL庆大霉素、50μM 2-巯基乙醇、100μM次黄嘌呤、0.4μM氨基喋呤和16μM胸苷)中,然后根据每个96孔板最终接种2×106个B细胞以200μL/孔接种于二十个96孔平底组织培养板中。然后将板置于容纳有5%CO2和95%空气的增湿37℃保温箱中7-10天。
抗人CD46抗体的筛选:
通过ELISA筛选来自十五个96孔板的上清液。更具体地讲,用碳酸盐缓冲液中的来自转染的HEK-293细胞的纯化重组CD46D-His融合蛋白以每孔100ng包被ELISA微量滴定板。将板在4℃下温育过夜,然后用每孔200μl含3%BSA的PBS/吐温(0.05%)封闭。将来自杂交瘤板的上清液添加至每个孔并在环境温度下温育1-2小时。用PBS/吐温洗涤各板,然后在室温下和与辣根过氧化物酶缀合的山羊抗小鼠IgG(Fc片段特异性的)(Jackson ImmunoResearch公司)温育一小时。洗涤后,将各板用TMB(3,3',5,5'-四甲基联苯胺)底物(赛默飞世尔公司34028)显影,并通过分光光度计在OD 450下分析。
将CD46特异性杂交瘤(与抗原反应的154份上清液)在细胞培养物中扩增,再次平板接种,再次筛选并通过有限稀释或单细胞FACS分选进行连续亚克隆。扩增所得的克隆群体,低温保存于冷冻介质(90%FBS、10%DMSO)中并储存于液氮中。
实例11
通过流式细胞术进行CD46调节剂表征
对于流式细胞测定法,将50×106个SW480细胞(ATCC目录号为CCL-228;已知天然表达高水平的人CD46)与等数目的中国仓鼠卵巢细胞(CHO-S;其不表达人CD46)混合至终浓度为2.5×106个细胞/mL。在十五块96孔板的每个孔中,将20μL该细胞混合物添加至25μL含CD46抗体的上清液,该上清液源自如实例10中所述获得的不同克隆。轻轻地涡旋混合样品并在4℃下将板温育30分钟。然后用PBS将细胞洗涤一次,然后用DyLight649抗小鼠IgG(BioLegend公司(BioLegend Inc.))在暗处于4℃染色30分钟。温育后,用PBS洗涤细胞并用DAPI(4',6-二脒基-2-苯基吲哚;用于从分析中除去死细胞)复染。用市售的小鼠单克隆CD46抗体(MEM-258;BioLegend公司)的1:100稀释液制备阳性对照样品,而阴性对照仅用抗小鼠IgG标记。通过流式细胞术分析样品。
使用上述流式细胞术方案,154份阳性杂交瘤上清液(自1,440份预期表达CD46抗体的杂交瘤克隆)中的114份据判断含有与细胞表面上的人CD46相互作用的抗体(数据未显示)。用流式细胞术进行的抗体筛选证明,本发明的调节剂可用于有效表征细胞表面CD46表达以及用于分离CD46阳性细胞。
实例12
CD46调节剂内化
筛选来自产抗CD46抗体的杂交瘤的上清液在K562细胞中内化的能力,该K562细胞在细胞表面上表达CD46。在室温下用Human TruStain(BioLegend公司)封闭起始浓度为106/ml的K562细胞(单细胞悬浮液)10分钟,并稀释至每种条件5×104个细胞。然后在冰上用含抗体的上清液将一式两份的样品染色30分钟,最终体积为50μl。然后用FACS染色培养基(FSM;2%胎牛血清/Hank's缓冲盐水溶液/25mM HEPES[pH 7.4])洗涤细胞以移除未结合的抗体。该步骤之后,在冰上用驴抗小鼠Alexa647(美国生命科技公司)进行第二次染色,历时30分钟。再次洗涤样品以移除未结合的抗体,然后重新悬浮于内化培养基(2%胎牛血清/伊斯考夫改良杜尔贝科培养基(Iscove's Modified Dulbecco's Medium))中。
为进行内化,将样品在5%CO2、37℃(或对于对照组为4℃)下温育1小时。然后通过将样品转移至冰并添加过量的冰冷FSM来中止内化。为移除任何未内化且残留于细胞表面上的抗体,在冰上用低pH PBS(pH 2.0)处理样品10分钟。根据该“酸性剥脱(acid strip)”程序,用FSM充分洗涤样品,重新悬浮于150ul含有2ug/ml DAPI的FSM中,并通过流式细胞术分析。所检测到的除背景外的任何信号均由抗体内化产生:抗体内化是一种保护荧光缀合物免于在酸性剥脱过程中从细胞表面移除的过程。除非另外指明,否则所有温育均在FSM中进行。
使用上述酸性剥脱方案筛选至少75份含CD46抗体的杂交瘤克隆上清液后,许多上清液显示出相对于IgG1和IgG2b阴性对照抗体的阳性荧光偏移(图9A)。例如,示例性的SC1.N149和SC1.N71克隆证明,在来自这些克隆的上清液中的抗体方面的良好内化能够内化Alexa647二抗并保护其免于酸性剥脱。这些数据证明,针对人CD46剪接变体特异性肽和CD46D-His的抗体中的一部分可在抗原呈递于细胞表面上时结合抗原并能够内化(图9)。
实例13
作为靶向部分的CD46调节剂
靶向稳定连接至抗体的细胞毒性药物代表一种强化抗体方法,该方法可能会对实体瘤患者具有很大治疗有益效果。为了确定上述CD46特异性抗体是否能够介导细胞毒性剂向活细胞的递送,进行了体外细胞杀伤测定法,其中将与核糖体失活蛋白皂草素缀合的抗小鼠二抗(先进靶向系统公司(Advanced Targeting Systems))与CD46抗体通过其小鼠Fc区结合,并在72小时后通过测量细胞生活力来测量这些皂草素缀合物内化并杀伤细胞的能力。
具体而言,将每孔5,000个K562细胞接种于96孔板的孔中。将上述抗CD46抗体作为含抗体上清液进行筛选,或者将该抗体从上清液纯化然后稀释至20μg/mL。分别将每一抗体的等分试样以1:1与抗小鼠ZAP或IgG-ZAP(先进靶向系统公司)混合,涡旋混合5秒,然后在室温下温育1小时。然后制备抗体-皂草素缀合物的两份额外的系列10倍稀释物,并分别将50μL的每种混合物添加至容纳K562细胞的孔中,所述孔已容纳有50μL培养基。然后将细胞/抗体缀合物混合物在37℃下温育24小时。在该温育后,将细胞在圆底96孔板中离心,移除上清液,并将100μL新鲜培养基添加至每个孔。然后将细胞再温育72小时,然后根据制造商的方案使用CellTiter-Glo(普洛麦格公司(Promega Inc.))计算活细胞数目。
如上所述筛选CD46特异性的内化性抗体克隆介导皂草素毒素内化和细胞杀伤的能力后,在实例12的内化测定法中能够内化的所有抗体克隆都能够介导体外细胞杀伤,而非特异性的小鼠IgG SAP抗体对照不能杀伤细胞(图9B)。这些观察结果证实,本文所述的内化性抗CD46抗体能够介导细胞毒性毒素向细胞的递送,例如从而导致CD46hi细胞的消除。由于负责肿瘤再生和对疗法的耐受性的结肠直肠肿瘤细胞和胰腺肿瘤细胞是如上所述的CD46hi,本文描述的单克隆抗体具有作为治疗剂的巨大潜力,该治疗剂可能会显著影响总体患者存活率超过当前的护理标准疗法。
实例14
CD46调节剂的测序
基于前文所述,选择多种以明显高的亲和力结合固定化的人CD46的例示性独特单克隆抗体。如图11A和11B中以表格形式所示,对编码来自实例10的单克隆抗体的DNA进行的序列分析证实了许多具有独特的VDJ重排并且呈现新颖的互补决定区。注意,图11B中所示的互补决定区是根据Chothia等人(出处同上)定义。
对于测序的起始,TRIZOL试剂购自英杰公司(美国生命科技公司)。One step RT PCR试剂盒和QIAquick PCR纯化试剂盒购自凯杰公司,其中RNasin购自普洛麦格公司。定制的寡核苷酸购自集成DNA技术公司。
将杂交瘤细胞在TRIZOL试剂中裂解用于RNA制备。将104μL至105个细胞重新悬浮于1ml TRIZOL中。添加200μl氯彷后用力震荡管。将样品在4℃下离心10分钟。将水相转移至新的微量离心管中并添加等体积的异丙醇。用力震荡管并让其在室温下温育10分钟。然后将样品在4℃下离心10分钟。用1ml 70%乙醇洗涤离心沉淀物一次并在室温下稍作干燥。用40μL经DEPC处理的水重新悬浮RNA离心沉淀物。通过在1%琼脂糖凝胶中分级分离3μL来确定RNA制备物的品质。将RNA储存于-80℃冷冻机中直至使用。
使用可变域引物的混合物获得用对鼠免疫球蛋白重链和κ轻链具有特异性的通用引物组扩增的杂交瘤的可变DNA序列。使用One step RT-PCR试剂盒扩增来自每份RNA样品的VH和VK基因区段。Qiagen One-Step RT-PCR试剂盒提供Sensiscript和Omniscript逆转录酶、HotStarTaq DNA聚合酶、Qiagen OneStep RT-PCR缓冲液、dNTP混合物和Q溶液(一种使得能够有效扩增“困难”(例如富含GC)模板的新型添加剂)的共混物。
制备反应混合物,该混合物包括3μL RNA、0.5μL 100μM重链或κ轻链引物、5μL 5×RT-PCR缓冲液、1μL dNTP、1μL含有逆转录酶和DNA聚合酶的酶混合物以及0.4μL核糖核酸酶抑制剂RNasin(1单位)。该反应混合物含有逆转录和PCR所需的所有试剂。热循环仪程序为逆转录步骤50℃持续30分钟、95℃持续15分钟,接着进行30个循环:95℃持续30秒、48℃持续30秒、72℃持续1.0分钟。然后在72℃下最后温育10分钟。
为制备用于直接DNA测序的PCR产物,使用QIAquickTMPCR纯化试剂盒根据制造商的方案纯化这些产物。使用50μL无菌水从离心柱洗脱DNA,然后直接从两条链测序。直接对PCR片段测序并使用VBASE2分析DNA序列(Retter等人,Nucleic Acid Res.(《核酸研究》)33;671-674,2005)。
如上文所论述的,在图10A–10R中分别列出了十八(18)个示例性抗体重链和轻链可变区的氨基酸和核酸序列(SEQ ID NO:14-85),而在图11A和11B中分别以表格形式列出了这些抗hCD46抗体的遗传排列方式和推导的CDR(如Chothia等人(出处同上)所定义)(SEQ ID NOs:86-193)。
值得注意的是,经测序的这18种单克隆抗体中大部分(50%)含有VK10和VK14轻链种系区段。更具体而言,在免疫小鼠组库(repertoire)中强烈地偏倚于IGKV10-94和IGKV14-111基因的使用。进一步分析显示,18种单克隆抗体中有6种使用IGKV10-94基因,19种单克隆抗体中有3种使用IGKV14-111基因。使用IGKV14-111基因区段的三种抗体(SC1.N56、SC1.N66和SC1N77)能识别CD46sushi结构域1内的表位。使用IGKV10-94基因区段的六种抗体中有五种能识别Sushi结构域3-4内的表位。虽然不清楚克隆选择过程的性质,但有可能是这些种系基因区段的CDR区形成有利于结合CD46的抗原决定簇的构象。同时,在相应重链中未观察到可变区偏倚。
实例15
CD46调节剂的表位确定
如上文所论述的,CD46是I型膜糖蛋白,其中细胞外结构域的氨基末端结构域(即由外显子1-6所编码的那些,是所有CD46转录物共有的)由四个短共有重复序列(SCR)构成。这些SCR每一者是大约60个氨基酸的富含半胱氨酸的结构域。接在CD46的这四个SCR后面的是STP结构域,该结构域限定三种剪接变体CD46D、CD46F和CD46J,如Karosi等人(出处同上)所述,将该文献以引用的方式全文并入本文。为了区分泛CD46抗体(即结合一个或多个SCR的抗体)与同种型特异性CD46抗体,大致如实例9中所述在pSec-Tag载体中产生泛CD46ECD-Fc构建体。该构建体编码四个SCR(即外显子1-6),将其用于使用与上文针对CD46ECD变体所述相同的方法在HEK-293T细胞中表达CD46ECD-Fc(数据未示出)。针对与泛CD46ECD蛋白或同种型特异性CD46ECD蛋白每一者的结合,对杂交瘤上清液每一者进行了测试。将源于CD46外显子1-6的序列的带His标签的纯化CD46抗原和来自实例9的CD46D-His、CD46F-His和CD46J-His用于包被ELISA板。通过HRP标记的山羊抗小鼠IgG检测每种单克隆抗体的结合。泛CD46抗体通过其与包括CD46细胞外结构域的前六个外显子而缺少外显子7-10的CD46抗原反应的能力来鉴别。发现160种单克隆抗体中有155种为泛抗体,其结合至所有的CD46重组表达的胞外结构域。五种单克隆抗体不能识别CD46的前6个外显子中的表位,但识别限定CD46D、CD46F和CD46J这三种剪接变体的STP结构域。
图12A示出了SC1.N122和SC1.N29抗体的ELISA数据的图示。数据显示,SC1.N122是泛CD46抗体,因为其结合至CD46外显子1-6(即CD46ECD-Fc)、CD46D-His、CD46F-His和CD46J-His。在另一方面,SC1.N29显示与CD46外显子1-6很少结合或没有结合,但确实显示出与CD46D-His、CD46F-His和CD46J-His结合。因而,这些数据表明SC1.N29与由外显子8和外显子9编码的ST结构或外显子10内的近膜结构域结合。
为了更具体地鉴别CD46中为SC1.N29所识别的区域,将源于CD46的各个外显子-外显子连接区的合成肽直接包被在ELISA板上。通过HRP标记的山羊抗小鼠IgG检测SC1.N29与那些肽的结合。如图12B中所示,SC1.N29结合至肽4,该肽源于外显子9-外显子10连接区。由于SC1.N29与肽4(图12B)和CD46J(图12A)结合,这些数据表明SC1.N29与外显子10中的区域结合,因为仅这些残基是所述肽与CD46J蛋白二者所共有的。
实例16
单克隆抗体CD46调节剂的人源化
使用计算机辅助CDR移植方法(Abysis数据库,UCL Business Plc.)和标准的分子工程改造技术将鼠抗体SC1.N71和SC1.N149人源化以提供hSC1.N71和hSC1.N149调节剂。基于与小鼠构架序列的最高序列同源性及其典型结构选择可变区的人构架区。出于分析的目的,根据Kabat等人的编号方式将氨基酸分配至各CDR域。制备了若干人源化抗体变体以产生最佳人源化抗体。这两类人源化抗体均保留与人构架区联合的来自小鼠杂交瘤的抗原结合互补决定区(CDR)。人源化的SC1.N71单克隆抗体以改善的亲和力结合至CD46抗原,而人源化的SC1.N149单克隆抗体保持与其小鼠对等物相同的抗原亲和力。
使用本领域公认的技术进行分子工程改造程序。为此,根据制造商的方案(Plus RNA纯化系统,美国生命科技公司)从杂交瘤提取总mRNA。将设计用于靶向整个小鼠组库的包含三十二种小鼠特异性5'前导序列引物的引物混合物与3'小鼠Cγ1引物组合使用,以扩增抗体重链的可变区并测序。类似地,将设计用于扩增Vk小鼠家族中的每一者的三十二种5'Vk前导序列引物混合物与对小鼠κ恒定区具有特异性的单一反向引物的组合用于扩增κ轻链并测序。使用逆转录酶聚合酶链反应(RT-PCR)从100ng总RNA扩增VH和VL转录物。
对每一杂交瘤进行总共八次RT-PCR反应:Vκ轻链四次,Vγ重链(γ1)四次。使用QIAGEN One Step RT-PCR试剂盒进行扩增(凯杰公司)。使用特异性V区引物直接对所提取的PCR产物进行测序。使用IMGT分析核苷酸序列以鉴别具有最高序列同源性的种系V、D和J基因成员。使用V-BASE2(Retter等人,出处同上)以及通过将VH和VL基因与小鼠种系数据库比对,来将所得的序列与Ig V区和Ig J区的种系DNA序列相比较。
根据核苷酸序列信息,获得关于SC1.N71和SC1.N149的重链和轻链的V、D和J基因区段的数据。基于序列数据,设计对抗体的Ig VH和VK链的前导序列具有特异性的新引物组,用于重组单克隆抗体的克隆。随后,将V-(D)-J序列与小鼠Ig种系序列比对。N71的重链基因鉴别为VHQ52.a13.37(V)、DSP2.9(D)和JH3,而N149基因的重链鉴别为IGHV1-18(V)、DSP2.8(D)和JH3。对于这两种单克隆抗体,轻链基因均来自IGKV10-94和JK1种系基因家族。
将从SC1.N71获得的重链和轻链序列与功能性人可变区序列比对并评估同源性和典型结构。基于该分析,选取了VH4-59种系和JH4J区段,其中在人源化SC1.N71构建体中未使用架构氨基酸置换。人源化SC1.N71重链的可变区显示与人VH4-59种系序列具有88%同源性,且与小鼠可变区具有78%序列同源性。对于SC1.N71的轻链,采用类似的处理,结果是选择人种系VK O2和J区段JK1,无架构氨基酸置换。所得的hSC1.N71k轻链可变区显示与人VKO2种系序列具有90%同源性(阳性Z分值为0.945),且与小鼠可变区具有85%序列同源性。人源化SC1.N71重链的核酸序列和相应的氨基酸序列(SEQ ID NO:198和199)以及人源化轻链的核酸序列和相应的氨基酸序列(SEQ ID NO:200和201)在图13A中示出,其中所述CDR(如Kabat等人所定义)标有下划线。
按照类似的程序来产生hSC1.N149。该分析提供了包含VH1-18基因区段和J区段JH4的人源化重链,无架构氨基酸置换。人源化SC1.N149重链的可变区显示与人VH1-18种系序列具有87%同源性,且与小鼠可变区具有77%序列同源性。对于轻链可变区,该分析表明,无架构置换的VK O2和J区段JK1将会是有效的。人源化SC1.N149k轻链可变区显示与人VKO2种系序列具有87%同源性(阳性Z分值为0.942),且与小鼠可变区具有80%序列同源性。人源化SC1.N149重链的核酸序列和相应的氨基酸序列(SEQ ID NO:202和203)以及人源化轻链的核酸序列和相应的氨基酸序列(SEQ ID NO:204和205)在图13A中示出,其中所述CDR(如Kabat等人所定义)标有下划线。
将两条重链的合成的人源化可变DNA片段(集成DNA技术公司)克隆进人IgG1表达载体中。将可变轻链片段克隆进人C-κ表达载体中。通过将重链和轻链共转染进CHO细胞中来表达抗体。
更具体而言,为产生抗体,将鼠和人源化可变基因PCR产物定向克隆进人免疫球蛋白表达载体中。在Ig基因特异性PCR中使用的所有引物均包括限制位点(对于IgH为AgeI和XhoI,对于IgK为XmaI和DraIII),其使得可以分别直接克隆进含有人IgG1和IGK恒定区的表达载体中。简而言之,用Qiaquick PCR纯化试剂盒(凯杰公司)纯化PCR产物,随后分别用AgeI和XhoI(IgH)、XmaI和DraIII(IgK)进行消化。纯化经消化的PCR产物,随后连接进表达载体中。以10μL总体积用200U T4-DNA连接酶(纽英伦生物技术公司(New England Biolabs))、7.5μL经消化并纯化的基因特异性PCR产物和25ng线性化载体DNA进行连接反应。通过在42℃下热休克用3μL连接产物使感受态大肠杆菌DH10B细菌(美国生命科技公司)转化并平板接种于氨苄青霉素板(100μg/mL)上。然后将VH区的AgeI-EcoRI片段插入pEE6.4HuIgG1表达载体的相同位点中,同时将合成的XmaI-DraIII VK插入物克隆进各pEE12.4Hu-k表达载体的XmaI-DraIII位点中。
通过用适当的质粒使用293fectin转染HEK 293细胞来产生产人源化抗体的细胞。就此而言,用QIAprep离心柱(凯杰公司)纯化质粒DNA。在150mm板(BD-Falcon公司(Falcon,Becton Dickinson))中,在标准条件下,在补充有10%热灭活FCS、100μg/mL链霉素、100U/mL青霉素G(均来自美国生命科技公司)的达尔伯克氏改良伊格尔氏培养基(DMEM)中培养人胚肾(HEK)293T(ATCC No CRL-11268)细胞。
对于短暂转染,将细胞培养至80%汇合。将等量IgH和相应IgL链载体DNA(12.5μg每种载体DNA)添加至与1.5mL opti-MEM中的50μL HEK 293转染试剂混合的1.5mL Opti-MEM中。将该混合物在室温下温育30分钟并均匀地分布于培养板。转染后三天采集上清液,用20mL补充有10%FBS的新鲜DMEM更换并在转染后6天再次采集。通过以800×g离心10分钟使培养物上清液去除细胞碎片并保存于4℃下。用蛋白G珠(通用电气医疗公司)纯化重组嵌合抗体和人源化抗体。
实例17
CD46调节剂的结合特征的确定
使用多种方法分析所选的如上文所述产生的CD46调节剂的结合特征。具体而言,对于大致使用如上文实例9中所述的标准技术产生和表达的三种CD46同源物,就亲和力、动力学、分类别(binning)和交叉反应性对多种CD46抗体进行表征。更具体而言,表达并纯化猕猴(在本公司内进行蛋白质测序和表达,数据未示出)、狨猴(Callithrix jacchus;GenBank登录号:Q8HYX8.2)和松鼠猴(Saimiri sciureus;使用GenBank登录号:AAB66819.1和AAC39671.1的组合制备构建体;数据未示出)CD46同源物,然后通过ForteBIO分析。还通过蛋白质印迹测量所述抗体与还原的或未还原的抗原的反应性,十分少的所测抗体与还原的抗原结合。这些实验的结果在图14中以表格形式列出。
关于该数据,以三种方式测量亲和力以确保精确度。首先,在ELISA中测量固定量的针对抗原系列稀释液探测的抗体的结合信号,以测定相对调节剂活性(数据未示出)。其次,接着使用标准的抗原浓度系列在ForteBIO RED(ForteBIO公司(ForteBIO,Inc.))上利用生物层干涉测定分析法测量所选的调节剂的亲和力和动力学常数kon和koff。最后,通过表面等离子共振(Biacore System,通用电气医疗公司)测量所选的调节剂的亲和力。基于标准抗原浓度系列以及使用1:1Langmuir结合模型,测定抗体与抗原结合的Kd以及动力学常数kon和koff。图14确定了用于产生该表中包括的亲和力测量值的方法(F代表ForteBIO,B代表Biacore)。一般而言,所选的调节剂显示具有处于纳摩尔范围内的相对高的亲和力。
为了进一步表征CD46调节剂,制备了截短型蛋白质构建体,其每一种缺失四个sushi结构域中的一个。使用ELISA测试了与这些构建体的结合以鉴别特定调节剂的CD46靶标区域。该工作的实验细节在实例14中列出,其中每种所测抗体的结合结构域在图14中示出。
为确定由CD46调节剂识别的表位是包含邻接氨基酸还是通过抗原的二级结构所并置的非邻接氨基酸形成,在还原和非还原条件下进行了蛋白质印记法。更具体地讲,使用本领域所熟知的标准电泳技术,使两种状态下的CD46抗原暴露于所选的调节剂。如图14中详细说明的,大部分CD46调节剂实质上仅与二硫键完整的抗原(NR)反应,而有两种调节剂与非还原和还原的抗原(NR/R)均反应。
最后,在ForteBIO中使用一系列浓度的重组表达的单体CD46抗原来评价猕猴、狨猴和松鼠猴CD46同源物的交叉反应性。如图14中所列,所选的调节剂可与多种的同源物反应。具体而言,SC1.N71和SC1.N149可与猕猴和狨猴反应,但不与松鼠猴反应。表格中的ND表示未测定数据。
实例18
所选的CD46调节剂的表位确定
为了确定由所选的如上文所述产生的CD46调节剂所限定的表位,构建并表达了CD46ECD的若干不同变体。更具体而言,使用扩增各种CD46SCR结构域的引物设计CD46缺失突变体(如Adams等人,Journ.Immunol.(《免疫学杂志》),第147卷:3005,1991中所述,将该文献以引用的方式全文并入本文)并将这些突变体与His标签融合以进行亲和纯化(凯杰公司,Ni-NTA)。然后使用标准的生物化学技术大致如实例9中所述克隆并表达四种单独的His融合构建体,各略掉四个SCR结构域中的一个。使用293Fectin(美国生命科技公司),将分离的无内毒素质粒DNA(凯杰公司)用于转染贴壁HEK-293细胞。在转染后72小时,收获包含所表达的缺失型突变体的HEK-293转染细胞的上清液。对若干CD46的单克隆抗体通过其识别缺失确定的SCR结构域的各CD46蛋白的能力进行了测试。更具体地讲,通过大致使用本文其他地方描述的方法所进行的ELISA测定法,所选的抗体调节剂被鉴别为分别针对SCR结构域1至4的任何组合。这些调节剂中的十二种的数据可以表格形式见于图14中的标题“结构域”下,其中指明了所得的结合结构域。应该指出的是,一种抗体(SC1.N29)不结合至任何sushi结构域而是结合至外显子9,如实例15中所证实的。
本实例再次证明了能够产生和选择与所述治疗靶标的所选的同种型或剪接变体免疫特异性缔合的CD46调节剂。
实例19
单克隆抗体CD46调节剂的表征
使用实例17中所述的技术,对人源化构建体hSC1.N71和hSC1.N149进行分析以确定它们的结合特征。更具体地讲,对于两种抗体,将人源化抗体结合直接与亲本鼠抗体进行比较以鉴别由人源化过程引起的速率常数的任何微小变化。
就这一点而言,使用表面等离子共振(SPR)通过Biacore测量鼠SC1.N71的亲和力以提供图15A中所示的结果。基于浓度系列12.5、6.25、3.125和1.5625nM(产生图15A和15B中从上到下的曲线)以及使用1:1Langmuir结合模型,抗体与抗原结合的Kd估计为1.1nM。接着用人源化构建体进行的类似实验显示出同等结果(图15B),这表明人源化过程并未不利地影响亲和力。就这一点而言,测量结果表明,当用人CD46测试时人源化构建体的Kd为0.7×10-9,相比之下亲本鼠抗体的Kd为1.1×10-9(图15C)。
然后进行类似的实验以将hSC1.N149的结合与其鼠亲本SC1.N149的结合相比较(数据未示出)。如可在图15C中所见的,人源化抗体的Kd为1.2×10-9,相比之下,亲本鼠抗体的Kd为1.1×10-9。
除了亲和力测量外,进一步测试抗体以测定关于狨猴和猕猴抗原的交叉反应性。如图15C中所示,SC1.N71和SC1.N149二者均与猕猴和狨猴CD46同源物二者发生强的交叉反应,从而有利于毒理学研究。与狨猴和猕猴的反应性尽管稍低于对人靶标的反应性,但仍完全处于可接受的治疗窗口内。
实例20
CD46调节剂可用作诊断剂
根据本文的教导,可将所公开的CD46调节剂用作诊断剂以检测来自患者的生物样品中的CD46相关生物标记。
如先前提到的,CD46是I型糖蛋白,已知存在于细胞质膜中但可通过金属蛋白酶的作用从膜分开。CD46由于其mRNA的选择性剪接而以多种分子量同种型存在,该选择性剪接是基于外显子切换和/或省略掉跨膜结构域两侧的近膜区。由于显示具有这类性质,在某些疾病病症中CD46应可以在体液如血清或血浆中检测到,并因而可用于诊断目的或用作疾病生物标记。为了确认本发明的这一方面,使用夹心ELISA格式用抗CD46抗体产生如图16A所示(插图)的标准曲线,并将该标准曲线的一部分(图16A的主图)用于定量从健康受试者和患有各种实体瘤的患者获得的血清样品中的CD46水平(图16B)。
更具体而言,将50mM碳酸钠缓冲液(pH9.6)中的单克隆抗体SC1.N35.6以1μg/ml吸收至标准ELISA板。在用含有0.05%(v/v)吐温-20的PBS(PBST)洗涤板后,在环境温度下将板在含有2%(w/v)牛血清白蛋白的PBS(从现在起称为“稀释剂”)中封闭两小时。弹去板的内含物,在环境温度下将不同浓度的纯化重组CD46D-His或在稀释剂中稀释的血清样品添加至板中保持最少两个小时。将板在PBST中洗涤,然后将稀释剂中的与生物素缀合的CD46特异性山羊多克隆抗体以0.5μg/ml添加。温育一小时后,再次用PBST洗涤该板并与缀合至辣根过氧化物酶的链霉亲和素(Jackson Immuno Research公司)的1:2000稀释物一起温育30分钟。在用PBST将全部板洗涤两次后,将100μL TMB底物(赛默飞世尔公司)添加至孔并在暗处温育30分钟。通过每孔添加100μL 2M硫酸来终止颜色反应。使用标准的读板仪读取所有孔中的λ=450nm的吸光度。
在该数据集中,将来自12名健康成人的血清中的CD46水平与来自17名结肠直肠癌患者、6名骨髓瘤患者、15名乳腺癌患者、7名卵巢癌患者、10名非小细胞肺癌患者、14名前列腺癌患者和9名胰腺癌患者的血清样品相比较。如图16B中所示,这些数据显示健康成人血清样品中的平均CD46浓度为大约12.1±2.2ng/ml,而结肠直肠癌、乳腺癌和非小细胞肺癌患者中的CD46浓度显著较高(分别是26.6±3.4、30.6±2.3和42.0±7.1ng/ml)。这些结果清楚地证明,本发明所公开的调节剂可有效充当诊断剂用于检测和/或监测赘生性障碍。
实例21
充当靶向部分的CD46调节剂
稳定连接至抗体的细胞毒性药物的靶向代表一种强化抗体方法,该方法可能会对实体瘤患者具有很大治疗有益效果。为了确定上述CD46特异性抗体是否能够介导细胞毒性剂向活细胞的递送,进行了体外细胞杀灭测定法,其中将与核糖体失活蛋白皂草素缀合的链霉亲和素(先进靶向系统公司)结合至生物素化的CD46抗体调节剂,并在72小时后通过测量细胞生活力来测量这些皂草素复合物内化并杀灭细胞的能力。更具体而言,将每孔10,000个HEK-293T细胞接种于96孔板的孔中。第二天,将上述纯化的且生物素化的抗CD46抗体稀释至100nM。分别将每一抗体的等分试样以1:1的摩尔比与链霉亲和素-ZAP(先进靶向系统公司)混合,然后在室温下温育30分钟。将抗体–链霉亲和素-ZAP缀合物系列稀释并将所有稀释液添加至细胞。然后将细胞/抗体-皂草素混合物在37℃/5%CO2下温育72小时。在该温育后,使用CellTiter-Glo(普洛麦格公司)按照生产商的方案对活细胞数目进行计数。无抗体–链霉亲和素-ZAP的培养物用作参照,并将它们的发光值设定为“100%活细胞”。
使用该方案,数种如先前实例中所述能够内化的抗体也能够介导活体外细胞杀灭(数据未示出),而生物素标记的同种型对照抗体不能杀灭细胞。也就是说,这些内化性调节剂中的数种能够介导导致细胞死亡的皂草素毒素内化。图17示出了示例性的内化性调节剂SC1.N71、SC1.N146(作为小鼠/人嵌合抗体)和SC1.N149的这种细胞杀灭能力,其中曲线的下行部分代表与对照相比细胞以浓度依赖的方式死亡。此外,图17中所示数据证明,来自实例16的两种抗CD46抗体(hSC1.N71和hSC1.N149)保留初始小鼠抗体介导细胞的CD46依赖性的毒素摄入的能力。具体而言,记录了如下引起50%细胞死亡的有效浓度(EC50):生物素-人IgG1,53.1nM;生物素-小鼠SC1.N71,51.4pM;生物素人SC1.N71,26.6pM;生物素嵌合SC1.N146,12.1pM;生物素-小鼠SC1.N149,70.4pM;生物素人SC1.N149,174pM。
实例22
CD46调节剂与细胞表面上的受体相互作用
为了证明细胞杀灭是由CD46调节剂与细胞表面上表达的CD46受体之间的相互作用介导,将慢病毒用于稳定递送小发夹RNA(shRNA),该RNA在转导进宿主细胞后,即整合进宿主细胞的基因组中,并在表达后,特异性结合至CD46mRNA的区域,从而引起细胞内的快速mRNA降解以及宿主细胞的CD46表达降低或丧失。
使用确立的技术制备并浓缩含有CD46发夹的第三代慢病毒原种(美国生命科技公司)。用慢病毒原种转导HEK293T细胞,该病毒原种编码CD46特异性shRNA和作为成功转导的标记物的蓝色荧光蛋白。转导后第六天,通过流式细胞术分析细胞的CD46表达和高的蓝色荧光蛋白表达(未示出),通过FACS分选展现出最大CD46下调和最高蓝色荧光蛋白表达的细胞(即表达shRNA C1的那些细胞)。将分选的细胞另外培养7天,然后在类似于上文实例21中所述的测定法的体外杀灭测定法中将它们与它们的亲本对等物平行测试。另外,两类细胞系均用与荧光团藻红蛋白缀合的抗CD46抗体(R&D Systems公司)染色并通过流式细胞术进行分析,以证明经慢病毒转导(并分选)的细胞系中CD46表达下调。结果在图18A和18B中示出。
更具体地讲,图18A证明,当用抗CD46抗体染色时,HEK-293T-C1细胞(灰色峰)与其亲本对等物(白色峰)相比平均荧光强度降低10倍。HEK-293T细胞被CD46调节剂有效杀灭,但它们的衍生HEK293T-C1(其表达会下调CD46表达的shRNA)没有被CD46调节剂有效杀灭(图18B)。在该特定实例中,将指定浓度的纯化抗体和120nM的与核糖体失活蛋白皂草素缀合的抗小鼠IgG分子的Fab片段(先进靶向系统公司;FAB-ZAP)添加至HEK293T细胞或分选的HEK293T-C1细胞。在温育72小时后,使用CellTiter-Glo(普洛麦格公司)按照生产商的方案测定活细胞数目。仅含有细胞和FAB-ZAP的培养物用作对照,并将它们的发光值设定为“100%活细胞”。
实例23
CD46调节剂介导受体依赖的毒素摄入
在体外培养许多代的传统细胞系与源自患者的原发性肿瘤细胞在其生物学方面显著不同。为了评估CD46调节剂是否可以介导类似于患者肿瘤的癌细胞所进行的受体依赖的毒素摄入,在体外杀灭测定法中测试了衍自患者的在免疫功能降低的小鼠中继代的非传统异种移植物。
具体而言,将BR31p6细胞(源于乳腺癌患者的细胞系)以10,000/孔接种于Primaria TC板中并在低氧培养箱中培养24小时。更换培养基并将如上面实例21中所述制备的生物素化抗体和链霉亲和素-ZAP缀合物添加至该培养物保持72小时。使用CellTiter-Glo(普洛麦格公司)按照生产商的方案对活细胞数目进行计数。无抗体–链霉亲和素-ZAP的培养物用作参照,并将它们的发光值设定为“100%活细胞”。BR31细胞仅在生物素化SC1.N149和链霉亲和素-ZAP一起存在时被杀灭。单独的SC1.N149或生物素化同种型对照抗体+链霉亲和素-ZAP均不介导显著的细胞杀灭(图19A)。
为了证明CD46调节剂可在许多实体瘤适应症中用作细胞毒性有效载荷的媒介物,将源于非传统异种移植物CR42p3(一种源于结肠直肠癌患者的细胞系)和PA20p6(一种源于胰腺癌患者的细胞系)的肿瘤以每孔2000个细胞接种于Primaria TC板中。在低氧培养箱中培养72小时后,将1.0nM纯化抗体(CD46调节剂或其同种型对照)和40nM FAB-ZAP(参见图19B)添加至培养物,另外培养168小时。使用CellTiter-Glo(普洛麦格公司)按照生产商的方案对活细胞数目进行计数。仅含有细胞和FAB-ZAP的培养物用作对照,并将它们的发光值设定为“100%活细胞”。抗体SC1.N71和SC1.N149特异性地杀灭CR42和PA20细胞,其中相比于SC1.N149,SC1.N71看起来稍微更强效(图19B)。
这些数据清楚地证明了所公开的调节剂在充当细胞毒性有效负载在表达CD46配体的致瘤细胞中的选择性内化的载体时的特异性和广泛有效性。
实例24
CD46调节剂使胰腺肿瘤对化学疗法敏感
为了评估所公开的调节剂是否可以增加胰腺肿瘤的化学敏感性,将抗CD46抗体与抗癌剂在体内测定法中组合。
更具体地讲,使用源于患者的NTX-PA14肿瘤系在免疫功能降低的小鼠中起始肿瘤,然后当所有小鼠的平均肿瘤体积达到大约500mm3时将这些小鼠随机分配进三组中的其中一组(每组10只小鼠)。两组每周用20mg/kg剂量的吉西他滨和10mg/kg靶向CD46的抗体(SC1.N149)或对照非特异性同种型匹配抗体(MOPC)处理两次。用作对照的剩余的一组每周一次接受2mg/kg剂量的抗CD46抗体-药物缀合物,该缀合物不能内化或介导细胞杀灭。在第3次处理后的第一天(随机分组后的第8天),并且当肿瘤积极响应相应的给药方案时,对每组2只小鼠实施安乐死并通过流式细胞术对残余TPC的出现率进行计算。具体而言,将分离自如上所述处理的小鼠的肿瘤细胞的单细胞悬浮液与抗标记物抗体接触,该标记物使得可以对TPC亚群进行鉴别和定量。在来自用抗CD46抗体SC1.N149与吉西他滨的组合处理的小鼠的肿瘤中,表达与TPC群体相关联的细胞表面标记物(即CD46和CD324)的人细胞的百分比显著低于对照组和吉西他滨+MOPC抗体处理组(27%的人细胞对比约39%)(图20A)。
除了在该研究中用作对照的小鼠(由于它们的肿瘤负荷大而必须将它们实施安乐死)外,其余的每组8只小鼠继续接受另外的11次吉西他滨和抗体处理(总共14次处理),为期7周,此后将小鼠仅用抗体(分别是MOPC或SC1.N149)每周处理两次并监测肿瘤负荷(即肿瘤体积测量)。总的来说,两个吉西他滨处理组中的肿瘤均响应它们各自的处理方案并退化至低于100mm3;然而,用SC1.N149抗体和吉西他滨处理的那些小鼠显示出比单独用吉西他滨处理的小鼠中的肿瘤更长的无进展生存期(分别是75天和30天)(图20B)。
这些数据证明,在胰腺癌中靶向CD46的抗体能够使肿瘤细胞对护理标准的化疗剂吉西他滨敏感。考虑到先前证明了TIC刺激肿瘤再发—相比于仅用吉西他滨处理,用裸抗CD46抗体和吉西他滨二者处理的小鼠中该TIC刺激的肿瘤再发被显著延缓—这里给出的数据表明裸SC1.N149抗体能够特异性地有利于TIC对化疗药物例如吉西他滨的敏感性。
实例25
CD46调节剂可减少NTX小鼠中的肿瘤起始细胞
通过皮下、肾包囊或异位移植人肿瘤片段或人肿瘤细胞的单细胞悬浮液对小鼠进行异种移植,其中至少有亚群表达CD46,使得其携带人肿瘤。一旦肿瘤达到100–500mm3的负荷即对携带人肿瘤的小鼠进行随机分组并用靶向人CD46的抗体-药物缀合物(ADC)处理,例如通过以最多10mg/kg单独或与护理标准化疗剂如伊立替康或吉西他滨组合一周给药一次或两次来进行。优选地,ADC将包含与细胞毒性药物部分或毒素缀合的抗CD46抗体。
在处理数周后,观察到肿瘤或变小直至无肿瘤块存留、或经历部分退化(其中某些肿瘤块存留),或保持其肿瘤块而不继续生长。在后面的情形中,对残余肿瘤块进行检查表明在肿瘤块中无人细胞存留(即其由残留的鼠基质细胞构成),或者显示肿瘤起始细胞减少或消除,如通过各种体外测定法(如对集落形成细胞进行计数)和体内测定法(如有限稀释分析以证明在经处理的肿瘤中肿瘤起始细胞的绝对减少或消除)所测定的。对小鼠进一步观察确认了通过肿瘤生长再发显著延缓(即>60天)或完全阻止肿瘤再发所体现的TIC的减少或消除。
本领域技术人员应进一步理解,在不脱离本发明的精神或其中心属性的情况下,本发明可以其他特定形式实施。因为本发明的以上描述仅公开其示例性实施例,所以应了解设想到其他变化形式涵盖在本发明的范围内。因此,本发明并不限于本文已详细描述的具体实施例。相反,应参考指示本发明的范围和内容的随附权利要求。
- 还没有人留言评论。精彩留言会获得点赞!