PKA抑制剂H‑89的新应用的制作方法
本发明涉及一种PKA抑制剂H-89的新用途,属于生物医药
技术领域:
。
背景技术:
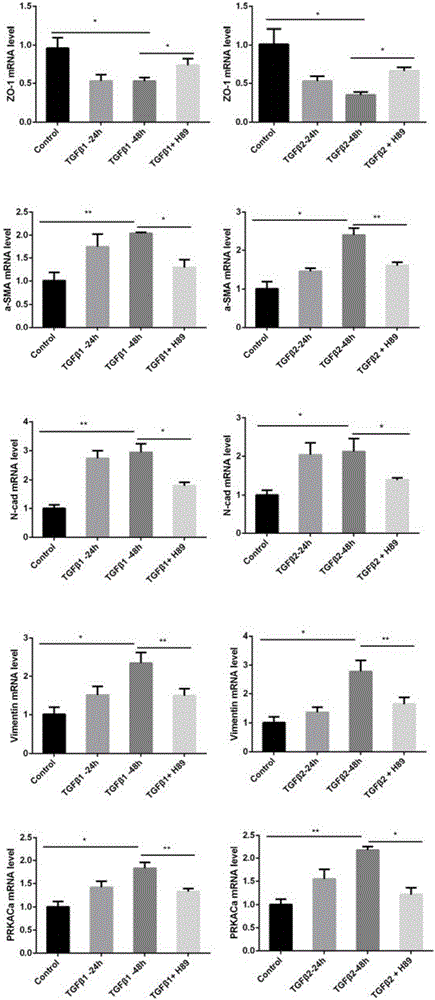
:增生性玻璃体视网膜病变(PVR)是指孔源性视网膜脱离后玻璃体腔内和视网膜表面的膜增生和收缩的病变,这些增生的膜可以牵拉和重新打开已经修复的裂孔,造成新的裂孔并且扭曲和遮挡黄斑,同时PVR也是最常见的导致视网膜脱离手术失败的原因,据报道其发生率为5.1%~11.7%,在最终失败的视网膜脱离手术中,75%的病因都归因于PVR,因此其也是致盲的主要原因。文献报道仅有11~25%的PVR患者经治疗后视力能够达到0.2以上。但是迄今为止对PVR的发病机制的研究仍不明确,临床上没有可用的有效治疗药物,仍主要通过玻璃体切除手术治疗,但手术较为复杂,且手术也不能彻底解决问题,术后容易复发,往往经过多次手术,患者的视功能仍逐渐下降甚至丧失,而且手术费用也很昂贵,给患者及家属带来沉重的心理负担及经济损失,因而深入研究PVR的发病机制,探寻安全有效的靶向药物治疗方法,来辅助视网膜脱离手术的成功,对于PVR的治疗具有重要的临床意义和社会价值。在增生性玻璃体视网膜病变的发病机制中,上皮-间质化(EMT)被认为是最重要的机制之一。EMT是指上皮细胞通过特定程序逐步转化成为具有间质表型细胞的生物学过程,如失去典型的上皮样形态,而转变为纤维样形态,并失去细胞之间的紧密连接,上皮细胞标记物如ZO-1,E-cad等表达下降,而间质细胞标记物如a-SMA,FN,Vimentin等表达增加,细胞的增生、迁移能力增强,在多种纤维化疾病中有着重要的作用。RPE细胞在多种细胞因子的作用下发生EMT是PVR的重要病理过程。目前关于PVR的EMT相关机制的研究最多的是TGFβ信号通路,被认为是最主要的PVR发病的纤维化因子,在PVR患者的玻璃体、视网膜下液以及增殖膜中都高表达。TGFβ信号通路包括经典的Smad信号通路和非经典信号通路。在经典的TGFβ-Smad信号通路中,TGFβ与I型受体结合,再直接磷酸化Smad2和Smad3,然后再与Smad4结合并转运到细胞核中去发挥它们的作用。而非经典的TGFβ信号通路主要包括丝裂原活化蛋白激酶(MAPK)、细胞外信号调节激酶1/2(ERK1/2)和磷脂酰肌醇-3激酶(PI3-K)/蛋白激酶B(PKB或者AKT)/哺乳动物雷帕霉素靶蛋白(mTOR),其中MAPK非经典通路包含p38MAPK,c-JNK和p42/44ERK。目前为止,在PVR的机制研究中,还没有涉及到关于蛋白激酶A(PKA)信号通路以及TGFβ和PKA信号通路相互关系的研究。PKA是一个在细胞中广泛存在的依赖于cAMP的丝-苏氨酸激酶,PKA包含两个调节亚基和两个激活亚基,当细胞内c-AMP浓度升高时,cAMP与调节亚基结合,改变调节亚基构象,使调节亚基和激活亚基解离,释放出激活亚基。活化的PKA激活亚基可使细胞内某些蛋白的丝氨酸或苏氨酸残基磷酸化,于是改变这些蛋白的活性,进一步影响到相关基因的表达,如一部分激活亚基可以转运到核内激活转录因子c-AMP反应元件结合蛋白(CREB)。PKA信号通路与细胞循环、存活、增殖、分化以及凋亡等多种生命活动相关。而目前在PVR的机制研究当中,除了TGFβ信号通路,还有肝细胞生长因子(HGF)、血小板生长因子(PDGF)、成纤维细胞生长因子(FGF)、骨形态蛋白(BMPs)以及结缔组织生长因子(CTGF)等信号通路,但是还没有有关PKA信号通路的研究,同时也没有TGFβ和PKA信号通路相互关系的研究。技术实现要素:本发明的目的就是为了探讨PVR的机制,尤其是TGFβ和PKA信号通路之间的关系,而进一步阐明PVR的机制,并提供一种PVR治疗的有效药物PKA抑制剂H-89。本发明的目的可以通过以下技术方案来实现:本发明发现在体外TGFβ诱导的EMT细胞模型以及体内SD大鼠PVR模型中,PKA抑制剂H-89都能够有效地抑制PVR。在体外模型中,我们利用10ng/ml的TGFβ在ARPE19细胞中诱导EMT,用5-20uM的H-89处理EMT的细胞,可以降低EMT相关基因a-SMA、Fibronectin等的表达,而升高上皮相关基因ZO-1等的表达,同时还能保护EMT引起的紧密连接的破坏及组织细胞骨架的重构。在体内试验中,我们利用玻璃体腔注射8ul的ARPE19细胞(2.4*106)的血小板富集血浆(PRP)悬液的方法成功诱导PVR模型,再通过玻璃体腔注射H-89(终浓度5-50uM)进行治疗,与生理盐水对照组相比,发现H-89能够保护由于PVR造成的SD大鼠的ERG下降以及视网膜结构的破坏。本发明的第一方面,提供了在体外的细胞模型中,PKA抑制剂H-89能够抑制ARPE19细胞发生EMT过程模拟的PVR过程。具体而言,PKA抑制剂H-89能够在体外从mRNA、蛋白以及基因定位等方面保护TGFβ引起的EMT相关基因的改变。本发明的第二方面,提供了在体内的SD大鼠PVR模型中,PKA抑制剂H-89能够抑制PVR的症状,并延缓其进展。具体而言,所述的PKA抑制剂H-89作为TGFβ诱导的人视网膜上皮细胞增值和迁移的抑制剂。在ARPE19细胞联合血小板富集血浆玻璃体腔注射诱导的PVR模型中,PKA抑制剂H-89的应用能够保护PVR引起的SD大鼠的视网膜电图b波波幅的下降。所述的PKA抑制剂H-89作为眼球结构改变抑制剂和前膜形成促进剂的应用。在ARPE19细胞联合血小板富集血浆玻璃体腔注射诱导的PVR模型中,PKA抑制剂H-89的应用能够还能够保护眼球结构的改变如前膜的形成等。所述的PKA抑制剂H-89作为间质细胞标记物抑制剂的应用。在ARPE19细胞联合血小板富集血浆玻璃体腔注射诱导的PVR模型中,H-89的应用能够降低EMT标记物a-SMA的表达。本发明的第三方面,揭示了在PVR的发病过程中,TGFβ与PKA信号通路的关系,发现在PVR的过程中,TGFβ能够激活PKA信号通路。表现为在体外细胞模型中,TGFβ1能够剂量依赖和时间依赖的增加PKA的活性。本发明的第四方面,提供了PKA抑制剂H-89作为PVR治疗药物与PVR抑制剂的依据,提供了一种通过玻璃体腔注射H-89进行PVR治疗的手段。具体而言,PKA抑制剂H-89作为预防和/或治疗增生性玻璃体视网膜病变药物的应用。以及PKA抑制剂H-89作为辅助视网膜脱离手术药物的应用,PKA抑制剂H-89以玻璃体腔注射剂的形式使用。本发明的第五方面,提供了一种预防和/或治疗增生性玻璃体视网膜病变的药物,主要成分为PKA抑制剂H-89。并提供了一种辅助视网膜脱离手术的药物,主要成分为PKA抑制剂H-89。本发明首次发现了PKA抑制剂H-89在体外以及体内的PVR模型中对PVR的抑制作用,H-89能够保护由于PVR发病过程中如EMT等引起的EMT相关的基因表达水平改变以及紧密连接的破坏等,并同时说明了在PVR的发病过程中,TGFβ和PKA信号通路的关系,TGFβ能够激活PKA信号通路,而PKA抑制剂H-89对PVR的抑制作用可能会通过抑制EMT来实现的。这些结果首次表明在PVR发病过程中,PKA信号通路的作用,以及PKA抑制剂H-89可以作为PVR治疗的药物。与现有技术相比,本发明具有以下优点:1、目前PVR的治疗仍以玻璃体切除手术为主,但是手术费用昂贵,且需要反复手术;而PKA抑制剂H-89为小分子化合物价格便宜,容易获得;2、PVR的药物治疗目前主要有糖皮质激素及非甾体类消炎药和抑制细胞增生的药物等,但是目前前者的应用证据还不是很充分,而后者能够广谱抑制细胞增殖,会带来严重的潜在的风险。而H-89能够在体内体外均有效抑制PVR,同时通过玻璃体腔注射进行眼局部用药,可以避免全身用药带来的潜在风险。附图说明图1A:H-89在mRNA水平减轻TGFβ1和TGFβ2引起的基因改变。图1B和1C:H-89在蛋白水平减轻TGFβ1引起的基因改变。图1D:H-89保护TGFβ1引起的EMT相关蛋白的定位改变以及表达量改变。图2A和2C:H-89在划痕实验中抑制TGFβ1引起的细胞增殖和迁移。图2B和2D:在Transwell迁移实验中,H-89抑制TGFβ1引起的细胞迁移。图3A和3B:H-89治疗能够挽回PVR体内造模引起的SD大鼠视网膜电图的b波波幅的下降。图4:眼球冰冻切片免疫荧光图显示H-89能够保护PVR造模引起的前膜形成,并降低EMT标记物a-SMA的表达量。图5:眼球冰冻切片免疫荧光图显示H-89能够保护PVR造模引起的前膜形成,并降低EMT标记物FN1的表达量。图6A和6C:TGFβ1能够激活PKA通路,TGFβ1对PKA活性的增加是剂量依赖的。图6B和6D:TGFβ1能够激活PKA通路,TGFβ1对PKA活性的增加是时间依赖的。具体实施方式下面结合附图和具体实施例对本发明进行详细说明。以下实施例中,ARPE19细胞购自ATCC,培养基为DMEM:F12培养基含10%血清和1%P/S。培养环境是37℃、5%CO2和95%空气。TGFβ1、TGFβ2购买自R&D公司。H-89购自Selleck公司,使用浓度为5-50uM。反转录试剂盒是PrimeScriptTMRTMasterMix(购自Takara公司),PCR试剂盒是SuperRealPreMixPlus(SYBRGreen)(购自天根公司)。所用引物由苏州金维智公司合成。Transwell小室,8uM孔径(购自康宁公司)。PKA活性测定试剂盒购自Promega公司。实施例1PKA抑制剂H-89在体外细胞模型中抑制EMTARPE19细胞EMT诱导:ARPE19细胞汇合度约为40-50%时,进行血清剥夺饥饿过夜处理,然后用10ng/ml的TGFβ1或者TGFβ2处理相应的时间,有或者无H-89干预。EMT诱导之后,细胞形态由典型的上皮样转变为成纤维形态,同时失去紧密连接,且细胞增殖也加快。实施例2EMT诱导及H-89处理后q-PCR检测mRNA变化水平:将正常对照、TGFβ诱导细胞以及H-89处理的TGFβ诱导细胞用1mlTrizol收集在1.5ml管中,进行抽提总RNA。经过逆转录和实时定量PCR分析,采用半定量的方法计算。主要步骤如下:1.向Trizol收集的样品中,加入五分之一200ul体积的氯仿,剧烈混匀后,以12000rpm的转速4℃离心10分钟。2.离心后,将上清转移到新的离心管中,注意不要取到中间的蛋白层,加入等体积的异丙醇。3.12000rpm的转速4℃离心10分钟,弃去上清,将沉淀用75%的乙醇洗1-2次。4.将沉淀室温干燥后,用适量的20ulDEPC水溶解。5.Nanodrop定量,并计算反转录所需的体积。6.RNA反转录:(1)20ul的体系,1000ng的RNA,取4ul的Takara的逆转录试剂supermix,再加ddH2O补到20ul.(2)反转录程序:37℃15分钟,85℃5秒,然后可于-20℃冰箱保存备用。7.定量PCR(1)将RNA反转录后得到的cDNA10倍稀释作为为模板,设计引物如表1。表1q-PCR中所用到的引物序列表Gapdh-ForwardAGGTCGGTGTGAACGGATTTGGapdh-ReverseTGTAGACCATGTAGTTGAGGTCAZO-1-ForwardATTGTCGTCGCATGTAGATCCZO-1-RevrseGGGTTCATAGGTCAGATTAGGCa-SMA-ForwardAATGCAGAAGGAGATCACGGa-SMA-ReverseTCCTGTTTGCTGATCCACATCN-Cad-ForwardCCCAAGACAAAGAGACCCAGN-Cad-ReverseGCCACTGTGCTTACTGAATTGFN1-ForwardGAGCTGCACATGTCTTGGGAACFN1-ReverseGGAGCAAATGGCACCGAGATAVimentin-ForwardCGTGAATACCAAGACCTGCTCVimentin-ReverseGGAAAAGTTTGGAAGAGGCAG(2)利用天根公司的SYBRGreen实时荧光定量PCR检测试剂盒,q-PCR的体系为20ul,2ul的cDNA模板,1ul的引物,10ul的2XPCRMix,7ul的ddH2O,检测目的基因的表达量。PCR扩增条件如下:94℃变性10分钟,进入循环(95℃5sec,60℃60sec),一共40个循环,并收集溶解曲线。(3)数据分析,采用2-△△Ct法进行处理,以Gapdh做为内参。实验结果如图1A所示,通过图可以看出,经TGFβ1和TGFβ2处理后,紧密连接蛋白ZO-1表达下降,而EMT相关基因a-SMA,N-cad,Vimentin以及PKA的激活亚基PRKACa的mRNA水平的表达量明显上升,而H-89处理能够抑制TGFβ引起的这些基因mRNA表达的改变。实施例3EMT诱导及H-89处理后WesternBlot检测蛋白变化水平1、蛋白的提取:将细胞接种在6cm的细胞培养皿中,经相应的处理后,加150μl含有ProteaseInhibitorCocktail的RIPA裂解液,用细胞刮收集细胞到新的EP管中,放冰上孵育30分钟,10000rpm,4℃离心15分钟,轻轻吸出上清至干净的离心管中,-80℃保存备用。2、蛋白浓度的测定:蛋白定量采用BCA定量法,具体方法如下:配制标准蛋白溶液2μg/μl,-20℃保存备用;根据标准品和样品的数目配制工作液,试剂A和试剂B按50:1的体积比充分混匀,现配现用;工作液总体积=(标准品个数+待测样品个数)×(2个复孔数)×(200μl工作液)。将标准品按0μl、1μl、2μl、4μl、8μl、16μl的体积加到酶标孔中,每孔加入200μl的BCA工作液,制作标准曲线;待测样品每孔加入2μl,再加入200μl的BCA工作液,37℃孵育30分钟;用多功能酶标仪测定560nm处的吸光度值。3、蛋白样品的准备:根据准备上样的蛋白量和蛋白浓度,加入5×loadingbuffer,混合后于100℃加热10分钟,使其充分的变性,4℃,12000rpm,离心2分钟,除去沉淀,-80℃贮存备用。4、SDS-PAGE电泳:分离胶的制备:10%的分离胶(10ml)配制方法如下:30%聚丙烯酰胺3.3ml,ddH2O2.7ml,1MTris(PH8.8)3.8ml,10%SDS0.1ml,10%过硫酸铵0.1ml,TEMED0.004ml;灌胶前加APS和TEMED,加完后充分混匀,迅速灌胶。用移液枪将配制好的分离胶溶液缓慢加入到装配好的玻璃板中,分离胶溶液高度约为6cm,给浓缩胶留出1.5cm高的位置,加好后在凝胶顶部缓缓加入无水乙醇促进胶凝,使凝胶表面呈一条直线;放置1小时左右直到凝胶完全凝固,当无水乙醇和凝胶之间有一条折线时说明凝胶已经凝固,倒掉胶上的无水乙醇,用滤纸吸干。制备5%的浓缩胶(4ml)方法如下:30%聚丙烯酰胺0.67ml,ddH2O2.7ml,1MTris(PH6.8)0.5ml,10%SDS0.04ml,10%过硫酸铵0.04ml,TEMED0.004ml;灌胶前加APS和TEMED,加完后充分混匀,迅速灌胶。用移液枪将配制好的浓缩胶溶液缓慢加入分离胶的上层,直至玻璃板的边缘,然后小心插入梳子,注意不要产生气泡,放置约1小时左右凝胶,凝胶之后拔出梳子,准备电泳。将准备好的蛋白样品和蛋白标记分子加入到加样孔中,防止气泡产生,使用Bio-Rad电泳仪,槽内加满电泳液以后即可开始电泳,电泳条件为:80V电压,30分钟,换120V电压,1小时30分钟左右。电泳至溴酚蓝刚好跑出分离胶底部停止。5、转膜:SDS-PAGE凝胶电泳结束以后,将玻璃板撬开后小心分离出凝胶,切去浓缩胶的部分,保留分离胶,浸泡于去离子水中;剪取与凝胶大小相似的PVDF膜放入无水甲醇中浸泡2分钟;将切好的凝胶、滤纸以及事先用无水甲醇浸泡过的PVDF膜放入转膜平衡液中平衡10分钟;采用Bio-Rad的转膜系统,以夹三明治的方式,从黑面到白面的顺序依次为:黑面(负极)-海绵垫-滤纸-凝胶-PVDF膜-滤纸-海绵-白面(正极),滤纸、凝胶和PVDF膜要对齐,彻底清除内部气泡,然后放入装满转膜液的转膜仪中,转膜条件为300毫安,2小时;转膜槽置于冰浴中。转膜结束后可以参考蛋白Marker转上PVDF膜作为转膜成功的标志,也可将膜用1×丽春红染液染色,然后用水冲洗掉没染上的染液就可看到膜上的蛋白。6、免疫杂交反应:用1×PBST洗掉丽春红,配置5%的BSA闭液,室温封闭1小时。加入用PBST稀释的一抗,4度过夜;1×PBST洗膜3次,每次10。加入PBST稀释的HRP标记的二抗,室温1小时。1×PBST洗膜3次,每次10。ECL化学发光采集结果,以Gapdh作为对照内参。7、数据统计分析:用ImageJ软件western条带的灰度分析,然后与对应的Gapdh进行相比,然后再利用GraphpadPrism软件进行统计分析及作图。实验结果如图1B及图1C所示,1B为条带图,1C为对条带进行灰度分析后的统计结果,由图可知经TGFβ1处理后,紧密连接蛋白ZO-1表达下降,而EMT相关基因a-SMA,N-cad,Vimentin,Fibronectin及PRKACa的表达量明显上升,而H-89处理能够挽救TGFβ引起的这些基因蛋白水平表达的改变。实施例4EMT诱导及H-89处理后免疫荧光检测蛋白定位及表达情况1、细胞处理:将细胞接种于预置在培养皿中的玻片上,经相应的处理之后,取出玻片;2、固定:用4%多聚甲醛固定10分钟,PBS洗3次,每次5分钟;3、透膜:0.1%tritonX-100透膜10分钟,PBS洗3次,每次5分钟;4、封闭:5%马血清室温封闭1小时;5、一抗:加5%马血清室稀释的一抗,置于湿盒内防止干燥,4℃孵育过夜;6、二抗:PBS洗3次,每次5分钟;加5%马血清室稀释的荧光素酶标记的与一抗同种属来源的二抗,置于湿盒内,避光37℃孵育1,PBS洗3次,每次5分钟;7、染核:用0.5μg/mlDAPI染细胞核3分钟,PBS洗3次,每次5分钟;8、封片:用荧光封片剂封片。9、拍照:用激光共聚焦显微镜,在油镜,600倍放大进行拍照。实验结果如图1D中的免疫荧光图所示,经TGFβ1处理后,ARPE19细胞之间的紧密连接被破坏,如紧密连接蛋白ZO-1的染色所示;细胞骨架F-actin重构变得紊乱,而H-89处理后,细胞之间的紧密连接重新出现,细胞骨架的重构引起的F-actin的紊乱也有所减轻。与EMT有关的蛋白a-SMA、Fibronectin和Vimentin以及PKA的激活亚基PRKACa经TGFβ1处理后表达量均上升,而H-89处理之后,这些蛋白的表达上升都被抑制。实施例5EMT诱导及H-89处理后划痕实验检测细胞迁移能力1、细胞处理:将细胞接种在96孔板中,做相应的处理之后(如实施例1中所述);2、划痕:用10uL移液枪枪头在细胞上呈“一”字划痕,然后用PBS清洗3次洗掉浮起的细胞。加入对应处理的培养基继续进行培养。3、拍照:在显微镜下分别在划痕0小时,24小时和48小时的时间点进行拍照。4、数据分析:用ImageJ软件进行划痕宽度的测量,获得宽度数据,然后再利用GraphpadPrism软件进行统计分析及作图数据如图2A和图2C所示,2A为不同时间点划痕的图像,而2C为经ImageJ软件统计分析后的结果,由图我们可以看出经TGFβ1处理后,ARPE19细胞的增殖迁移能力明显增强,48小时后划痕已经完全看不见,而H-89处理之后,细胞的增殖迁移能力下降特别明显,说明H-89能够有效地抑制ARPE19细胞的增殖迁移。实施例6EMT诱导及H-89处理后Transwell实验检测细胞迁移能力1.接种:8.0uM的Transwell小室至于24孔板当中,将用实施例1中不同处理的细胞接种于Transwell上室,上室加100ul的1%血清的含有对应处理因子的培养基,下室加600ul的10%血清的培养基;2.细胞迁移:将细胞置于37度,5%二氧化碳的培养箱中培养24小时,让细胞迁移;3.细胞染色:用棉签轻轻拭去上室未迁移的细胞,然后用甲醇固定半个小时,小室适当风干,再用伊红染色半个小时;4.拍照计数:20倍显微镜下随即六个视野观察细胞,记数。数据如图2B及2D所示,2B为伊红染色后的迁移细胞(图中亮色的部分),2D为细胞计数后的统计结果,由图可知,经TGFβ1处理后,ARPE19细胞迁移过Transwell小室膜的细胞数量明显增加,而H-89处理能够降低约三分之一的迁移细胞数目,说明H-89能够有效地抑制ARPE19细胞的迁移。实施例7玻璃体腔注射PVR造模1、大鼠准备:6-8W的SD大鼠购自斯莱克公司,饲养在同济大学动物中心。160~180g重,随机分为三组,PBS对照组,模型组(ARPE19+PRP),治疗组(ARPE19+PRP+H-89)。2、细胞准备:取体外培养的ARPE19细胞,P10-P15之间,调节细胞浓度使得每只眼的细胞数量为2.4*106,分到两个EP管中分别为模型组合治疗组,置于冰上备用。3、血小板富集血浆(PRP)的制备:将大鼠固定于鼠笼内,鼠尾暴露于笼外。穿刺前用酒精棉球擦拭鼠尾,将5号头皮针和1ml注射器相连接,用肝素钠稀释液冲洗针头和注射器;右手持针,左手拇指在上、示指在下捏住鼠尾,将鼠尾略弯曲以使进针处血管和针头方向平行,针头平行于鼠尾刺破表皮后继续进针3-5mm,针头进入尾静脉见回血,左手捏住鼠尾,右手推拉1ml注射器活塞,制造负压进行取血;取血结束后,应用脱脂棉球按压针眼部位30s,确定止血后放开大鼠。将取得的血转移到含3.8%枸橼酸钠的采血管内,低温离心,1000g,1min,其上清液为PRP。4、ARPE19+PRP悬液制备:按照已经计算好的细胞量和注射量,分别用PRP重悬ARPE19细胞,模型组为ARPE19+PRP,治疗组为ARPE19+PRP+H-89;使得H-89的终浓度为5-50uM。5、玻璃体腔注射:注射前大鼠腹腔注射2%戊巴比妥钠(1mL/400g体重)进行麻醉,1×速眠新(0.1ml/200g)进行肌肉松弛,然后给予一滴0.5%托吡卡胺散瞳(WuxiShanheGroup,Jiangsu,China),一滴0.4%盐酸奥布卡因表面麻醉(EisaiCoLtd,Tokyo,Japan)。在体视显微镜下,先用1ml注射器自角膜缘后垂直进针扎一小孔,然后再用注射针由该孔向玻璃体腔内注入相应液体。每只眼的注射体积为8ul。实施例8SD大鼠视网膜电图ERG采集1.仪器:APS全自动视觉电生理检查仪(APS-2000)购于重庆康华科技有限公司。暗适应:做视觉电生理功能检查前一天,把SD大鼠转移到暗房,进行暗适应。第二天开始做。2.大鼠的准备:向大鼠腹腔注射2%戊巴比妥钠(1mL/500g体重)进行麻醉,1×速眠新(0.1ml/200g)进行肌肉松弛,然后给予一滴0.5%托吡卡胺散瞳(WuxiShanheGroup,Jiangsu,China),一滴0.4%盐酸奥布卡因表面麻醉(EisaiCoLtd,Tokyo,Japan),每只眼睛各涂一点导电膏。插电极:地线接大鼠尾巴上,负极接大鼠两耳朵之间,正极接两眼睛角膜上,注意不要触到眼睑和巩膜上。3.数据采集:打开软件“视觉电生理图”,点“FERG”,再点1,2通道,一个为左眼通道,另一个为右眼通道,点“设置”,刺激次数为2次,刺激频率为0.05Hz;依次点击刺激强度(1)―0.0006325(cd*s/m)、(5)―0.006325(cd*s/m)、(9)―0.06325(cd*s/m),每次强度至少间隔2min。点“示波”,待波的基线平稳时,点击“采集”,等听到“嘀”的一声后,采集完毕,点击“保存”。再点击“设置”,修改文档号和刺激强度,依次类推。等所有强度做完后,换下一只大鼠。所有大鼠做完后,打开“文件”,进行标定,双击曲线,曲线变为白色,点击“标定”。标定完a波后,按空格键,标定b波。所有标定完毕,点击“打印”,保存为.PDF格式。点击左下角按钮,退出软件,关闭电脑,关闭放大器。数据如图3所示,其中3A为ERG的b波波形图,3B为b波波幅的统计图,由图可知,经注射诱导后模型组与PBS对照组相比,b波波幅明显下降,而治疗组与模型组相比,经H-89处理后,b波波幅有所回升,说明H-89能够对PVR造成的ERGb波波幅的下降有保护作用。实施例9眼球冰冻切片的制备1.眼球准备:PVR造模后的SD大鼠在不同时间点收取眼球样本,SD大鼠脱臼处死后,仔细摘除眼球,注意保留视神经;2.固定:置于4%多聚甲醛固定过夜;3.解剖:在解剖显微镜下沿角巩膜缘上缘解剖眼球,小心去除角膜,虹膜和晶状体,形成完整的视杯,注意操作轻柔防治造成视网膜脱离;4.脱水:用30%的蔗糖过夜脱水;5.包埋:用组织包埋液OCT包埋4℃平衡过夜;6.液氮速冻:将眼球用液氮快速冷冻,冷冻之前使得眼球的位置尽量垂直居中。-80℃保存冰冻样品。7.切片:用冰切机按8μm的厚度进行连续切片,取过视神经乳头的切片。将切片放在-80℃保存,使用前吹干。实施例10视网膜冰冻切片免疫荧光1.切片准备:取实施例9中所得的眼球冰冻切片样品进行免疫荧光染色检测。2.烤片:50℃烤片半小时。3.固定:4%PFA固定10分钟,再用PBS清洗三次,每次5分钟。4.透膜:用0.25%Triton-X100透膜15min,PBS洗3次,每次5min。5.封闭:5%马血清室温封闭1小时;6.一抗:加5%马血清稀释的相应一抗,置于湿盒内防止干燥,4℃孵育过夜。7.二抗:PBS洗3次,每次5min;加5%马血清稀释的荧光素酶标记的与一抗同种属来源的二抗,置于湿盒内,避光37℃孵育1小时。8.DAPI染核:PBS洗3次,每次5min;用0.5μg/mlDAPI染细胞核1min,PBS洗3次,每次5min。9.封片:用荧光封片剂封片。10.拍照观察:在显微镜下拍照观察。如图4和图5所示,为冰冻眼球切片免疫荧光图片,图4和图5分别为EMT相关基因a-SMA和FN1的表达情况,由图我们可以看出在PBS对照组完全没有a-SMA以及FN1的表达,在模型组,不仅有前膜形成,而且a-SMA和FN1的表达明显升高,而在H-89治疗组,a-SMA和FN1的表达量明显下降,尤其是FN1,几乎没有表达了。这进一步说明H-89对ARPE19联合PRP注射引起的前膜形成以及EMT过程有抑制作用,从而证明了H-89对PVR的治疗作用。实施例11ARPE19细胞中PKA活性的测定1.细胞用TGFβ1进行不同浓度以及不同时间段的相应处理。2.收样:消化细胞,用预冷的PKAExtractionbuffer重悬细胞,并用超声打碎细胞。3.PKA活性检测:(1)溶液配制:按照商家提供的说明书用PKAdilutionbuffer稀释所需的c-AMP-dependentProteinKinaseCatalyticSubunit至2ug/ml。并按一下体系混合各溶液,均在冰上操作。实验组阳性对照阴性对照5XPKAReactionbuffer5ul5ul5ulA1Peptide5ul5ul5ul5XPKAActivatorsolution5ul5ul5ulPeptideProtectionsolution1ul1ul1ulSample1-10ul●5ulPKAcatalyticSubunit0ulddH2OTo25ulTo25ulTo25ul其中样品和CatalyticSubunit单独加,将上述其他溶液混好后之后,从冰上拿开,并30℃水域1分钟,然后分别添加样品和CatalyticSubunit,室温孵育30分钟。(2)热阻止:用沸水浴或者95℃10分钟热阻止后,样品可保存在4-20℃的黑暗处,直到跑胶前。(3)跑胶:用50mM的Tristan-HCL(PH8.0)配制0.8%的琼脂糖胶。上样前,向样品中加1ul的80%的甘油,确保样品仍在管中。上样后,100伏,15-20分钟或者直到肉眼可见条带分离清楚为止。4.PKA活性定量:(1)割胶:跑胶后立即割胶,使得胶块溶解后的体积大约为250ul左右,转移到1.5毫升EP管中,95℃溶胶,不足的用ddH2O补充至250ul.(2)96孔板转移:准备一个干净的96孔板,取125ul的已经溶解的热胶、75ul的胶溶解液以及50ul的冰醋酸至1个1.5毫升的EP管中快速震荡后取250ul转移到96孔板的一个孔当中去,以此加完所有样品。(3)酶标仪读数:570nm波长处读数,以阴性对照孔为空白对照。结果如图6所示,其中6A、6C为跑胶后的条带图,6B、6D为统计图,由图可以看出TGFβ1可以激活PKA通路,增加PKA活性,并且该过程还是剂量依赖和时间依赖的。这进一步揭示了在体外PVR模型EMT的过程中PKA通路被激活,从而为H-89能够抑制EMT,对PVR有治疗作用提供了依据。上述的对实施例的描述是为便于该
技术领域:
的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1