一种新型的酪氨酸酶抑制剂的制作方法
本申请涉及生物工程领域,具体涉及一种新型的酪氨酸酶抑制剂。
背景技术:
茶为世界三大饮料之一,是我国的国饮,又是21世纪天然的绿色饮料。我国是产茶大国,目前我国茶园面积稳定在110万hm2,年产量超过60万吨,居世界第一位。但随着茶叶消费日趋高档化,有10万吨左右的中低档茶滞销和积压,此外每年茶叶加工的副产品(片、末、梗等)至少达1.6万吨,其经济价值低,难处理,茶叶的利用率很低,成为茶厂生产中的负担。因此,开发茶叶的新用途,开展茶叶的综合利用,尤其是利用积压的库存茶、低档茶叶和下脚料来生产副加值高的精细化学品,是一项具有重要意义的研究课题。
科学研究和临床医学实验表明,茶叶有降血糖、降血脂、抗癌、抗衰老、抗辐射等诸多保健作用。茶多酚为茶叶中最主要的功能性成分,已有大量研究表明,茶多酚不仅是一种天然的无毒的抗氧化剂,而且也是一种理想的天然药物,具有清除自由基和抗氧化等生物活性,在抑菌、抗病毒、防癌抗癌、抑制肿瘤、防治心血管疾病等方面具有良好功效。因此,茶多酚成为目前天然产物研究的热点,由于具有多种生理活性和功能,在医疗保健、食品行业、日用品等领域都得到了广泛的应用。因此,优化提取工艺,以中低档茶叶和下角料作为生产茶多酚的原料,分离提纯茶多酚则可以使茶叶资源得到充分利用,变废为宝,具有十分重要的经济和社会效益。
酪氨酸酶(EC 1.14.18.1,Tyrosinase)是一种结构复杂的多亚基的含铜氧化还原酶,是生物体内黑色素合成的关键酶,也是黑色素合成的限速酶。并且,酪氨酸酶在生物体中具有重要的生理功能,除了形成动物皮肤中的保护性黑色素外,它还与昆虫的伤口愈合与发育,果蔬的褐变有密切关系。因此多年来,酪氨酸酶一直受到国内外的关注,其研究涉及生物、医学、农学、化学、药学等多个学科和领域。近年来对酪氨酸酶尤其是酪氨酸酶抑制剂的关注度总体上呈上升趋势。目前已有一些抑制剂得到临床应用,作为化妆品添加剂,保护皮肤、去除黑斑;作为杀虫剂,防治田间害虫;作为保鲜剂,防止食品、果蔬的褐化过程。从天然植物组织中分离提取酪氨酸酶抑制剂是筛选寻找具有特异的、高效的酪氨酸酶抑制剂的一个主要渠道。
通过文献检索发现,有研究者做过从紫娟茶中提取蘑菇酪氨酸酶抑制物,并研究了抑酶效应,而对抑酶类型和机理未做研究。也有研究者做过从4种茶叶崂山绿茶、福建花茶、福建铁观音和云南普洱中提取土豆酪氨酸酶的抑制物,研究抑制效应,但对抑制类型和抑制机理未做研究。同时,已报道的研究并没有对茶叶中的缩合单宁进行分离纯化,只是用粗提物进行酪氨酸酶的抑制作用研究,而且没有发现对黄金桂茶叶缩合单宁的相关报道。
技术实现要素:
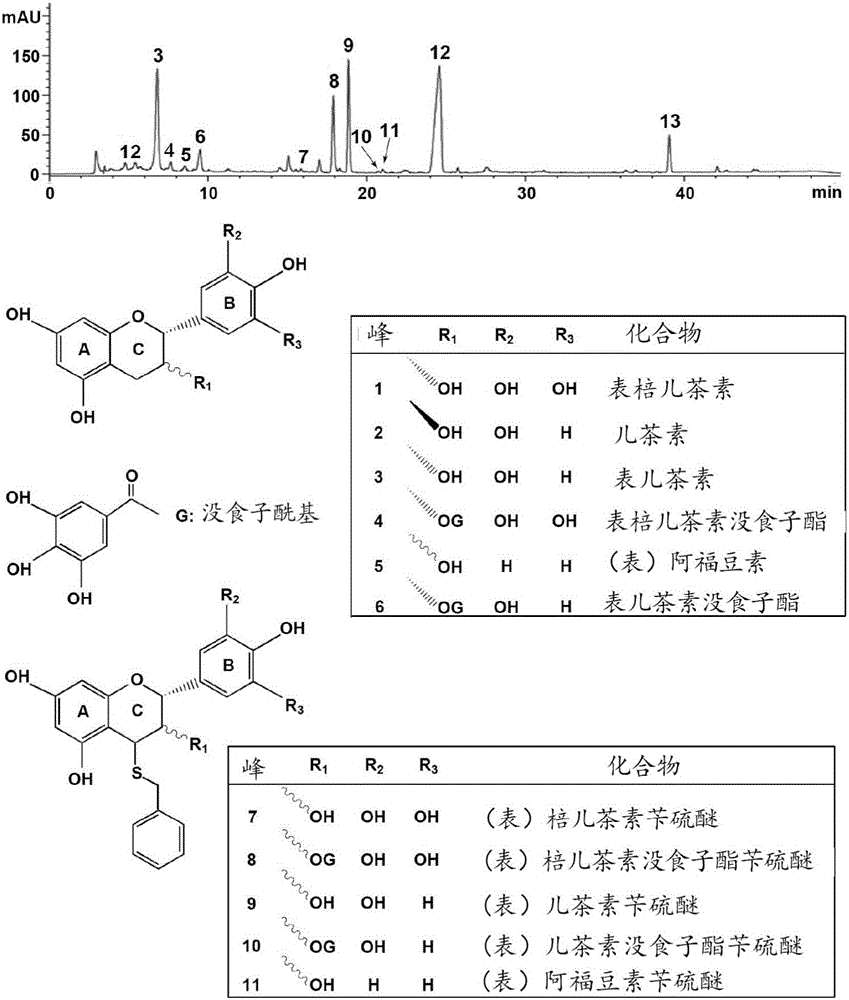
本申请提供了一种酪氨酸酶抑制剂,其中该酪氨酸酶抑制剂是以黄金桂茶叶为原料制备得到的。在一些实施方案中,该酪氨酸酶抑制剂可以由原花青素、原天竺葵定和原翠雀定形成的同聚物和异聚物组成,其中原花青素为主要成分。在一些实施方案中,该酪氨酸酶抑制剂通过MALDI-TOF-MS显示一系列在m/z 999,1287,1575,1863,等的质谱峰(图1),HPLC-ESI-MS显示11个对应峰(图2)。在一些实施方案中,该酪氨酸酶抑制剂对酪氨酸酶的半抑制率为54.8±1.27μg/mL,对酪氨酸酶的抑制类型为可逆抑制,抑制机理表现为混合型。
本申请以设计分离、筛选新的酪氨酸酶抑制剂为出发点,对黄金桂茶叶缩合单宁提取物的结构进行了鉴定,发现其具有明显的抑制酪氨酸酶活性的特性,安全有效,对环境友好。
本申请以天然的黄金桂茶叶为组织材料,分离出酪氨酸酶的抑制剂,鉴定了其结构特征,确证了其抑酶特性。
本申请采用黄金桂茶叶作为提取酪氨酸酶抑制剂的原料,采用茶多酚浸提工艺进行处理,通过MALDI-TOF-MS和HPLC-ESI-MS分析验证提取产物,确定产物缩合单宁是复杂的混合物,由原花青素、原天竺葵定和原翠雀定形成的同聚物和异聚物组成,其中原花青素为主要成分。该研究提取物对酪氨酸酶的半抑制率为54.8±1.27μg/mL,抑制效果明显,对酪氨酸酶的抑制类型为可逆抑制,抑制机理表现为混合型。
与现有技术相比,本申请具有如下优点:
①选定以普通绿茶为原料,来源广泛,取材方便。
②通过酪氨酸酶的反应动力学研究发现,此酪氨酸酶抑制剂对酪氨酸酶活力的抑制效果明显,且安全无毒。
③在多个领域如医疗美容、果蔬保鲜、病虫害防治等领域,具有很好的应用前景。
④采用的丙酮、甲醇、正己烷、二氯甲烷和葡聚糖凝胶等试剂价格低廉,操作简便,适合企业或个人的大中小规模生产加工。
本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得明显,或者通过实施本发明而了解。本发明的目的和其他优点可通过在说明书、权利要求书以及附图中所特别指出的结构来实现和获得。
附图说明
附图用来提供对本发明技术方案的进一步理解,并且构成说明书的一部分,与本申请的实施例一起用于解释本发明的技术方案,并不构成对本发明技术方案的限制。
图1:MALDI-TOF-MS鉴定实施例1获得的黄金桂茶叶缩合单宁提取物。
图2:反相HPLC鉴定实施例1获得的黄金桂茶叶缩合单宁提取物。各峰表示:1,表棓儿茶素;2,儿茶素;3,表儿茶素;4,表棓儿茶素没食子酯;5,(表)阿福豆素;6,表儿茶素没食子酯;7,(表)棓儿茶素苄硫醚;8,(表)棓儿茶素没食子酯苄硫醚;9,(表)儿茶素苄硫醚;10,(表)儿茶素没食子酯苄硫醚;11,(表)阿福豆素苄硫醚;12,过量的苄硫醇;13,硫解副产物。
图3:实施例1获得的黄金桂缩合单宁提取物对酪氨酸酶活力的影响。纵坐标表示相对酶活(即加入不同浓度的抑制剂后的酪氨酸酶的活力相对于没有加入抑制剂时酪氨酸酶活力的百分比),横坐标表示抑制剂(黄金桂缩合单宁提取物)的浓度,其中I为抑制剂的缩写。
图4:实施例1获得的黄金桂缩合单宁提取物对酪氨酸酶的抑制机理的判断。曲线0~3所代表的黄金桂缩合单宁提取物的浓度分别为:0、6.66、33.3、66.6μg/mL,其中E为酶的缩写。
图5:实施例1获得的黄金桂缩合单宁提取物对酪氨酸酶的抑制类型的判断。曲线0~3所代表的黄金桂缩合单宁提取物的浓度分别为:0、6.66、33.3、66.6μg/mL,其中I为抑制剂的缩写,S为底物的缩写。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,下文中将结合附图对本发明的实施例进行详细说明。需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互任意组合。
实施例中采用的蘑菇酪氨酸酶、L-DOPA、葡聚糖凝胶(Sephadex LH-20)购买自Sigma-Aldrich公司;丙酮、甲醇、正己烷、二氯甲烷均为国产分析纯。
实施例1.黄金桂茶叶缩合单宁提取物的获得
取黄金桂的冷冻干燥叶粉(新鲜叶子采于福建安溪,冷冻干燥采用真空冷冻干燥机(christ,ALPHA1-2LD Plus)进行)10g,用200mL的70%丙酮室温下浸取24h,3500g离心15min,收集上清。上述步骤重复三次。合并丙酮提取物,用旋转蒸发仪(BUCHI,R-205V)在38℃减压蒸馏除去丙酮。将剩余的水相先后用正己烷和二氯甲烷分相,从而去除了色素、脂类和非极性物质。得到的水溶液冻干后用50%甲醇溶解,通过Sephadex LH-20柱(30×2.5cm),先后用50%甲醇和70%丙酮洗脱。减压蒸馏去除丙酮,剩余的水溶液经过冷冻干燥即获得黄金桂茶叶缩合单宁提取物。
实施例2.实施例1获得的黄金桂茶叶缩合单宁提取物的结构特征的鉴定
通过MALDI-TOF-MS(方法参考文献Wei SD,Lin YM,Liao MM,Zhou HC,Li YY.Characterization and antioxidative properties of condensed tannins from the mangrove plant Aegiceras corniculatum.J Appl Polym Sci 2012,124:2463–2472.),实施例1获得的黄金桂茶叶缩合单宁提取物显示一系列在m/z999,1287,1575,1863,等的质谱峰(图1),HPLC-ESI-MS(方法参考文献Wei SD,Lin YM,Liao MM,Zhou HC,Li YY.Characterization and antioxidative properties of condensed tannins from the mangrove plant Aegiceras corniculatum.J Appl Polym Sci 2012,124:2463–2472.)显示11个对应峰(图2)。最终确定实施例1获得的产物缩合单宁提取物是复杂的混合物,由原花青素、原天竺葵定和原翠雀定形成的同聚物和异聚物组成,其中原花青素为主要成分。原花青素是酪氨酸酶催化底物的类似物,能竞争地结合酪氨酸酶,抑制酪氨酸酶的活性。
实施例3.实施例1获得的黄金桂茶叶缩合单宁提取物对酪氨酸酶的抑制酪氨酸酶活性
测活体系如下:0.3mL 1mg/mL的L-多巴(L-DOPA),0.75mL 0.2mM,PH=6.8的磷酸缓冲液,1.8mL的蒸馏水,0.1mL不同浓度(分别是0、5、15、25、35、50、65μg/mL)的实施例1获得的缩合单宁提取物,0.05mL酪氨酸酶水溶液(sigma,蘑菇酪氨酸酶)。恒温条件为30℃,测定波长为475nm。
如图3所示,实施例1获得的黄金桂缩合单宁提取物对酪氨酸酶的半抑制率为54.8±1.27μg/mL。
以L-DOPA的浓度为定量,加入的酪氨酸酶的量为变量,测定不同浓度的实施例1获得的缩合单宁提取物(分别是0、6.67、33.33、66.67 μg/mL)下酪氨酸酶催化L-DOPA的活力随酶量的关系。以酶活对酶量作图得到一组通过原点的直线,如图4所示,随着效应物浓度的增大,直线的斜率降低,说明实施例1获得的缩合单宁提取物对酶的抑制属于可逆抑制。对于实施例1获得的缩合单宁提取物的抑制类型的判断及测定相关抑制常数,采用Lineweaver-Burk双倒数作图法。
如图5所示,固定反应体系的酶量,改变底物L-DOPA和缩合单宁提取物的浓度,可以得到一组相交于第二象限的直线。说明随着实施例1获得的缩合单宁提取物浓度的增大,不但导致酶促反应的最大反应速度(Vmax)变小,还导致米氏常数(Km)变大,其抑制机理表现为混合型。并得出实施例1获得的缩合单宁提取物对游离酶(E)的抑制常数(KI)和效应物对酶和底物络合物(ES)的抑制常数(KIS)。实施例1获得的黄金桂缩合单宁提取物的抑制常数(KI)为69.76μg/mL,抑制常数(KIS)为20.27μg/mL。
虽然本发明所揭露的实施方式如上,但所述的内容仅为便于理解本发明而采用的实施方式,并非用以限定本发明。任何本发明所属领域内的技术人员,在不脱离本发明所揭露的精神和范围的前提下,可以在实施的形式及细节上进行任何的修改与变化,但本发明的专利保护范围,仍须以所附的权利要求书所界定的范围为准。
- 还没有人留言评论。精彩留言会获得点赞!