一种两亲性聚氨酯自组装纳米颗粒及其制备和应用的制作方法
本发明属于两亲性自组装纳米材料及其制备和应用领域,特别涉及一种两亲性聚氨酯自组装纳米颗粒及其制备和应用。
背景技术:
聚氨酯(PU)主要通过二异氰酸酯和二元醇或多元醇为基本原料加聚获得,由Bayer公司在1947年首次合成,到目前为止已经有60多年的发展历史。两亲性聚氨酯是亲水链段和疏水链段构成的嵌段共聚物或接枝共聚物。在水溶液中自组装形成颗粒,可用来做包封药物的载体,是目前药物控释体系研究的主要热点。
两亲性自组装纳米颗粒所形成的胶束能够用作药物载体的优点主要有以下几点:第一,制备条件相对简单,相比于表面活性剂胶束,两亲性高分子的胶束更稳定。第二,胶束的核有很高的药物负载能力,可以包埋的药物很多,固体或液体,疏水性等药物或亲水性药物,也可以是单方药物或复方药物。第三,他可以直接形成亲水表面,有效的防止蛋白质的吸附和网状系统的捕捉。第四,由于胶束的粒径小而且分布范围非常窄,可以通过分子设计来调节粒径的大小和对药物的释放速率。胶束的尺寸大小和脂蛋白、病毒以及人体内的组织单元大小相近,因此很容易穿过生理屏障,可以相对容易的实现靶向定位。而其胶束在人体内的分布主要和粒径尺寸大小以及它的表面形态有关系,和胶束核内包裹药物本身的性质关系不大。第五,胶束的表面可以进行修饰,如带上具有专一识别功能的基团或物质,就可以实现主动的靶向定位给药。靶向药物释放系统既可以通过药物对目标组织的亲和性进行设计,也可以利用病患组织性能的病理信号来达到导向定位的目的。由于很多药物都有令人担心的副作用,如抗癌药物,它可以在杀死癌细胞的同时,也杀死很多的正常细胞。和其他药物进入人体后会分散到各个组织和器官相比,纳米载药系统进入人体后则可以在病变组织有选择性的聚集起来,达到良好的治疗效果。所以,两亲性高分子纳米胶束在药物的控制释放、药物的靶向释放等方面具有很好的性能,具有很好的发展前景。
技术实现要素:
本发明所要解决的技术问题是提供一种两亲性聚氨酯自组装纳米颗粒及其制备和应用,本发明制备的两亲性聚氨酯可在水溶液中自组装形成纳米颗粒,该纳米颗粒同时具有可降解、包载药物的特性,这一特性拓宽了在组织工程支架、药物缓释等领域的应用前景。
本发明的一种两亲性聚氨酯自组装纳米颗粒,将两亲性聚氨酯在水溶液中自组装形成纳米
颗粒;
其中两亲性聚氨酯的结构式为:
其中n值为10~33。
本发明的一种两亲性聚氨酯自组装纳米颗粒的制备方法,包括:
(1)将聚乙二醇PEG溶于溶剂中置于带有转子的圆底烧瓶中,抽真空维持3-5min之后通入高纯氮气,重复抽真空通氮气三次,达到氮气保护使反应体系内保持无水无氧状态,加入六亚甲基二异氢氰酸酯HDI和二月桂酸二丁基锡,80℃条件下搅拌反应3h,然后降至室温,再加入N-BOC-丝氨醇的溶液,80℃条件下反应18h,提纯,干燥,得到中间产物PB(含BOC基团的聚合物);其中PEG、HDI与N-BOC-丝氨醇的投料摩尔比为1:1.2:1~1:2:1。;
(2)将上述中间产物PB溶于溶剂中,然后室温脱保护气体0.5-1h,旋转蒸发去除溶剂,中和,透析后冻干,得到含氨基聚氨酯PN,然后加入水中,搅拌,即得两亲性聚氨酯自组装纳米颗粒。
步骤(1)整个制备过程是在氮气保护和搅拌条件下进行。
所述步骤(1)中聚乙二醇的平均分子量为600~20000;聚乙二醇为干燥后的聚乙二醇。
步骤(1)中的溶剂均为二甲基亚砜DMSO。
步骤(1)中提纯,干燥为用无水乙醚沉淀提纯1-3次后放于真空干燥箱中干燥24-48h。
所述步骤(2)中溶剂为50:50的氯仿、三氟乙酸混合溶剂(体积比为50/50);中间产物PB溶于溶剂后的浓度为5%(w/v,g/ml)。
步骤(2)中中和为:采用PH=8.3的2%(w/v,g/ml)碳酸氢钠中和残留三氟乙酸。
本发明的一种两亲性聚氨酯自组装纳米颗粒的应用,两亲性聚氨酯自组装纳米颗粒作为靶向药物载体的应用,其中具体包括:
将叶酸FA溶于溶剂中,加入碳化二亚胺/羟基琥珀酰亚胺EDC/NHS活化20-30min,然后逐滴加入含氨基聚氨酯PN溶液,室温避光磁力搅拌过夜,透析,冷冻干燥,得到PN-FA;
将药物配成溶液,然后滴加入PN-FA溶液中,搅拌1-2h,透析,冻干,然后溶于去离子水中搅拌,得到作为靶向药物载体的纳米颗粒胶束。溶剂及溶液溶剂均为二甲基亚砜DMSO;EDC与NHS的投料摩尔比为3:1;FA在PN-FA中的摩尔含量为8%。
药物为阿霉素;阿霉素配成溶液具体为:阿霉素溶于DMSO中,加入三乙胺消耗掉盐酸阿霉素中的酸,配成溶液。
所述透析为放入截留分子量为1000的透析袋中透析12h。
未特别说明的透析袋所用截留分子量为3500。
本发明中亲水链段选用拥有良好水溶性的PEG,容易通过代谢排出体外,且其在体内几乎没有毒副作用。而HDI为小分子,对身体也没有毒副作用,可作为聚合物的疏水基团。通过具有疏水性的BN-BOC-丝氨醇、HDI和具有亲水性的聚乙二醇(PEG)聚合形成的聚氨酯能够呈现两亲性,也同时具备生物降解性,为生物医学提供新的生物降解高分子材料,在药物控制释放领域具有非常好的应用前景。
有益效果
(1)本发明制备的两亲性聚氨酯可在水溶液中自组装形成纳米颗粒,该纳米颗粒同时具有可降解、包载药物的特性,这一特性拓宽了在组织工程支架、药物缓释等领域的应用前景;
(2)本发明所用原料PEG拥有良好的水溶性,容易通过代谢排出体外,且其在体内几乎没有毒副作用,因此可选择其作为聚合物中的亲水链段;而HDI为小分子,对身体也没有毒副作用,亦可作为聚合物的疏水基团,通过具有疏水性的BN-BOC-丝氨醇、HDI和具有亲水性的聚乙二醇(PEG)聚合形成的聚氨酯能够呈现两亲性,良好的生物相容性,也同时具备生物降解性,为生物医学提供新的生物降解高分子材料,并且能够包载药物以达到缓释的效果,在药物控制释放领域具有非常好的应用前景;
(3)本发明所制备的两亲性聚氨酯的结构通过傅里叶变换红外光谱(FT-IR)、核磁共振谱(1HNMR)分析得到验证,进一步通过凝胶渗透色谱(GPC)可验证所制备的产品分子量符合预期要求,并且由所制备的两亲性聚氨酯可通过自组装形成胶束,胶束尺寸在20~200nm,具有纳米材料的相关性质。
(4)本发明原料来源丰富和制备工艺简单;所制备的两亲性聚氨酯具有良好的生物相容性、优异的生物可降解性、较高的载药能力的特点,用作药物载体时可达到高效、低毒和缓释的效果。在药物载体方面具有很可观的应用前景。
附图说明
图1是两亲性聚氨酯的合成路线及靶向接枝原理图;
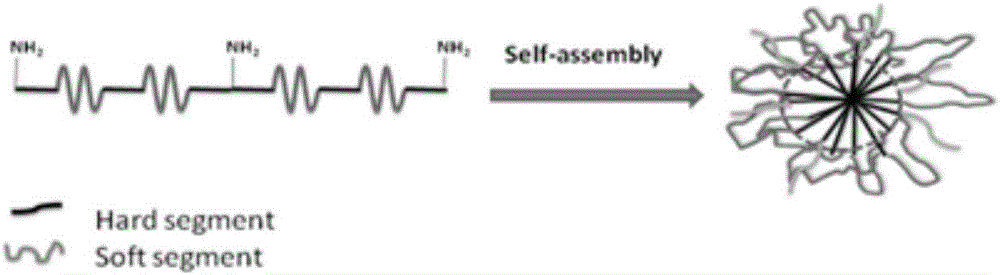
图2是两亲性聚氨酯自组装形成纳米颗粒原理图;
图3是两亲性聚氨酯自组装形成纳米颗粒电镜图(PEG为600);
图4是两亲性聚氨酯自组装纳米颗粒包载阿霉素和缓释阿霉素原理图;
图5是两亲性聚氨酯自组装纳米颗粒作为靶向药物载体对癌细胞的抑制效果(PEG为1500)其中,PN-DOX表示两亲性聚氨酯包载阿霉素,PN-FA-DOX表示靶向接枝两亲性聚氨酯包载阿霉。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
一种自组装两亲性聚氨酯纳米颗粒作为靶向药物载体的制备方法。所述原料为分子量为600的PEG,HDI,N-BOC-丝氨醇。
具体步骤是:
a.精确称量1.2g分子量为600的干燥PEG溶于无水DMSO中,氮气保护使反应体系内保持无水无氧状态;加入0.642mL HDI和2滴二月桂酸二丁基锡,80℃条件下搅拌反应3小时,然后再降至室温。加入0.382g N-BOC-丝氨醇的DMSO溶液。80℃条件下反应18h。将反应产物用无水乙醚沉淀提纯2次后放于真空干燥箱中干燥48h,得到中间产物PB。
b.将1g PB溶于10mL氯仿和10mL三氟乙酸混合溶剂,浓度为5%(w/v),室温脱保护1小时后,旋蒸除去溶剂,再用碳酸氢钠(2%,PH=8.3)中和残留三氟乙酸,放入截留分子量为35000的透析袋中透析3天,冻干即得到含氨基聚氨酯PN。
c.称取0.22mg叶酸溶解于DMSO中,室温避光磁力搅拌至溶解后加入0.191mg EDC和0.382mg NHS活化30min,逐滴加入溶解好的10mg/mL的PN/DMSO溶液,室温避光磁力搅拌过夜,放入截留分子量为35000的透析袋中透析3天,冻干即得产物PN-FA。
d.称取27mg的阿霉素,溶于2.25m L的DMSO中,再加入9μL的三乙胺,配成溶液A,取27mg PN-FA溶于2.25m L DMSO溶液中,配成溶液B。把A溶液缓慢滴加到B溶液中,搅拌2h,放入截留分子量为1000的透析袋中透析12h,冻干即得目标产物。
e.将1mg目标产物溶于1mL去离子水中搅拌,即形成了目标纳米颗粒胶束。
实施例2
一种自组装两亲性聚氨酯纳米颗粒作为靶向药物载体的制备方法。所述原料为分子量为1000的PEG,HDI,N-BOC-丝氨醇。具体步骤是:
a.精确称量2g分子量为1000的干燥PEG溶于无水DMSO中,氮气保护使反应体系内保持无水无氧状态;加入0.642mL HDI和2滴二月桂酸二丁基锡,80℃条件下搅拌反应3小时,然后再降至室温。加入0.382g N-BOC-丝氨醇的DMSO溶液。80℃条件下反应18h。将反应产物用无水乙醚沉淀提纯2次后放于真空干燥箱中干燥48h,得到中间产物PB。
b.将1g PB溶于10mL氯仿和10mL三氟乙酸混合溶剂,浓度为5%(w/v),室温脱保护1小时后,旋蒸去除溶剂,再用2%碳酸氢钠(PH=8.3)中和残留三氟乙酸,放入截留分子量为35000的透析袋中透析3天,冻干即得到含氨基聚氨酯PN。
c.称取0.22mg叶酸溶解于DMSO中,室温避光磁力搅拌至溶解后加入0.191mg EDC和0.382mg NHS活化30min,逐滴加入溶解好的10mg/mL的PN/DMSO溶液,室温避光磁力搅拌过夜,放入截留分子量为35000的透析袋中透析3天,冻干即得产物PN-FA。
d.称取27mg的阿霉素,溶于2.25m L的DMSO中,再加入9μL的三乙胺,配成溶液A,取27mg PN-FA溶于2.25m L DMSO溶液中,配成溶液B。把A溶液缓慢滴加到B溶液中,搅拌2h,放入截留分子量为1000的透析袋中透析12h,冻干即得目标产物。
e.将1mg目标产物溶于1mL去离子水中搅拌,即形成了目标纳米颗粒胶束。
实施例3
一种自组装两亲性聚氨酯纳米颗粒作为靶向药物载体的制备方法。所述原料为分子量为1500的PEG,HDI,N-BOC-丝氨醇。具体步骤是:
a.精确称量3g分子量为1500的干燥PEG溶于无水DMSO中,氮气保护使反应体系内保持无水无氧状态;加入0.642mL HDI和2滴二月桂酸二丁基锡,80℃条件下搅拌反应3小时,然后再降至室温。加入0.382g N-BOC-丝氨醇的DMSO溶液。80℃条件下反应18h。将反应产物用无水乙醚沉淀提纯2次后放于真空干燥箱中干燥48h,得到中间产物PB。
b.将1g PB溶于10mL氯仿和10mL三氟乙酸混合溶剂,浓度为5%(w/v),室温脱保护1小时后,旋蒸去除溶剂,再用碳酸氢钠(2%,PH=8.3)中和残留三氟乙酸,放入截留分子量为35000的透析袋中透析3天,冻干即得到含氨基聚氨酯PN。
c.称取0.22mg叶酸溶解于DMSO中,室温避光磁力搅拌至溶解后加入0.191mg EDC和0.382mg NHS活化30min,逐滴加入溶解好的10mg/mL的PN/DMSO溶液,室温避光磁力搅拌过夜,放入截留分子量为35000的透析袋中透析3天,冻干即得产物PN-FA。
d.称取27mg的阿霉素,溶于2.25m L的DMSO中,再加入9μL的三乙胺,配成溶液A,取27mg PN-FA溶于2.25m L DMSO溶液中,配成溶液B。把A溶液缓慢滴加到B溶液中,搅拌2h,放入截留分子量为1000的透析袋中透析12h,冻干即得目标产物。
e.将1mg目标产物溶于1mL去离子水中搅拌,即形成了目标纳米颗粒胶束。
实施例4
一种自组装两亲性聚氨酯纳米颗粒作为靶向药物载体的制备方法。所述原料为分子量为2000的PEG,HDI,N-BOC-丝氨醇。具体步骤是:
a.精确称量4g分子量为2000的干燥PEG溶于无水DMSO中,氮气保护使反应体系内保持无水无氧状态;加入0.642mL HDI和2滴二月桂酸二丁基锡,80℃条件下搅拌反应3小时,然后再降至室温。加入0.382g N-BOC-丝氨醇的DMSO溶液。80℃条件下反应18h。将反应产物用无水乙醚沉淀提纯2次后放于真空干燥箱中干燥48h,得到中间产物PB。
b.将1g PB溶于10mL氯仿和10mL三氟乙酸混合溶剂,浓度为5%(w/v),室温脱保护1小时后,旋蒸去除溶剂,再用碳酸氢钠(2%,PH=8.3)中和残留三氟乙酸,放入截留分子量为35000的透析袋中透析3天,冻干即得到含氨基聚氨酯PN。
c.称取0.22mg叶酸溶解于DMSO中,室温避光磁力搅拌至溶解后加入0.191mg EDC和0.382mg NHS活化30min,逐滴加入溶解好的10mg/mL的PN/DMSO溶液,室温避光磁力搅拌过夜,放入截留分子量为35000的透析袋中透析3天,冻干即得产物PN-FA。
d.称取27mg的阿霉素,溶于2.25m L的DMSO中,再加入9μL的三乙胺,配成溶液A,取27mg PN-FA溶于2.25m L DMSO溶液中,配成溶液B。把A溶液缓慢滴加到B溶液中,搅拌2h,放入截留分子量为1000的透析袋中透析12h,冻干即得目标产物。
e.将1mg目标产物溶于1mL去离子水中搅拌,即形成了目标纳米颗粒胶束。
实施例5
根据实施例1所示方法制备自组装两亲性聚氨酯纳米颗粒,通过凝胶渗透色谱(GPC)测得分子量为34784,元素分析测得含氮量为5.47%,动态光散射测得粒径为119nm,计算得载药量为38.5%,缓释100h后累计释放出23%,靶向载药后对癌细胞有抑制作用。
实施例6
根据实施例2所示方法制备自组装两亲性聚氨酯纳米颗粒,通过凝胶渗透色谱(GPC)测得分子量为82106,元素分析测得含氮量为4.40%,动态光散射测得粒径为78.4nm,计算得载药量为12.8%,缓释100h后累计释放出50%,靶向载药后对癌细胞有抑制作用。
实施例7
根据实施例3所示方法制备自组装两亲性聚氨酯纳米颗粒,通过凝胶渗透色谱(GPC)测得分子量为87925,元素分析测得含氮量为3.30%,动态光散射测得粒径为24.8nm,计算得载药量为12.3%,缓释100h后累计释放出51%,靶向载药后对癌细胞有抑制作用,如图。
实施例8
根据实施例4所示方法制备自组装两亲性聚氨酯纳米颗粒,通过凝胶渗透色谱(GPC)测得分子量为108774,元素分析测得含氮量为2.26%,动态光散射测得粒径为85nm,计算得载药量为8.4%,缓释100h后累计释放出84%,靶向载药后对癌细胞有抑制作用。
实施例9
根据实施例1所示方法制备自组装两亲性聚氨酯纳米颗粒,溶于水溶液中形成浓度为1mg/ml的胶束。通过透射电镜观察为均一圆形颗粒。如图。
本具体实施方式所制备两亲性聚氨酯自组装纳米颗粒作为靶向药物载体如图所示,图1为实施例1所制备的一种两亲性聚氨酯的结构示意图。从图2可以看出此结构具有亲水片段和疏水片段,可在水溶剂中自组装形成核壳结构的胶束。从图3为实施例9描述的透射电镜图,可以看出两亲性聚氨酯自组装形成的纳米颗粒(PEG为600)粒径约为25nm。从图4可以看出由于这种载体的两亲性结构,从而使其对药物有一定的负载能力。从图5可以看出靶向接枝的两亲性聚氨酯自组装纳米颗粒比未靶向组对癌细胞的抑制效果有明显提高。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种具有葡萄糖敏感性和温度敏感性的自组装纳米粒子及其制备方法
- 一种基于纳米材料自组装的土霉素sers检测方法
- 暴露高能晶面纳米片自组装的三维网络结构α?Fe<sub>2</sub>O<sub>3</sub>的制备方法
- 一种三氧化钨纳米带自组装成微纳米星的制备方法
- 一种葡萄糖和温度敏感性的自组装纳米粒子及其制备方法和应用
- 允许通过嵌段共聚物的自组装产生纳米结构体的方法
- 一种自组装纳米止血剂、其制备方法及应用
- 一种纳米片自组装棱台状(NH<sub>4</sub>)<sub>2</sub>V<sub>3</sub>O<sub>8</sub>的制备方法
- 一种干燥介导金纳米颗粒自组装制备金基底的方法及其应用
- 一种以杆菌肽为模板自组装合成球状金纳米粒子的方法
- 一种基于纳米材料自组装的土霉素sers检测方法
- 暴露高能晶面纳米片自组装的三维网络结构α?Fe<sub>2</sub>O<sub>3</sub>的制备方法
- 一种三氧化钨纳米带自组装成微纳米星的制备方法
- 一种葡萄糖和温度敏感性的自组装纳米粒子及其制备方法和应用
- 允许通过嵌段共聚物的自组装产生纳米结构体的方法
- 一种自组装纳米止血剂、其制备方法及应用
- 一种纳米片自组装棱台状(NH<sub>4</sub>)<sub>2</sub>V<sub>3</sub>O<sub>8</sub>的制备方法
- 一种干燥介导金纳米颗粒自组装制备金基底的方法及其应用
- 一种以杆菌肽为模板自组装合成球状金纳米粒子的方法
- 一种果胶-多臂聚乙二醇自组装制备纳米药物的方法