新乌头碱在制备钙通道阻断剂中的应用的制作方法
本发明属于医药领域,具体涉及新乌头碱在制备钙通道、特别是L-型钙通道Cav1.2亚型阻断剂中的应用。
背景技术:
乌头类中药属于毛茛科植物,在我国使用已有2000多年的历史。其植物主根为乌头,侧根为附子,独根为天雄,均可入药,是临床常用的祛风散寒、除痹止痛之品。附子为毛茛科植物乌头子根的加工品,首次记载于《神农本草经》,被誉为“回阳救逆第一要药”。乌头碱(ACO)是主根乌头的重要成分,其在临床上已引起心律失常和消化道副作用。新乌头碱(MACO)是侧根附子的生物碱类物质,是ACO的结构类似物,共同拥有C19母核结构,文献资料检索结果分析表明,附子作为中医的常用药物,其药理作用非常广泛,具有抗炎镇痛、强心、抗休克、抗心律失常等多种作用,临床常用附子作为配伍药用于治疗厥逆亡阳、脉微欲绝;肾阳不足、畏寒肢冷;风寒湿痹、周身骨节疼痛等症获得了较好的效果。但乌头碱以及新乌头碱是否作用于L-型钙通道以及作用效果如何目前并无任何报道。
电压门控型钙通道按电生理特性可分为:高电压门控型钙通道及低电压门控型钙通道。前者分为:L-型、N-型、P/Q-型及R-型;后者又称之为短暂T-型。L-型钙通道是一种高电压门控型钙离子通道,普遍存在于体内各型细胞膜上。按其药理学特性及表达不同,可分为Cav1.1、Cav1.2、Cav1.3及Cav1.4四种。Cav1.2型钙通道分布广泛,介导的钙离子(Ca2+)内流诱导细胞产生钙依赖的钙释放机制,使细胞发生相应的生理和生化反应。在心肌细胞膜上,Cav1.2亚型是L-型钙通道的主要亚型,也是心肌细胞兴奋过程中钙离子内流的主要通道。Ca2+可通过L-型钙通道的内流构成心室肌细胞动作电位平台期。随着Ca2+通过L-型钙通道内流,激活了Ca2+从肌浆网中释放,对钙稳态和工作心肌细胞的兴奋-收缩偶联过程都起到重要作用。目前钙通道、特别是L-型钙通道阻断剂,例如硝苯地平(Nifedipine)在临床上广泛用于高血压、心绞痛以及心力衰竭等心血管疾病的预防或治疗。
技术实现要素:
本发明要解决的技术问题是克服现有技术中针对钙通道的阻断剂较少,且现有乌头碱副作用大的现状,提供一种新乌头碱在制备钙通道、特别是L-型钙通道Cav1.2亚型阻断剂中的应用。
本发明解决上述技术问题的技术方案之一是:新乌头碱在制备钙通道阻断剂中的应用。
其中,所述新乌头碱可以作为唯一活性成分;新乌头碱还可以与其他活性成分例如其他现有钙通道阻断剂共同起作用。
本发明所述钙通道阻断剂又称钙拮抗剂。L-型钙通道,特别是Cav1.2亚型,其为心血管系统上的主要钙通道之一,目前临床上常用的钙通道阻断剂主要作用于L-型钙通道。本发明中,较佳地,所述钙通道为L-型钙通道Cav1.2亚型。
由此,本发明解决上述问题的技术方案之二是:新乌头碱在制备预防和/或治疗心血管疾病的药物中的应用。所述心血管疾病为本领域现有L-型钙通道能作用的心血管病,包括但不仅限于高血压病、心绞痛等。
新乌头碱(MACO)的结构式如下:
其中,新乌头碱可以购买,也可以自行提取。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:新乌头碱浓度依赖性对钙通道,特别是L-型钙通道Cav1.2亚型产生阻断作用,可以将其作为钙通道阻断剂,用于治疗高血压等心血管疾病。不同于乌头碱在临床上引起的心律失常和消化道副作用,新乌头碱的使用可以显著避免上述副作用。
附图说明
下面结合附图及实施例对本发明作进一步描述:
图1:Cav1.2转染HEK293细胞,电生理验证其介导的L-型钙通道电流。其中,HEK293细胞钳制在-70mV,刺激方波采用-60mV至0mV,刺激时程为150ms。A,DMSO溶剂(0.1%)对HEK293细胞转染的Cav1.2电流无任何作用(n=5)。B,硝苯地平(Nifedipine)(5μM)可显著阻断L-型Cav1.2电流(n=5)。C,统计柱状图显示DMSO溶剂及硝苯地平对Cav1.2电流的作用。***p<0.001vs.对照组(control),“对照”组在检测时没有添加试剂。
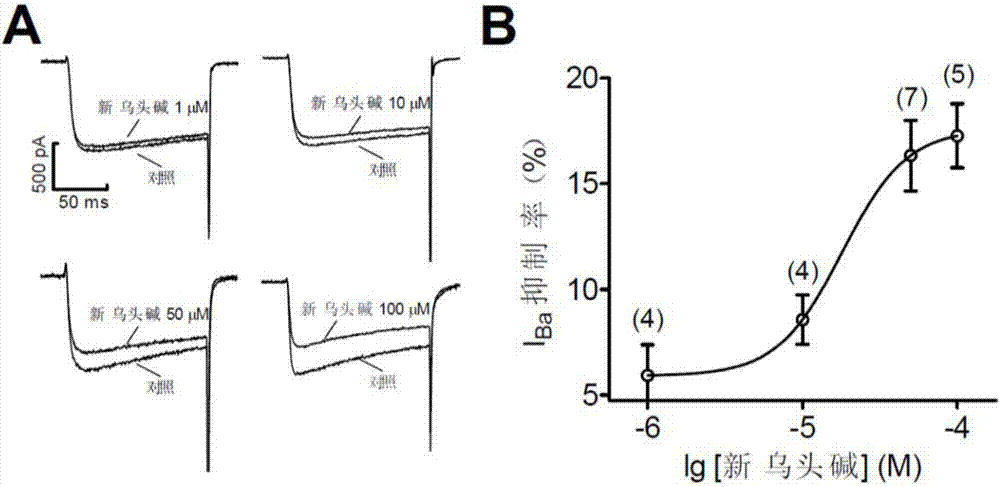
图2:新乌头碱可剂量依赖性抑制Cav1.2通道电流。其中,A,不同浓度的新乌头碱对Cav1.2电流的抑制示意图。HEK293细胞钳制在-70mV,刺激方波采用-60mV至0mV,刺激时程为150ms。B,新乌头碱浓度依赖性抑制Cav1.2通道电流。浓度依赖曲线采用sigmoidal Hill方程(Y=1/(1+10(log IC50-X)nH)拟合。括号内数字为各浓度新乌头碱的细胞记录个数。“对照”组在检测时没有添加试剂。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
实施例1 HEK293细胞转染及Cav1.2电流验证
1.实验材料:
HEK293细胞购自美国ATCC公司,转染用试剂组分购自美国SIGMA公司。
2.实验方案:
1)细胞培养及转染:
取一瓶培养良好的HEK293细胞(判断标准:贴瓶壁70-80%,光镜下细胞色泽较亮,无明显的漂浮细胞),弃培养液,加入HBSS(Hank's平衡盐溶液)轻洗两遍后加入约1mL的0.25%胰蛋白酶(trypsin)消化液消化,约3分钟后加入DMEM高糖培养液(购自Hyclone公司)吹打,使细胞悬浮,将细胞悬液转入一离心管中,离心,1000转/分,约5分钟,弃去上清液,加入DMEM高糖培养液,吹打使细胞悬浮。然后取1ml细胞悬液至已有DMEM高糖培养液的离心管中,缓慢吹打再取1ml细胞悬液至1ml的DMEM高糖培养基中,传代至35mm的培养皿中。24小时后进行转染。细胞转染采用磷酸钙转染法。具体如下,恒温培养箱中取出24小时前放入的HEK293细胞,换液DMEM培养基,放入培养箱中待用。将Cav1.2钙离子通道亚单位(质粒)Cav1.2 1.5μg、α2δ1.25μg(含eGFP绿色荧光基因),β2α1.25μg,TAG(Cav1.2,α2δ,β2α,TAG质粒取自新加坡国立大学Soong Tuck Wah实验室)(Liao et al.,JBC,2015)0.25μg混合后,往其中加入75μl CaCl2溶液,混合均匀后逐滴加入到75μl 2×HBS溶液中,缓慢吹打,静置12分钟后逐滴加入到已贴壁细胞,移入恒温培养箱,48小时后运用全细胞膜片钳记录。
2)电流记录:
应用全细胞膜片钳记录带有荧光的HEK293细胞Cav1.2电流,每组记录3-7个细胞。检测时,待电流稳定后(约2分钟后)在培养液中分别加入DMSO溶剂(0.1%)、硝苯地平(5μM)。
3.实验结果:
如图1(A)-(C)所示,1‰DMSO作为阴性对照对L-型钙电流无明显作用,抑制率为0.32%(n=5);如图1(B)-(C)所示,10μM硝苯地平作为阳性对照能够显著抑制L-型钙电流,抑制率为86.6%(n=5)。
HEK293细胞钳制在-70mV,刺激方波采用-60mV至0mV,刺激时程为150ms。A,DMSO溶剂(0.1%)对HEK293细胞转染的Cav1.2电流无任何作用(n=5)。B,硝苯地平(5μM)可显著阻断L-型Cav1.2电流(n=5)。C,统计柱状图显示DMSO溶剂及硝苯地平对Cav1.2电流的作用。***p<0.001vs.对照组(control)。
实施例2新乌头碱剂量依赖性抑制Cav1.2通道电流。
1.实验材料:
新乌头碱(CAS:2752-64-9)购自成都瑞芬思生物科技有限公司。
2.实验方案:
1)细胞培养及转染:
同实施例1。
2)电流记录:
应用全细胞电压钳模式记录显微镜下带有绿色荧光的HEK293细胞Cav1.2通道电流,每组记录4-7个细胞。检测时,待电流稳定后(约2分钟后),在培养液中加入新乌头碱,其中,新乌头碱的终浓度分别为1μM,10μM,50μM和100μM。
检测新乌头碱对转染Cav1.2通道质粒后48小时的HEK293细胞L-型钙通道电流的影响。
3.实验结果:
结果如图2所示,全细胞膜片钳结果显示,新乌头碱能够抑制Cav1.2通道电流,且该作用具有浓度依赖性。其最大抑制率为17.26±2.01%(n=5,p<0.001)。
HEK293细胞钳制在-70mV,刺激方波采用-60mV至0mV,刺激时程为150ms。A,不同浓度的新乌头碱对Cav1.2电流的抑制示意图。B,新乌头碱浓度依赖性抑制Cav1.2通道电流。浓度依赖曲线采用sigmoidal Hill方程(Y=1/(1+10(log IC50-X)nH)拟合。括号内数字为各浓度新乌头碱的细胞记录个数。
上述实例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人是能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所做的等效变换或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种大电导钙激活钾通道阻断剂-Martentoxin及其制备方法和用途的制作方法
- 虎纹捕鸟蛛毒素-xvi的制作方法
- 异丁酸(1R<sup>*</sup>,2R<sup>*</sup>,4R<sup>*</sup>)-2-(2-{[3-(4,7-二甲氧基-1H-苯并咪唑-2-基)-丙基]-甲基 ...的制作方法
- 制备s-(-)-氨氯地平或其盐的方法以及其中所用的中间体的制作方法
- 在疼痛的治疗中用作钠或钙通道阻断剂的杂芳基氨基磺酰基苯基衍生物的制作方法
- 治疗脂质代谢障碍的氮杂环丁酮衍生物的制作方法
- 作为钙通道阻断剂的新化合物的制作方法
- 龙胆酸氨氯地平及其制备方法
- 在疼痛的治疗中用作钠或钙通道阻断剂的杂芳基氨基磺酰基苯基衍生物的制作方法
- 用作钙通道阻断剂的哌嗪取代化合物的制作方法