抗坏血酸钠与三乙基四胺协同使用在抗乳腺癌药物中的应用及抗乳腺癌药物的制作方法
本发明属于医药技术领域,具体涉及抗坏血酸钠与三乙基四胺协同使用在抗乳腺癌药物中的应用及抗乳腺癌药物。
背景技术:
过氧化氢在癌症细胞生物学中发挥着不可或缺的作用。癌细胞比正常细胞产生更多的过氧化氢,首先由于过度反应的酶在电子传递链上产生过多的活性氧(ros),其次由于超氧化物歧化酶(sod)的过度表达,把过氧化物(o2-)转化为过氧化氢(h2o2)。
乳腺癌是全球女性癌症相关死亡的主要原因。像许多恶性肿瘤一样乳腺癌的特点是过度表达的sod随着过氧化氢酶(cat)的下调,将过氧化氢转化为水和氧气。因此乳腺癌细胞维持细胞内过氧化氢高于正常细胞,这表明乳腺癌细胞能够积累和允许一定范围内的过氧化氢。然而,轻微提高癌细胞中的过氧化氢已经被证明对抑制细胞周期和诱导细胞凋亡有利,这表明癌症细胞中过氧化氢的选择性超载可能是乳腺癌的治疗策略。事实上,过氧化氢诱导剂已经表现出成为抗癌药物的潜质。然而,大多数癌症化疗药物对宿主是有毒性的。因此,现有药物或天然产物选择性地促进癌细胞的过氧化氢产生,同时保证正常的细胞活动,作为实现治疗灵活性和选择性的候选者是很有前途的。
抗坏血酸(asc),也被称为维生素c,是著名的天然抗氧化剂。它一直被认为是必不可少的自由基清除剂。先前的研究已经报道,高浓度的asc能够诱导自氧化,从而揭示了抗癌效果,而低浓度的asc未能显示类似的效果。
在连续的单电子氧化反应中,高浓度的asc给予氧2个电子导致脱氢抗坏血酸(dha)和过氧化氢的形成。asc连续的单电子氧化可以通过阴离子asc2-,在二氧化物存在的情况下氧化产生asc-,脱氢抗坏血酸和过氧化氢。
这个过程表示为以下公式:
抗坏血酸+h2o→asch-+asc·-
asc2-+o2→asc·-+o2·-
2asc·-+h+→asch-+dha
2o2·-+2h+→h2o2+o2
因此,重要的是要调查高浓度的asc是否与自然氧化相关,这对其抗癌效果至关重要。asc非常稳定,在单独存在的情况下几乎不自然氧化。然而在金属氧化物催化剂存在的时,例如铁、铜、锰、asc自然氧化可以大幅提升,这就是证明了抗坏血酸离子的积累(asc·-)并最终导致大量o2·-和过氧化氢的产生。此外,o2·-可以进一步降低过氧化氢接受asc的电子。asc在水溶液中自然氧化的催化剂的功能主要依赖于他们的组成部分,特别是氨基酸组,它被认为有促氧化的作用。三亚乙基四胺(teta)是一种端粒酶抑制剂,几十年来在临床上用于治疗癌症。先前的研究表明teta可以在人类卵巢癌细胞环境下通过抑制铜/锌过氧化物歧化酶即sod1,克服顺铂的耐药性。teta是一种碱性化合物,包含两个氨基酸组并倾向于参与氧化还原以及水溶液中酸碱反应。它拥有4个氮原子,1s22s22p3电子排列。每个氮原子有一个孤对电子,可以与asc的质子配对。
技术实现要素:
针对现有技术存在的上述不足,本发明提供抗坏血酸钠与三乙基四胺协同使用在抗乳腺癌药物中的应用及抗乳腺癌药物,抗坏血酸钠与三乙基四胺协同使用具有良好的使乳腺癌细胞体积变少、质量变轻的效果,本发明抗乳腺癌药物具有优异的治疗乳腺癌、抑制乳腺癌细胞向其他脏器中转移扩散的功效。
为了实现上述目的,本发明采用的技术方案如下:抗坏血酸钠和三乙基四胺协同使用在抗乳腺癌药物中的应用。
抗坏血酸钠和三乙基四胺协同使用在制备抗乳腺癌药物中的应用。
抗坏血酸钠、三乙基四胺和天然活性物协同使用在抗乳腺癌、抑制乳腺癌细胞向肺、脾、肝、肾和心脏转移药物中的应用;其中,所述天然活性物包括赖氨酸、脯氨酸或绿茶提取物。
抗坏血酸钠、三乙基四胺和天然活性物协同使用在制备抗乳腺癌、抑制乳腺癌细胞向肺、脾、肝、肾和心脏转移药物中的应用;其中,所述天然活性物包括赖氨酸、脯氨酸或绿茶提取物。
一种抗乳腺癌药物,其组分包括抗坏血酸钠和三乙基四胺,其中,抗坏血酸钠和三乙基四胺作为抗乳腺癌的主要活性成分。
作为优化,所述药物的剂型包括片剂、丸剂、胶囊剂、颗粒剂、注射液、注射用粉剂、注射用乳剂、口服溶液、口服混悬液、口服乳剂或缓释片剂。
作为进一步优化,所述药物的剂型为片剂,包括如下质量份的组分:40~50份抗坏血酸钠、30~35份三乙基四胺、8~10份木薯淀粉、2~4份蜂蜜、2~3份羟甲基纤维素钠、1~2份二氧化硅和8~12份水;所述药物制备时将抗坏血酸钠磨碎后与木薯淀粉、羟甲基纤维素钠和二氧化硅混合均匀,过200~300目筛并取筛下物,将所述筛下物与三乙基四胺、蜂蜜和水混合,将混合物压片后制得所述抗乳腺癌药物。
作为一种改进方式,所述药物的剂型为胶囊,采用如下方法制得:将45~55质量份抗坏血酸钠磨碎后与8~10质量份辛烯基琥珀酸酯化淀粉混合均匀并过200~300目筛取筛下物,得到混合粉料,将所述混合粉料与30~40质量份三乙基四胺和5~8质量份玉米油混合均匀,将混合均匀后的混合物于胶体磨研磨3~5min,制得囊芯物,将明胶、羟丙基纤维素和水按照3~4:2~3:1~1.5的质量比混合后加热溶解均匀,得到囊壁材料,采用压丸机并以所述囊芯物和所述囊壁材料为原料,制备成所述抗乳腺癌胶囊。
作为另一种改进方式,所述药物的组分还包括赖氨酸、脯氨酸或绿茶提取物。
作为优化,所述药物的剂型为缓释片剂;采用如下方法制得:将40~45质量份抗坏血酸钠、30~35质量份三乙基四胺、15~20质量份玉米多孔淀粉、20~25质量份水和8~12份赖氨酸混合均匀并搅拌吸附10~20min,将搅拌吸附后的混合物于50~70℃下干燥处理1~2h,得到干燥混合物,将所述干燥混合物、饴糖、羟乙基纤维素和水按照75~85:10~15:5~7:6~10的质量比混合均匀并进行压片,制得所述抗乳腺癌药物。
与现有的技术相比,本发明具有如下有益效果:
1、本发明首先假设teta可能增强乳腺癌细胞中asc的自然氧化,从而提高细胞内过氧化氢,进一步促进asc对乳腺癌细胞的选择性细胞毒性,发明人通过创造性的实验验证调查了teta在asc溶液中产生h2o2的作用,用体外模型来研究它在调节乳腺癌细胞凋亡中的作用,以及通过使用一个体内动物模型来研究潜在的分子机制。经过上述假设和创造性的验证,本发明首创性地发现抗坏血酸钠和三乙基四胺协同使用具有优异的抑制乳腺癌效果,证明teta能增强asc依赖的过氧化氢的生成,能够协同增效过氧化氢介导的乳腺癌细胞选择性毒性。
2、本发明采用体内动物模型验证asc协同teta抑制乳腺癌的效果,结果显示采用asc协同teta的方式乳腺癌的重量和体积大小显著减少,明显优于仅使用asc和仅使用teta的抑制效果,取得了意想不到好的抑制乳腺癌的效果。
3、本发明通过试验验证采用asc协同teta的治疗方式,对患有基底样乳腺癌、her2阳性乳腺癌、三阴性乳腺癌的乳腺癌患者均具有良好的治疗以及抑制乳腺癌细胞转移扩散的功效,为乳腺癌的治疗提供了效果优异的新途径,具有良好的医药应用前景。
4、采用asc和teta的方式仅会协同增效癌细胞的细胞毒作用,但对正常细胞的活性影响较小,对机体正常细胞的伤害力小,安全可靠性能更高,不会带来副作用。
附图说明
图1为teta对asc氧化的影响图。电极氧监测仪检测asc水溶液的耗氧率(ocr)。单独1mmasc,30mteta/1mmasc,和30mteta分别加入10%fbs的dmem中。每个反应中加入600u/毫升过氧化氢酶来确定o2的回归。
图2为mtt法评估mcf-7存活图;*<0.005,#<0.0001,=6。
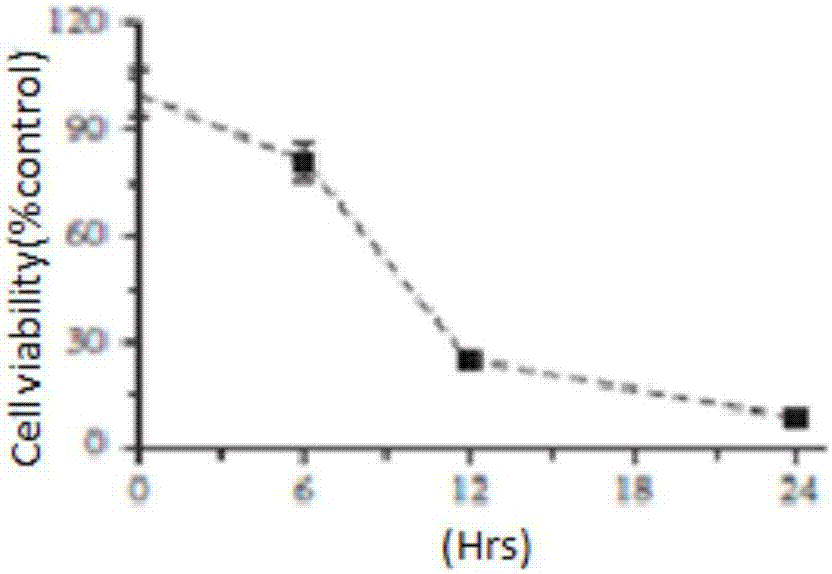
图3为在经过6,12,24hours的1mmasc/10mteta处理后用mtt法检测mcf-7细胞活性,=6。
图4为western检测凋亡信号中,不同递增剂量的asc/teta(1:100)的作用。
图5为1mmasc/10mteta12小时后mcf-7细胞克隆形成实验。
图6为在mcf-7细胞中加入1mmasc,再分别加入10m,30m,or50m的teta并处理12小时,3个独立的实验统计分析,*<0.05相对控制组,#<0.01相对asc组,=3。
图7为asc/teta作用于各细胞系的选择性毒性。mcf-7、mda-mb-157、mda-mb-231,u87,hcc-9204,h1299,hs578bst,huvec和v79细胞分别用1mm,3mm,和5mm的asc培养,同时加入10m,30m,or50m的teta保持teta对asc1:100的比例。通过mtt法检测培养12小时后,asc/teta对不同细胞的细胞毒性;实验重复三次。
图8为分别用1mmasc,10mteta,1mmasc/10mteta,5mmnac和1mmasc/10mteta以及5mmnac处理mcf-7细胞4小时,用h2dcf荧光染色mcf-7细胞中的ros图。
图9为用1mmasc/10mteta,3mmasc/30mteta,,3mmasc/30mteta以及5mmnac处理mcf-7细胞12小时。western检测ras的表达和h3乙酰化图。
图10为用1mmasc/10mteta对mcf-7细胞分贝处理6,12,24小时;western检测ras的表达和h3乙酰化图。
图11为用1mmasc,10mteta,5mmnac,1mmasc/10mteta和1mmasc/10mtetaplusnac处理mcf-7细胞12小时;用mtt法测量细胞活性图,*<0.005,=4.实验重复三次。
图12为乳腺癌和正常细胞中的cat表达水平—1mmasc,10mteta,300u/ml过氧化氢酶,1mmasc/10mteta,1mmasc/10mteta加过氧化氢酶处理mcf-7细胞12小时结果;克隆形成实验,*<0.0001,#<0.0001,=4。
图13为乳腺癌和正常细胞中的cat表达水平—免疫印迹法测定hs578bst和mcf-7细胞中cat的表达水平图。
图14为乳腺癌和正常细胞中的cat表达水平—hs578bst细胞中cat的表达被catshrna抑制图。
图15为乳腺癌和正常细胞中的cat表达水平—catshrna处理后用mtt法测量hs578bst细胞活性,<0.005,=4。
图16为sod在asc/teta介导细胞凋亡中的作用—1mmasc,10mteta,100u/mlsod1,1mmasc/10mteta,1mmasc/10mtetaplussod用于处理mcf-7细胞12小时。克隆形成实验被用于确定板植入率*<0.0001,#<0.05,=4。
图17为western评估hs578bst和mcf-7细胞中sod1的表达水平图。
图18为通过免疫印迹试验检测sod1shrna下调mcf-7细胞中sod1的表达图。
图19为经sod1shrna处理后的mcf-7细胞活性由mtt实验测量,*<0.05,=4图。
图20为asc/teta对erk和sod表达的影响图—不同时间段mcf-7细胞在3mmasc,30mteta,或3mmasc/30mteta的培养;western评估erk,ras,cyt-c的蛋白水平。
图21为小鼠乳腺癌模型中asc/teta抑制肿瘤生成,5×106mcf-7皮下注入磁性裸鼠后腿部,14天后随机分为4组,(0.01mpbs);asc(3g/kg体重);teta(30mg/kg体重);asc(3g/kg体重)+teta(30mg/kg体重),分别经腹腔内注射,每日一次,处理后25天图——脏器指数图。
图22为小鼠乳腺癌模型中asc/teta抑制肿瘤生成,5×106mcf-7皮下注入磁性裸鼠后腿部,14天后随机分为4组,(0.01mpbs);asc(3g/kg体重);teta(30mg/kg体重);asc(3g/kg体重)+teta(30mg/kg体重),分别经腹腔内注射,每日一次,处理后25天图——不同组的肿瘤代表性图片
图23为小鼠乳腺癌模型中asc/teta抑制肿瘤生成,5×106mcf-7皮下注入磁性裸鼠后腿部,14天后随机分为4组,(0.01mpbs);asc(3g/kg体重);teta(30mg/kg体重);asc(3g/kg体重)+teta(30mg/kg体重),分别经腹腔内注射,每日一次,处理后25天——肿瘤体积p<0.0001,n=6。
图24小鼠乳腺癌模型中asc/teta抑制肿瘤生成,5×106mcf-7皮下注入磁性裸鼠后腿部,14天后随机分为4组,(0.01mpbs);asc(3g/kg体重);teta(30mg/kg体重);asc(3g/kg体重)+teta(30mg/kg体重),分别经腹腔内注射,每日一次,处理后25天图——肿瘤的重量*p<0.05,#p<0.005,n=6。
具体实施方式
下面结合具体实施例对本发明作进一步详细说明。
一、材料和方法
1.1细胞培养。
所有的细胞系均购自中科院上海细胞库(上海)。d-mem高糖培养基中培养(dmem,hyclone,sh30022.01b,usa)在37℃,5%co2浓度的co2培养箱中添加10wt.%的胎牛血清(fbs)(gibco,美国)。
1.2耗氧量测定。耗氧率(ocr,d[o2]/dt)的测定如下:在dmem(10wt.%fbs)中把一个克拉克电极氧监测仪(ysiinc.)连接到esa生物多电极系统。测量和记录teta对asc的耗氧量。通过添加过氧化氢酶测定h2o2的积累(sigma,c9322-1g,德国)。
1.3mtt比色法。mcf-7细胞在96-孔板(3×103细胞/)中培养,紧随其后的是12小时或24小时的处理。媒介中包含的asc是受到mtt比色法之前的asc,因为asc的氧化产物干扰mtt比色。无血清的100μldmem加入到每个孔中,然后各孔再加3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-diphenytetrazoliumromide(mtt,sigma,德国)20μl/孔。37℃的温度下培养4h,吸除各孔培养液后加150μl/孔的dimethylsulfoxide(dmso),震动10min,检测od490值。
1.4ros测量。使用h2dcf(sigma,德国)检测细胞内ros,步骤如下:10μm的h2dcf添加30min后,通过荧光显微镜分析细胞(keyencecorporation)。
1.5蛋白质印迹法。使用冷冻的ripa裂解缓冲液(碧云天生物科技,上海,中国)获得mcf-7细胞,蛋白质浓度测定采用bca量化工具(碧云天生物科技,中国上海);蛋白质印迹法具体如下:anti-ac-h3,anti-sod1,anti-cat,anti-erk,anti-p-erk,anti-cyt-candanti-caspase9的一抗购买自巴傲得生物科技(南京,中国),anti-parp,rabbitanti-caspase3,andanti-ac-h3购买自cellsignalingtechnology(丹佛,美国),anti-raswaspurchasedfrombd,usa,andanti-gapdh的购买自earthox(米尔布雷,美国)。二抗是从南京巴傲得生物技术购买(南京,中国),高灵敏度的化学发光底物eclsupersignalwestfemtomaximumsensitivitysubstrate从thermofisher购买。
1.6瞬时转染。在转染前的24小时,1×105个细胞接种在24孔板中。根据制造商的协议,shrna(600ng/孔)和质粒(大肠杆菌质粒,cole1质粒)(800ng/孔)被脂质体3000转染。
sod1,nm000454.3-582s1c1:
ccgggctgtagaaatgtatcctgatctcgagatcaggatacatttctacagctttttg
cat,nm001752.2-1371s1c1:
ccggcggagattcaacactgccaatctcgagattggcagtgttgaatctccgtttttg
1.7异种移植的研究。6周龄雌性裸鼠(balb/cnu)购自生命河实验室(北京,中国),动物实验由重庆医科大学医学伦理委员会批准,所有的程序都按照美国国立卫生研究院的实验动物喂养和使用指南。总而言之,将mcf-7细胞(5×106200l)皮下注入小鼠的后腿,0.72mg,90天释放17-estradiol的颗粒被皮下植入到正反面促进肿瘤生长的最佳区域。肿瘤被允许生长14天到达3-5mm的最大尺寸,治疗在第14天开始。小鼠随机分为4组,包括控制组(0.01pbs);asc(3克/公斤体重);teta(30毫克/公斤体重)和asc(3克/公斤体重)+teta(30毫克/公斤体重),每组10只老鼠。通过连续25天每日腹腔内注射治疗,每2天使用游标卡尺测量肿瘤大小,同时估计肿瘤体积基于以下公式:肿瘤体积(mm3)=×2/2,其中l是肿瘤的最大尺寸,w意味着肿瘤垂直方向的尺寸。肿瘤大小达到1,000mm3,用co2安乐处死动物。
1.8统计分析。mean±sd表示。基于各实验设计的要求,采用graphpadprism5软件进行统计。即t-tests和2-wayanova。
二、结果
2.1teta协同抗坏血酸钠氧化。
为了探究teta从asc促进h2o2生成的效果,分别测量了含有teta的asc的耗氧量,和缺乏teta的asc的耗氧量。正如图表1所示,1mmasc在10wt.%fbs的dmem的耗氧量为55nmol/l/s;而增加30μm的teta后,耗氧量增加到110nmol/l/s,而仅有30μm的teta几乎不消耗o2和产生h2o2。然而,在过氧化氢酶存在下(600u/ml),asc/teta中h2o2的积累被显著抑制,相对于asc或teta的单独存在下。综上所述,这些证据强有力地证明teta能增强asc依赖的过氧化氢的生成。
2.2asc/teta共同促进mcf-7细胞凋亡。
为了进一步检测乳腺癌细胞中asc/teta诱导h2o2的细胞毒性,mcf-7细胞被分别加入asc(1mm)和不同剂量的teta(10μm,30μm,and50μm)12小时,mtt比色法结果表明,单独加入asc导致mcf-7细胞增殖减少40%,而单独加入teta本身并没有表现出对细胞活性的影响。有趣的是相比单独加入asc,加入asc和teta组合时细胞存活率显著下降(图2)。此外,24小时asc/teta的持续培养使细胞存活率进一步降低,表明asc/teta联合抗癌作用呈时间剂量依赖性(图3)。进一步的免疫印迹实验表明asc/teta抑制mcf-7细胞活性通过caspase9和caspase3凋亡信号的上升(图4)。形态学和细胞克隆实验证实teta和asc介导的细胞毒作用于mcf-7人乳腺癌细胞(图5和图6)。总之,这些结果表明,teta和asc协同在体外具有抗乳腺癌的作用,且抗乳腺癌效果明显高于仅使用asc的抗乳腺癌效果。
2.3asc和teta协同增强体外细胞毒性。
为了进一步验证asc和teta的协同作用是特异性地针对肿瘤细胞的死亡,除了各种癌细胞系asmcf-7、mda-mb-157、mda-mb-231,u87,hcc-9204,h1299外,包括多样的正常hs578bst,内皮细胞,和v79用不同浓度的teta溶液(5μm,10μm,30μm,and50μm)孵育,与相应剂量的asc(0.5mm、1mm、3mm和5mm)按照1:100比例配成teta/asc。mtt法检测结果表明,asc和teta协同增效癌细胞的细胞毒作用,但对正常细胞的活性影响较小(图7)。
2.4h2o2对于asc/teta诱导产生mcf-7细胞的细胞毒性至关重要。我们评估了mcf-7细胞的ros水平。经过4小时的潜伏期单独加入asc仅中度升高mcf-7细胞的ros水平,而单独加入teta没有显示对ros产生任何影响。然而,相比其他组,asc/teta共培养导致了ros的急剧增加,而n-乙酰半胱氨酸(nac,sigma,v900429,德国),除h2o2外,还降低了ros,asc/teta显示了更少的荧光染色(图8)。总之,这些数据表明,teta不仅增效h2o2,也增效了mcf-7细胞中其他种类从asc中产生ros。
然而,ros包括过氧化氢(h2o2)、超氧阴离子(o2·-)、羟基自由基,要确定asc/teta的细胞毒性是否特定地来自于h2o2。随着asc/teta,nac被应用于mcf-7细胞。
蛋白质印迹法表明asc/teta联合作用导致ras基因表达的抑制,并没有被额外的nac而解除。相反的,虽然asc/teta也导致剂量依赖性h3乙酰化升高,但这种功效被5mmnac完全逆转(图9)。此外,asc/teta对ras表达的影响和h3乙酰化表现出时间依赖性(图10)。数据表明,teta/asc抑制mcf-7细胞ras蛋白表达主要通过h2o2,同时上调h3乙酰化主要是通过其他类型的ros。最重要的是,5mmnac未能消除由asc/teta引起的细胞毒性。总之,这些结果表明(图11),在mcf-7细胞中,asc/teta诱导的h2o2是主要的细胞毒性物质,可能通过抑制ras来表达。
2.5asc/teta诱导的mcf-7过氧化氢的选择性细胞毒性源于cat表达的缺乏。随后我们研究了asc/teta联合对癌细胞和正常细胞的细胞毒性机制的差异。克隆形成实验检测了asc/teta诱导细胞死亡的过氧化氢酶的作用。数据(图12)表明,单独加入asc适度降低了mcf-7细胞的平板效率,teta和过氧化氢酶显示了相似的效果。然而,asc/teta的联合显著抑制mcf-7细胞的平板效率,但在过氧化氢酶存在的情况下,这种下降完全恢复了。那么我们通过免疫印迹法确定了在mcf-7细胞内和普通细胞内cat的表达水平。结果表明mcf-7细胞内的cat表达水平明显低于正常细胞(图13)。为了进一步确定cat抵抗asc/teta诱导细胞死亡的重要性,shcat被转染到正常乳腺上皮细胞hs578bst;它只是很大程度上抑制了cat在hs578bst细胞的表达(图14),但也大大损伤了细胞的活性(图15)。这些强烈表明了癌细胞选择性细胞毒性是由于cat下调导致,因此联合使用teta和asc的细胞毒性主要是由h2o2介导。
2.6asc/teta诱导的mcf-7细胞的细胞毒性不由o2·-介导。尽管已经发现h2o2对于teta/asc介导细胞毒作用极为重要,但o2·-抗癌效应的可能性尚未排除。为了区分o2·-和h2o2对teta/asc联合诱导产生细胞毒性时的作用,100u/mlsod被应用于1mmasc的mcf-7细胞和10μmteta的mcf-7细胞。相比于cat,sod未能挽回asc和teta都存在情况下细胞的存活,而是加剧了细胞的死亡(图16)。这表明o2·-并不有助于teta和asc介导肿瘤细胞的细胞毒性。意料之中,sod蛋白在mcf-7细胞中表达明显高于正常细胞(图17)。为了进一步证实这一发现,mcf-7细胞内的sod1被shrna敲降(图18)。在asc/teta联用下,shsod1并未增强mcf-7细胞活性,而是导致更多细胞死亡(图19)。这些数据表明,asc/teta对mcf-7的细胞毒性不是由o2·-介导。
2.7asc/teta作用于癌细胞相关的信号
我们调查了参与asc/teta诱导细胞死亡的信号通路。如图20所示,通过免疫印迹实验表明,asc/teta联合使用抑制了mcf-7细胞中erk1/2和sod1的表达。为了进一步明确asc和teta导致细胞死亡的类型,我们检监测了细胞色素c(cyt-c),细胞凋亡的关键调节者。asc/teta诱导cyt-c有时间依赖性,这与之前mtt的结果一致。这些数据表明asc/teta诱导癌细胞凋亡可能是由ras-erk所介导的。
2.8teta增强体内asc诱导的细胞毒性
为了检验联用asc/teta是否对体内的肿瘤细胞具有细胞毒性,小鼠体内的移植肿瘤在经过25天的联用注射后,其差异无统计学意义,4组之间的脏器指数观察(图21)后表明asc/teta对这些器官毒性低。然而,在25天肿瘤体积组之间存在差异,对照组肿瘤体积为971.1±24.20mm3,单独加入teta组体积为898±16.03mm3,单独加入asc组体积为746.5±14.44mm3,但明显降低的是asc/teta组,体积为278±16.42mm3。与之契合的是,肿瘤的重量分别为1.276±0.097g,0.969±0.095g,1.226±0.087g对应对照组,asc组、teta组,但显着下降到0.478±0.094g的是有由asc/teta处理的这组(图22、23、24)。
三、抗乳腺癌药物:
本发明发明人在创造性地发现asc和teta协同使用能够显著减少乳腺癌肿瘤体积大小和重量的基础上,通过进一步的研究,给出了如下种抗乳腺癌药物的组成方式,具体如下:
实施例1
一种抗乳腺癌药物,剂型为片剂,包括如下质量份的组分:50mg抗坏血酸钠、35mg三乙基四胺、10mg木薯淀粉、4mg蜂蜜、3mg羟甲基纤维素钠、2mg二氧化硅和12mg水;所述药物制备时将抗坏血酸钠磨碎后与木薯淀粉、羟甲基纤维素钠和二氧化硅混合均匀,过200目筛并取筛下物,将所述筛下物与三乙基四胺、蜂蜜和水混合,将混合物压片后制得所述抗乳腺癌药物。
某患有基底样乳腺癌的乳腺癌患者服用本实施例抗乳腺癌药物,每天服用一片,连续服用16周后,检测乳腺癌细胞有明显的体积变小,证明本实施例抗乳腺癌患者对患有基底样乳腺癌的患者具有良好的治疗效果。
实施例2
一种抗乳腺癌药物,剂型为胶囊,采用如下方法制得:将55mg抗坏血酸钠磨碎后与10mg辛烯基琥珀酸酯化淀粉混合均匀并过300目筛取筛下物,得到混合粉料,将所述混合粉料与40mg三乙基四胺和8mg玉米油混合均匀,将混合均匀后的混合物于胶体磨研磨5min,制得囊芯物,将明胶、羟丙基纤维素和水按照4:3:1.5的质量比混合后加热溶解均匀,得到囊壁材料,采用压丸机并以所述囊芯物和所述囊壁材料为原料,制备成所述抗乳腺癌胶囊。
某患有her2阳性乳腺癌的乳腺癌患者服用本实施例抗乳腺癌药物,每天服用一粒胶囊,连续服用20周后,检测乳腺癌细胞有明显的体积变小,肉眼可见乳腺癌细胞的数量也变少,证明本实施例抗乳腺癌患者对患有her2阳性乳腺癌的患者具有良好的治疗效果。
实施例3
一种抗乳腺癌药物,剂型为缓释片剂;采用如下方法制得:将45mg抗坏血酸钠、35mg三乙基四胺、20mg玉米多孔淀粉、25mg水和12mg赖氨酸混合均匀并搅拌吸附20min,将搅拌吸附后的混合物于70℃下干燥处理2h,得到干燥混合物,将所述干燥混合物、饴糖、羟乙基纤维素和水按照85:15:7:10的质量比混合均匀并进行压片,制得所述抗乳腺癌药物。
某患有三阴性乳腺癌的乳腺癌患者服用本实施例抗乳腺癌药物,每天服用一片,连续服用15周后,检测乳腺癌细胞有明显的体积变小,肉眼可见乳腺癌细胞的数量也变少,且乳腺癌细胞向肺、脾、肝、肾和心脏中转移量极少,证明本实施例抗乳腺癌患者对患有三阴性乳腺癌的患者具有良好的治疗以及抑制乳腺癌细胞转移扩散的功效。
四、发明内容分析与讨论:
鉴于乳腺癌的典型特征之一是sod过度表达,随着cat表达的抑制,肿瘤细胞内氧化应激与正常细胞相比更高。wlassoff等人表明,来源于h2o2的羟基自由基在三苯氧胺-二茂(络)铁共轭存在的情况下促进乳腺癌细胞凋亡。其他团队已经证明癌细胞中过量的过氧化氢的产生和积累可能引起癌症细胞周期阻滞和细胞凋亡,这表明细胞内h2o2浓度升高可能是治疗乳腺癌的一种有效方法,因此一种能够选择性诱导h2o2生成的天然化合物的物质有望成为治疗乳腺癌的理想方法。
asc是一个有效的天然抗氧化剂,对癌症治疗一直被认为是有益的。有趣的是据报道,在癌细胞中asc通过贡献一个电子而被氧化,与金属离子发生氧化反应产生抗癌的过氧化氢。另一团队也表明,用1mmasc处理c6细胞4小时,触发细胞内cu的释放,可以进一步促进asc氧化,这表明asc自氧化产生的过氧化氢可能对癌症治疗是有益的。然而,asc诱导的过氧化氢对治疗癌症的有效性仍然是有争议的。首先,asc等离子体浓度与乳腺癌风险没有明显的关联;其次,过氧化氢被发现能增强乳腺癌发生的风险。这两种情况表明不仅需要高剂量的asc诱导细胞内急剧升高的h2o2流,还需要一种从asc自然氧化中促进h2o2产生的试剂,可能是asc临床上用于乳腺癌治疗的关键。考虑到人的asc循环浓度比较高,从20到80mol/l,在各个国家都相对稳定,所以把asc作为药物对乳腺癌作用是合理的。事实上,逐渐累积的证据表明高剂量的asc可能有利于乳腺癌的治疗。yun等最近报道高剂量的asc选择性杀伤kras和braf突变的结直肠癌细胞。同样,另一团队也表明,药理浓度的asc能对各种大肠癌细胞系起到抑制增殖和诱导细胞凋亡的作用,可能是通过促进细胞内氧化应激来完成的。asc也表现出对胰腺癌细胞的抗癌特性,进一步提供的证据表明,高剂量的asc在金属离子催化下,诱导癌细胞中过氧化氢流导致氧化应激,最终使细胞凋亡。
这些结果表明,asc能够导致癌细胞的死亡,但因为不同癌细胞之间的差异性很大,并没有相关研究证明asc能否导致乳腺癌细胞死亡,且采用如何浓度的asc能够提高乳腺癌细胞死亡率,而不是促进乳腺癌的发生也有待研究商榷,以及采用怎么样的物质协同增效过氧化氢的乳腺癌细胞选择性毒性都是有待研究的。
因此,本发明发明人通过一系列创造性的试验研究,通过实验数据证实,高剂量的asc是必不可少的诱导体外mcf-7细胞凋亡和抑制体内肿瘤发生的物质。虽然许多研究表明,asc可作为乳腺癌化疗的辅助药物,但这主要取决于在肿瘤细胞治疗的过程中asc诱导的氧化应激,而这还有待调查。
teta是有等排相似电荷缺陷的亚精胺与cu(ii)的螯合物。它通常用于治疗wilson病。最近,其治疗癌症的潜力已被揭开;越来越多的证据表明,teta在通过抑制端粒酶活性对抗癌症,在抗肿瘤血管形成中,通过调节代谢抑制癌细胞增殖以及诱导细胞死亡的过程中都起着重要的作用,然而,这些研究主要集中在teta的化学性质对癌症的作用,特别是氨基,和作为一个潜在的asc氧化催化剂的作用。我们是第一个发现,在水溶液中,teta通过增加asc氧化而提高h2o2产量。随后,我们检查了asc/teta联用是否足以导致乳腺癌细胞死亡。在体外和体内实验证明,单独的高剂量asc只对癌细胞产生轻微毒性,因此单独的teta几乎没有任何作用。然而,asc/teta联用显著抑制mcf-7细胞活力,强烈提示asc/teta的组合联用可以是一种很有前途诊断乳腺癌的新兴辅助治疗。然而,潜在的分子机制仍有待发现。
为了确定asc/teta对乳腺癌细胞的细胞毒性,h2dcf荧光染色ros后的结果表明,asc/teta显著促进癌细胞生成ros。然后我们也确定了asc/teta诱导癌细胞死亡的ros类型。加入nac不抑制asc/teta的细胞毒作用,强有力证明了,来自于asc/teta的过氧化氢是ros的主要类型,这就是能选择性杀伤乳腺癌细胞的原因。然而许多研究已经证实,长期的细胞外的高浓度h2o2,在几个月内能促进乳腺癌细胞增殖,结果形成侵入性的表型。然而,我们的研究结果与wlassoff等人是一致的,根据他们的报道,h2o2是刺激细胞凋亡的三苯氧胺-二茂(络)铁中对mcf-7共轭处理的羟基。这表明,h2o2依赖型乳腺癌最好的治疗窗口将不会超过六个月。然而,在今后的研究中要进行asc/teta下细胞内h2o2流的实时监测是否如先前报道一样。
有趣的是我们理解了teta/asc是否是癌细胞的选择性毒性。之前已经证明asc阻止某些癌细胞的生长,比如hela,sk-br-3,sk-br-3-dox,l929,和melb16,但并不影响一些其他细胞的生长:hef,ovcar,hep2,hep2va3,和v79。我们的研究表明,asc/teta选择性毒性包括的肿瘤细胞有:mcf-7、mda-mb-157、mda-mb-231,u87,hcc-9204,h1299,但对正常hs578bst,huvec细胞系和v79有轻微的毒性。总之,这些数据表明asc/teta选择性地杀伤一些特定类型的癌细胞,包括雌激素受体呈阳性的mcf-7乳腺癌细胞。
为了研究乳腺癌细胞中asc/teta选择性毒性机制,通过shrna调节了sod1和cat的表达。有趣的是,sod1的下调未能改善asc/teta对癌细胞的细胞毒性,相反,过度的过氧化氢酶能有效抑制由asc/teta诱导癌细胞死亡。这证实了h2o2而非o2·-是asc/teta诱导细胞死亡的因素。此外,为了进一步研究sod1和cat在乳腺癌细胞中的表达模式是否干扰细胞活性,shrna分别敲降了sod1和cat。与正常细胞相比sod1在mcf-7细胞中过度表达,shsod1rna导致mcf-7的细胞活性显著降低,这表明内源性sod1是维持乳腺癌细胞生理功能的关键。可能sod1,h2o2对癌细胞是一个重要的分子信号。据了解,一定水平的过氧化氢促进癌细胞增殖和生长。此外,由于对cat在mcf-7细胞中的表达水平较低,我们下调了hs578bst细胞中的cat,显示细胞活力增强。这表明低水平的cat可能有益于细胞,通过阻断过氧化氢的消耗,从而保持有益的细胞内h2o2浓度。
大量的研究表明,ras-erk通路与乳腺癌细胞的生长和转移有关。我们的数据还表明,asc/teta抑制ras和erk的表达具有时间和剂量依赖性。也抑制随后的癌细胞凋亡,通过细胞色素c和凋亡蛋白酶的释放已证实,虽然单独的teta或asc也有类似的作用。在这项工作中,我们也观察到使用asc/teta联用可以导致mcf-7内h3整体乙酰化,这与mcf-7细胞活性和h2o2产生无关。已有证据表明,通过sirt1抑制而提高组蛋白乙酰化诱导了乳腺癌细胞凋亡,可能通过上调p21。因此,进一步探讨在特定基因的启动子区域的组蛋白修饰是否参与asc/teta诱导乳腺癌细胞凋亡这将非常有趣。此外,我们发现asc/teta联用也导致mcf-7细胞的sod1下调,这与sod1shrna实验结果一致,说明asc/teta组合抗乳腺癌的作用一定程度上受到sod1抑制所介导。尽管其他研究也表明asc可能通过akt和rhoa分别参与调控乳腺癌细胞的增殖和迁移,但目前还不清楚asc/teta是否有效地通过同样的途径,这值得进一步验证。
细胞模型的异体移植实验证实了我们的研究结果。asc/teta的使用显著地减少了肿瘤尺寸和重量,然而裸鼠的内脏器官没有受到影响。这个结果证实了teta联合asc抑制体内乳腺癌作用显著。然而,在实验中asc使用的剂量是3g/kg体重,相比之前剂量较高。需要对asc/teta进一步的药理学和药代动力学研究来测出乳腺癌治疗的最佳给药方式和剂量。同样地,在对乳腺癌小鼠模型实验中,asc联合其它天然混合物,包括赖氨酸,脯氨酸和绿茶提取物的治疗能显著减少肿瘤重量和抑制肺、脾、肝、肾和心脏的转移。类似地在动物实验中,包括asc的天然抗氧化混合物也显示能有效抑制放射诱导的肿瘤。也有报道苯并a芘诱导的大鼠模型,asc的高剂量口服给药表现出显著的抑癌和延长寿命作用。
另外,h2o2介导的asc/teta对癌细胞凋亡的影响,协同抗氧化特性具有潜在的阻止正常细胞被细胞间或细胞外高含量ros损伤的作用。从其他团队的研究结果表明,这些额外的抗肿瘤发生的作用可能是通过抑制hif1。然而,有证据表明,药物asc可能有副作用。asc诱导的红细胞的促凝血和凝血酶原激活,以及体内血栓形成已被报道。癌症患者的红细胞表现出asc对血栓形成影响的极度灵敏,这表明静脉注射vc治疗需要小心地反复确认。asc的衍生物,6-脱氧-6-氯代-抗坏血酸,在抑制癌细胞增殖中表现出更有效的作用,更可能用于临床治疗乳腺癌。
总之,目前的研究工作表明,与teta协同asc治疗乳腺癌增强了过氧化氢的生成,从而抑制了肿瘤发生的ras/erk信号通路和诱导细胞凋亡。
本发明的上述实施例仅仅是为说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化和变动。这里无法对所有的实施方式予以穷举。凡是属于本发明的技术方案所引申出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 还没有人留言评论。精彩留言会获得点赞!