一种羟基磷灰石/相转变溶菌酶涂层杂化材料及其制备方法与流程
本发明属于骨组织修复材料的制备技术领域,具体涉及一种利用相转变溶菌酶制备的羟基磷灰石涂层杂化材料及制备方法。
背景技术:
羟基磷灰石(hap),分子式为ca10(po4)6(oh)2,是一种由有机和无机纳米杂化体所组成的复合物,与人体和动物硬组织骨、牙齿的无机基质具有相似的组成,具有良好的生物相容性、生物活性、骨传导和骨结合能力,在当代生物医学与组织工程学中都有巨大的潜在应用前景。然而,目前所制备的羟基磷灰石材料大多都是惰性的、缺乏界面活性,因此成功的制备出具有生物活性的羟基磷灰石有机-无机杂化材料的关键在于设计出一种具备灵活可控的界面粘附模板材料。目前许多学者采用胶原蛋白、丝素蛋白、壳聚糖、甲克素等为仿生矿化模板诱导羟基磷灰石的生成。但是这些制备技术仍然存在价格昂贵、生物降解快、机械强度低、制备成分不单一、工艺复杂,并且适用于少数基材以及原材料来源单一等缺点,因此开发一种新型、简单、绿色环保,且适用于多种基材的生物涂层用于仿生矿化制备羟基磷灰石的技术仍是科学家们面临的一项挑战。简而言之,对于生物矿化来说开发具有生物功能化的有机和无机材料仍然是一个至关重要的挑战。
技术实现要素:
本发明所要解决的技术问题在于提供一种操作简单、绿色环保、具有普适性的羟基磷灰石/相转变溶菌酶涂层杂化材料的制备方法。
解决上述技术问题所采用羟基磷灰石/相转变溶菌酶涂层杂化材料的制备方法为:在基材表面负载溶菌酶相转变产物或粘附溶菌酶二维纳米薄膜后,将基材浸入氯化钙水溶液中螯合钙离子,然后将螯合钙离子的基材浸入模拟体液或模拟唾液中,在密闭条件下37~70℃孵化7~14天,得到羟基磷灰石/相转变溶菌酶涂层杂化材料。
上述在基材表面负载溶菌酶相转变产物的方法与公布号cn105039953a的发明专利申请公开的方法相同;在基材表面粘附溶菌酶二维纳米薄膜的方法与公布号cn105153443a的发明专利申请中公开的在基材表面形成生物蛋白质二维纳米薄膜(即溶菌酶二维纳米薄膜)的方法相同。
上述制备方法中,优选将基材浸入氯化钙水溶液中浸泡48小时,且每隔12小时更换一次氯化钙水溶液,用以螯合钙离子,其中所述氯化钙水溶液中氯化钙的浓度为0.002~2mol/l,优选氯化钙的浓度为0.01~0.05mol/l。
上述制备方法中,进一步优选在密闭条件下70℃孵化7天。
上述的基材为au、ag、cu、pt、ti、si、sio2、ito、石英、云母、玻璃、牙齿、zro2、聚对苯二甲酸、聚丙烯、聚碳酸酯、聚酰亚胺、聚苯乙烯、聚二甲基硅氧烷、聚四氟乙烯、医用导管、木材、碳纤维、棉纤维、陶瓷中的任意一种。
本发明通过模拟自然界生物矿化,以化学性质稳定、易于改性的天然生物大分子溶菌酶为蛋白质模板,成功的利用其表面丰富的功能性基团通过螯合作用将钙离子固定至基材表面,之后通过静电相互作用力在体外进行模拟生物矿化的过程成功诱导羟基磷灰石(hap)的成核并结晶,制备出与天然骨成分相近、结构相似且机械强度高、表面积大、生物活性好的生物活性涂层材料——羟基磷灰石/相转变溶菌酶涂层杂化材料(hap@ptl)。
本发明制备的羟基磷灰石/相转变溶菌酶涂层杂化材料,不仅具有优越的机械稳定性,而且具有良好的生物相容性和高的骨诱导性、骨传导性,可以作为组织修复材料指引新组织的形成和骨的诱导矿化,有望成为新型的硬组织替代材料。
本发明操作过程简便可控、条件温和、晶体形貌可控、绿色环保、成本低廉,且适用于在多种基材表面制备羟基磷灰石,为发展普适性的羟基磷灰石生物涂层的制备提供了新的技术手段,也为实际的生物医学应用提供了一种低成本、实用的方法,具有广泛的应用前景。
附图说明
图1是实施例1制备的hap@ptl涂层杂化材料的x-射线衍射光谱。
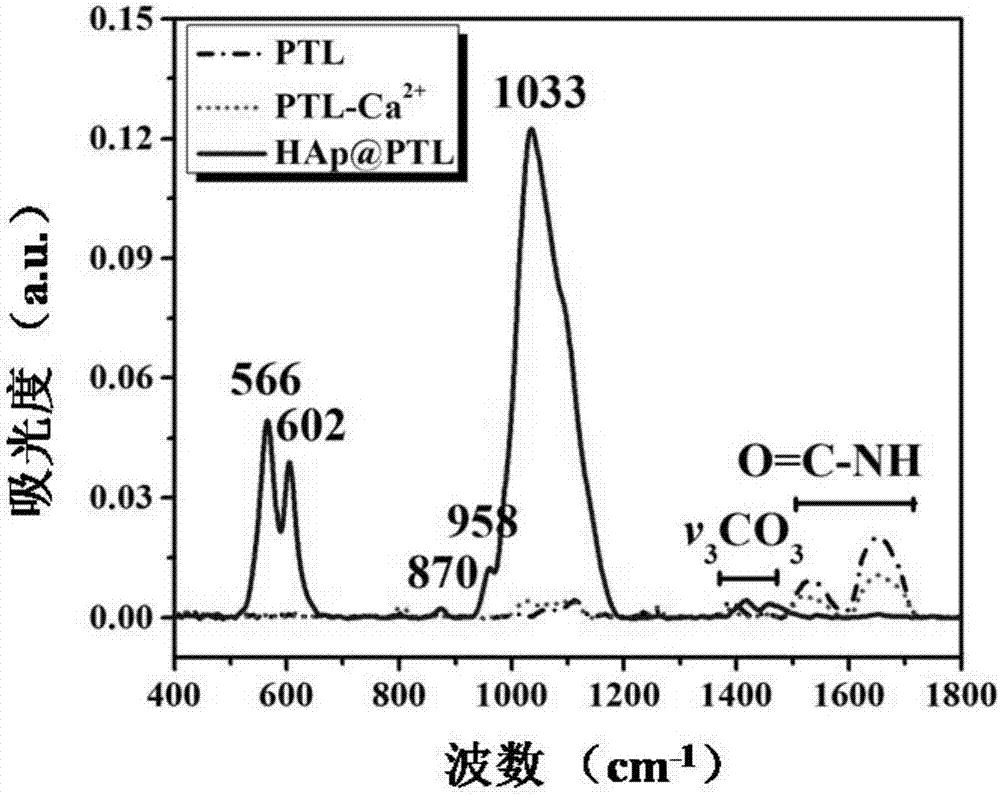
图2是实施例1制备的ptl、ptl-ca2+、hap@ptl涂层杂化材料的红外光谱。
图3是实施例1制备的ptl、hap@ptl涂层杂化材料的拉曼光谱。
图4是实施例1制备的hap@ptl涂层杂化材料的能谱图。
图5是实施例1制备的hap@ptl涂层杂化材料的扫描电镜图。
图6是实施例1制备的hap@ptl涂层杂化材料的透射电镜图。
图7是实施例1制备的hap@ptl涂层杂化材料的电子衍射图。
图8是实施例2制备的hap@ptl涂层杂化材料的扫描电镜图。
图9是实施例3制备的hap@ptl涂层杂化材料的扫描电镜图。
图10是实施例4制备的hap@ptl涂层杂化材料的扫描电镜图。
图11是实施例5制备的hap@ptl涂层杂化材料的扫描电镜图。
图12是实施例6制备的hap@ptl涂层杂化材料的扫描电镜图。
图13是实施例7制备的hap@ptl涂层杂化材料的扫描电镜图。
图14是实施例8制备的hap@ptl涂层杂化材料的扫描电镜图。
图15是实施例9制备的hap@ptl涂层杂化材料的扫描电镜图。
图16是实施例10制备的hap@ptl涂层杂化材料的扫描电镜图。
图17是实施例11制备的hap@ptl涂层杂化材料的扫描电镜图。
图18是实施例1制备的hap@ptl涂层杂化材料的摩擦率。
图19是实施例1制备的hap@ptl涂层杂化材料的细胞活性检测(cck-8测试)。
图20是实施例1制备的hap@ptl涂层杂化材料的细胞活性检测(alp测试)。
图21是实施例1制备的hap@ptl涂层杂化材料表面的细胞形貌。
图22是实施例1制备的hap@ptl涂层杂化材料的组织甲苯胺蓝染色。
图23是实施例1制备的hap@ptl涂层杂化材料的组织苏木精-伊红染色。
具体实施方式
下面结合附图和实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。
实施例1
将0.1433g三(2-羧乙基)膦加入10ml10mmol/lph值为7.4的三羟甲基氨基甲烷缓冲溶液中,用naoh调节ph值至5.8,配制成50mmol/l的三(2-羧乙基)膦的三羟甲基氨基甲烷缓冲溶液;将20mg溶菌酶加入10ml10mmol/lph值为7.4的三羟甲基氨基甲烷缓冲溶液中,配制成2mg/ml的溶菌酶的三羟甲基氨基甲烷缓冲溶液;将0.2ml50mmol/l的三(2-羧乙基)膦的三羟甲基氨基甲烷缓冲溶液与0.2ml2mg/ml的溶菌酶的三羟甲基氨基甲烷缓冲溶液混合均匀,将直径为1cm的钛片与混合液表面接触,室温静置50分钟,在钛片表面粘附一层溶菌酶二维纳米薄膜(ptl),其厚度约为50nm。将表面粘附溶菌酶二维纳米薄膜的钛片完全浸入0.02mol/l的氯化钙水溶液中,常温浸泡48小时,且每隔12小时更换一次氯化钙水溶液,用以螯合钙离子。将溶菌酶二维纳米薄膜表面螯合钙离子(ptl-ca2+)的钛片用超纯水清洗后用氮气吹干,再将其完全浸入模拟体液中,在密闭条件下70℃孵化7天,用超纯水清洗后常温真空干燥30分钟,得到hap@ptl涂层杂化材料。
发明人采用x-射线衍射仪、红外光谱仪、拉曼光谱仪、扫描电镜以及能谱仪、透射电镜对所得样品进行表征,结果见1~7。由图1的x射线衍射分析证明,在溶菌酶二维纳米薄膜表面生长的晶体为羟基磷灰石而不是其他磷酸钙。在图2的红外光谱中,溶菌酶二维纳米薄膜的酰胺键出现在1530和1675cm-1,hap@ptl涂层杂化材料在566、602和1033cm-1处出现了新峰,主要是o-p-o键弯曲振动。在图3的拉曼光谱中,对比于原始的ptl出现了一些新的峰,主要是在430cm-1处的p-o键、593cm-1处的o-p-o键弯曲振动和962cm-1处的p-o伸缩振动,962cm-1处的峰是hap结晶最具有代表性的标志。图4的能谱数据也证明了由溶菌酶二维纳米薄膜诱导的hap的ca/p比为1.66与天然骨成分相近。由图5~7可见,在钛片表面形成一层均匀且致密的羟基磷灰石晶体,羟基磷灰石聚集体是由针状的纳米晶体簇沿轴向排列构成的,这种垂直排列的羟基磷灰石结构类似于天然的骨与牙齿的羟基磷灰石的形貌,电子衍射也证实了纳米羟基磷灰石具有典型的(200)、(002)、(211)、(300)晶面,其中第(002)晶面表明溶菌酶二维纳米薄膜诱导的羟基磷灰石晶体主要沿c轴定向生长。上述表征结果证明由溶菌酶二维纳米薄膜诱导矿化的羟基磷灰石的成分及结构与天然骨组织相似。
实施例2
本实施例中,将实施例1的钛片用zro2替换,其他步骤与实施例1相同,得到hap@ptl涂层杂化材料(见图8)。
实施例3
本实施例中,将实施例1的钛片用医用导管替换,其他步骤与实施例1相同,得到hap@ptl涂层杂化材料(见图9)。
实施例4
本实施例中,将实施例1的钛片用牙齿替换,其他步骤与实施例1相同,得到hap@ptl涂层杂化材料(见图10)。
实施例5
本实施例中,将实施例1的钛片用聚四氟乙烯替换,其他步骤与实施例1相同,得到hap@ptl涂层杂化材料(见图11)。
实施例6
本实施例中,将实施例1的钛片用木头替换,其他步骤与实施例1相同,得到hap@ptl涂层杂化材料(见图12)。
实施例7
本实施例中,将实施例1的钛片用布替换,其他步骤与实施例1相同,得到hap@ptl涂层杂化材料(见图13)。
实施例8
将0.1433g三(2-羧乙基)膦加入10ml10mmol/lph值为7.4的三羟甲基氨基甲烷缓冲溶液中,用naoh调节ph值至9.0,配制成50mmol/l的三(2-羧乙基)膦的三羟甲基氨基甲烷缓冲溶液;将20mg溶菌酶加入4ml10mmol/lph值为7.4的三羟甲基氨基甲烷缓冲溶液中,配制成5mg/ml的溶菌酶的三羟甲基氨基甲烷缓冲溶液;将0.2ml50mmol/l的三(2-羧乙基)膦的三羟甲基氨基甲烷缓冲溶液与0.2ml5mg/ml的溶菌酶的三羟甲基氨基甲烷缓冲溶液混合均匀,将所得混合液滴加到钛片表面,在潮湿环境中室温培养2小时,然后将金片浸入超纯水中,振荡清洗干净,室温真空干燥1小时,得到负载溶菌酶相转变产物的金片。将负载溶菌酶相转变产物的金片完全浸入0.02mol/l的氯化钙水溶液中,常温浸泡48小时,且每隔12小时更换一次氯化钙水溶液,用以螯合钙离子。将螯合钙离子的金片用超纯水清洗后用氮气吹干,再将其完全浸入模拟体液中,在密闭条件下70℃孵化7天,用超纯水清洗后常温真空干燥30分钟,得到hap@ptl涂层杂化材料(见图14)。
实施例9
本实施例中,将实施例8的金片用硅片替换,其他步骤与实施例8相同,得到hap@ptl涂层杂化材料(见图15)。
实施例10
本实施例中,将实施例8的金片用聚丙烯替换,其他步骤与实施例8相同,得到hap@ptl涂层杂化材料(见图16)。
实施例11
本实施例中,将实施例8的金片用碳纤维替换,其他步骤与实施例8相同,得到hap@ptl涂层杂化材料(见图17)。
为了证明本发明的有益效果,发明人对实施例1制备的hap@ptl涂层杂化材料进行了机械性能和生物学评价,具体试验如下:
1、机械性能测试
使用布鲁克公司的umt-5摩擦试验机在不同摩擦环境下测试hap@ptl涂层杂化材料、表面旋涂有hap的钛片的摩擦损伤,所用载荷f=10n-25n,等效于实际的骨接触压力是0.25-0.8mpa;主轴转速:70r/min,实验温度:t=36.5℃;测试环境:干摩擦和模拟体液sbf。采用磨损率比较材料的磨损程度,其中磨损率定义为单位行程的磨损体积,其计算公式如下所示:
式中w(mm3/m)为涂层体积磨损率,s(m)为磨损行程,m(mg)为磨损质量,ρ为涂层的密度,ρ=3.16mg/mm3。由图18可见,不论是在干摩擦下还是sbf润滑的条件下,在hap@ptl涂层杂化材料的磨损率比表面旋涂有hap的钛片都降低了约10倍。说明在两种摩擦条件下,hap@ptl涂层杂化材料的耐磨性能明显提高。
2、生物学评价
(1)cck-8测试
将hap@ptl涂层杂化材料、ptl、空白钛片依次进行紫外线照射和体积分数为70%的乙醇水溶液浸泡2小时灭菌,随后用ph=7.4的pbs缓冲溶液反复冲洗,去除表面残留的乙醇。将灭菌后的样品置于24孔培养板中,在骨髓间充质干细胞培养基溶液中培养24小时,然后将骨髓间充质干细胞以1×104个/cm2的密度接种于24孔培养板中,在37℃、5%co2的细胞培养箱内培养,用dmem培养液作为对照,每两天换一次培养液。在培养1、3、5、7天时,分别在24孔板的各孔中加入100μl新的dmem培养液和10μlcck-8溶液,然后在37℃、5%co2的细胞培养箱内培养4小时。之后轻轻吸出培养液,振荡均匀后,直接用分光光度法在酶标仪上(bio-rad680,美国)测定490nm处培养液的吸光度。所有的样品重复测定3次,结果取平均值。由图19可见,培养1天后,三种材料上的细胞光密度值没有明显变化,并且三种材料之间的od值也没有显著差异。随着培养时间延长,三种材料上的细胞密度值也不断增加,在第3天,三种材料之间的增殖能力也没有显著性差异,但在第5天和第7天,虽然三种材料表面的细胞光密度值对比于第1天都有很显著的提高,但是其中hap@ptl涂层杂化材料表面的细胞光密度值明显高于空白钛片的细胞od值。说明相转变溶菌酶表面诱导矿化的羟基磷灰石涂层对细胞增殖起着决定性作用。
(2)碱性磷酸酶测
用0.25%胰蛋白酶液将骨髓间充质干细胞从培养基上消化,离心分离,去除上清液,加入dmem培养液。骨髓间充质干细胞以1×105个/cm2的密度接种于96孔培养板中,将上述试验(1)中灭菌后的样品放入96孔板中加入500μldmem培养液,在37℃、5%co2的细胞培养箱内培养,隔天更换一次培养液。当样品在成骨诱导培养基中分别培养第3、7、14、21天时,将样品分别从培养板中取出,用ph=7.4的pbs缓冲液清洗三次后,加入200μl细胞裂解液(10mmtris-hcl,2mmnacl和1%tritonx-100,ph7.5),4℃裂解12小时。然后分别从每个孔板中收集30μl上清液加入到ph=10的硼酸盐缓冲液中,之后加入50μlpnpp溶液,37℃水浴加热反应15分钟后,加入150μl0.1mol/lnaoh水溶液终止反应。随即用紫外-可见光分光光度计测定520nm处的吸光值。使用bca试剂盒归一化碱性磷酸酶(alp)的活性。所有的样品重复测定3次,结果取平均值。由图20可见,骨髓间充质干细胞经定向诱导后,三种材料表面上骨髓间充质干细胞的alp活性随着时间的延长都在不断的增加。培养7天和14天后,hap@ptl涂层杂化材料表面的细胞alp活性均显著地高于ptl和空白钛片的alp活性,显著性差异明显(p<0.05)。说明本发明基于相转变溶菌酶为模板诱导矿化的羟基磷灰石涂层有利于成骨细胞和其前体细胞的黏附、增殖和分化,alp活性表达也显著增高。
(3)细胞形态的观察
分别在上述试验(1)中灭菌后的hap@ptl涂层杂化材料表面培养骨髓间充质干细胞,接种密度为5000个/cm2。在检测细胞伸展和粘附时,采用罗丹明标记的鬼笔环肽对细胞骨架进行染色,采用hochest33258对细胞核进行染色,然后采用激光共聚焦显微镜观察培养5天后的细胞在样品表面的粘附和伸展情况。由图21可见,hap@ptl涂层杂化材料表面的骨髓间充质干细胞数量明显增多,且细胞的丝状伪足也有明显增多,并且骨髓间充质干细胞之间相互连成片状。说明hap@ptl涂层杂化材料可以更好的支持骨髓间充质干细胞的体外培养,且细胞相容性良好,更能促进成骨细胞的增殖分化。
(4)hap@ptl涂层杂化材料的皮下植入
将灭菌后的hap@ptl涂层杂化材料在骨髓间充质干细胞的培养液中培养7天后移植于大鼠的背部皮下植入区,植入8周后,将连有周围组织的样品取出,并浸泡在4%的福尔马林溶液中过夜。最后,用组织切片机将取出的组织样品进行硬组织切片。将硬组织切片进行甲苯胺蓝染色、苏木精-伊红染色后,于光学显微镜下进行观察并拍照。由图22~23可见,皮下植入8周后,hap@ptl涂层杂化材料呈现出良好的组织再生能力。并且,hap@ptl涂层杂化材料在宿主边缘处有大量的新骨以及纤维组织形成,且新骨与宿主骨形态相相近。结合两种染色发现,植入hap@ptl涂层杂化材料有明显的新生骨质染色,表明术后8周骨组织中的胶原成熟程度以及新生骨的能力有显著地提高。说明hap@ptl涂层杂化材料能很好的促进成骨细胞增殖分化,并进一步实现骨缺损的修复。
- 还没有人留言评论。精彩留言会获得点赞!
- 具有多级缓控释效果的羟基磷灰石载药微球的制备方法与流程
- 一种羟基磷灰石包覆PRB填充材料及其制备方法和地下水除铀应用方法与制造工艺
- 25‑羟基维生素D荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 25‑羟基维生素D3荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 壳聚糖/羟基磷灰石复合纤维的制备方法与制造工艺
- 一种羟基磷灰石‑碳纳米管复合生物陶瓷的制备方法与制造工艺
- 羟基磷灰石‑碳纳米管复合生物陶瓷的制备方法与制造工艺
- 羟基磷灰石吸附特性对水中钴离子的富集检测方法与制造工艺
- 以羟基磷灰石晶须增强可降解共聚物‑硅酸钙复合骨修复材料为原料的骨修复用制品的制造方法与工艺
- 一种胶原蛋白/羟基磷灰石复合人工骨及其制备方法与制造工艺