一种稳定的盐酸帕罗西汀片剂及其制备方法与流程
本发明属于医药
技术领域:
,涉及一种稳定的盐酸帕罗西汀片剂及其制备方法。
背景技术:
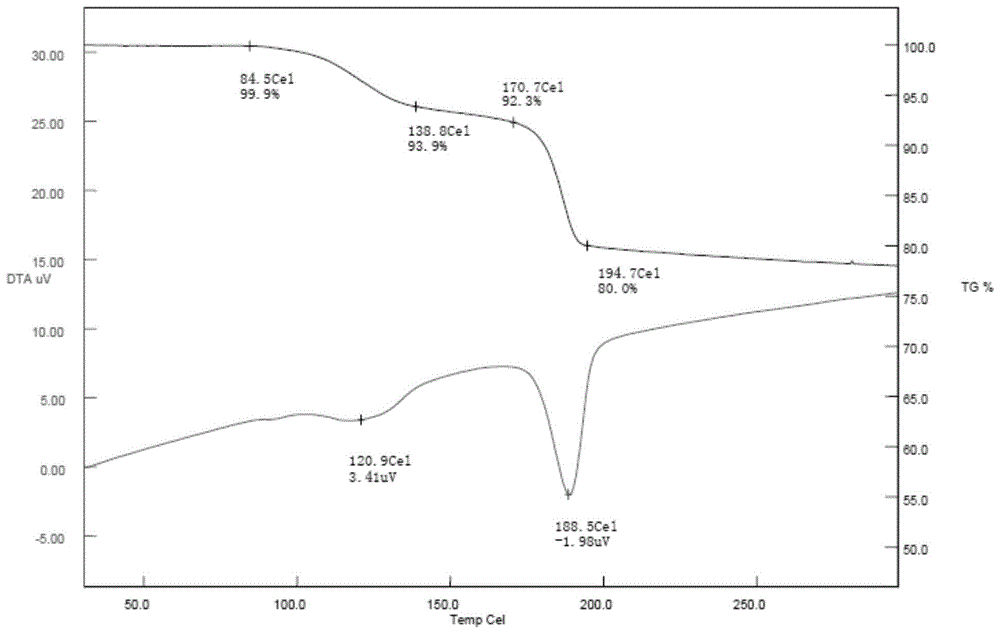
:盐酸帕罗西汀片是20世纪90年代上市的一种治疗抑郁症的药物,目前已有多家企业生产和销售,在全球范围内广泛使用,给患者带来了良好收益。盐酸帕罗西汀化学名:(一)-(3S,4R)-4-(4-氟苯基)-3-[[(3,4-亚甲二氧基)苯氧基]甲基]哌啶盐酸盐半水化合物,其结构式如下:分子式:分子量:374.84盐酸帕罗西汀含有芳醚和仲氨结构,受湿度和温度的影响较大。其盐酸盐形式较稳定,碱性环境中稳定性变差,在湿热条件下会降解,使产品显红色。最早在美国专利4,007,196中指出盐酸帕罗西汀的结构具有抗抑郁活性。美国Glaxosmithkline公司将其开发为口服片剂和混悬液并于1992年在美国首先上市。同时在FDA批准的Label中公布了该产品的处方组成为:盐酸帕罗西汀,二水磷酸氢钙,羟丙甲纤维素,硬脂酸镁,羧甲基淀粉钠等。专利WO95/16448中指出本品在加工过程中经常看到不希望的粉色变化。并在专利中公开了盐酸帕罗西汀片剂干法制粒的制备方法,通过干法制粒有效降低了产品变红的几率。专利中的辅料组成包括:磷酸氢钙,微晶纤维素,羟基乙酸淀粉钠和硬脂酸镁等。国内专利CN102525966A公开了一种采用湿法制粒制备盐酸帕罗西汀片剂的方法,辅料为微晶纤维素,山梨醇等多种药学上常用辅料;CN103520131A公布了一种盐酸帕罗西汀半水合物胶囊的制备方法,辅料中填充剂选择为无水磷酸氢钙及二水磷酸氢钙,工艺为混合后直接填充。采用近中性的磷酸氢钙作为辅料可以使盐酸帕罗西汀产品更稳定,这一点在申请人的试验中已经证实,并且使用磷酸氢钙的产品的稳定性明显优于使用微晶纤维素、乳糖等填充剂产品的稳定性,而使用二水磷酸氢钙的稳定性更优于无水磷酸氢钙。尽管如此,在研究中发现该产品还存在两个问题:一是在湿法制粒工艺下,仍然不可避免产品变红的现象;二是二水磷酸氢钙为最稳定的辅料选择,但其结构中含有两个结晶水,在环境温度高于38℃时,二水磷酸氢钙将缓慢失去结晶水,温度持续升高,同时在一定湿度下二水磷酸氢钙会快速转化为无水磷酸氢钙,从而释放出结晶水,如图1~4磷酸氢钙和失水后磷酸氢钙的TG/DTA图谱和XRPD图谱所示。当使用二水磷酸氢钙为主要填充剂的产品遇到短暂高温时,释放出的结晶水被保留在产品包装内,被产品中的崩解剂吸收从而膨胀,最终导致产品膨胀失去应有外观和机械强度,影响产品的流通和使用。技术实现要素:本发明提出一种稳定的盐酸帕罗西汀片剂及其制备方法,解决了湿法制粒工艺过程中盐酸帕罗西汀产品变红、以及以二水磷酸钙为主要填充剂时盐酸帕罗西汀片在高温下硬度变差的问题。本发明的技术方案是这样实现的:一种稳定的盐酸帕罗西汀片剂,包括以下重量份的组分:盐酸帕罗西汀7.6份,填充剂67.4~81.9份,粘合剂2~5份,稳定剂3~10份,崩解剂5~7份,润滑剂0.5~3份。作为进一步的技术方案,包括以下重量份的组分组成:盐酸帕罗西汀7.6份,填充剂74.4份,粘合剂3份,稳定剂8份,崩解剂6份,润滑剂1份。作为进一步的技术方案,所述稳定剂为蔗糖。作为进一步的技术方案,所述填充剂为二水磷酸氢钙,所述二水磷酸氢钙为细粉,粒径D90在10~20um。作为进一步的技术方案,所述粘合剂为聚维酮K30。作为进一步的技术方案,所述崩解剂为羧甲基淀粉钠。作为进一步的技术方案,所述润滑剂为硬脂酸镁。作为进一步的技术方案,该盐酸帕罗西汀片剂为薄膜衣片,衣膜材料为欧巴代系列包衣粉。一种稳定的盐酸帕罗西汀片剂的制备方法,采用湿法制粒工艺。作为进一步的技术方案,所述湿法制粒工艺中,润湿剂为纯化水或聚维酮K30的水溶液。本发明使用原理及有益效果为:众所周知,蔗糖在药剂中是常见的矫味剂,而本发明中加入的蔗糖与配方中其它组分配伍,不仅能够有效抑制湿法制粒过程中产品变红的现象,而且使得制备的盐酸帕罗西汀片剂更稳定,起到了意料不到的效果。本发明中,采用二水磷酸氢钙为填充剂、羧甲基淀粉钠为崩解剂、蔗糖为稳定剂、聚维酮K30为粘合剂、硬脂酸镁为润滑剂,各组分相互配合,制备的盐酸帕罗西汀片剂崩解迅速,溶出完全,稳定性好,与已上市产品相比,本发明制备的盐酸帕罗西汀片剂更能够适应苛刻的运输和贮存条件,以及我国多气候带分布的特点,因此,适合推广使用。本发明中,蔗糖的加入,一方面,能够抑制湿法制粒过程中产品变红的现象,另一方面,蔗糖和聚维酮K30配伍,使得制备的盐酸帕罗西汀片剂在温度40℃±2℃,相对湿度75%条件下放置6个月的变化更小、更稳定,能有效解决盐酸帕罗西汀片剂硬度变化的问题。本发明中,盐酸帕罗西汀片剂采用湿法制粒,采用纯化水作为润湿剂,制备过程中粉尘污染低,对环境影响小,适合工业化生产。附图说明下面结合附图和具体实施方式对本发明作进一步详细的说明。图1为磷酸氢钙(粗粉)TG/DTA图谱;图2为磷酸氢钙(细粉)TG/DTA图谱;图3为磷酸氢钙的XRPD图谱;图4为失水后磷酸氢钙的XRPD图谱;图5为本发明实施例4制备的盐酸帕罗西汀片剂的XRPD图谱;具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例1一种稳定的盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙245.7g,聚维酮K3015g,蔗糖9g,羧甲基淀粉钠18g,硬脂酸镁1.5g,欧巴代9g,其制备方法,采用湿法制粒工艺,润湿剂为纯化水,具体包括以下步骤:S1、按照上述的配方,称取各个组分备用;S2、将盐酸帕罗西汀与配方中其它组分混合均匀;S3、加入润湿剂,继续制粒;S4、将制得的湿颗粒干燥,压片;S5、将片芯包衣,得到一种稳定的盐酸帕罗西汀片剂。实施例2一种稳定的盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙241.2g,聚维酮K3015g,蔗糖15g,羧甲基淀粉钠18g,硬脂酸镁3g,欧巴代9g,其制备方法采用湿法制粒工艺,润湿剂为聚维酮K30的水溶液,具体步骤同实施例1。实施例3一种稳定的盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙229.2g,聚维酮K309g,蔗糖18g,羧甲基淀粉钠18g,硬脂酸镁3g,欧巴代9g,其制备方法采用湿法制粒工艺,润湿剂为纯化水,具体步骤同实施例1。实施例4一种稳定的盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙223.2g,聚维酮K309g,蔗糖24g,羧甲基淀粉钠18g,硬脂酸镁3g,欧巴代9g,其制备方法采用湿法制粒工艺,润湿剂为聚维酮K30的水溶液,具体步骤同实施例1。实施例5一种稳定的盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙211.2g,聚维酮K3015g,蔗糖30g,羧甲基淀粉钠18g,硬脂酸镁9g,欧巴代6g,其制备方法采用湿法制粒工艺,润湿剂为纯化水,具体步骤同实施例1。实施例6一种稳定的盐酸帕罗西汀片剂,每1000片包括以下重量的组分::盐酸帕罗西汀22.8g,二水磷酸氢钙226.2g,聚维酮K309g,蔗糖24g,羧甲基淀粉钠15g,硬脂酸镁4.5g,欧巴代12g,其制备方法采用湿法制粒工艺,润湿剂为纯化水,具体步骤同实施例1。实施例7一种稳定的盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙220.2g,聚维酮K309g,蔗糖24g,羧甲基淀粉钠21g,硬脂酸镁6g,欧巴代9g,其制备方法采用湿法制粒工艺,润湿剂为聚维酮K30的水溶液,具体步骤同实施例1。实施例8一种稳定的盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙217.2g,聚维酮K306g,蔗糖24g,羧甲基淀粉钠18g,硬脂酸镁3g,欧巴代9g,其制备方法采用湿法制粒工艺,润湿剂为聚维酮K30的水溶液,具体步骤同实施例1。实施例1~8配方中各组分重量份数如下表所示:表1实施例1~8配方中各组分重量(单位:g)实施例1~8制备的盐酸帕罗西汀片剂的性能如下表所示:表2实施例1~8制备的盐酸帕罗西汀片剂的性能通过表2数据可以看出,盐酸帕罗西汀片颗粒中蔗糖用量从6%~10%、聚维酮K30用量从2%~5%、崩解剂用量从5%~7%时,流动性无明显差异,且流动性均较好,Hausner比均小于1.2,说明在本发明配方的用量范围内,制备的盐酸帕罗西汀片剂性能均较好。对比例1一种盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙235.2g,聚维酮K3015g,羧甲基淀粉钠24g,硬脂酸镁3g,欧巴代9g。其制备方法同实施例1。对比例2一种盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙247.2g,聚维酮K309g,羧甲基淀粉钠18g,硬脂酸镁3g,欧巴代9g。其制备方法同实施例1。对比例3一种盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙241.2g,聚维酮K309g,羧甲基淀粉钠24g,硬脂酸镁3g,欧巴代9g。其制备方法同实施例1。对比例4一种盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙247.2g,蔗糖9g,羧甲基淀粉钠18g,硬脂酸镁3g,欧巴代9g。其制备方法同实施例1。对比例5一种盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙241.2g,蔗糖15g,羧甲基淀粉钠18g,硬脂酸镁3g,欧巴代9g。其制备方法同实施例1。对比例6一种盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙232.2g,蔗糖24g,羧甲基淀粉钠18g,硬脂酸镁3g,欧巴代9g。其制备方法同实施例1。对比例7一种盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙220.2g,蔗糖30g,羧甲基淀粉钠24g,硬脂酸镁3g,欧巴代9g。其制备方法同实施例1。对比例8一种盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙226.2g,蔗糖30g,羧甲基淀粉钠18g,硬脂酸镁3g,欧巴代9g。其制备方法同实施例1。对比例9一种盐酸帕罗西汀片剂,每1000片包括以下重量的组分:盐酸帕罗西汀22.8g,二水磷酸氢钙235.2g,聚维酮K3015g,蔗糖6g,羧甲基淀粉钠18g,硬脂酸镁3g,欧巴代9g。对比例1~9配方中各组分重量份数如下表所示:表3对比例1~9配方中各组分重量(单位:g)注:—表示无此项对实施例1~4及对比例1~8制备的盐酸帕罗西汀片剂进行硬度、崩解时限测试,测试结果见下表:表4实施例1~4及对比例1~8的盐酸帕罗西汀片剂硬度、崩解时限测试结果通过表4中数据可知,与对比例1~8相比,本发明实施例1~4制备的盐酸帕罗西汀片在存放30天后性能更稳定,能有效避免盐酸帕罗西汀片剂硬度变差的问题。对比例1~3配方中少了蔗糖,对比例5~8配方中少了聚维酮K30,说明蔗糖和聚维酮K30配合使用,使得制备的盐酸帕罗西汀片剂更稳定。选取实施例1~5、对比例1及对比例9制备过程中得到的湿颗粒密封置于60℃烘箱中,观察颜色变化,结果见下表:表5实施例1~5、对比例1及对比例9制备过程中得到的湿颗粒颜色变化结果通过表5中数据可知,与对比例1、对比例9相比,本发明实施例1~5制备过程中得到的湿颗粒开始变红时间明显延长,在不加蔗糖和蔗糖用量为2%时产品变红时间相同,而蔗糖用量从3%到10%时产品变红现象明显得到抑制,说明蔗糖的加入且蔗糖用量为3%~10%时能够有效抑制产品的变红现象。当蔗糖用量超过10%时,随着蔗糖用量的增加,产品变红现象虽然得到抑制,但是产品的崩解时限延长,因此,蔗糖用量3%~10%是优选方案。以本发明实施例4制备的盐酸帕罗西汀片剂为实验组,以美国上市的参比制剂“PAXIL”为对照组,根据2015版药典二部附录XIXC原料药与药物制剂稳定性试验指导原则,对实验组和对照组的片剂进行了加速实验,在温度40℃±2℃,相对湿度75%条件下放置6个月,实验结果如下表:表6实验组和对照组的片剂加速实验结果组别0天加速1月加速2月加速3月加速6月实验组/N11012311610498对照组/N9786665343通过表6中数据可知,与对照组相比,本发明实施例制备的盐酸帕罗西汀片剂在温度40℃±2℃,相对湿度75%条件下放置6个月变化更小,因此本发明实施例制备的盐酸帕罗西汀片剂更稳定。实施例4制备的盐酸帕罗西汀片剂检验报告如表12所示,其它实施例也进行了检验,检验报告结果与实施例4几乎无差别,故省略。表7实施例4制备的盐酸帕罗西汀片剂检验报告图5为本发明实施例4制备的盐酸帕罗西汀片剂的XRPD图谱,实施例1~3、5~8也进行了XRPD检测,测试图谱与实施例4几乎无差别,故省略实施例1~3、5~8的XRPD图谱。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1