一种用于培养和/或扩增间充质干细胞的培养基及其培养方法与流程
本发明属于生物医学领域,具体涉及一种培养和/或扩增间充质干细胞的培养基及其培养方法。
背景技术:
干细胞作为形成机体各种组织器官的始祖细胞,在特定条件下具有自我复制和多向分化能力,因此干细胞研究具有为大量严重疾患和损伤带来新型治疗方法的无限潜力。某些基于干细胞的治疗,如造血干细胞移植治疗白血病以及上皮干细胞治疗烧伤和角膜疾病,已有成型的临床标准。近年来,干细胞研究的进展已大大拓展了干细胞治疗的应用范围。截至2010年10月18日,在美国国立卫生研究院正式登记的干细胞治疗临床试验有3248项。基于成人干细胞的治疗方案已被广泛应用于超过73种疾病,包括1400项FDA批准的临床试验,其中涉及神经系统的疾病包括但不限于:遗传性疾病、神经细胞瘤、帕金森病、脑瘫、肌萎缩性侧索硬化症和脊髓损伤。干细胞移植疗法改变了传统神经修复的观念,已成为治疗难治性疾病的一种新策略。间充质干细胞(mesenchymalstemcells,MSCs)是干细胞研究的一个重要分支,最先在骨髓中被发现,因此被统称为骨髓间充质干细胞(bonemarrowmesenchymalstemcells,BMSCs),后来相继在脐带等多种结缔组织和器官间质中被发现。间充质干细胞具有强大的增殖能力和多向分化潜能,在一定诱导条件下具有向成骨细胞、成软骨细胞、成肌细胞、肌腱细胞、脂肪细胞及基质细胞等中胚层细胞分化的能力,同时还可以向外胚层的神经元细胞和内胚层的肝卵圆细胞分化。已有多项研究表明,把MSCs植入体内,可向多种造血组织以外的组织,如肺、骨、软骨和皮肤等处定位并分化为相应的组织细胞。此外,间充质干细胞具有免疫调节及免疫重建功能,并且来源方便,易于分离、培养、扩增和纯化,经多次传代扩增后仍具有干细胞特性,不存在免疫排斥。因此,MSCs可能成为细胞移植和基因治疗的理想材料,目前国内外正在探索将其用于神经系统疾病及多领域多学科难治性疾病的治疗,并已取得了重大突破性进展。我国MSCs的研究发展较为迅速,某些核心技术已占国际领先地位,呈现令人鼓舞的临床应用前景。MSCs在骨髓移植中有着极其重要的应用价值,一方面在骨髓微环境中支持造血;另一方面,对移植免疫有一定的影响,能够在某些方面减轻移植物抗宿主效应。此外,MSCs与其他来源的干细胞相比具有以下优势:①获取方便,可从患者本人骨髓等取材;②可在体外快速培养扩增,定向诱导分化为神经元、星形胶质细胞、少突胶质细胞;③理论上,致瘤风险很低,安全性高,避免异体骨髓可能带来的感染、肿瘤和遗传性疾病;④具有低免疫源性和免疫调理的特点,避开了免疫排斥的难题;⑤避免了胚胎干细胞带来的伦理问题。因此,MSCs及其衍生物成为当今临床移植治疗难治性神经系统疾病主要选择的细胞种类。但是,关于MSCs的研究还存在着急需解决的共性问题,主要是:①MSCs的分离问题,由于人体骨髓中的MSCs很少,分离提取的方法极为重要,目前虽已在Friedenstein方法基础上不断改进,但仍不理想;②细胞培养问题,培养基与培养方法涉及到反复传代及多向分化性能的保持及BMSCs的纯度;③定向分化及其功能问题,经诱导因子在体外定向分化为神经元,移植后能否产生突触联系,能否分泌相应的递质,即神经元的功能是临床效果的关键问题;④安全问题,如致癌性及载体的安全性。目前广泛应用的人MSCs培养体系多采用胎牛血清,残存的胎牛血清本身可能引起严重的免疫反应。在体外培养过程中,细胞的吞噬作用使牛血清中的蛋白分子细胞内在化,即使通过洗涤也不能清除牛血浆蛋白。在正常条件下获得108个MSCs大约会携带7~30mg胎牛血浆蛋白,多次输注时存在并发血清病的危险,严重干扰治疗效果及其评估。因此,建立一种无异种蛋白、高效的人MSCs培养体系,是开展相关细胞治疗必需的基础。许多研究者采用无血清培养方法,但是MSCs在无血清条件下增殖缓慢,周期较长,大约40到45天左右,并且存在分化能力减弱的问题,应用细胞因子的费用非常高昂,不能从根本上解决异种蛋白内在化问题。目前已经报道的采用人体自体血浆或血清或如血小板裂解物来解决这一问题的研究。例如,在中国专利申请CN101760445A中公开了一种采用低浓度自体血清培养骨髓间充质干细胞的方法,但是培养基中还需要添加诸如胰岛素、转铁蛋白、白蛋白等多种细胞生长因子和蛋白成分,导致成本增加且操作繁琐。因此,还有待进一步开发间充质干细胞的培养方法。
技术实现要素:
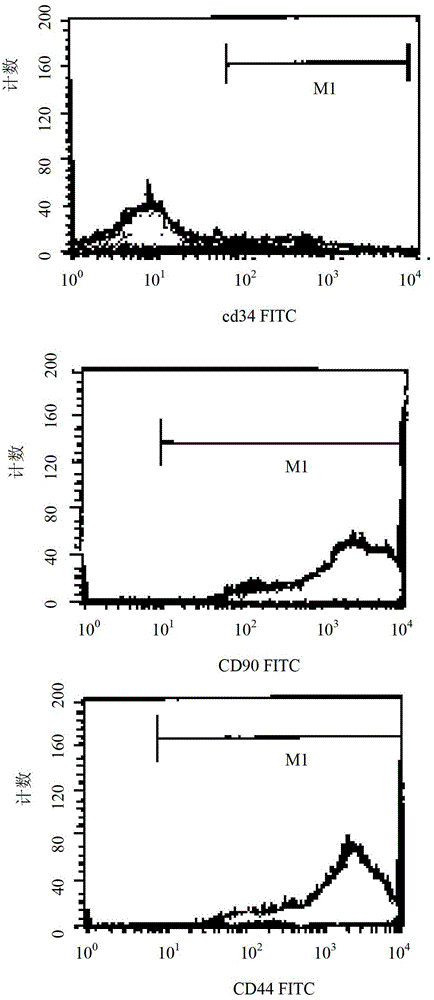
因此,本发明的目的是提供一种用于培养和/或扩增间充质干细胞的培养基。本发明的另一个目的是提供一种培养和/或扩增间充质干细胞的方法。发明的目的是通过以下技术方案来实现的。一方面,本发明提供一种用于培养和/或扩增间充质干细胞的培养基,所述培养基为在基础细胞培养基中添加了以下成分:体积百分比为2~5%的骨髓血浆。优选地,所述基础培养基中包括以下成分:氨基酸、维生素、无机盐和其他成分。优选地,所述氨基酸选自甘氨酸、丙氨酸、谷氨酰胺、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸及其盐、谷氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸中的一种或多种。优选地,所述维生素选自维生素B1、维生素B2、维生素B6、维生素B12、维生素H、氯化胆碱、泛酸钙、叶酸、烟酰胺和肌醇中的一种或多种。优选地,所述无机盐选自氯化钙、硫酸铜、硝酸铁、硫酸铁、氯化镁、硫酸镁、氯化钾、碳酸氢钠、氯化钠、碳酸氢钠、氯化钠、磷酸氢二钠、磷酸二氢钠和硫酸锌中的一种或多种。优选地,所述其他成分选自葡萄糖、次黄嘌呤、亚油酸、硫辛酸、四甲烯二胺、丙酮酸钠、植物血球凝集素中的一种或多种。优选地,所述骨髓血浆与待培养和/或扩增的间充质干细胞来源于同种哺乳动物,例如人。优选地,所述骨髓血浆与待培养和/或扩增的间充质干细胞来源于同一哺乳动物个体,例如同一人体。优选地,所述血浆通过以下方法制备:采集骨髓20~30ml,肝素抗凝,于20~26℃,1025~1450g下,离心15~20min,吸取上清,过滤,即得。此外,本发明还提供了上述培养基在培养和/或扩增间充质干细胞中的应用。另一方面,本发明提供一种培养和/或扩增间充质干细胞的方法,所述方法采用上述培养基培养和/或扩增间充质干细胞。优选地,所述方法包括以下步骤:将间充质干细胞接种于上述培养基中,于37℃、100%饱和湿度下的5%CO2培养箱中进行培养。本发明还提供了通过上述方法培养和/或扩增的间充质干细胞。本发明还提供了上述培养和/或扩增的间充质干细胞在制备用于再生和/或修复受损的肺、骨、软骨、皮肤、肝脏、肾脏的组合物中的应用。此外,发明还提供了一种成骨样和/或成肝样细胞的制备方法,所述方法包括将上述的间充质干细胞分化成骨样细胞和/或成肝样细胞。可见,本发明提供一种半骨髓法体外培养骨髓间充质干细胞的方法,半骨髓法的命名是相对于全骨髓法体外培养骨髓间充质干细胞,即取部分骨髓成分作为培养基的营养成分的方法。本发明将2~5%的骨髓血浆添加到特制基础细胞培养液中,以半骨髓法培养骨髓间充质干细胞,其培养方法操作方便、损伤小。在本发明提供的间充质干细胞培养基中,完全采用以前在分离培养方法中废弃的骨髓血浆作为营养基质,同时采用特制的基础培养基来配合补充骨髓血浆中的成分,保留了BMSCs原来的生长环境。本发明特别优选使用自体髓血浆,由于骨髓血浆来自自体,无免疫排斥和疾病传染的潜在风险;在细胞分离过程中未用淋巴细胞分离液来分离细胞,尽量减少外源性成分的接触,并保留了部分ficoll密度梯度离心法结合贴壁法分离掉营养物质。在研究中,本发明人选择目前常用的分离培养的方法(常规胎牛血清培养)作为对照,观察本发明提供的方法的分离培养的效果,发现用2种不同的体外培养体系,获得的BMSCs均具有BMSCs的一般生物学特性:细胞为典型的成纤维细胞样,呈漩涡状贴壁生长,有黏附特性;体外扩增至5代,细胞形态不发生明显改变,培养的细胞稳定表达CD90、CD44,且结果相似。所得细胞是骨髓中一群处于未分化状态的非定向干细胞,而且不是造血干细胞、内皮祖细胞,也非纤维细胞,细胞表型一致率极高,符合目前公认的BMSCs特征。以骨髓血浆作为营养基质半骨髓法分离培养BMSCs的新方法,培养传代时间明显比常规胎牛血清培养组缩短:从原代到P5代培养时间分别为25天(骨髓血浆)、29天(胎牛血清)。而本发明新方法原代、P1代、P3代活细胞计数分别为(4.94×105、6.73×105、6.99×105),也明显高于胎牛血清组(分别为4.19×105、5.37×105、6.73×105)。由此可见,以骨髓血浆作为营养基质半骨髓法分离培养BMSCs的新方法的培养优势在于:骨髓血浆,特别是与BMSCs自体同源,保持原BMSCs的部分环境和营养成分,半骨髓法减少了淋巴细胞分离液离心分离造成的细胞数量和部分营养成分的丢失,因此其培养的各代细胞数较高、死亡率较低,利用该方法传代培养5代所获得的细胞数量基本可以满足临床治疗和相关研究需要,具有极大的临床应用价值。本发明人在研究中还观察了以骨髓血浆作为营养基质半骨髓法分离培养的BMSCs多向分化的能力(成骨样和成肝样细胞分化),之所以选择成骨样和成肝样细胞分化进行研究,除了证明生成的BMSCs有多向分化的能力外,另一方面是因为通常成骨和成肝细胞分化后移植用于临床治疗所需的细胞数量(通常成骨细胞局部移植细胞量和肝动脉移植细胞量均超过1×1010个)远远超过BMSCs进行其它分化(如成神经分化)后移植用于临床所需的细胞数(例如通常蛛网膜下腔移植1次大约为2~4×107个),而且对培养基是否含外源性蛋白的要求也更高。结果表明,本发明使用的新方法获得的BMSCs,在一定外源条件下可以向成骨样和肝样细胞方向分化,更适合于临床的需要。因此,本发明优选的实施方案是完成自体BMSCs的自体体液培养、传代,移植干细胞从分离、培养到诱导的整个体外过程,未接触任何含异体和异种动物源的成分,解决了培养基中含有异种和异体蛋白的问题,从而避免了培养后细胞移植发生血浆病、异种蛋白过敏和免疫排斥现象,更符合临床干细胞移植的需要。只需抽少量骨髓(20~30mg)即能达到治疗的目的。这种采用自体血浆和离心方法的半全髓法培养BMSCs,既能减少病人痛苦(另抽血清),又能实现无人畜共患疾病,还能避免异种蛋白的反应(胎牛血清),减少不必要的开支(刺激因子),是完全安全有效地,更加符合临床细胞移植的要求。附图说明图1为本发明实施例1中进行原代培养不同时间的BMSCs形态学观察(×40)。图2为本发明实施例1中P5代BMSCs细胞表面标志物流式细胞仪分析结果。图3为实施例2中成骨诱导后细胞形态学的变化(×100),其中A、B、C分别为诱导后第2、3、6天。图4为实施例2中成骨诱导后RT-PCR检测细胞I型胶原mRNA的表达。图5为实施例2中成骨诱导后细胞I型胶原的免疫组织化学染色(×100),其中A为诱导前,B,C:分别为诱导72h、7d,D为阴性对照。图6为实施例2中成肝细胞诱导后细胞形态学的变化(×40),其中A、B、C分别为诱导后第7、14、21天。图7为实施例2中成肝诱导后细胞糖原染色(×200),其中A为诱导后27d染色,B为阴性对照。图8为实施例2中成肝诱导后细胞AFP和ALB免疫组织化学染色(×100),其中A为诱导后3天AFP表达,C为诱导第21天ALB表达,B和D分别是AFP和ALB阴性对照。图9为实施例2中成肝诱导后RT-PCR检测细胞ALBmRNA的表达。具体实施方式以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。实施例1本实施例提供了半骨髓法体外培养骨髓间充质干细胞的方法,具体包括以下步骤:(1)人体自体血浆的制备通过无菌采集病人骨髓20~30ml,15IU/ml肝素抗凝,常温下进行1025~1450g水平离心15~20min后,去除细胞层备用,制得人体自体血浆。(2)自体BMSCs培养基的制备将步骤(1)制得的人体自体血浆以20-50ml/l的浓度加入至基础培养基中(基础培养基的具体配方如下,pH6.8±0.3,渗透压299±5%)混合。(3)BMSCs的提取和培养将步骤(1)中获得的细胞层接种于25cm2的培养瓶(含步骤(2)制备的培养基)中,置37℃、100%饱和湿度下的5%CO2培养箱,48h半量换液,72h后全量更换新鲜培养基,以后每隔3天换液1次。倒置显微镜下观察,细胞生长达80~90%融合时,用0.25%胰酶消化传代,一瓶扩增三瓶,每7天扩增传代一次,共计5代,并标记为P1~P5代。(4)培养获得的BMSCs的形态学观察倒置显微镜下观察,BMSCs分离接种24h后细胞呈半贴壁状态,偏平(图1A),48h后完全贴壁,有“出芽现象”(图1B),72h~96h后细胞呈纺锺状,有伪足生长(图1C),加入新鲜培养基后,细胞逐渐形成梭形。5~7d后由15~20个细胞融合成,逐渐形成大集落(图1D),培养7~9天细胞排列有一定的方向性,呈漩涡状排列,象成纤维细胞(图1E)。培养9~12天细胞融合90%以上,传代扩增,1瓶扩3瓶,24小时细胞完全贴壁,此时细胞增殖较旺盛,约5~7d扩增一次,共计5次,P5代90%融合时排列渐整齐(图1F)。(5)BMSCs培养传代时间原代接种后2~6天为生长潜伏期,主要为BMSCs的贴壁生长阶段,培养细胞的增殖不甚活跃;第4~7天细胞的增殖开始变得活跃起来;第6~9天细胞数目呈指数级递增,此期为对数增殖期;随后细胞生长进入平台期;传代细胞一般1~2天为生长潜伏期,3~5天后达对数生长期,5~7天左右能达到80%以上融合,细胞传代后第7天进入平台期。P1代细胞80%融合时间为4天;P2~P5代细胞80%融合时间平均为4天;从抽取骨髓到P5代细胞80%,融合时间为25天。(6)各代BMSCs活细胞计数每瓶(T25)P1代细胞80%融合BMSCs活细胞计数为4.94×105;P3代细胞80%融合BMSCs活细胞计数为6.73×105;P5代细胞80%融合BMSCs活细胞计数为6.99×105。(7)BMSCs的表面标志物测定P5代BMSCs流式细胞仪检测结果见图2。结果显示,BMSCsCD90和CD44均阳性表达,CD34阴性表达。另外,在实验中,采用常规胎牛血清培养作为对照(用含10%胎牛血清的DMEm/F12培养基,培养上述方法分离出的BMSCs),以比较以上方法的分离培养效果。结果表明,虽然获得的BMSCs具有BMSCs的一般生物学特性(与以上方法培养获得的BMSCs相似),但是,从原代到P5代培养时间更长为29天,并且P1代、P3代活细胞计数明显更低,分别为4.19×105、5.37×105、6.73×105。实施例2本实施例证实了实施例1制备的BMSCs具有多向分化能力,以将其分化为成骨样细胞和成肝样细胞为例。1.BMSCs成骨诱导的鉴定:BMSCs按1.5×105细胞/mL接种于6孔培养板(内铺有100mg/mL多聚赖氨酸预处理的盖玻片),加入含骨髓血浆的天澄1号培养基,观察细胞融合80~90%后,吸去培养基。加条件培养基(步骤(2)的基础培养基加入10nmol/L地塞米松、10mmol/Lβ-甘油磷酸钠、50μmol/L维生素C),置37℃、饱和湿度的5%CO2培养箱诱导培养,每3d换液1次。(1)诱导后的形态学观察倒置显微镜下培养72h后细胞经矿化后由单一的纤维状变成立方形三角形多边形,体积增大,在诱导剂(10nmol/L地塞米松、10mmol/Lβ-甘油磷酸钠、50μmol/L维生素C)的作用下细胞表面分泌出颗粒状物质,增殖细胞之间界限模糊,局部细胞可呈复层生长与成骨细胞有相似的形态和生长特点,最终有骨结节形成。而未诱导细胞仍为成纤维细胞样,细胞密度增加,局部有重叠交错,后生长抑制脱落(图3)。(2)RT-PCR方法检测诱导后细胞Ⅰ型胶原蛋白的表达结果结果见图4,图像结果分析表明,BMSCs的I型胶原mRNA的表达很弱,成骨细胞定向诱导后,I型胶原mRNA的表达明显增强,其中marker为50bp-500bp,第1道、第2道为诱导前,第3道为诱导后72h。(3)BMSCs诱导前后的Ⅰ型胶原免疫组化染色观察倒置显微镜下观察,诱导前P5代的BMSCs的I型胶原在细胞中的表达很弱(图5A),成骨细胞定向诱导后,表达明显增强,细胞外基质可见大量条带状棕褐色着色(图5B,5C为诱导72h、7d),阴性对照组细胞(P3,未加诱导剂)基本无阳性反应(图5D)。(4)诱导前后细胞碱性磷酸酶(ALP)的活性诱导前P5代的MSCs的碱性磷酸酶活性很低为平均2.37×10-4U/gprot,成骨细胞定向诱导后,碱性磷酸酶活性明显增强,达到8.53×10-3U/gprot,两者相差了36倍。2.BMSCs成肝诱导的鉴定对数生长期的BMSCs按1×105细胞/mL接种于6孔培养板(内铺有以100mg/mL多聚预处理的盖玻片),加含骨髓血浆的天澄1号培养基,观察细胞融合80~90%时,吸去完全培养基,加入条件培养基(步骤(2)中的基础培养基加入为含HGF、FGF、EGF各10ug/L),置37℃、饱和湿度的5%CO2培养箱诱导培养,每3~5d换液1次,共培养21d。(1)倒置显微镜观察P3代BMSCs经细胞因子诱导处理,在最初的1周细胞形态变化不大,随诱导时间延长,细胞自梭形逐渐变成多边形,且改变的比率随培养时间延长而增加,改变从细胞克隆的外周开始,向其内侧延伸,且细胞增值速度变缓。而非诱导细胞仍为成纤维细胞样,细胞密度增加,局部有重叠交错,随后生长抑制、脱落,具体可参见图6。(2)过碘酸希夫(PeriodicAcid-Schiff,PAS)实验糖原染色结果见图7,可见诱导后27d细胞糖原染色均为阳性(胞浆呈桃红色),而阴性对照细胞(P3,未加诱导剂)无糖原表达。(3)诱导前后细胞的AFP和ALB免疫组化染色观察诱导前P3代的BMSCs中未见AFP和ALB的表达,而诱导后细胞第3天可见AFP表达明显增强,细胞外基质可见大量条带状棕黄色着色(二氨基联苯胺显色,呈棕黄色,图8A),21天可见ALB表达(见图8B)。未诱导的阴性对照组细胞不表达AFP和ALB(见图8C和D)。(4)RT-PCR检测诱导后细胞ALBmRNA的表达BMSCs诱导前的ALBmRNA的表达很弱,细胞定向诱导后,7d、14d、21d均可见ALBmRNA表达,并随诱导时问的延长ALBmRNA的表达呈逐渐升高(见图9),对照组细胞(P3,未加诱导剂)ALBmRNA始终呈阴性表达。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1