一种CD105纳米抗体Nb50的制作方法
本发明属于生物医学或生物制药技术领域,更具体地说,涉及一种针对于cd105多肽分子抗原表位分子的纳米抗体(nb50)、其编码序列及用途。
背景技术:
cd105又名endoglin,为内皮细胞细胞膜表达的糖蛋白,是转化生长因子β(transformgrowthfactor,tgf-β)受体复合物的成分之一,但能独立存在于细胞表面。cd105含有633个氨基酸,相对分子质量约为68051,是一种与增殖相关的并可被缺氧诱导的蛋白,其胞膜外部分含有561个氨基酸,跨膜区域含有25个氨基酸,胞膜内部分含有47个氨基酸,构成cd105的尾部。在cd105的细胞外部分,有4个潜在的糖基化位点,分别是第63位、96位、109位和282位氨基酸残基。这些糖基化位点可以被n-糖苷酶或内糖苷酶f修饰,因此证明这些位点具备功能。
cd105作为一种细胞膜糖蛋白,在增殖的内皮细胞和肿瘤组织的新生血管内皮细胞中呈过表达,而在正常成熟的血管内皮细胞中不表达或弱表达。它是抑制肿瘤血管生成、治疗肿瘤的重要靶分子,与肿瘤组织浸润、转移有关。因此,作为一种可靠的肿瘤新生血管标志物将为临床的诊断、治疗及预后的判断提供重要的参考信息。
然而,目前市场上使用的cd105检测试剂主要是通过fitc荧光素标记的抗cd105单克隆抗体来实现的,这种传统方法存在抗体稳定性差、灵敏度低、生产成本高等缺点。
纳米抗体技术,是生物医学科学家在传统抗体的基础上,运用分子生物学技术结合纳米粒子科学的概念进行的抗体工程革命,从而研发出的最新和最小的抗体分子,最初由比利时科学家莱曼德.哈马斯在骆驼血液中发现。普通的 抗体蛋白由两条重链和两条轻链组成,而从骆驼血液中发现的新型抗体只有两条重链,没有轻链,这些“重链抗体”能像正常抗体一样与抗原等靶标紧紧结合,但不像单链抗体那样相互黏连聚集成块。以该“重链抗体”为基础的纳米抗体不仅分子量只是普通抗体的1/10,而且化学性质也更加灵活,稳定性好,可溶性高,表达容易且容易获得,并容易偶联其他分子。但是,现有技术中并没有针对cd105研发出适用的纳米抗体。
技术实现要素:
本发明要解决的技术问题在于,针对现有技术中缺乏针对cd105表位的纳米抗体的缺陷,提供一种cd105纳米抗体,同时提供编码该cd105纳米抗体的dna分子以及该纳米抗体的用途等。
本发明解决其技术问题所采用的技术方案是:本发明的第一方面,提供了一种cd105纳米抗体,该cd105纳米抗体为针对cd105表位的纳米抗体,包括两条如seqidno:9所示氨基酸序列的vhh链。本发明中该cd105纳米抗体可以简称为nb50。
本发明第二方面,提供了一种针对cd105纳米抗体的vhh链,包括框架区fr和互补决定区cdr,所述框架区fr包括下组的fr的氨基酸序列:seqidno:1所示的fr1,seqidno:2所示的fr2,seqidno:3所示的fr3,seqidno:4所示的fr4;所述互补决定区cdr包括下组的cdr的氨基酸序列:seqidno:5所示的cdr1,seqidno:6所示的cdr2,seqidno:7所示的cdr3。框架区结构相对保守,主要起着维持蛋白质结构的作用;互补决定区结构相对多样化,主要负责抗体的识别。
优选地,所述针对cd105纳米抗体的vhh链,它具有seqidno:9所示的氨基酸序列。
本发明第三方面,提供了一种dna分子,它用于编码选自下组的蛋白质:本发明所述的cd105纳米抗体nb50,或者本发明所述的针对cd105纳米抗体的vhh链。
优选地,所述的dna分子,它具有seqidno:8所示的核苷酸序列。
本发明提供的cd105纳米抗体可通过噬菌体扩增或基因工程重组表达的方式进行大量制备。噬菌体扩增是指将展示有cd105纳米抗体nb50的噬菌体,通过生物扩增的方式,大量繁殖生产展示有cd105纳米抗体nb50的噬菌体粒子。基因工程重组表达的方式是指将编码cd105纳米抗体nb50的基因,通过克隆至表达载体,以蛋白表达的形式进行纳米抗体的大量制备。
本发明的第四方面,提供了一种表达载体,它含seqidno:8所示的核苷酸序列。
本发明的第五方面,提供了一种宿主细胞,它可以表达本发明的cd105纳米抗体nb50。
本发明的第六方面,提供了本发明所述的cd105纳米抗体nb50在制备cd105检测试剂方面的用途。本发明的cd105纳米抗体nb50可以替代传统的cd105抗体,制备cd105检测试剂,用于检测cd105多肽分子。本发明还提供了cd105纳米抗体nb50在制备抗肿瘤药物方面的用途。本发明也相应提供了一种cd105检测试剂或抗肿瘤药物,包括如前所述的cd105纳米抗体nb50。
本发明的第七方面,提供了本发明所述的cd105纳米抗体nb50在非治疗目的免疫学检测中的用途。该免疫学检测的类型包括酶联免疫吸附检测、胶体金免疫层析、免疫斑点杂交等基于抗原抗体特异性反应的免疫学分析检测类型。本发明cd105纳米抗体nb50在应用时,可以通过噬菌体扩增获得的展示有cd105纳米抗体nb50的噬菌体粒子直接用于分析检测以及将cd105纳米抗体nb50经过原核生物或真核生物表达后以蛋白的形式进行免疫学检测分析。
本发明的第八方面,提供了本发明所述的cd105纳米抗体nb50在制备结合吸附cd105试剂中的应用。例如,可以将本发明cd105纳米抗体制成免疫亲和柱,吸附抓取cd105,在富集后供进一步的研究等。
实施本发明,具有以下有益效果:本发明首先合成cd105多肽,并使其具有免疫原性,然后将cd105分子偶联在酶标板上,展示该蛋白的正确空间结构,以此形式的抗原利用噬菌体展示技术筛选免疫纳米抗体基因库(骆驼重 链抗体噬菌体展示基因库),从而获得了cd105特异性的纳米抗体基因,将此基因转至大肠杆菌中,从而建立了能在大肠杆菌中高效表达的纳米抗体株;本发明方法筛选得到的cd105纳米抗体具有与cd105免疫反应特性,且特异性好、亲和力高,可应用于制备cd105检测试剂或抗肿瘤药物等。
附图说明
下面将结合附图及实施例对本发明作进一步说明,附图中:
图1为本发明cd105纳米抗体的氨基酸编号和结构示意图;
图2是本发明cd105纳米抗体的dna电泳图;
图3是本发明cd105纳米抗体经镍柱树脂凝胶亲和层析纯化后的sds-page的电泳图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。
本发明利用噬菌体展示技术,从驼源免疫的单域重链抗体库中筛选能与靶分子cd105抗原特异性结合的单域重链抗体(vhh)噬菌体克隆,而获得了能在大肠杆菌中高效表达的纳米抗体株,即cd105纳米抗体nb50。
下面结合具体实施例,进一步阐述本发明。
实施例1:针对于cd105的纳米抗体文库的构建:
(1)首先合成cd105多肽,将1mgcd105与弗氏佐剂等体积混合,免疫一只新疆单峰驼,每周一次,共免疫7次,刺激b细胞表达抗原特异性的纳米抗体;
(2)7次免疫结束后,提取100ml骆驼外周血淋巴细胞并提取总rna;
(3)合成cdna并利用套式pcr扩增vhh;
(4)利用限制性内切酶psti及noti酶切20ugpcomb3噬菌体展示载体(biovector中国质粒载体菌株细胞基因保藏中心供应)及10ugvhh并连接两个片段;(5)将连接产物转化至电转感受态细胞tg1中,构建cd105纳米 抗体文库并测定库容,库容大小为1.85×108。
实施例2:针对cd105的纳米抗体筛选过程:
(1)将溶解在100mmnahco3、ph8.2中的20ugcd105偶联在nunc酶标板上,4℃放置过夜;
(2)第二天加入100ul0.1%酪蛋白,室温封闭1-3h;
(3)1-3h后,加入100ul噬菌体(5×1011tfu免疫骆驼纳米抗体噬菌展示基因库),室温作用1-2h;
(4)用0.05%pbs+tween-20洗4-6遍,以洗掉不结合的噬菌体;
(5)用100mmtea(三乙胺)将与cd105特异性结合的噬菌体解离下,并感染处于对数期生长的大肠杆菌tg1,37℃培养1h,产生并纯化噬菌体用于下一轮的筛选,相同筛选过程重复3-5轮,逐步得到富集。
实施例3:用噬菌体的酶联免疫方法(elisa)筛选特异性单个阳性克隆:
(1)从上述3-5轮筛选后含有噬菌体的细胞培养皿中,挑选96个单个菌落并接种于含有100微克每毫升的氨苄青霉素的tb培养基(1升tb培养基中含有2.3克磷酸二氢钾,12.52克磷酸氢二钾,12克蛋白胨,24克酵母提取物,4毫升甘油)中,生长至对数期后,加终浓度1毫摩尔的异丙基硫代半乳糖苷(iptg),30-35℃培养过夜。
(2)利用渗透法获得粗提抗体,并将抗体转移到经抗原包被的elisa板中,在室温下放置1-1.5小时。
(3)用pbst洗去未结合的抗体,加入一抗鼠抗ha抗体(mouseanti-hatagantibody,购自北京康为世纪生物科技有限公司),在室温下放置1-1.5小时。
(4)用pbst洗去未结合的抗体,加入anti-mousealkalinephosphataseconjugate(山羊抗小鼠碱性磷酸酶标记抗体,购自艾美捷科技有限公司),在室温下放置1-1.5小时。
(5)用pbst洗去未结合的抗体,加入碱性磷酸酶显色液,于elisa仪上,在405nm波长,读取吸收值。
(6)当样品孔od值大于对照孔od值3倍以上时,判为阳性克隆孔。
(7)将阳性克隆孔的菌转摇在含有100微克每毫升的lb液体中以便提 取质粒并进行测序。
通过上述实验,本发明得到了6个阳性克隆孔与抗原表现出3倍以上的结合力,视为初筛阳性克隆株。根据序列比对软件vectornti分析各个初筛阳性克隆株的基因序列,把cdr1,cdr2,cdr3序列相同的株视为同一克隆株,而其序列不同的株视为不同克隆株,可以得到一组抗体的vhh链的氨基酸序列如seqidno:9所示。该cd105纳米抗体被编号为nb50,其氨基酸编号和结构示意图如图1所示。
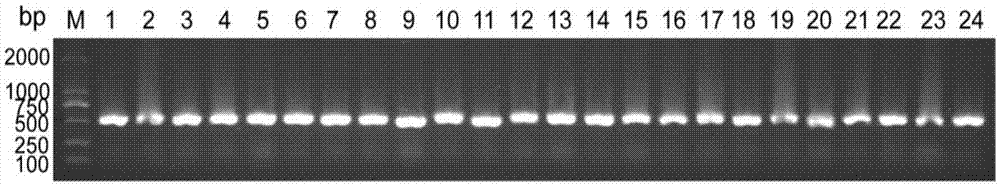
请参阅图2,为cd105纳米抗体的dna电泳图。图中标号为m的第一个凝胶孔的dna条带是:1000bp的dna分子标记,后面从左至右标号为1-24的凝胶孔的dna条带均为cd105纳米抗体dna电泳条带。这些1-24凝胶孔的dna均为cd105纳米抗体dna的pcr产物,该pcr产物带约为500bp。
实施例4:纳米抗体在宿主菌大肠杆菌中表达、纯化:
(1)将前面测序分析获得的氨基酸序列如seqidno:9所示的克隆株的质粒电转化到大肠杆菌wk6中,并将其涂布在la+glucose即含有氨苄青霉素和葡萄糖的培养平板上,37℃培养过夜;
(2)挑选单个菌落接种在5ml含有氨苄青霉素的lb培养液中,37℃摇床培养过夜;
(3)接种1ml的过夜菌种至330mltb培养液中,37℃摇床培养,培养到od值达到0.6~1时,加入iptg,30-35℃摇床培养过夜;
(4)离心,收菌;
(5)利用渗透法,获得抗体粗提液;
(6)经镍柱离子亲和层析可制备纯度达90%以上的蛋白。
请参阅图3,为cd105纳米抗体经镍柱树脂凝胶亲和层析纯化后的sds-page的电泳图。标号m代表蛋白分子标记,标号nb50代表本发明实施例4得到的cd105纳米抗体nb50的sds-page条带,图中单位为kda。结果显示,cd105纳米抗体nb50的大小约为15kda,该cd105纳米抗体nb50经过上述纯化过程,其纯度可达到95%以上。
本发明还对上述实施例4纯化后的cd105纳米抗体nb50进行了动力学 亲和力分析。实验测得结合速率常数为8.14×104(单位m-1s-1),解离速率常数为1.32×10-3(单位s-1),由此计算得到平衡解离常数为1.62×10-8(单位m)。与从噬菌体文库中选出的其它克隆株的亲和力数据相比,该cd105纳米抗体nb50平衡解离常数较低,代表抗体抗原间难以解离,其亲和力较强。
本发明是根据特定实施例进行描述的,但本领域的技术人员应明白在不脱离本发明范围时,可进行各种变化和等同替换。此外,为适应本发明技术的特定场合或材料,可对本发明进行诸多修改而不脱离其保护范围。因此,本发明并不限于在此公开的特定实施例,而包括所有落入到权利要求保护范围的实施例。
- 还没有人留言评论。精彩留言会获得点赞!