利用源自人干细胞的肝细胞的免疫肝毒性筛选方法与流程
本发明涉及一种利用源自人干细胞的肝细胞的免疫肝毒性筛选方法及免疫肝毒性筛选试剂盒。
背景技术:
目前,在新药开发方面,因毒性而导致的失败率在非临床阶段约占20%,且在临床阶段约占13%之高的比例。以新的合成化合物(new chemical entity;NCE)登记后,虽然被淘汰的新药候选物质的毒性机制和靶器官尚不清楚,但据百时美施贵宝(Bristol-Myers Squibb)的1993~2006年的资料报道显示,在非临床阶段的靶器官中,心脏和肝脏之和约为42%。对1990年之后因毒性问题而市场上被撤回的市售的医药品,按照临床阶段的原因分别进行分析的实际结果为,13种(约40%)为肝毒性,11件(33%)为因QT时间(QT interval)增加所致的心脏疾病(心律失常),这两种原因占全部原因的73%。此外,在2004年以后,每年有1个以上的医药品因肝毒性而从市场被退回,不仅如此,在目前使用的医药品中,被美国食品及药物管理局(FDA)发出黑框警告(black box warning,作为最高级别的警告,在医药品的使用方面受到限制)的医药品总共达515项品种,其中,大部分主要是因肝毒性及心脏毒性的问题而受到警告。
目前使用的医药品中的800种以上会诱发肝毒性,其占美国全部急性肝功能衰竭(Acute liver failure)的30%以上,占黄疸入院患者的2~20%。源自药物的肝毒性(drug induced liver injury)是引起临床前阶段中新药开发的中断,临床阶段中临床试验的中断,以及市售后市场上被撤回的最主要的原因。诱发肝毒性的医药品有包括抗生素和抗癌剂在内的高血压治疗剂、抗惊厥剂、高脂血症治疗剂、抗精神病医药品、非甾体类抗炎药、吸入麻醉剂、糖尿病治疗剂、生药制剂等多种,最近,美国FDA及欧洲医药局(European Medicines Agency)也是为了使源自药物的肝毒性最小化而努力之中。对肝毒性医药品的肝毒性机制进行分析的结果为,代谢活性化占很大的比重,美国FDA于2008年2月发行了“用于检验药物代谢体的工业上的安全性的介绍”,并强调了对于药物代谢体的研究在新药开发中为重要的研究领域。
因肝毒性而被退回的14种药物中的9种,附有警告书的14种药物中的10种中报道有活性代谢体,在通常情况下,药物所带来的肝毒性中,与母体药物(parent drug)引起的肝毒性相比,大部分情况是因源自母体药物的代谢体而引起的。在诱发肝毒性的药物代谢体的物理化学特性中,介导肝毒性的特征为亲电子性。因此,在新药开发的初期阶段,提出了能够探索亲电子性的毒性代谢体的形成的研究方法。代谢活化会引起问题的化学结构有,1)联氨(hydrazine)及酰肼(hydrazide),2)芳基乙酸(arylacetic acid)及芳基丙酸(arylpropionic acid),3)噻吩(thiophene)、呋喃(furan)及吡咯(pyrrole),4)苯胺(aniline)及酰苯胺(anilide),5)醌(quinone)及醌亚胺(quinoneimine),6)中链脂肪酸(medium chain fatty acid),7)卤代烃(halogenated hydrocarbon)及部分卤代芳烃(halogenated aromatic)(Br>Cl>F),8)硝基芳烃(nitroaromatic),9)α,β-不饱和烯醇-状结构(α,β-unsaturated enol-like structure),10)硫醇(thiol)或硫羰基(thiono)[噻唑烷二酮授权专利10-1334159(thiazolidinedione)及硫脲(thiourea)]及11)氨噻唑(aminothiazole)类等,具有非常多的结构。
目前在新药开发方面,存在多种肝毒性评价系统的问题。第一,可以例举出不存在能够预测肝毒性的特定靶标。例如,在心脏毒性的情况下,HERG通道分析(channel assay)作为评价心脏毒性的基准而被公开,并且报道有关于活体内的效果和相关性的论文,但存在肝毒性难以以特定靶蛋白质构建评价系统的问题。
第二,动物实验结果的人肝毒性预测力微弱。例如,在国际生命科学研究所(international life sciences institute)的1999年研究结果中,在238种的新药候选物质中,在新药开发过程中31个被观察到具有肝毒性,但在动物实验中观察到肝毒性的为58%,因此,在动物实验中肝毒性的预测力相对较低。此外,在罗纳普朗克(Rhone-Roulenc Rorer)的肝毒性评价分析结果中,报道了动物实验结果与临床结果的差异较大。
第三,在高易感性个体中,确认了特异体质性肝毒性(idiosyncratic hepatotoxicity)的表达。市场上被撤回的肝毒性药物在特征上剂量依赖性和机制不清楚,在易感性强的特定个体中会诱发非常严重的毒性(在一万名或十万名中约有一名)。因此,会出现到临床3期为止的临床试验过程或新药上市申请(new drug application,NDA)过程中未被发现的问题。
第四,在经典的动物试验中,在新药开发中肝毒性的预测力不符合行业要求。因种的不同所引起的药物代谢体样品的定性及定量的差异会使种间肝毒性存在差异,此外,在经典的肝毒性评价的情况下,未能预测因特异体质性肝障碍(idiosyncratic liver injury)而从市场被退回的药物的肝毒性。
第五,作为细胞培养实验系统,将人肝癌细胞株HepG2细胞、转化HepG2细胞[细胞色素450P(cytochrome P450,CYP)等药物代谢酶过表达细胞株]、永生的人肝细胞(immortalized human hepatocytes)(SV40 T抗原基因插入等)、原代肝细胞(primary hepatocytes)(人或大鼠等)等用作肝毒性预测模型,但是在临床上的肝毒性预测方面均具有很大的限制。
对此,本发明人为了基于源自人干细胞的肝细胞而进行免疫肝毒性检查技术的开发,经过努力研究的结果为,用乙醇、CCl4及对乙酰氨基酚对由人干细胞分化的肝细胞及人肝细胞进行处理,从而诱发肝毒性后,构建分化肝细胞的免疫毒性物质分析系统,以确认所述肝细胞所分泌的介质细胞因子、趋化因子及脂质介质,使用所述系统在诱发肝毒性的所述细胞中确认了免疫毒性物质。此外,通过确认在不需要动物模型的情况下,利用与本发明的人肝细胞类似的细胞能够评价候选药剂等的检查对象化合物的代谢或肝毒性,从而明确了利用所述源自人干细胞的肝细胞,能够有效地被用作免疫肝毒性筛选方法及用于检测肝毒性诱发物质的试剂盒,从而完成了本发明。
技术实现要素:
发明所要解决的问题
本发明的目的在于,涉及一种利用源自人干细胞的肝细胞的免疫肝毒性筛选方法。
本发明的另一目的在于,涉及一种利用源自人干细胞的肝细胞的免疫肝毒性筛选试剂盒。
用于解决问题的手段
为了实现上述目的,本发明提供一种肝毒性诱发物质的筛选方法,所述肝毒性诱发物质的筛选方法包括以下步骤:1)用被检测物质处理由人干细胞分化的肝细胞;以及2)对所述步骤1)的肝细胞的凋亡或增殖抑制水平进行测定。
此外,本发明提供一种肝毒性诱发物质的筛选方法,所述肝毒性诱发物质的筛选方法包括以下步骤:1)用被检测物质处理由人干细胞分化的肝细胞;2)收取所述步骤1)的肝细胞的培养液或上清液;以及3)在所述步骤2)的培养液或上清液中分析细胞因子、趋化因子或脂质介质。
此外,本发明提供一种用于检测肝毒性诱发物质的试剂盒,其包含由人干细胞分化的肝细胞。
此外,本发明提供一种用于检测肝毒性诱发物质的试剂盒,其包含由人干细胞分化的肝细胞及该肝细胞分化的介质检测试剂。
此外,本发明提供一种用于检测肝毒性诱发物质的试剂盒的用途,所述试剂盒包含由人干细胞分化的肝细胞。
此外,本发明提供一种用于检测肝毒性诱发物质的试剂盒的用途,所述试剂盒包含由人干细胞分化的肝细胞及该肝细胞分化的介质的检测试剂。
发明效果
本发明涉及一种利用源自人干细胞的肝细胞的免疫肝毒性筛选方法,用乙醇、CCl4及对乙酰氨基酚对由人干细胞分化的肝细胞及人肝细胞进行处理,从而诱发肝毒性后,构建分化肝细胞的免疫毒性物质分析系统,以确认所述肝细胞所分泌的介质细胞因子、趋化因子及脂质介质,由于使用所述系统能够在诱发肝毒性的所述细胞中确认免疫毒性物质,因此,利用所述源自人干细胞的肝细胞能够有效地被用作免疫肝毒性的筛选方法。
附图说明
图1为示出源自人多能胚胎干细胞的肝细胞分化的示意图。
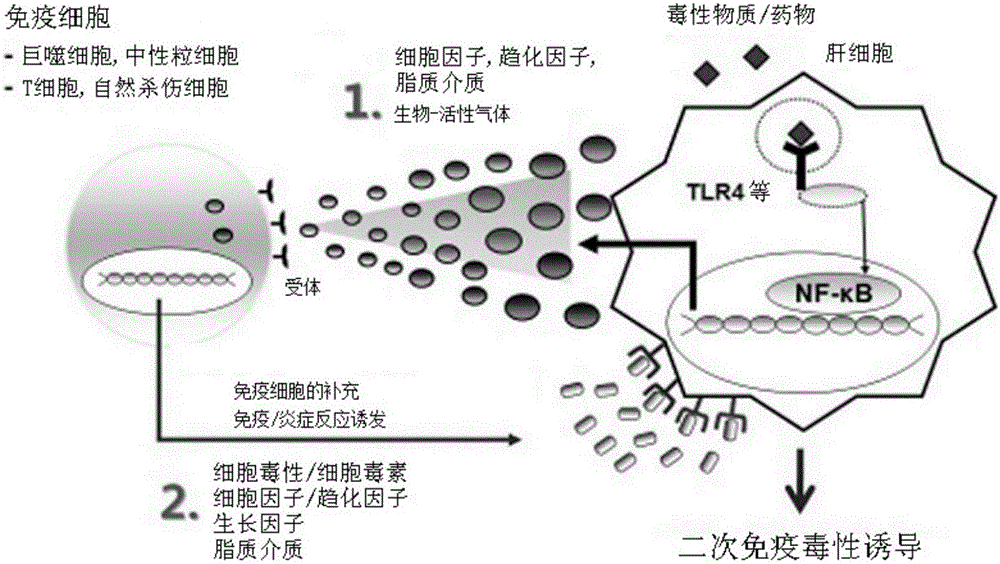
图2为示出1次及2次肝毒性诱导的示意图。
图3为示出构建免疫毒性物质酶联免疫吸附测定(ELISA)分析系统的图。
图4为示出根据用乙醇处理由人胚胎干细胞分化的肝细胞及人肝细胞的免疫毒性物质ELISA分析的图。
图5为示出根据用CCl4处理由人胚胎干细胞分化的肝细胞及人肝细胞的免疫毒性物质ELISA分析的图。
图6为示出根据用对乙酰氨基酚处理由人胚胎干细胞分化的肝细胞及人肝细胞的免疫毒性物质ELISA分析的图。
具体实施方式
下面,对本发明进行详细说明。
本发明提供一种肝毒性诱发物质的筛选方法,所述肝毒性诱发物质的筛选方法包括以下步骤:1)用被检测物质处理由人干细胞分化的肝细胞;以及2)对所述步骤1)的肝细胞的凋亡或增殖抑制水平进行测定。
在所述方法中,步骤1)的人干细胞优选为人胚胎干细胞,但并不限定于此。
优选地,在所述方法中,步骤1)的分化是通过包含a)培养人干细胞,从而诱导分化的步骤;以及b)将上述分化的细胞在添加了肝细胞生长因子的培养基中培养的步骤的方法实施的,但并不限定于此。
在所述方法中,肝毒性诱发物质优选选自乙醇、CCl4及对乙酰氨基酚中的任意一种,但并不限定于此。
在本发明的具体实施例中,本发明人为了确认是否能够由人胚胎干细胞向内胚层等其它分化性系统细胞进行分化,诱导了由人胚胎干细胞(CHA-hESC4)向作为内胚层的肝细胞(hepatocytes)的分化。此外,为了比较用毒性物质对上述细胞进行处理而表现出的免疫毒性,采用如图1示出的示意图的方法,诱导了由人多能胚胎干细胞(CHA-hESC15)向肝细胞的分化(图1)。将所述分化的肝细胞在肝细胞培养基中培养5天,并诱导肝细胞的成熟,从而获得成熟的肝细胞。
此外,肝毒性反应由肝细胞直接与药物及毒性物质进行反应的1次毒性反应,以及与药物反应生成的代谢产物(metabolites)诱导免疫细胞的活化及炎症反应而引起的2次免疫毒性组成。为了分析免疫毒性,由于需要因肝细胞生成的蛋白质、脂质、生物活性气体等代谢物质的分析(参照图2),因此构建了对人IL-1β、IL-6、IL-10、IL-12、TNF-α、IFN-α、IFN-β及TGF-β等8种作为炎症性(pro-inflammatory)细胞因子系列的免疫毒性物质的ELISA检测。确保对于各个细胞因子的抗体和各个细胞因子,从而根据浓度检测ELISA反应,并确立了最优条件(参照图3)。
此外,为了确认根据对由人干细胞分化的肝细胞及人肝细胞进行药物处理的免疫毒性物质的分析,分别用不同浓度的乙醇对所述细胞进行处理时,没有确认到炎症性(pro-inflammatory)细胞因子的生成,但是确认了在用乙醇对人肝细胞进行处理的情况下,检测出了一部分细胞因子。因此,以与一般毒性检查结果类似的状态,可以推导出在源自干细胞的肝细胞的情况下,未显示出对于乙醇(ethanol)的毒性反应(参照图4)。
此外,为了确认根据对由人干细胞分化的肝细胞及人肝细胞进行药物处理的免疫毒性物质的分析,用CCl4对由人胚胎干细胞(hESC4)分化的肝细胞进行处理时,在上述细胞中检测出了IL-6、IL-10及IFN-α,确认了根据CCl4处理浓度的不同,一般情况下得到增加。此外,用CCl4对人肝细胞(hESC15)进行处理时,虽然在上述细胞中也确认了检测出IL-6、IL-10及IFN-α,但是鉴于在培养上述细胞时的细胞数量低于由干细胞分化的肝细胞的细胞数,因此,确认了分泌的细胞因子的量在人肝细胞中显示为高(参照图5)。
此外,为了确认根据对由人干细胞分化的肝细胞及人肝细胞进行药物处理的免疫毒性物质的分析,在用对乙酰氨基酚对由人胚胎干细胞(hESC4)分化的肝细胞进行处理时,确认了在上述细胞中检测出IL-6、TNF-α及IFN-β,确认了根据对乙酰氨基酚处理浓度的不同,一般情况下得到增加。此外,在用对乙酰氨基酚对人肝细胞进行处理时,虽然在上述细胞中也确认了检测出IL-6、TNF-α及IFN-β,但是鉴于在培养上述细胞时的细胞数量低于由干细胞分化的肝细胞的细胞数,因此,确认了分泌的IL-6及IFN-β细胞因子的量在人肝细胞中显示为高,确认了特异性地在干细胞分化肝细胞中检测到的TNF-α细胞因子的量非常高(参照图6)。
因此,用乙醇、CCl4及对乙酰氨基酚对由人干细胞分化的肝细胞及人肝细胞进行处理,从而诱发肝毒性后,构建了分化肝细胞的免疫毒性物质分析系统,以确认所述肝细胞所分泌的介质细胞因子、趋化因子及脂质介质,由于使用所述系统可以在诱发了肝毒性的所述细胞中确认免疫毒性物质,因此,能够将构建的免疫毒性物质分析系统有效地用作利用源自人干细胞的肝细胞的免疫肝毒性筛选方法。
此外,本发明提供一种肝毒性诱发物质的筛选方法,所述肝毒性诱发物质的筛选方法包括以下步骤:1)用被检测物质处理由人干细胞分化的肝细胞;2)收取所述步骤1)的肝细胞的培养液或上清液;以及3)在所述步骤2)的培养液或上清液中分析细胞因子、趋化因子或脂质介质。
在所述方法中,步骤1)的干细胞优选为人胚胎干细胞,但并不限定于此。
在所述方法中,步骤3)的细胞因子优选选自IL-1β、IL-6、IL-10、IL-12、TNF-α、IFN-α及IFN-β中的任意一种,但不限定于此。
在所述方法中,步骤3)的趋化因子优选选自IL-8、IP-10、RANTES、MIP-1及MCP中的任意一种,但并不限定于此。
在所述方法中,步骤3)的脂质介质优选选自前列腺素(prostaglandin)以及白三烯(leukotriene)中的任意一种,但并不限定于此。
在所述方法中,肝毒性诱发物质优选选自乙醇、CCl4及对乙酰氨基酚中的任意一种,但并不限定于此。
本发明的免疫肝毒性筛选方法用乙醇、CCl4及对乙酰氨基酚对由人干细胞分化的肝细胞及人肝细胞进行处理,从而诱发肝毒性后,构建分化肝细胞的免疫毒性物质分析系统,以确认所述肝细胞所分泌的介质细胞因子、趋化因子及脂质介质,由于使用所述系统能够在诱发肝毒性的所述细胞中确认免疫毒性物质,因此,能够有效地被用作肝毒性诱发物质的筛选方法。
此外,本发明提供一种用于检测肝毒性诱发物质的试剂盒,其包含由人干细胞分化的肝细胞。
此外,本发明提供一种用于检测肝毒性诱发物质的试剂盒,其包含由人干细胞分化的肝细胞及该肝细胞分化的介质的检测试剂。
此外,本发明提供一种用于检测肝毒性诱发物质的试剂盒的用途,所述试剂盒包含由人干细胞分化的肝细胞。
此外,本发明提供一种用于检测肝毒性诱发物质的试剂盒的用途,所述试剂盒包含由人干细胞分化的肝细胞及该肝细胞分化的介质的检测试剂。
在所述方法中,肝毒性诱发物质优选选自乙醇、CCl4及对乙酰氨基酚中的任意一种,但并不限定于此。
在所述方法中,肝分化介质优选选自细胞因子、趋化因子及脂质介质中的任意一种,但并不限定于此。
在所述方法中,介质的检测试剂优选选自下述表1中所示的检测试剂中的任意一种,但并不限定于此。
表1
本发明的免疫肝毒性筛选方法用乙醇、CCl4及对乙酰氨基酚对由人干细胞分化的肝细胞及人肝细胞进行处理,从而诱发肝毒性后,构建分化肝细胞的免疫毒性物质分析系统,以确认所述肝细胞所分泌的介质细胞因子、趋化因子及脂质介质,由于使用所述系统能够在诱发肝毒性的所述细胞中确认免疫毒性物质,因此,能够有效地被用作用于检测肝毒性诱发物质的试剂盒。
下面,通过实施例及实验例对本发明进行详细说明。但是,下述实施例及实验例仅例示本发明而已,本发明的内容并不被下述实施例及实验例所限定。
<实施例1>诱导由人胚胎干细胞向肝细胞的分化
为了确认是否能够由人胚胎干细胞向内胚层等其它分化性系统细胞进行分化,诱导了由人胚胎干细胞向内胚层的肝细胞(hepatocytes)的分化(Cai,J.et.al,(2007)Hepatology45(5):1229-1239.)。
具体地,hESC细胞株是用CHA-hESC4细胞株在无支持细胞的系统(feeder-free system)中,培养3天,以使其充满(confluent)调整的培养基(condit ioned medium)中。培养后,将所述hESC细胞在含有50ng/ml的激活素A(Activin A;派普泰克公司,美国)的RPMI-1640(海克隆(Hyclone)公司,美国)培养基中培养5天,从而诱导分化。然后,将所述分化的细胞在含有30ng/ml的成纤维细胞生长因子4(fibroblast growth factor4,FGF4;派普泰克公司)及20ng/ml的骨形成蛋白2(bone morphogenetic protein 2,BMP2;派普泰克公司)的肝细胞培养基(hepatocyte culture medium,HCM;龙沙(Lonza)公司,美国)中培养5天后,在添加了20ng/ml的肝细胞生长因子(hepatocyte growth factor,HGF;派普泰克公司)的肝细胞培养基中进一步培养5天,从而诱导了由hESC向肝细胞的分化。将所述分化的肝细胞在添加了10ng/ml的制瘤素M(oncostatin M,OSM;R&D系统公司,美国)及0.1μM的地塞米松(dexamethasone,Dex;西格玛奥德里奇公司,美国)的肝细胞培养基中培养5天,并诱导肝细胞的成熟(Maturation),从而获得成熟的肝细胞。
<实施例2>诱导由人多能胚胎干细胞向肝细胞的分化
为了诱导源自人多能胚胎干细胞的肝细胞的分化,实施了以下方法。
具体地,采用如图1中所示的方法,hESC细胞株为CHA-hESC15细胞株在无支持细胞的系统(feeder-free system)中,培养3天,以使其充满(confluent)调整的培养基(condit ioned medium)中。培养后,采用与上述<实施例1>相同的方法进行培养,从而诱导肝细胞的成熟(Maturation),从而获得成熟的肝细胞(图1)。
<实施例3>构建分化的肝细胞的免疫毒性物质分析系统
肝毒性反应由肝细胞直接与药物及毒性物质进行反应的1次毒性反应,以及与药物反应生成的代谢产物(metabolites)诱导免疫细胞的活化及炎症反应而引起的2次免疫毒性组成。为了分析免疫毒性,由于需要因肝细胞生成的蛋白质、脂质、生物活性气体等的代谢物质的分析(图2),因此通过实施下述方法构建了炎症性(pro-inflammatory)细胞因子系列的免疫毒性物质分析系统。
具体地,将采用上述<实施例1>中记载的方法制备的由人干细胞分化第19天的肝细胞以每孔90%的浓度分株到6-孔板上,然后,使用1000mg/L的DMEM-低葡萄糖(low glucose)培养液(Dulbecco’s Modified Eagle’s Medium,制备公司威健(Welgene)第001-11)进行替换后,培养2小时。然后,获得了所述源自干细胞的肝细胞培养液。为了去除上述细胞的副产物,以12000xg、20分钟及4℃的条件实施离心分离后,获得了上清液。然后,将作为捕获抗体(capture antibody)的2.5μg/ml的抗-IL-1β抗体、2μg/ml的抗-IL-6抗体、2.5μg/ml的抗-IL-10抗体、2μg/ml的抗-IL-12抗体、1μg/ml的抗-TNF-α抗体、2μg/ml的抗-IFN-α抗体、1μg/ml的抗-IFN-β抗体及2μg/ml的抗-TGF-β抗体在37℃下培养2小时,并涂布到96孔ELISA板上,清洗后利用0.2%的I-封阻(I-block)(福斯特城,加利福尼亚州)在37℃下封阻了(blocking)2小时。对上述经过封阻的捕获抗体进行清洗后,将标准物质(标准,在未结合蛋白质的柔性板(flexible plate)上从10ng/ml的浓度开始,实施2倍稀释(fold serial)至4.88pg/ml,以完成准备)和上清液分株到ELISA板(格雷内尔(Greiner),克雷姆斯明斯特(Kremsmunster),奥地利)上,在37℃下培养2小时。培养后,添加生物素化(biotinylation)的检测抗体(抗-IL-1β抗体:2μg/ml、抗-IL-6抗体:1μg/ml、抗-IL-10抗体:1μg/ml、抗-IL-12抗体:1μg/ml、抗-TNF-α抗体:1μg/ml、抗-IFN-α抗体:4μg/ml、抗-IFN-β抗体:2μg/ml、抗-TGF-β抗体:1μg/ml,最终浓度(final concent rat ion)),在37℃下培养2小时。培养后,在常温下培养结合了碱性磷酸酶(alkaline phosphatase)的链霉亲和素(streptavidin)30分钟,添加5mM的硝基苯基磷酸物质(nitrophenyl phosphate substrate),在405nm的波长下利用酶标仪进行了测定。
其结果如图3中所示,构建了对于人IL-1β、IL-6、IL-10、IL-12、TNF-α、IFN-α/β及TGF-β等8种的作为炎症性(proinf lammatory)细胞因子系列的免疫毒性物质的ELISA检查。确保对于各个细胞因子的抗体和各个细胞因子,从而根据浓度检查了ELISA反应,并确立了最优条件。此外,为了证明ELISA技术方法构建,分析了各个细胞因子的标准曲线(standard curve),并确认了所有的R2值均得出为0.9以上(图3)。
<实施例4>根据对分化的肝细胞进行药物处理的免疫毒性物质的分析
<4-1>根据使用乙醇(ethanol)进行处理的免疫毒性物质的确认
为了通过上述<实施例1>中记载的方法对由人胚胎干细胞向肝细胞进行了分化诱导的细胞进行药物处理并分析免疫毒性物质,实施了下述方法。
将采用上述<实施例1>中记载的方法进行培养而分化第19天的肝细胞以每孔90%的浓度分株到6-孔板上,然后,使用1000mg/L的DMEM-低葡萄糖(low glucose)培养液(Dulbecco’s Modified Eagle’s Medium,制备公司威健(Welgene)第001-11)进行替换后,培养了2小时。分别用不同浓度的0、100及200mM的乙醇(默克(Merk),第100983)对上述培养的细胞处理24小时。为了用乙醇对源自干细胞的肝细胞和人肝细胞进行处理,并比较炎症性(pro-inflammatory)细胞因子的生成,对采用上述<实施例2>中记载的方法进行培养的人肝细胞分别用不同浓度的0、100及200mM的乙醇(默克,第100983)处理了24小时。然后,为了提取免疫毒性物质,获得了所述源自干细胞的肝细胞及人肝细胞培养液。为了去除上述细胞的副产物,以12000xg、20分钟及4℃的条件实施离心分离后,获得了上清液。利用上述<实施例3>中记载的方法所构建的细胞因子ELISA分析系统,实施了根据乙醇处理的分化肝细胞的细胞因子分泌性能分析。
其结果如图4中所示,对由人干细胞(hESC4)向肝细胞实施了分化诱导的细胞分别用浓度不同的乙醇进行处理时,没有确认到炎症性(pro-inflammatory)细胞因子的生成,但是确认了在用乙醇对利用<实施例2>中记载的方法培养的人肝细胞进行处理的情况下,检测出了一部分细胞因子。因此,以与一般毒性检查结果类似的状态,可以推导出在源自干细胞的肝细胞的情况下,未显示出对于乙醇(ethanol)的毒性反应(图4)。
<4-2>根据使用CCl4进行处理的免疫毒性物质的确认
为了对通过上述<实施例1>中记载的方法由人胚胎干细胞向肝细胞进行了分化诱导的细胞进行药物处理,并分析免疫毒性物质,实施了下述方法。
具体地,制备CCl4(四氯化碳和二甲基亚砜(DMSO)以1:1混合的储存液(stock),西格玛第319961号),并分别用不同的浓度的0、5、10及20mM的上述CCl4对采用上述<实施例1>中记载的方法由人胚胎干细胞(hESC4)分化的肝细胞处理了24小时。为了用CCl4对源自人胚胎干细胞的肝细胞和人肝细胞进行处理,并比较炎症性(pro-inflammatory)细胞因子生成,对采用上述<实施例2>中记载的方法进行培养的人肝细胞分别用不同浓度的0、5、10及20mM的CCl4(西格玛,第319961号)处理了24小时。然后,为了提取免疫毒性物质,获得了所述源自干细胞的肝细胞及人肝细胞培养液。为了去除上述细胞的副产物,以12000xg、20分钟及4℃的条件实施离心分离后,获得了上清液。利用上述<实施例3>中记载的方法所构建的细胞因子ELISA分析系统,实施了根据乙醇处理的分化肝细胞的细胞因子分泌性能分析。
其结果如图5中所示,用CCl4对由人干细胞(hESC4)分化的肝细胞进行处理时,在上述细胞中检测出了IL-6、IL-10及IFN-α,确认了根据CCl4处理浓度的不同,一般情况下得到增加。此外,用CCl4对人肝细胞(hESC15)进行处理时,虽然在上述细胞中也确认了检测出IL-6、IL-10及IFN-α,但是鉴于在培养上述细胞时的细胞数量低于由干细胞分化的肝细胞的细胞数,因此,确认了分泌的细胞因子的量在人肝细胞中显示为高(图5)。
<4-3>根据使用对乙酰氨基酚(Acetoaminophen)进行处理的免疫毒性物质的确认
为了对通过上述<实施例1>中记载的方法由人胚胎干细胞向肝细胞进行了分化诱导的细胞进行药物处理,并分析免疫毒性物质,实施了下述方法。
具体地,将1.75M的对乙酰氨基酚(Acetoaminophen,西格玛,第A5000号)溶解到DMSO之后,并以0、10及20mM的浓度对采用上述<实施例1>中记载的方法由人胚胎干细胞(hESC4)分化的肝细胞处理了24小时。为了用对乙酰氨基酚对源自人胚胎干细胞的肝细胞和人肝细胞进行处理,并比较炎症性(pro-inflammatory)细胞因子生成,对采用上述<实施例2>中记载的方法进行培养的人肝细胞(hES15)分别用不同浓度的0、10及20mM的对乙酰氨基酚处理了24小时。然后,为了提取免疫毒性物质,获得了所述源自干细胞的肝细胞及人肝细胞培养液。为了去除上述细胞的副产物,以12000xg、20分钟及4℃的条件实施离心分离后,获得了上清液。利用上述<实施例3>中记载的方法所构建的细胞因子ELISA分析系统,实施了根据乙醇处理的分化肝细胞的细胞因子分泌性能分析。
其结果如图6中所示,用对乙酰氨基酚对由人干细胞(hESC4)分化的肝细胞进行处理时,确认了在上述细胞中检测出IL-6、TNF-α及IFN-β,确认了根据对乙酰氨基酚处理浓度的不同,一般情况下得到增加。此外,确认了用对乙酰氨基酚对人肝细胞(hES15)进行处理时,虽然在上述细胞中也确认了检测出IL-6、TNF-α及IFN-β,但是鉴于在培养上述细胞时的细胞数量低于由干细胞分化的肝细胞的细胞数,因此,确认了分泌的IL-6及IFN-β细胞因子的量在人肝细胞中显示为高,确认了特异性地在干细胞分化肝细胞中检测到的TNF-α细胞因子的量非常高(图6)。
- 还没有人留言评论。精彩留言会获得点赞!