用于转基因表达的合成启动子构建体的制作方法
相关申请的交叉引用
本申请要求在2014年5月19日提交的南非临时专利申请号2014/03606的权益,此申请的全部内容以引用的方式并入本文。
本发明涉及植物中基因表达的调节。
背景技术:
植物中不可靠和低水平的组成型转基因表达是用于作物改良和生物制药的植物生物技术的主要挑战之一。若干个分子元件可发挥作用,但转基因的低水平表达主要是由于弱的启动子。目前,可用的启动子的选择是有限的,并且这些启动子中的大多数基于常规野生型启动子元件,其中花椰菜花叶病毒35s(camv35s)是最广泛使用的启动子中的一种。
然而,存在对驱动高于其能够通过野生型甚至修改版本的camv35s的水平的转基因表达的需要,特别是对于生物制药应用。
技术实现要素:
本文公开了用于增强植物中的转基因表达的合成启动子构建体;包含合成启动子构建体的表达盒;和使用合成启动子构建体在植物中表达转基因蛋白的方法。
本文提供了包含调节核酸序列的分离的多核苷酸,所述调节核酸序列(a)与seqidno:1、3、4或18中任一个示出的多核苷酸序列或其功能等价片段具有至少95%或更多的序列同一性,或(b)在严格条件下与seqidno:1、3、4或18中任一个示出的多核苷酸序列的互补序列杂交。
在一些实施方案中,调节核酸序列与seqidno:1、3、4或18中任一个或其功能等价片段具有95%、96%、97%、98%、99%或100%的序列同一性。在一些实施方案中,调节核酸序列与seqidno:1、3、4或18中任一个或其功能等价片段具有100%的序列同一性。
在一些实施方案中,调节核酸序列或其功能等价片段含有选自由以下组成的组的一个或多个基序:sorlrep2at、asf1motifcamv、as1camv、atrichpspete、gt1motifpsrbcs、inrntpsadb、ctrmcamv35s、-10pehvpsbd、ltreatlti78、cbfhv、drecrtcoreat、ltrecoreatcor15、mycconsensusat、lrenpcabe、sorlip1at、boxiipcchs、cca1atlhcb1、cgf1atcab2、gt1consensus、iboxcore、rbcsconsensus、ciacadianlelhc、gatabox、sorlip5at以及cactftppca1。
分离的多核苷酸还可包含一个或多个限制酶位点以用于插入与调节核酸序列异源的第二核酸序列,使得插入的第二核酸序列将可操作地连接到调节核酸序列,并且调节核酸序列能够指导第二可操作连接的核酸序列的转录。
在一些实施方案中,第二核酸序列编码与调节核酸序列异源的靶蛋白,并可操作地连接到调节核酸序列。例如,第二核苷酸序列可编码可用于食品或饮料工业、制药工业(例如作为疫苗或治疗性蛋白)、农业或化学工业的靶蛋白。在一些实施方案中,第二核苷酸序列编码治疗性蛋白。在一些实施方案中,第二核苷酸序列编码(a)肺表面活性蛋白-b(sp-b)前蛋白原或其功能片段或类似物;(b)sp-b成熟肽或其功能片段或类似物;或(a)和(b)两者的一种或多种拷贝。
在一些实施方案中,分离的多核苷酸还包含终止子序列,例如选自nos聚a、35s聚a、rbcs1终止子或本领域的技术人员已知的另一种终止子的终止子序列。调节核酸序列或其功能等价片段可以可操作地连接到终止子序列。
分离的多核苷酸还可包含以下元件中的一个或多个:
(i)编码信号肽的多核苷酸序列,诸如equistatin的信号肽区或烟草硫堇(nicotianatabacumthionin)(ntsp)的信号肽区;
(ii)编码运输肽的多核苷酸序列,诸如内质网(er)-运输肽,例如sekdel(seqidno:34)、kdel(seqidno:35)、hdel(seqidno:36);油体-运输肽(例如油质蛋白)、蛋白贮藏液泡-运输肽(例如,来自例如大麦凝集素、菜豆的菜豆蛋白或大豆β-伴大豆球蛋白α'子单元的液泡分选决定簇(vsd));质体,其包含叶绿体、有色体或白色体-运输肽(例如,能够与质体的类囊体膜相互作用的肽,诸如来自茄属(solanum)的rubisco的小子单元的叶绿体靶向信号);或本领域技术人员已知的另一种运输肽;
(iii)编码标签的多核苷酸序列,诸如聚组氨酸、瘦素、胚胎发育晚期丰富蛋白(lea)、凝集素、麦芽糖结合蛋白(mbp)或谷胱甘肽s-转移酶(gst)或本领域的技术人员已知的其他标签;
(iv)编码用于检测的标记物蛋白的多核苷酸序列,诸如黄色荧光蛋白(ypet)、绿色荧光蛋白(gfp)、氯霉素乙酰转移酶(cat)、荧光素酶或本领域的技术人员已知的其他标记物蛋白;
(v)编码蛋白酶裂解位点的多核苷酸序列,诸如肠激酶、凝乳酶或烟草蚀刻病毒(tev)蛋白酶裂解位点中的一个或多个;或
(vi)用于靶向质体诸如叶绿的psba调节5′-utr或3′utr区体。
还提供了用于在植物细胞或植物中表达蛋白的表达盒。表达盒包含本文所述的分离的多核苷酸。基于植物的表达盒可适用于根癌农杆菌(agrobacteriumtumefaciens)-介导的转化。
还提供了包含本文所述的分离的多核苷酸或基于植物的表达盒中任一个的植物细胞。植物细胞可以在悬浮培养物中的多个植物细胞中、在组织培养物中的植物细胞中、在植物或转基因植物的叶片中或其任何部分中的植物细胞中。植物细胞可来自单子叶植物或双子叶植物。在一些实施方案中,植物是烟草(nicotianatobacum)植物。
还提供了包含本文所述的分离的多核苷酸或基于植物的表达盒中任一个的植物子代或种子。
本文还提供了通过将本文所述的分离的多核苷酸引入植物细胞并且在植物细胞中表达靶蛋白的一种在植物细胞中表达靶蛋白的方法。所述方法还可包括使植物细胞暴露于一种或多种诱导刺激的步骤。例如,这种诱导刺激可以是不同强度和周期的光暴露、冷休克、热休克、干旱条件诱导或激素诱导(诸如由于脱落酸(aba))中的任一个或多个。
“分离”的多核苷酸意指从其天然环境合成或分离并且以足以允许其鉴别或使用的量存在的多核苷酸。分离的多核苷酸可以是(i)体外通过例如聚合酶链反应(pcr)扩增;(ii)通过克隆重组产生;(iii)如通过裂解和凝胶分离纯化;或(iv)通过例如化学合成的一种多核苷酸。分离的多核苷酸是可通过本领域熟知的重组dna技术容易地操纵的一种多核苷酸。因此,被包含在其中5'和3'限制性位点是已知的或其中聚合酶链反应(pcr)引物序列已被公开的载体中的核苷酸序列被认为是分离的,但以其原生状态存在于其天然宿主中的核苷酸序列不是。分离的多核苷酸可以基本上被纯化,但不是必需的。在本发明的上下文中,多核苷酸与术语“核酸”可互换使用。
如本文所用,“调节核酸序列”是指通常但不总是位于编码序列的上游(5'),并且通过提供对rna聚合酶和/或在具体位点开始转录所需的其他因子的识别控制编码序列的表达的dna序列。调节核酸序列的示例是启动子。启动子包含负责启动转录的核心启动子元件以及修饰基因表达的其他调节元件。应当理解,位于编码序列的内含子或3'内的核苷酸序列也可有助于调节编码序列的表达。
本文所用的术语“功能等价片段”是指在调节可操作地连接的编码序列的表达中,保持少20%(例如,至少:30%;40%;50%;60%;70%;75%;80%;85%;90%;95%;97%;98%;99%;或全部)的调节核酸序列的生物活性的调节核酸序列的一部分。测量和比较核酸序列的相对调节活性的方法是本领域众所周知的。
如本文所用,术语“序列同一性”是指任何给定的查询序列与主题序列之间的同一性的程度。“序列同一性”的百分比通过在比较窗上比较两个最优比对的序列来确定,其中比较窗中的核苷酸序列的片段可相较于参照序列(其不包含添加或缺失)可包含添加或缺失(例如,空位或突出)以用于两个序列的最优比对。所述百分比是通过以下进行计算:确定两个序列中出现相同核酸碱基的位置数以得到匹配位置数,用匹配位置数除以比较窗口中的位置总数,并且将结果乘以100而得到序列同一性百分比。输出是相对于查询序列主题序列的百分比同一性。用于确定两个具体多核苷酸序列之间的百分比序列同一性的各种方法是本领域的技术人员熟知的。例如,一种使用方法是基本局部比对搜索工具(blast)工具,所述工具找到序列之间的局部相似性的区(www.ncbi.nlm.nih.gov/blast/)。
本文使用的术语“可操作地连接”意指异源核苷酸序列的转录或翻译在调节核酸序列的影响下。“可操作地连接”还旨在表示两个核苷酸序列的结合,使得每个dna片段的编码序列保持在正确的阅读框中。
“异源”多核苷酸序列或蛋白是非天然地可操作地连接到调节核酸序列并且由其调节的序列或蛋白。
术语“类似物”在本文中用于是指在结构上和/或功能上类似于参照蛋白或肽分子,但包含一个或多个氨基酸残基的至少一个修饰、添加、缺失或取代的蛋白或肽分子。
本文所用的“严格的条件”或“严格的杂交条件”是指探针将在比与其他序列更大的可检测程度上(例如,超过背景至少2倍)与它的靶标序列杂交所处的条件。严格的条件是序列依赖性的并且在不同的环境中将是不同的。通过控制杂交和/或洗涤条件的严格性,可鉴别与探针100%互补的靶标序列(同源探测)。另选地,可调整严格性条件以允许序列中的一些失配,使得检测到较低程度的相似性(异源探测)。通常,严格条件将是其中以下的那些:在ph7.0至8.3时的盐浓度为约0.01m至1.0mna离子浓度(或其他盐),并且温度对于短探针(例如10个至50个核苷酸)是至少约30℃,并且对于长探针(例如,大于50个核苷酸)是至少约60℃。还可以通过加入去稳定剂如甲酰胺来实现严格条件。
除非另外定义,否则本文中所用的所有技术和科学术语均具有与本发明所属领域一般技术人员通常所理解含义相同的含义。尽管可使用与本文所述的那些方法和材料类似或等效的方法和材料来实施本发明,但以下描述合适的方法和材料。本文提到的所有公布、专利申请、专利和其他参考文献通过引用整体并入。如有矛盾,以包括定义在内的本说明书为准。此外,材料、方法和实例仅具有说明性而非意图具有限制性。
附图和下文的描述中阐释了本发明的一个或多个实施方案的细节。从说明书和附图、以及从权利要求中,本发明的其它特征、目的以及优点将会显而易见。
附图说明
图1示出了本文所述的启动子表达盒的代表性图示。
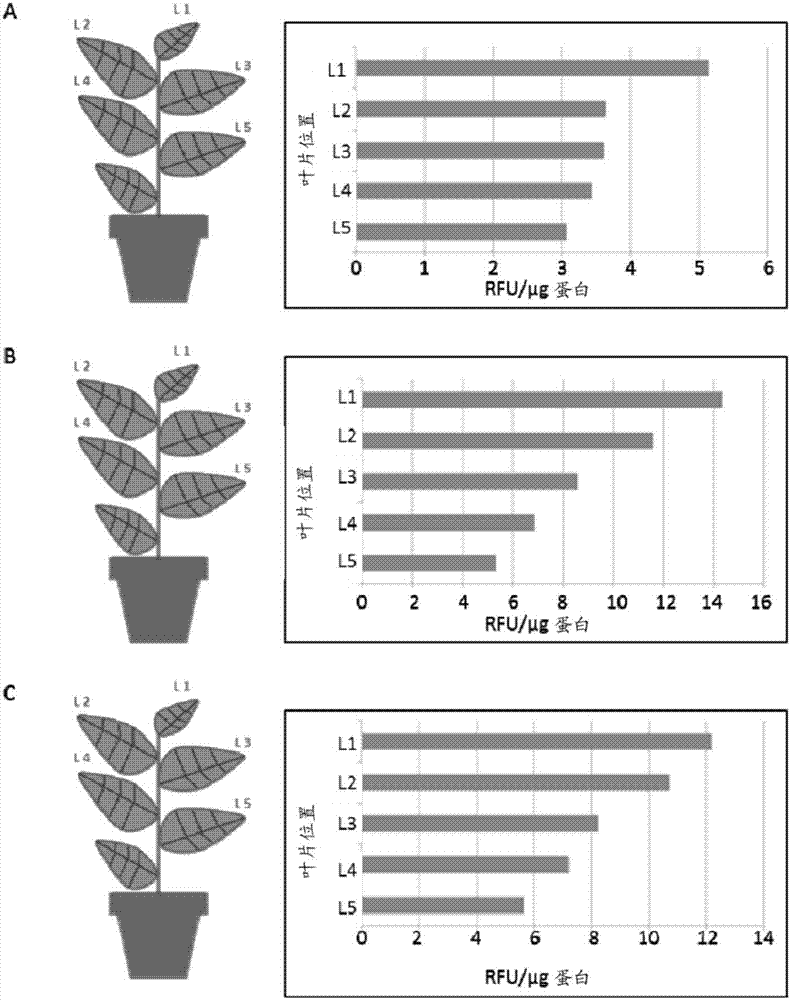
图2示出了来自3个独立的转基因系分析的5个叶片中ypet报告基因表达的图形表示。
图3示出了所有候选合成启动子盒与两个对照启动子(c1和c2)之间的比较的图形表示,从而示出具有最高报告基因表达的每个启动子的转基因系。虚线表示所测量的最高c2(2x35s)荧光值(4.34rfu/μg蛋白)。误差棒示出了所测量的每个转基因系的三个叶片之间的se。wt=野生型,azprom-neg=无启动子阴性对照(‘空载体’)。
图4示出了本文所述的多核苷酸序列的序列表。
图5示出了使用
图6示出了使用
具体实施方式
本文提供了用于增强植物中的转基因表达的合成启动子构建体;包含合成启动子构建体的表达盒;和使用合成启动子构建体在植物中表达转基因蛋白的方法。
植物中转基因表达的时间和/或空间控制在许多农业和生物医药应用中是期望的。实现这种控制的一种方式是通过合理设计调节核酸序列,例如,启动子。启动子可以是诱导型、组成型和/或组织特异性的。用于植物中转基因活性的靶向控制的启动子工程应用包括生物和非生物胁迫耐受性、高水平的转基因表达和感测环境和/或化学刺激。根据生物技术应用,例如作物改良或生物医药肽的商业上可行的表达,高水平组成型和靶向/诱导型转基因表达系统均是重要的。
强的组成型转基因表达继续是期望的性状。充当增强子的花椰菜花叶病毒35s(camv35s)启动子[benfey和chua1990]及其重组修饰,例如原生camv35s加上另外的35s亚结构域-b已在植物中广泛地用于高水平的转基因表达[benfey等人1990;bhullar等人2003,2007]。然而,当前具有能与之相比的或甚至比camv35s更好的活性的强组成型启动子的选择和可用性仍相对有限。
植物基因工程研究中的挑战,例如启动子可用性、转基因表达的水平不足和同源依赖性的基因沉默(hdgs),需要工程化和使用新型合成启动子[venter和botha2010]。除了新型合成强组成型启动子的设计,调节启动子模块内特异性顺式基序架构,可允许预测应用以响应于各种环境、物理或化学刺激以赋予诱导型表达[venter2007]。相比于来自病毒和/或植物来源的常规野生型启动子,精心设计的合成启动子可在植物基因工程应用中提供优越的转基因表达水平、对转基因(或多种转基因)表达的精细控制并且限制同源依赖性基因沉默。
因此,申请人开发了21个候选合成启动子以用于使用逐步方法在转基因植物系中进行测试:1)鉴别已知在植物中高度表达的基因的启动子(例如,通过文献搜索),2)基于特异性植物转录因子(tf)结合位点(或顺式基序)的存在,例如通过使用已知基序的数据库诸如place(higo等人,1999)或plantcare(lescot等人,2002),选择那些启动子(调节模块)中的特定区,3)结合不同和/或重复的启动子模块以构建合成启动子,以及4)对于转基因蛋白的有效表达,体内测试转基因植物系中的候选合成启动子构建体。
选择用于合成启动子设计的调节模块的示例包括:
·以在植物中高水平的转基因表达见长的启动子;
·已知在植物中以高水平表达的基因;
·与光合作用相关联的启动子;以及
·如使用place[higo等人,1999]检测的植物转录因子结合位点。
此外,使用place[higo等人,1999]的顺式基序选择主要地基于:
·光照调节、激活;
·叶片特异型表达;
·已知充当增强子的基序;
·与低温响应性相关联的基序;以及
·来自特异性启动子的基序,例如已知在植物中驱动高水平的转基因表达的camv35s和核酮糖-1,5-二磷酸羧化酶小子单元启动子(rbcss)。
将候选调节模块设计和/或扩展至包含以上提及的顺式基序中的大部分选择,这包括作为诱导型元件起作用的基序。因此,本领域的技术人员将理解所述方法可包括将植物细胞暴露于一种或多种诱导刺激的步骤,所述诱导刺激包括不同强度和周期的光暴露、冷休克、热休克、干旱条件诱导或激素诱导(诸如由于脱落酸(aba))。
然后在使用荧光报告基因蛋白,ypet(黄色荧光蛋白)的情况下,在转基因烟草属植物中测试21种候选合成启动子,虽然可使用本领域的技术人员已知的任何其他报告基因蛋白,诸如荧光素酶、绿色荧光蛋白(gfp)、氯霉素乙酰转移酶(cat)等。有趣的是,基于使用进行于电脑中(insilico)的合理设计策略设计的大多数候选合成启动子未显示出显著改善或比对照camv35s启动子执行得更差。这展示了为了测定合成启动子构建体的功效,执行体内测试的必要性。进行于电脑中的功效的证据不是足够的。然而,相比对照camv35s启动子,来自各种合成启动子构建体的若干第一代转基因植物系确实显示了增强的ypet表达,并且合成启动子构建体中的一个特别地显示了异常地改善的蛋白表达:它比最高执行对照2xcamv35s启动子将蛋白表达增加了约5倍。
因此,本文提供了包含调节核酸序列的分离的多核苷酸。调节核酸序列可以是或含有与seqidno:1、3、4或18中示出的多核苷酸序列中任一个或其功能等价片段具有至少80%序列同一性(例如,至少85%、90%、95%、96%、97%、98%、99%或100%序列同一性)的序列。在一些实施方案中,调节核酸序列与seqidno:1、3、4或18中任一个或其功能等价片段具有95%、96%、97%、98%、99%或100%的序列同一性。在一些实施方案中,调节核酸序列与seqidno:1、3、4或18中任一个或其功能等价片段具有100%的序列同一性。
调节核酸序列还可以是或含有在严格条件下杂交的与seqidno:1、3、4或18中任一个互补的序列。杂交条件是本领域的技术人员熟知的。本文所用的“严格的条件”或“严格的杂交条件”是指探针将在比与其他序列更大的可检测程度上(例如,超过背景至少2倍)与它的靶标序列杂交所处的条件。严格的条件是序列依赖性的并且在不同的环境中将是不同的。通过控制杂交和/或洗涤条件的严格性,可鉴别与探针100%互补的靶标序列(同源探测)。另选地,可调整严格性条件以允许序列中的一些失配,使得检测到较低程度的相似性(异源探测)。通常,探针具有少于约1000个核苷酸的长度,经常具有少于500个核苷酸的长度。
通常,严格条件将是其中以下的那些:在ph7.0至8.3时的盐浓度为约0.01m至1.0mna离子浓度(或其他盐),并且温度对于短探针(例如10个至50个核苷酸)是至少约30℃,并且对于长探针(例如,大于50个核苷酸)是至少约60℃。还可以通过加入去稳定剂如甲酰胺来实现严格条件。示例性严格条件包括在37℃下在6x氯化钠/柠檬酸钠(ssc)中杂交,之后在55℃至60℃下在0.5x或1xssc中洗涤。示例性高严格性条件包括在45℃下在6xssc中杂交,之后在65℃下在0.2xssc,0.1%sds中洗涤。杂交的持续时间通常少于约24小时,通常约4至约12小时。
在一些实施方案中,调节核酸序列或其功能等价片段可含有选自由以下组成的组的一个或多个基序:sorlrep2at、asf1motifcamv、as1camv、atrichpspete、gt1motifpsrbcs、inrntpsadb、ctrmcamv35s、-10pehvpsbd、ltreatlti78、cbfhv、drecrtcoreat、ltrecoreatcor15、mycconsensusat、lrenpcabe、sorlip1at、boxiipcchs、cca1atlhcb1、cgf1atcab2、gt1consensus、iboxcore、rbcsconsensus、ciacadianlelhc、gatabox、sorlip5at以及cactftppca1。需注意,以上提供的基序如place数据库(higo等人,1999)中所述被注释,但如果使用另一个数据库,诸如plantcare(lescot等人,2002)可具有不同的注释。还需注意,由表1中描述的序列所显示的基序可以在5’-3’取向(+)或相反的3’-5’取向(-)。
分离的多核苷酸还可包含一个或多个限制酶位点以用于插入与调节核酸序列异源的第二核酸序列,使得插入的第二核酸序列将可操作地连接到调节核酸序列,并且调节核酸序列能够指导第二可操作连接的核酸序列的转录。在一些实施方案中,第二核酸序列编码与调节核酸序列异源的靶蛋白,并可操作地连接到调节核酸序列。
本文所述的启动子可用作强组成型启动子以用于在食品和饮料行业、制药工业(例如,作为疫苗或治疗性蛋白)、农业工业或化学工业等中的高水平转基因表达。需认识到任何感兴趣的基因可以可操作地连接到本文所公开的启动子序列并且在植物中表达。
在本发明的一个实施方案中,表达的转基因蛋白是可用于制药工业中的蛋白,具体地治疗性蛋白。本发明的一个具体实施方案,表达的转基因蛋白是肺表面活性蛋白-b(sp-b)前蛋白原或sp-b成熟肽、其功能片段或类似物[pryhuber1998]。
因此,第二核苷酸序列可编码可用于食品或饮料工业、制药工业、农业或化学工业的靶蛋白。在一些实施方案中,第二核苷酸序列编码治疗性蛋白。在一些实施方案中,第二核苷酸序列编码以下中的一种或多种拷贝:(a)肺表面活性蛋白-b(sp-b)前蛋白原或其功能片段或类似物;(b)sp-b成熟肽或其功能片段或类似物;或(a)和(b)两者。
除了靶转基因蛋白,调节核酸序列或其功能等价片段可以可操作地连接到本领域的技术人员已知的一种或多种元件,包括但不限于以下:
(i)编码信号肽的多核苷酸序列,诸如equistatin的信号肽区或烟草硫堇(ntsp)的信号肽;
(ii)编码运输肽的多核苷酸序列,诸如内质网(er)-运输肽,例如sekdel(seqidno:34)、kdel(seqidno:35)、hdel(seqidno:36);油体-运输肽(例如油质蛋白)、蛋白贮藏液泡-运输肽(例如,来自例如大麦凝集素、菜豆的菜豆蛋白或大豆β-伴大豆球蛋白α'子单元的液泡分选决定簇(vsd));质体,其包含叶绿体、有色体或白色体-运输肽(例如,能够与质体的类囊体膜相互作用的肽,诸如来自茄属(solanum)的rubisco的小子单元的叶绿体靶向信号);或本领域技术人员已知的另一种运输肽。
(iii)编码标签的多核苷酸序列,诸如聚组氨酸、瘦素、胚胎发育晚期丰富蛋白(lea)、凝集素、麦芽糖结合蛋白(mbp)或谷胱甘肽s-转移酶(gst)或本领域的技术人员已知的用于改善的蛋白表达、稳定性或纯化的其他标签;
(iv)编码用于检测的标记物蛋白的多核苷酸序列,诸如黄色荧光蛋白(ypet)、绿色荧光蛋白(gfp)、氯霉素乙酰转移酶(cat)、荧光素酶或本领域的技术人员已知的其他标记物蛋白;以及
(v)编码位于靶蛋白侧翼的蛋白酶裂解位点的多核苷酸序列,诸如肠激酶、凝乳酶或烟草蚀刻病毒(tev)蛋白酶裂解位点中的一个或多个,以用于通过蛋白水解裂解的感兴趣的靶蛋白的释放。
此外,本发明的调节核酸序列或其功能等价片段可以可操作地连接到psba调节5′-utr和3′utr区以用于靶向质体,具体地叶绿体。
在一些实施方案中,分离的多核苷酸还包含终止子序列,例如选自nos聚a、35s聚a、rbcs1终止子或本领域的技术人员已知的另一种终止子的终止子序列。调节核酸序列或其功能等价片段可以可操作地连接到终止子序列。
本文还提供了包含本文所述的分离的多核苷酸的表达盒。表达盒可适用于根癌农杆菌介导的转化。表达盒可包括调节核酸序列,所述调节核酸序列(a)与seqidno:1、3、4或18中任一个示出的多核苷酸序列或其功能等价片段具有至少95%或更多的序列同一性,或(b)在严格条件下与seqidno:1、3、4或18中任一个示出的多核苷酸序列的互补序列杂交。表达盒还可包括可操作地连接到调节核酸序列的第二核酸序列并且调节核酸序列能够指导第二可操作地连接的核酸序列的转录。第二核酸序列可编码可用于食品或饮料工业、制药工业(例如作为疫苗或治疗性蛋白)、农业或化学工业的靶蛋白。在一些实施方案中,第二核苷酸序列编码治疗性蛋白,例如肺表面活性蛋白-b(sp-b)前蛋白原或sp-b成熟肽、其功能片段或类似物。
表达盒还可包含以下元件中的一个或多个:
(i)编码信号肽的多核苷酸序列,诸如equistatin的信号肽区或烟草硫堇(ntsp)的信号肽区;
(ii)编码运输肽的多核苷酸序列,诸如内质网(er)-运输肽,例如sekdel(seqidno:34)、kdel(seqidno:35)、hdel(seqidno:36);油体-运输肽(例如油质蛋白)、蛋白贮藏液泡-运输肽(例如,来自例如大麦凝集素、菜豆的菜豆蛋白或大豆β-伴大豆球蛋白α'子单元的液泡分选决定簇(vsd));质体,其包含叶绿体、有色体或白色体-运输肽(例如,能够与质体的类囊体膜相互作用的肽,诸如来自茄属的rubisco的小子单元的叶绿体靶向信号);或本领域技术人员已知的另一种运输肽。
(iii)编码标签的多核苷酸序列,诸如聚组氨酸、瘦素、胚胎发育晚期丰富蛋白(lea)、凝集素、麦芽糖结合蛋白(mbp)或谷胱甘肽s-转移酶(gst)或本领域的技术人员已知的其他标签;
(iv)编码用于检测的标记物蛋白的多核苷酸序列,诸如黄色荧光蛋白(ypet)、绿色荧光蛋白(gfp)、氯霉素乙酰转移酶(cat)、荧光素酶或本领域的技术人员已知的其他标记物蛋白;
(v)编码蛋白酶裂解位点的多核苷酸序列,诸如肠激酶、凝乳酶或烟草蚀刻病毒(tev)蛋白酶裂解位点中的一个或多个;或
(vi)用于靶向质体诸如叶绿的psba调节5′-utr或3′utr区体。
还提供了包含本文所述的分离的多核苷酸或基于植物的表达盒中任一个的植物细胞。植物细胞可以是在悬浮培养物中的多个植物细胞、组织培养物中的植物细胞、植物或转基因植物的叶片中或其任何部分中的植物细胞中。植物细胞可来自单子叶植物或双子叶植物。在一些实施方案中,植物是烟草植物。还提供了包含本文所述的分离的多核苷酸或基于植物的表达盒中任一个的植物子代或种子。
本文还提供了通过将本文所述的分离的多核苷酸引入植物细胞并且在植物细胞中表达靶蛋白的一种在植物细胞中表达靶蛋白的方法。所述方法还可包括使植物细胞暴露于一种或多种诱导刺激的步骤。例如,这种诱导刺激可以是不同强度和周期的光暴露、冷休克、热休克、干旱条件诱导或激素诱导(诸如由于脱落酸(aba))中的任一个或多个。
将通过以下实例的方式描述本发明,这些实例不应被理解为以任何方式限制本发明的范围。
实施例
实施例1
1.1.材料和方法
1.1.1.在植物转化载体中启动子合成和克隆
通过dna2.0(www.dna20.com)和blueheronbiotech(www.blueheronbio.com)进行所有启动子表达盒的合成和亚克隆。在impactvector1.1(plantresearchinternational,wageningen;www.pri.wur.nl/uk/products/impactvector/)内,在asci/ncoi位点之间合成每个启动子,从而替换杭菊(chrysanthemummorifolium)的rbcs1启动子。在impactvector1.1内的每个启动子表达盒包含在ncoi/bglii位点之间合成的驱动用于ypet荧光蛋白的编码的基因的启动子(合成或未修饰)和在bglii/paci位点之间的来自杭菊(c.morifolium)的rbcs1基因的终止子(如图1中所示)。随后,每个启动子表达盒被切除并且在适用于农杆菌(agrobacterium)介导的植物转化的修饰(以适应asci和paci限制性位点)的二元载体中亚克隆。
1.1.2.合成启动子设计
用于合成启动子设计的调节模块基于包括以下的各种因子:
·以在植物中高水平的转基因表达见长的启动子;
·已知在植物中以高水平表达的基因;
·与光合作用相关联的启动子;以及
·如使用place[higo等人,1999]检测的植物转录因子结合位点。
此外,使用place[higo等人,1999]的顺式基序选择主要地基于:
·光照调节、激活;
·叶片特异型表达;
·已知充当增强子的基序;
·与低温响应性相关联的基序;以及
·来自特异性启动子的基序,即已知在植物中驱动高水平的转基因表达的camv35s和核酮糖-1,5-二磷酸羧化酶小子单元启动子(rbcss)。
将候选调节模块设计和/或扩展至包含以上提及的类型的顺式基序中的大部分选择,这包括作为诱导型元件起作用的基序。
选择两种启动子作为对照启动子以用于对21种新设计的合成启动子进行对比性分析。对照启动子是命名为c1的野生型camv35s启动子(genbank登记号v00140)[seqidno:22]和与融合到它的另外的结构域_b(具有73bp延伸)一起的也被称为2x35s的双增强子camv35s结构域-b以及命名为c2的5’-utr[seqidno:23],所述双增强子camv35s结构域-b在初始35s启动子的结构域_b(genbankac:v00140.1)处具有73bp的延伸。合成启动子被设计成azprom-1至azprom-21。
使用impactvector表达盒并且结合二元载体诸如pcambia,鉴别用于亚克隆目的的不应在启动子中被切割的特异性限制酶位点。当检测到特异性限制酶位点时,提出修订并且将序列提交至place数据库以通过初始推定的转录因子-结合位点与包含限制性酶位点的初始序列保持相同的方式修订序列。
表1示出了存在于被选择用于在植物中驱动转基因的高水平表达的启动子中的各种顺式基序。表2示出了设计用于测试(包括它们的尺寸和组分)的各种候选合成启动子。
1.1.3.转基因植物和基因组pcr的产生
在温度(22℃)调节的生长室中,在16小时光照/8小时黑暗的光周期下,将烟草属植物(烟草硫堇varsamsun)保持在ms培养基上。通过电穿孔将在二元载体中亚克隆的启动子表达盒移动至根癌农杆菌(agrobacteriumtumefacien)菌株lba4404中,并且使用标准叶盘法转化烟草属叶片[horsch等人1985]。在抗生素选择下在ms培养基上再生植株,并且使初级转基因烟草属植株硬化并且在22℃的封闭(containment)温室中生长。在大约12周后,在316μmol.m-2.s-1的光照强度的16小时光照/8小时黑暗光周期的情况下,将植物转移至调节为24℃的生长室。为了确认转基因状态,使用genejet基因组dna纯化试剂盒(thermofisherscientificinc,usa),从推定的转基因烟草属叶片材料提取基因组dna。使用引物:ypet_frw(5’-ctcagtaagtggggaaggtgaaggc-3’)[seqidno:27]和ypet_rev(5’-tgccagctgaacacctccatcctcg-3’)[seqidno:28],在94℃持续2分钟的预变性循环下,之后35个扩增循环(94℃变性,30秒;55℃退火,30秒;72℃聚合,30秒)以扩增457bp片段,使用
表1:合成启动子设计的place顺式基序分析
表2:候选合成启动子
*无ypetatg
1.1.4.荧光筛选
ypet报告基因是具有在517nm下的激发和在530nm下的发射的修饰用于荧光共振能量转移(fret)应用的黄色荧光蛋白(yfp)。使用具有485nm至515nm的青色led输出的手持式rofinpolilightflareplus2forensic手电筒(rofinforensics,australia)和具有190nm至545nm范围内的橙色滤光镜进行快速目视筛选。将转移至生长室的植物连续地筛选8周至12周。将来自35s和2x35s叶片的最高ypet荧光用作对比以筛选合成启动子植物系。丢弃其中前3叶片具有较低的ypet荧光的高度在20cm至40cm范围内的植物系。使用nanodrop荧光光谱仪(thermofisherscientificinc,usa)分析未丢弃的植物。
1.1.5.取样
选择的烟草属植物至少30cm高(从罐中土壤的顶部)。使用10mm直径的软木钻孔工具从烟草属叶片打出10mm的叶片盘。靠近叶片的中间紧挨但不包括中静脉,但包括侧静脉,打出每个10mm的叶片盘。取样五个不同的叶片,命名为l1、l2、l3、l4以及l5。第一叶片(l1)是具有至少10cm的长度的第一叶片。然后取样沿植物向下的以下叶片,直到第五叶片。每个第五叶片具有从叶片的中间打出的5个叶盘以用于分析。
1.1.6.ypet蛋白提取
所使用的提取缓冲液是具有2%2-巯基乙醇的1xpbs(sigma79383)。将每个提取物(每个叶片)的五个10mm叶片盘添加至2ml埃彭道夫管中的1ml的提取缓冲液。将两个4mm的不锈钢球置于每个埃彭道夫管中。将管置于组织裂解器中并以15分钟/30rpm摇动。接着,添加500μl的氯仿。然后将管剧烈涡旋20秒并且以最大速度(13000rpm)离心10分钟。移除上清液(300ml至500ml)并且用于测量荧光强度。
1.1.7.荧光强度测量
使用提取缓冲液(1xpbs),将用于ypet检测(白色led)的nanodropnd3300方案用作空白读数。进行野生型植物读数并且空白读数作为背景荧光被扣除。分析2μl的提取物并且获得作为相对荧光单元(rfu)值的读数。
1.1.8.总蛋白量化
根据制造商的说明书,使用quant-ittm蛋白测定试剂盒(thermofisherscientificinc,usa)提取蛋白。使用高范围(high-range)的nanodropnd3300quant-it方案来产生标准曲线。使用quant-ittm蛋白缓冲液进行空白读数。
分析2μl的提取物并且获得作为蛋白量化(μg/ml)的读数。将所有启动子测量量化为rfu/μg蛋白。
1.2.结果
针对每种启动子构建体,产生大约9至28个独立的转基因植物系。从野生型烟草属和使用具有ypet报告基因但无启动子序列的‘空’表达盒转化的转基因系进行荧光测量。这是为了分析背景荧光和来自表达抗生素选择基因的二元载体启动子的启动子‘泄露’。
1.2.1.使用手持式手电筒的荧光筛选
使用polilightflare手电筒进行第一轮筛选(整个植物分析)。我们开始筛选所有的c1(35s)和c2(2x35s)植物系,其中保留最明亮的系以用于荧光分析。丢弃未显示或显示非常低的荧光的植物系。荧光光谱显露待丢弃的植物的阈值明亮度为大约小于每个转基因系2rfu/μg蛋白。当使用polilight筛选所有其他启动子表达盒的转基因植物系时,使用最明亮的c1和c2对照植物以用于视觉对比分析。
1.3.荧光光谱
最初结果显示类似于mitsuhara等人1996的每个叶片位置的平均启动子活性。相对于叶片位置,所有启动子构建体具有类似的表达谱(如图2a、b和c所示)。然而,通常位置l2、l3和l4的叶片尺寸是类似的。基于这些谱,我们选择叶片位置:l2、l3和l4的平均表达数据以用于荧光分析和所有启动子构建体之间的对比。用于对比分析的初级对照启动子是c2(2x35s),其中通过荧光目测和光谱分析总共27个转基因植物系。将四个启动子鉴别为具有最高表达值,所述最高表达值在从2.71rfu/μg蛋白至最大4.34rfu/μg蛋白的范围内。
筛选所有启动子并且每个候选合成启动子盒的具有最明亮的ypet荧光的转基因植物系(t0初级转化体)在图3中示出。由于低(<2rfu/μg蛋白)荧光而被丢弃的具有候选合成启动子的植物系被命名为‘n.f.’表示‘无荧光’。条形图(图3)上的虚线代表最高c2(2x35s)值。所表示的转基因植物系还示出了每个候选合成启动子盒的最高报告基因值。如从图中可看出,azprom-1、azprom-3、azprom-4以及azprom-18是相比于c2对照工作最有效地的四个候选启动子。表3指示在这些四个启动子盒的每一个中鉴别的place数据库基序。
令人惊讶地,发现相比于使用c2对照启动子的转基因植物的最高报告基因值,azprom-18在转基因植物的最高报告基因值下具有五倍更大的ypet转基因的表达。此外,它也是最强的总体合成启动子中的一个,其中测试的每个转基因植物具有在2rfu/μg蛋白截止值以上的ypet荧光水平(表4)。
使用手持式polilight手电筒,可快速筛选转基因系并且在目测确认和对比c1和c2植物系中最明亮的荧光后,来自具有总体低活性的若干合成启动子的系可被丢弃。
因此鉴别的四个合成启动子azprom-1、azprom-3、azprom-4以及azprom-18,特别是azprom-18显示了用于植物基因工程策略和生物医药应用中的实用性。
表3:在选择的启动子盒中通过place数据库分析鉴别的基序
azprom-1
基序从5’-起始至3’-结束的位置(取向+或-)
豌豆质体蓝素启动子(609bp)
葡萄属vpp启动子(342bp)
azprom-3
基序从5’-起始至3’-结束的位置(取向+或-)
豌豆质体蓝素启动子(445bp)x2
camv35s最小启动子(98bp)
如在-53bp下从豌豆质体蓝素转录起始位点所计算的)豌豆质体蓝素5’-utr(52b)
cactftppca11007(-)
cactftppca11025(+)
gt1consensus1034(+)
azprom-4
基序从5’-起始至3’-结束的位置(取向+或-)
豌豆质体蓝素启动子(445bp)x2
葡萄属vpp启动子(342bp)
azprom-18
基序从5’-起始至3’-结束的位置(取向+或-)
athcab2选择区(115bp)x2
athcab2启动子区(-564,相对于起始密码子)
表4:针对在2rfu/μg蛋白截止值以上的ypet荧光阳性的转基因植物系的数目和百分比
实施例2
2.1.材料和方法
2.1.1.使用合成启动子azprom_18的两种融合蛋白的表达
包含azprom_18[seqno.18]合成启动子的impactvector1.1内的表达盒通过使用编码以下的cdna替换编码ypet荧光蛋白的单个基因来修饰:(i)ypet–接头1-tev裂解位点-人成熟(8kda)肺表面活性蛋白sp-b肽[seqidno:29]-tev裂解位点–接头2-ypet(az18_1xsp-b)[seqidno:30]的单个拷贝;或(ii)ypet–接头1-tev裂解位点-人成熟(8kda)肺表面活性蛋白sp-b肽[seqidno:29]-tev裂解位点–接头2-ypet(az18_2xsp-b)[seqidno:31]的双拷贝。然后修饰的azprom_18启动子表达盒被切除并且在适用于农杆菌介导的植物转化的二元载体pcambia中亚克隆。
2.1.2.转基因植物的生成和荧光筛选
在温度(22℃)调节的生长室中,在16小时的光周期下,将烟草属植物(烟草硫堇varsamsun)保持在ms培养基上。通过电穿孔将包含融合盒az18_1xsp-b和az18_2xsp-b的pcambia表达载体引入到根癌农杆菌菌株lba4404中[mattanovich等人1989],之后使用标准叶片盘法进行植物转化[horsch等人1985]。在卡那霉素选择下在ms培养基上再生烟草属植株,并且使初级转基因植株硬化并且在22℃的标准温室条件下在封闭温室中生长。为了评估烟草属植物的转基因状态,使用具有485nm至515nm的青色led输出的手持式rofinpolilightflareplus2forensic手电筒(rofinforensics,australia)和具有190nm至545nm范围内的橙色滤光镜筛选植株。将显示荧光的植株转移至生长室并且连续地筛选8周至12周。
2.1.3.蛋白提取和蛋白印迹分析
使用含有具有7m尿素、2m硫脲、5%chaps以及5%2-巯基乙醇的1x磷酸盐缓冲盐水(pbs,sigma-aldrich,79383)的缓冲液从植物组织提取蛋白。使用1ml的提取缓冲液提取在液氮中研磨的500mg的植物叶片材料。将提取物涡旋1分钟并且静置在工作台上10分钟,其后将它再次涡旋并且在13000xg下离心10分钟。直接使用上清液,装载到凝胶中以用于蛋白印迹分析。使用bis-trismops缓冲液和4%-12%梯度凝胶,使用lifetechnologiesbolttm系统(lifetechnologies)进行sdspage。根据制造商的说明书,使用lifetechnologies
2.2.结果&讨论
2.2.1.蛋白印迹分析
蛋白印迹分析显示,当相比于
其他实施方案
应理解,虽然本发明已结合其发明详述进行了描述,但以上描述意图说明且并非限制本发明的范围,本发明的范围是由所附权利要求书来限定。其它方面、优势和改进在以下权利要求书范围内。
参考文献
benfeypn,renl,chuan-h(1990)combinatorialandsynergisticpropertiesofcamv35senhancersubdomains.emboj9:1685–1696
bhullars,chakravarthys,advanis,dattas,pentald,kumarburmap(2003)strategiesfordevelopmentoffunctionallyequivalentpromoterswithminimumsequencehomologyfortransgeneexpressioninplants:cis-elementsinanoveldnacontextversusdomainswapping.plantphysiol132:988–998
bhullars,dattas,advanis,chakravarthys,gautamt,pentald,kumarburmap(2007)functionalanalysisofthecauliflowermosaicvirus35spromoter:re-evaluationoftheroleofsubdomainsb5,b4,andb2inpromoteractivity.plantbiotechnolj5:696–708
higo,k.,y.ugawa,m.iwamotoandt.korenaga(1999)plantcis-actingregulatorydnaelements(place)database:1999.nucleicacidsresearchvol.27no.1pp.297-300.
horschr,fryj,hofmannn,eichhlotzd,rogerss,frayleyr(1985)asimpleandgeneralmethodfortransferringgenesintoplants.science227(4691):1229-1231
lescotm,déhaisp,thijsg,marchalk,moreauy,vandepeery,rousépandrombautss(2002)plantcare,adatabaseofplantcis-actingrefulatoryelementsandaportaltotoolsforinsilicoanalysisofpromotersequences.nucleicacidsresearch30(1):325-327
mattanovichd,rukerf,dacamaramachadoa,laimerm,regnerf,steinkelinerh,himmlerg,katingerh(1989)efficienttransformationofagrobacteriumspp.byeletroporation.nucleicacidsresearch17(16):6747
mitsuharai,ugakim,hirochikah,ohshimam,murakamit,gotohy,katayosey,nakamuras,honkurar,nishimiyas,uenok,mochizukia,tanimotoh,tsugawah,otsukiy,ohashiy(1996)efficientpromotercassettesforenhancedexpressionofforeigngenesindicotyledonousandmonocotyledonousplants.plantcellphysiol37:49–59.
benfeyandchuan-h(1990)thecauliflowermosaicvirus35spromoter:combinatorialregulationoftranscriptioninplants.science250:959-966
pryhubergs(1998)regulationandfunctionofpulmonarysurfactantproteinb.moleculargeneticsandmetabolism64:217-228
venterm(2007)syntheticpromoters:geneticcontrolthroughcisengineering.trendsplantsci.12,118–124
venterm&bothafc(2010)inplantdevelopmentalbiology—biotechnologicalperspectivesvol.2(edspua,e.c.&davey,m.r.)393–408(springer).
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于转录组测序构建的棒状杆菌组成型表达载体启动子的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及gnd基因的表达载体的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及lrp基因的表达载体的制造方法与工艺
- 一株呕吐毒素降解菌及其应用的制造方法与工艺
- 一种具有家蚕血细胞特异性活性的启动子的鉴定方法与流程
- 一种改造的质粒复制子及其应用的制造方法与工艺
- 一种水稻种子特异性启动子Posseed及其应用的制造方法与工艺
- 一种在水稻幼穗特异表达的启动子及其应用的制造方法与工艺
- 一种表达外源基因的启动子及其应用的制造方法与工艺
- 可诱导的CRISPRon或CRISPRi小鼠胚胎干细胞及其应用的制造方法与工艺