液滴中的高通量基因组装的制作方法
本专利申请要求2014年11月21日提交的美国专利申请流水号14/550,713、2014年9月15日提交的美国专利申请流水号14/486,346、和2014年6月16日提交的美国临时专利申请62/012,842的优先权,这些申请通过提述被并入本文。
背景
DNA构建体的高通量合成与组装是合成生物学、以及旨在革新分子产品和生物产品的开发与制造方式的生物工程循环(bio-engineering cycle)的不可或缺的部分。过去数年来已经开发了若干用于组装合成DNA寡核苷酸成更长的构建体的方法。许多方法利用聚合物或连接酶的组合将较短的寡核苷酸(例如长度为50到200个核苷酸的分子)接合形成长达1,000到5,000个碱基对的构建体。这些方法足以构建编码功能性蛋白质的完整基因。
许多高通量方法是利用自动化机器人系统在微量滴定板中进行的。这些系统可减少人力成本,但由于组装所需的各种反应的数量和规模,试剂(包括起始寡核苷酸)的成本仍然是可观的。
概述
本公开提供,除其他事项之外,一种方法,其包括:(a)获得多组寡核苷酸的混合物,其中每组中的寡核苷酸各自包含末端索引子序列,能够被组装以产生合成子;和(b)将所述寡核苷酸混合物组装成阵列,由此将不同组的寡核苷酸彼此在空间上分离。在一些实施方案中,所述方法可包括(c)使阵列与溶液接触,从而为每个被所述寡核苷酸结合的特征产生包含该特征的分立的(discrete)液滴,并且,任选地,将不可混溶的液体置于所述液滴之上,从而为每个被所述寡核苷酸结合的特征由液滴所界定的分立的(discrete)反应室(reaction chamber)。该方法可进一步包括在使得每个反应室中组装成合成子的条件下温育所述阵列。还提供了一种组合物,其包含多组寡核苷酸,其中每组中的寡核苷酸包含末端索引子序列,并能够被组装产生合成子。
本领域技术人员审视下面的附图和详细说明之后会或能够显见本发明的其他装置、设备、系统、方法、特征和优势。所有此类其他系统、方法、特征和优势应包括在本说明书内且落入本发明的范围。
附图简述
熟练技术人员会理解下文描述的附图仅为了例示目的。附图并不意图以任何方式限制本文中的教导的范围。
图1示意性显示了主题方法的一个实施方案的一些一般原则。
图2示意性显示了来自寡核苷酸文库的寡核苷酸杂交到阵列上的寡核苷酸的一个实施方案。
图3示意性显示了图2的文库寡核苷酸如何能够被延伸以产生双链寡核苷酸。
图4示意性显示了如何通过将阵列进入水性液体而形成反应容器。
图5演示了来自寡核苷酸文库的寡核苷酸杂交到阵列上的寡核苷酸的另一个实施方案。
图6示意性显示了图5的文库寡核苷酸如何能够被延伸以产生双链寡核苷酸。
图7示意性显示了使用具有可切割联接的双链寡核苷酸的一种备选组装方法。
图8示意性显示了使用单链寡核苷酸的一种备选组装方法。
图9示意性显示了一组寡核苷酸,其含有(i)末端索引子序列和(ii)组装序列,其中末端索引子序列与组装序列被可光切割或化学可切割接头所分隔。
图10示意性显示了一种寡核苷酸,其含有(i)末端索引子序列和(ii)组装序列,其中末端索引子序列与组装序列被可光切割或化学可切割接头所分隔,并杂交形成阵列的特征。
图11-14示意性显示了能产生可组装片段的备选方法。
定义
在更为详细描述例示性的实施方案前,列出以下定义以例示并定义描述中使用的术语的意义和范围。
数字范围包括限定范围的数字。除非另外指示,核酸以5’至3’方向左至右书写;氨基酸序列以氨基至羧基方向左至右书写。
除非另有定义,本文中使用的所有技术和科学术语与本发明所属领域的普通技术人员的通常理解具有相同的意义。Singleton,et al.,DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY,2D ED.,John Wiley and Sons,New York(1994),及Hale&Markham,THE HARPER COLLINS DICTIONARY OF BIOLOGY,Harper Perennial,N.Y.(1991)给技术人员提供本文中使用的许多术语的一般意义。不过,为了清楚和易于参考,下文定义了某些术语。
必须指明,如本文中和所附权利要求书中使用的,单数形式“一”、和“所述/该”均包括指多个的情况,除非上下文另有明确要求。例如,术语“一(种/个)引物”指一(种/个)或多(种/个)引物,即单独一(种/个)引物和多(种/个)引物。进一步注意到,撰写权利要求书时可以排除任何任选的要素。因此,这种表述可以作为与权利要求要求结合使用的排他术语,如“唯一”,“仅仅”等,或者使用“否定式”限定的在先引用基础。
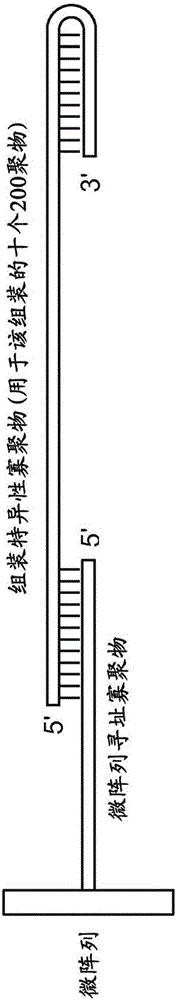
如本文中使用,术语“阵列”意在描述多个可寻址的区域的二维排列,各可寻址的区域携带与该区域关联的寡核苷酸。阵列的寡核苷酸可以在沿着核酸链上的任何点处共价附着于基底,但是一般附着在一个末端(例如,3’或5’末端)。
任何给定的基底可以携带1、2、4或更多个布置在基底的前表面上的阵列。取决于用途,任何或所有阵列可以是相同的或彼此不同的,并且每个阵列可以含有多个点或特征。阵列可以在小于20cm2的区域中,例如在小于10cm2、小于5cm2、或小于1cm2的区域中含有至少10个、至少100个、至少1,000个、至少10,000个、至少100,000个或至少106或更多个特征。在一些实施方案中,特征的宽度(对于圆点而言为直径)可以在1μm至1.0cm的范围,但这些尺寸之外的特征也在考虑之中。在一些实施方案中,特征的宽度可以在3.0μm至200μm,例如5.0μm至100μm或10μm至50μm的范围。通常会存在特征间区域(interfeature areas),此类区域不携带任何聚合化合物。应当理解的是,当存在时,特征间区域可以有不同大小和构型。
每个阵列可以覆盖小于100cm2,例如小于50cm2,小于10cm2或小于1cm2的区域。在一些实施方案中,携带一个或多个阵列的基底一般会成形为矩形或正方形立体(尽管其它形状是可能的),具有超过4mm且小于10cm,例如超过5mm且小于5cm的长度,和超过4mm且小于10cm,例如超过5mm且小于5cm的宽度。
阵列可以使用液滴沉积来制造,通过脉冲喷射多核苷酸前体单元(如单体)(在原位制作的情况下),或先前获得的多核苷酸。此类方法详细记载于例如US 6,242,266,US 6,232,072,US 6,180,351,US 6,171,797,US 6,323,043,Caren等在1999年4月30日提交的美国专利申请流水No.09/302,898,以及其中引用的参考文献。这些参考文献在此通过提及并入本文。其它液滴沉积方法可以用于制造,如本文中先前描述的。还有,代替液滴沉积方法,可以使用光刻阵列制作方法。特别地,在通过光刻法制备阵列时,不需要存在特征间区域。
当阵列具有多个具备不同模块(例如不同多核苷酸序列)的区域,使得某个区域(即,阵列的“特征”、“点”或“区域”)在阵列上的特定的预定位置(即,“地址”)时,阵列是“可寻址的”。各阵列特征通常被,但不需要被,居间空间所分离。
术语“核苷酸”意图包括那些不仅含有已知的嘌呤和嘧啶碱基,而且还含有已经修饰的其它杂环碱基的模块。此类修饰包括甲基化的嘌呤或嘧啶、酰化的嘌呤或嘧啶、或其它杂环。另外,术语“核苷酸”包括这样的模块,它们含有半抗原或荧光标记物,而且不仅可以含有常规的核糖和脱氧核糖,而且也可以含有其它糖。经修饰的核苷或核苷酸还包括糖模块上的修饰,例如一个或多个羟基基团替换为卤素原子或脂肪族基团,或者官能化为酯、胺等。
术语“核酸”和“多核苷酸”在本文中可互换使用,描述由核苷酸,例如脱氧核糖核苷酸或核糖核苷酸构成的任何长度,例如大于约2个碱基、大于约10个碱基、大于约100个碱基、大于约500个碱基、大于1000个碱基,直至约10,000或更多个碱基的聚合物,可以酶促或合成生成(例如,如记载于美国专利No.5,948,902和其中引用的参考文献的PNA),并且可以以与两个天然存在的核酸的方式类似的序列特异性方式与天然存在的核酸杂交,例如可以参与Watson-Crick碱基配对相互作用。天然存在的核苷酸包括鸟嘌呤、胞嘧啶、腺嘌呤、胸腺嘧啶、尿嘧啶(分别为G、C、A、T和U)。DNA和RNA分别具有脱氧核糖和核糖糖主链,而PNA主链由通过肽键连接的重复N-(2-氨基乙基)-甘氨酸单元构成。在PNA中,多个嘌呤和嘧啶碱基通过亚甲基羰基键与主链连接。锁定核酸(LNA),经常称为难接近的RNA,是一种经修饰的RNA核苷酸。LNA核苷酸的核糖模块用额外的桥修饰,所述桥连接2’氧和4’碳。桥“锁定”3’-内(North)构象的核糖,其经常存在于A-形式的双链体中。只要期望,可以混合LNA核苷酸与寡核苷酸中的DNA或RNA残基。术语“非结构化核酸”或“UNA”是含有非天然核苷酸的核酸,所述非天然核苷酸以降低的稳定性彼此结合。例如,非结构化的核酸可以含有G’残基和C’残基,其中这些残基对应于G和C的非天然存在的形式,即类似物,它们以降低的稳定性彼此碱基配对,但是保留分别与天然存在的C和G残基碱基配对的能力。非结构化的核酸记载于US20050233340,在此将其通过提及并入本文用于公开UNA。
如本文中使用,术语“寡核苷酸”意指长度约2至200个核苷酸,直至500个核苷酸的核苷酸多聚体。寡核苷酸可以是合成的或可以酶促生成,并且在一些实施方案中,长度为30至150个核苷酸。寡核苷酸可以含有核糖核苷酸单体(即,可以是寡核糖核苷酸)和/或脱氧核糖核苷酸单体。例如,寡核苷酸的长度可以是10至20、21至30、31至40、41至50、51-60、61至70、71至80、80至100、100至150或150至200个核苷酸。
如本文中使用,术语“引物”指这样的寡核苷酸,无论是天然存在的(如在纯化的限制性消化物中)还是合成生成的,其当被置于与核酸链互补的引物延伸产物被诱导合成的条件下,即在存在核苷酸和诱导剂,如DNA聚合酶的情况下并且在合适的温度和pH的条件下时,可发挥合成起始点的作用。引物必须有足够长度以在诱导剂存在下引发期望的延伸产物的合成。引物的确切长度会取决于许多因素,包括温度、引物来源和方法的使用。例如,对于某些应用,根据靶序列的复杂性,寡核苷酸引物可含有15-25或更多个核苷酸,但它可以含有更少的核苷酸。
可以使用任何合适的方法生成聚合化合物的阵列,所述方法包括将预先生成的聚合化合物沉积到基底的表面上,然后与基底连接的方法,以及还有原位合成方法。
如本文中使用,术语“基底表面上含有聚合化合物的区域”意图指含有聚合化合物的特征(features that contain the polymeric compounds),如上文讨论的。
如本文中使用,术语“疏水性”和“亲水性”是相对术语,意图指溶液被吸引到表面或从表面被排斥的程度。可以通过测量溶液在表面上的接触角测量疏水性和亲水性,如记载于Johnson et al.(J.Phys.Chem.1964Contact Angle Hysteresis 68:1744–1750)。接触角是静态疏水性的量度,接触角滞后和滑动角(slide angle)是动态量度。还可参见Roger P.Woodward的题目为Contact Angle Measurements Using the Drop Shape Method的文章,其可以在通过在“firsttenangstroms.com/pdfdocs/CAPaper.pdf”前放置“http://www.”形成的网址获得。
如本文中使用,术语“选择性水化”意图指将水性溶液选择性应用于阵列的含有聚合化合物(或彼此紧密相邻的其选择基团)的区域,而非那些区域之间的区域的步骤。此步骤产生在其表面上具有液滴阵列的基底,其中液滴的边缘对应于含有聚合化合物的特征的边界。这可以通过多种不同方法来实现,包括将阵列浸入水性溶液中,其中特征与非特征区之间疏水性的差异导致产生被限于所述特征的液滴。
如本文中使用,术语“分立(或离散)(的)液滴”意图指基底的表面上彼此分开的液滴。每个分立液滴可以占据阵列的单个特征(即,其中每个液滴位于单个聚合化合物之上)或者每个分立液滴可以占据阵列的多个特征(其中诸液滴被积极诱导以预定义的方式扩散入(bleed into)彼此中,从而一个液滴可以含有多种寡核苷酸)。
如本文中使用,术语“预定义”意图指在做出前已知的某事物。
如本文中使用,术语“从表面释放聚合化合物”意图指从基底表面切离产物的步骤。此步骤通过切割将产物与阵列表面连接的可切割接头来完成。这可以通过例如使用可光切割接头或限制酶来实现。
如本文中使用,术语“在基底上彼此相邻”意图指含有聚合化合物的区域,所述聚合化合物彼此紧密相邻(即彼此紧靠,没有中间含有聚合化合物的任何其它区域)。
如本文中使用,术语“混合物”意图指这样的溶液,其中组分彼此散在,并且不在空间上分离。
如本文中使用,术语“水性”意图指溶剂包含水的介质。
液滴如本文中使用,术语“组”、“多个”(multiple或plurality)指含有至少2个成员的群体。在某些情况下,多个可以具有至少10,至少100,至少1,000,至少10,000,至少100,000,至少106,至少107,至少108或至少109或更多个成员。
如本文中使用,术语“在溶液相中”意图指处于不与固体基底结合或维系的水性环境中的聚合化合物。这样的聚合化合物可以溶解在所述的水性环境中。
如本文中使用,术语“使……接触”意在指置于接触中。术语“使阵列与溶液接触”意在涵盖阵列与溶液之间的直接接触,例如通过浸/蘸入(dipping)或喷洒(misting),也涵盖通过凝结将溶液沉积在基地表面上。
如本文中使用,术语“经由可切割接头与基底结合”意图指这样的安排,其中聚合化合物经由可切割键(cleavable bond)与基底连接。例如,可以使用碱(例如氨或三甲胺)、酸、氟化物或光子等切割可切割键。
如本文中使用,术语“预先定义的寡核苷酸组合”意指寡核苷酸的组合,其中该组合是事先计划的。
如本文中使用的,“寡核苷酸的混合物”指含有多个不同的寡核苷酸的水性溶液,所述寡核苷酸溶解在该溶液中。混合物可包括至少50,至少100,至少500,至少1,000,至少5,000,至少10,000或至少50,000个或更多个寡核苷酸。寡核苷酸的混合物可以这样制作:原位合成寡核苷酸,即在阵列中就地合成寡核苷酸,然后在寡核苷酸被合成出来之后,将它们从阵列表面切割下来。此类方法的例子记载于例如Cleary et al.(Nature Methods 2004 1:241-248)和LeProust et al.(Nucleic Acids Research 2010 38:2522-2540)。在该实例中,可以利用例如碱(例如氨或三甲胺)、酸、氟化物或光子来切下寡核苷酸。
如本文中使用的,术语“多组”,在包含多组寡核苷酸的组合物的语境中,是指多个独立(distinct)的寡核苷酸群体,其中一组寡核苷酸可包含至少2个、至少5个、至少10个、至少50个、或至少100个或更多个(例如3至50个、例如4至30个)寡核苷酸,且组合物可含有至少5组、至少10组、至少50组、至少100组、至少500组、至少1,000组、至少5,000组或更多组寡核苷酸。
如本文中使用的,术语“能够被组装产生合成子的寡核苷酸组/一组寡核苷酸”及其语法上的等同物是指一组寡核苷酸,它们能够被酶促组装成更长的序列,该序列在本文中称为“合成子”(synthon),含有来自每个寡核苷酸的、以限定顺序排列的序列。应当理解,一个组中的寡核苷酸包括:(i)末端索引子序列和(ii)组装序列,其中每组寡核苷酸的各合成序列可以组装产生合成子。典型地,在真实的组装发生之前,寡核苷酸中的至少一些的末端索引子序列被移除。例如,一组寡核苷酸的组装序列可以在(i)或(ii)之后被组装:(i)在所有的末端索引子序列,除了一个之外,均已从组装序列被切割掉之后(在此情况下,合成子将会被栓系于阵列,见图1);或者(ii)在所有的末端索引子序列均已从组装序列被切割掉之后(在此情况下合成子会处于溶液中而不是栓系于阵列)。序列组装可以使用多种不同方法实现,包括但不限于聚合酶链式组装(Hughes,et al.Methods in Enzymology 2011 498:277-309及Wu,et al.J.Biotechnol.2006,124:496-503)和有序连接。Gibson组装(Gibson Methods in Enzymology 2011 498:349–361)在特定情形下可以使用。在某些实施方案中,在组装之前用限制酶或利用光或化学刺激消化寡核苷酸。
如本文使用的,术语“聚合酶链式组装”是指这样一种程序,其中将多个重叠的寡核苷酸组合,并施以多轮的引物延伸(即,在聚合酶和核苷酸的存在下,多个连续的引物延伸、变性、及复性的循环),以利用这些寡核苷酸彼此作为模板来扩增这些寡核苷酸,从而产生产物分子。在某些实例中,可以使用结合到产物分子末端位点的引物来扩增最终的产物分子。
如本文中使用的,术语“有序连接”(ordered ligation)是指这样的规程,其中利用DNA连接酶将双链片段彼此连接而产生合成子,其中合成子中的片段的顺序由被连接在一起的突出端的序列所决定。术语“有序连接”还指这样一种规程,其中单链寡核苷酸以限定的顺序彼此杂交,并且可以被连接到一起而产生合成子(参见例如图8最下部)。
在一个实例中,能够被组装产生合成子的寡核苷酸组是一组单链引物,所述引物具有突出末端,使得每个引物可以利用另一引物作为模板被延伸,并且能够通过聚合酶链式组装产生合成子。
在另一个实例中,能够被组装产生合成子的寡核苷酸组是一组寡核苷酸,这些寡核苷酸在其双链形式中能够被IIS型限制性内切核酸酶消化产生片段,所述片段能够以限定的顺序相互连接、从而生成合成子。
在另一个实例中,能够被组装产生合成子的寡核苷酸组是一组双链寡核苷酸,所述双链寡核苷酸含有交错的(staggered)可切割联接,使得所述双链寡核苷酸被合适的刺激(例如化学剂或光刺激)切割可产生这样的片段,所述片段能够以限定的顺序相互连接,
在另一个实例中,能够被组装产生合成子的寡核苷酸组是一组单链寡核苷酸,每个所述单链寡核苷酸含有可切割联接,使得所述单链寡核苷酸被合适的刺激(例如化学剂或光刺激)切割可产生这样的寡核苷酸:这些寡核苷酸能够以限定的顺序相互杂交并相互连接以产生合成子。
如本文中使用的,术语“末端索引子序列”是指在寡核苷酸群体的末端或其附近出现的独特序列,其中,每个寡核苷酸组内的寡核苷酸具有相同的索引子序列,且每个寡核苷酸组具有不同的索引子序列。索引子序列彼此不同,亦不同于彼此的互补序列。例如,第一种独特序列的核苷酸序列与第二种独特序列或其互补序列不同。各索引子序列彼此不相互杂交,即,它们被如此设计,使得它们在严格条件下不相互退火。这样的序列,某些文章中称为“序列记号”(sequence tokens),在例如US20070259357和Brenner等人(Proc.Natl.Acad.Sci.1992 89:5381-3)中有描述,将上述文献通过提述并入本文。末端索引子序列的长度可为8-50个碱基,例如10-35个碱基长。在一些情况下,末端索引子序列可长达100个碱基。
如本文使用的,术语“空间上分离的”,在“将各组寡核苷酸彼此在空间上分离”的语境中,是指将不同的寡核苷酸组彼此分开,使得不同的寡核苷酸组存在于阵列上不同的位置。具体而言,第一组中的寡核苷酸与阵列上第一个位置产生关联,第二组中的寡核苷酸与阵列上第二个位置产生关联,第三组中的寡核苷酸与阵列上第三个位置产生关联,以此类推。
如本文使用的,术语“单链寡核苷酸”是指大体上是单链的寡核苷酸分子。单链寡核苷酸可能在一个末端具有端的发夹(例如具有8-30个碱基对的茎的发夹)。
如本文使用的,术语“双链寡核苷酸”是指基本上为双链,例如含有至少50个碱基对的双链区的寡核苷酸分子。双链寡核苷酸可以作为长发夹被合成。在一些实施方案中,双链寡核苷酸可以由杂交在一起的单链寡核苷酸构成,如图11-14所示。
术语“合成子”,如本文所用的,指已经从数个更短的核酸体外组装而成的合成核酸。
说明书全文中可能出现其它术语定义。
示例实施方案描述
在描述各个实施方案前,应当理解本公开的教导不限于描述的具体的实施方案,并且因此当然可以变化。还应当理解,本文中使用的术语是仅为了描述具体的实施方案,并且并不意图为限制性的,因为本教导的范围仅会限于所附权利要求书。
本文中使用的部分标题仅为了组织目的,并且不应解释为以任何方式限制描述的主题。虽然本教导结合各个实施方案描述,但是并不意图本教导限于此类实施方案。相反,本教导涵盖各个备选、修改、和等同方案,如本领域技术人员应当领会。
除非另有定义,本文中使用的所有技术和科学术语与本公开所属领域的普通技术人员的通常理解具有相同的意义。虽然与本文中描述的方法和材料相似或等同的任何方法和材料也可以在实施或测试本教导中使用,现在描述一些例示性的方法和材料。
任何出版物的引用是为了其在申请日前的公开,并且不应解释为本发明没有资格承认凭借在先发明而早于此类出版物。此外,提供的出版日期可以不同于可以独立确认的实际出版日期。
如在阅读本公开后对于本领域技术人员会显见的,本文中描述并例示的每个单个的实施方案具有分立的组分和特征,其在不偏离本教导的范围或精神的前提下可以容易地与任何其它几个实施方案的特征分开或组合。可以以叙述的事件的次序或者以逻辑上可能的任何其它次序实施任何叙述的方法。
本文提及的所有专利和出版物,包括此类专利和出版物内公开的所有序列通过提及明确并入。
方法
一种方法的某些特征示于图1。在特定的实施方案中,该方法可包括(a)获得多组寡核苷酸的水性混合物4。在该实例中,第一组寡核苷酸由寡核苷酸A、B、C和D构成,第二组寡核苷酸由寡核苷酸W、X、Y和Z构成,其中,在该实例中,各寡核苷酸在相同基底的表面上原位合成(例如,使用例如Cleary et al.,Nature Methods 2004 1:241-248,LeProust et al.,Nucleic Acids Research 2010 38:2522-2540的方法),然后从支持物切割出来。如例示的,寡核苷酸在基底2上不需要以任何特定顺序合成。如上所述,每组寡核苷酸可以被组装以产生合成子,即可以被酶促组装成更长的序列,该序列以限定的顺序包含来自每个寡核苷酸的序列。在某些实施方案中,各寡核苷酸,在其双链形式中,能够被IIS型限制酶消化或者被化学品或光切割以产生片段,所述片段能够通过聚合酶链式组装或者通过有序连接而组装。在一些情况下,例如在依赖聚合酶链式组装的实施方案中,组中的每个寡核苷酸可具有这样的区域,所述区域具备与同组中的另一寡核苷酸(或其互补序列)的互补性(例如至少8个、至少12个、或至少15个核苷酸)。在一个实例中,能够被组装成合成子的寡核苷酸组是一组单链引物,所述引物具有重叠的末端,使得每个引物在切割后能够利用另一引物作为模板而延伸,且能够通过聚合酶链式组装产生合成子。
如上文指出的,每个组内的寡核苷酸各自包含末端索引子序列,并且能够被组装而产生合成子。换言之,每组内的寡核苷酸能够被组装以产生合成子,每组内的寡核苷酸含有相同的末端索引子序列,且不同组中的寡核苷酸以它们的索引子序彼此区分。接下来,该方法包括(b)将该寡核苷酸混合物杂交到阵列6,从而将不同组的寡核苷酸彼此在空间上分离。在这些实施方案中,一组的寡核苷酸定位到一个特征,另一组的寡核苷酸定位到另一特征。如所示的,寡核苷酸A、B、C、D定位到特征8,且寡核苷酸W、X、Y、Z定位到特征10。如所示的,这些寡核苷酸可以直接杂交到固定在阵列上的寡核苷酸。在下文更详细描述的其他实施方案中(图1中未显示),寡核苷酸可通过衔接子寡核苷酸杂交到固定在阵列上的寡核苷酸。如所示的,并且下文会更详细描述,杂交的寡核苷酸可以是单链的(例如,12),并且,在某些情况下,可包含3’发夹,3’发夹可以被延伸以产生双链延伸产物。在其他实施方案中,寡核苷酸可为双链寡核苷酸(例如14)。
接下来,该方法可进一步包括:(c)使阵列与溶液接触,从而为每个被所述寡核苷酸结合的特征产生独立的液滴,所述液滴包含一个或多个特征。如所示的,在图1中,特征8被包封在液滴16中,特征10被包封在特征18中。在这些实施方案中,溶液含有将杂交的寡核苷酸组装成合成子所需的所有必要试剂(可包括,例如,下述的一种或多种:聚合酶、核苷酸、连接酶、缓冲液和ATP)。例如,如果使用发夹寡核苷酸,那么该方法可进一步包括使阵列与包含聚合酶及核苷酸(以及,任选地,其他试剂,包括例如连接酶和ATP)的溶液接触,从而延伸该发夹,并且为每个被所述寡核苷酸结合的特征产生双链延伸产物的组。如果使用衔接子寡核苷酸,该方法可包括使阵列与包含聚合酶及核苷酸(以及,任选地,连接酶和ATP)的溶液接触,从而延伸该衔接子,并且为每个被所述寡核苷酸结合的特征产生双链延伸产物的组。如上文指出的,该方法可以通过多种不同方式实施,可以通过如下进行:将阵列浸入含有全部必需试剂的水性溶液中,其中特征与非特征区域之间的疏水性将液体的液滴限制于特征。
然后,方法可进一步包括将不可混溶的液体20置于液滴之上,藉此为每个被所述寡核苷酸结合的特征产生独立的反应室(即各面(即一面被基底,另一面被不可混溶的液体)全被包封的液滴)。如图1所示,添加不可混溶液体20导致生成反应室22和24。不能混溶的液体可以包含矿物油如Petroleum Special,烷如十七烷,卤化烷如溴代十六烷,碳酸油,全氟碳,部分氟化的液体例如3M的NovekTMHFE-7500,烷基芳烃(alkylarene),卤化烷基芳烃,醚,或具有高于100℃的沸腾温度的酯,举例而言。不能混溶的液体在水中应当是不溶的或微溶的。在某些情况下,液体可以含有或不含添加的具有等于、小于、或大于例如4.0、5.0、6.0、7.0、8.0、9.0或10.0的亲水性-亲脂性平衡(HLB)值的表面活性剂。本领域技术人员可以领会,可以通过使用具有各种HLB值的各种表面活性剂来调节油相的表面活性剂亲和力差异(SAD),使得可以制备稳定的液滴。例如,可以使用可降低非氟化化合物的溶解度的氟化载体油(具有氟化尾部的表面活性剂)。在某些情况下,可以使用硅油,矿物油,碳链油和全氟化聚碳链及其改性物,或小的非极性分子(四氯化碳,醚,氯仿等)。在这些实施方案中,可以通过轻轻地移液不可混溶液体到阵列顶部,使流体流过包括阵列基板的流动池或室,来将液滴包封在不可混溶液体中,尽管也可以使用其他方法(例如,将阵列浸入不可混溶液体)。
接下来,将反应室保持在寡核苷酸组装成合成子的条件下。该方法的该步骤可以包括将阵列保持在等温条件下(例如,在30℃和75℃的范围内的温度(取决于所使用的酶)),然而在一些情况下,可以对阵列进行热循环。在图1显示的实例中,反应产生合成子26(其包含来自寡核苷酸A、B、C和D的序列)和合成子28(其包含来自寡核苷酸W、X、Y和Z的序列)。这些寡核苷酸(或它们的经延伸的版本)可以使用(例如)聚合酶链式组装或有序连接组装成合成子。
在聚合酶链组装实施方案中,将多个重叠的寡核苷酸组合并进行多轮引物延伸(即,在聚合酶和核苷酸存在下的引物延伸,变性和复性的多个连续循环),以使寡核苷酸彼此作为模板,从而产生产物分子。在使用聚合酶链组装的实施方案中,可以组装产生合成子的初始寡核苷酸组可以是具有重叠末端的单链引物组,使得每个引物可以使用另一个引物作为模板进行延伸,并且可以产生聚合酶链式组装的合成子。
在有序连接方法中,使用DNA连接酶将双链片段彼此连接以产生合成子,其中合成子中各片段的顺序由被连接到一起的各突出端的序列所决定。在这些实施方案中,能够被组装产生合成子的初始寡核苷酸组可以是这样的寡核苷酸的组:所述寡核苷酸在其双链形式中可被IIs型限制性内切核酸酶消化以产生片段,所述片段可按照限定的顺序彼此连接,从而产生合成子。在备选的实施方案中,能够被组装产生合成子的初始寡核苷酸组可以是这样的双链寡核苷酸的组,所述双链寡核苷酸包含交错的可切割联接,其中在通过适当的刺激切割所述联接之后,产生可彼此连接的片段。该实施例在图7中示出。在该实施方案中,使用在适当位置含有可化学切割或可光切割接头的寡核苷酸。5'末端包含末端索引子序列,该序列将结合于阵列;圆圈代表两种类型的可切割接头。寡核苷酸与阵列杂交。在某些情况下,可以进行任选的连接步骤。在这些实施方案中,微阵列上的寡核苷酸的5'-末端可以被合成为含有所需的末端磷酸,或者使用激酶将其磷酸化。连接后,寡聚物共价连接到表面。如果不进行连接步骤,则不需要3'-末端的可切割接头,并且原始寡核苷酸可以直接合成为具有所需的末端3'-OH。在任一情况下,进行洗涤以除去不需要的寡聚物。可化学切割的接头需要在一定条件下切割,使得经切割的寡聚物在表面上保持其空间位置而不发生可能的交叉污染,例如使用氨气或光。
在一些情况下,可能需要两种不同的可化学切割的接头。一些接头应遗留3'-OH,而其它接头应遗留5'磷酸。一种合适的可用于5'-磷酸末端形成的亚磷酰胺如下所示。这种接头及其它合适的遗留5'-末端磷酸酯的接头可以从商业来源获得。
对于寡核苷酸的以3'-羟基终止的末端,合适的亚磷酰胺单体是已知的,并且包括相关的亚磷酰胺(US20040152905)和胸苷-琥珀酰基己酰胺CED亚磷酰胺(Chemgenes)。使用胸苷-琥珀酰基己酰胺CED亚磷酰胺接头,将产生在3'-末端以T残基终止的寡核苷酸。可以构建替代的接头,使得寡核苷酸以任何所需的碱基终止。
在用氨气化学切割后,可以把组装粘性末端寡核苷酸所需的连接酶加入到将要覆盖每个特征的液滴中。
也可以使用可光化学切割的接头。由于特征尚未被切割,可以用含有连接酶和缓冲液的单独的液滴覆盖它们,而不必担心交叉污染(例如可以这样产生:将载玻片浸入试剂的大量储液中,随后小心取出,以在特征上,而不在特征之间的表面上留下“试剂液滴”)。在用水性缓冲液和酶的溶液(和任选地不混溶的流体以防止蒸发)覆盖单个特征之后,将载玻片暴露于适当波长的光以切割寡核苷酸。随后的粘性末端寡核苷酸的连接可在同一液滴中进行。
一种在5'-末端留下所需磷酸酯的市售(Glen Research)可光切割的接头亚磷酰胺如下所示。
一种合适的可遗留3’-OH的可光切割的接头如下所示。
使用这样的接头,最后一个残基可以纳入接头结构本身中,并且如果需要,可以合成包含任何碱基作为最后残基的替代的可光切割的接头。
本公开的实施例部分以及图7和图8中进一步详细描述了如何使用含有可光切割或可化学切割的接头的寡核苷酸组装合成子。
图11-14显示了一种用于产生可组装的切割产物的替代方法。在这些实施方案中,不含有发夹的单链寡核苷酸彼此杂交以形成双链体,并且每个双链体的寡核苷酸之一含有末端索引子序列,该序列与固定在阵列上的寡核苷酸(直接或通过衔接子间接地)杂交。然后切割固定的双链体(使用例如IIS型限制性内切核酸酶,或如上所述的化学或光刺激),并使用任何合适的方法彼此组装。如图11和12所示,每个双链体可以在两个位点(一个位点邻近阵列,另一个位点远离阵列)处被切割,以产生含有适当的突出端的片段。在其它实施方案中(如图13和14所示),双链体可以在切割之前已经含有突出端之一。在这些实施方案中,双链体可以在单个位点(其邻近阵列)处被切割,以产生含有适当的突出末端的片段。
如图1所示,合成子在被制备后可以固定在阵列上(例如通过接头30和32)。在其它实施方案中,合成子可以在反应室中的溶液中(即,不固定在阵列上)。这可以通过,例如,用限制酶消化合成子,或通过切割将合成子固定到阵列的接头来完成。在一些实施方案中,可以使用全部处于溶液相的一组切割产物进行组装,得到不是固定于阵列上的合成子。在这些实施方案中,所述方法可以涉及:将一组寡核苷酸与其他组的寡核苷酸在空间上分离,切割所示寡核苷酸(例如,如果寡核苷酸是单链的,则使用化学或光刺激,或者如果寡核苷酸是双链的,则利用化学或光刺激,或限制酶),然后将产物(其现在处于溶液相中)组装成合成子。在某些情况下(特别是如果合成子固定在阵列上时),可以除去不可混溶的流体和液滴,并且可以在从阵列释放合成子之前洗涤阵列的表面。然后可以将合成子收集在水相中,并且在某些情况下,使用结合到合成子末端位点的引物(例如通用引物)扩增。该方法可以用于平行制备至少10,至少50,至少100,至少500,至少1,000,至少5,000,至少10,000或至少50,000个合成子。在其它实施方案中,使用处于溶液相中的引物,合成子可以通过原位扩增,即,当它们附着到阵列表面(例如通过接头30和32)的同时进行扩增。
IIS型限制性内切核酸酶是具有从切割位点偏移的识别位点的限制性酶。有许多内切核酸酶可用于本文所述的基因组装方法。以下是可以使用的II型酶的不完全列表:Acc36I,AceIII,AcuI,AlfI,AloI,Alw26I,AlwXI,BaeI,Bbr7I,BbsI,Bbv16II,BbvI,BbvII,Bce83I,BceAI,BcefI,BcgI,Bco116I,Bco5I,BcoKI,BfuAI,Bli736I,Bme585I,BpiI,BplI,BpmI,BpuAI,BpuEI,BpuJI,BpuSI,BsaI,BsaXI,Bsc91I,BscAI,Bse3DI,BseGI,BseKI,BseMI,BseMII,BseRI,BseXI,BseZI,BsgI,BslFI,BsmAI,BsmBI,BsmFI,Bso31I,BsoMAI,Bsp24I,Bsp423I,BspBS31I,BspCNI,BspD6I,BspIS4I,BspKT5I,BspLU11III,BspMI,BspST5I,BspTNI,BspTS514I,BsrDI,Bst12I,Bst19I,Bst6I,Bst71I,BstBS32I,BstF5I,BstFZ438I,BstGZ53I,BstMAI,BstOZ616I,BstPZ418I,BstTS5I,BstV1I,BstV2I,Bsu6I,BtgZI,BtsI,BveI,CjeI,CjePI,CspCI,CstMI,Eam1104I,EarI,EciI,Eco31I,Eco57I,Eco57MI,EcoA4I,EcoO44I,Esp3I,FalI,FaqI,FauI,FokI,GsuI,HaeIV,HgaI,Hin4I,Ksp632I,LweI,MmeI,PhaI,PpiI,PsrI,RleAI,SapI,SfaNI,SmuI,Sth132I,StsI,TaqII,TspDTI,TspGWI,Tth111II,和VpaK32I。这些酶都具有共同的一个特征是它们会在一个末端留下没有特异性识别序列的突出端。由于突出端的碱基数,识别位点之间的距离和它们切割底物的效率,它们具有不同程度的效用。5'或3'突出端由不同的IIS型酶产生。任何类型的突出端都可以用于该方法,酶的组合或混合物亦然,无论是用于提高切割效率或是突出端多样性和特异性的目的。
合成子本身可以是任何序列,并且在某些情况下,可以编码氨基酸序列,即可以是编码序列。在其他实施方案中,合成子可以是调节序列,例如启动子或增强子。在特定情况下,合成子可编码调节RNA。在某些情况下,合成子可以具有生物或结构功能。
在特定情况下,可将合成子克隆到设计用于表达合成子的表达载体中。在这些实施方案中,表达载体可以含有启动子,终止子和其它必需的调节元件,以实现转录,并且在某些情况下实现合成子的翻译,或者是作为单一蛋白,抑或作为与另一种蛋白的融合物。在这些实施方案中,所述方法可以进一步包括将表达载体转移到细胞中以产生由合成子编码的表达产物(例如蛋白质)。该方法的该实施方案可以包括筛选表达产物的活性。
还提供了包含多组寡核苷酸的组合物,其中每组内的寡核苷酸包含末端索引子序列,并且可以组装以产生合成子。在一些组合物中,寡核苷酸,在其双链形式中,可被IIs型限制酶消化以产生片段,所述片段可通过有序连接或聚合酶链式组装而组装。在特定情况下,组合物可包含:第一组式A-X的合成寡核苷酸,其中A为第一组中全部寡核苷酸所共有的末端索引子序列,且X在第一组的各寡核苷酸中不同;其中第一组中的寡核苷酸,在其双链形式中,可被IIs型限制性酶消化以产生能够以限定的顺序彼此组装的片段;和第二组式B-Y的合成寡核苷酸,其中B对于第二组中的所有寡核苷酸是共同的,并且不同于A,并且其中Y在第二组中的各寡核苷酸中不同;其中第二组中的寡核苷酸在其双链形式中可被IIs型限制酶消化,以产生能够以限定的顺序彼此组装的片段。
实施例
以下实施例描述了从200个核苷酸寡核苷酸(200聚体)开始组装~1,500个碱基对构建体的两种相关方法,所述寡核苷酸在微阵列表面上合成,然后从底物上切下,由此产生寡核苷酸的复杂混合物。在另一微阵列上的限定的特征中组装1.5kbp构建体。在这种格式中,在一个微阵列载玻片上可以同时组装32,000个1.5kbp构建体。这相当于4800万个碱基对的组装。显然,该描述是示例性的。所述方法不限于1.5kbp构建体,并且所述方法可以推广用于构建任何长度的基因或不同长度的基因的组。以下专利申请的全部教导据此通过引用并入本文:2014年4月15日提交的61/979,711。
实施例1
起始材料
标准微阵列载玻片:微阵列载玻片上的每个特征,例如约4,000个特征,每个特征包含~50聚体的探针,该探针具有:5'25聚体的独特序列,用于从寡核苷酸文库寻址并捕获组装所需的每个寡核苷酸;以及3’25聚体的支柱区域。在该实施例中,各寡核苷酸探针的3'末端附接于微阵列的表面。该实施例假定每个特征具有~4×10-17摩尔的探针。
寡核苷酸文库合成(OLS):为一批4,000个1.5kbp组装体(4,000个组装体×10个寡核苷酸/组装体×6个冗余特征/寡核苷酸=240,000个总特征数)合成一个~200聚体寡核苷酸的244,000个特征的载玻片,每个寡核苷酸具有150个核苷酸的工作有效载荷,其中给定组装体的所有寡核苷酸序列均具有:与(用于寡核苷酸组装的单独微阵列的)微阵列探针特征互补的共有的5'25聚体序列、以及充当产生DNA的第二链所需的聚合酶引物位点的3'发夹序列。这种发夹寡核苷酸的一个实例示意性地示于图2中。对于OLS,可以假定10%全长产率,其将提供约2.5×10-17摩尔的每种寡核苷酸。每个寡核苷酸还将含有两个独立的IIs型限制性核酸内切酶位点,一个靠近所得dsDNA的5'端,另一个靠近所得dsDNA的3'端,当被切割时,将驱动~150碱基对片段的使用DNA连接酶的组装。这里,每个组装体的寡核苷酸数目(10)是示例性的,所需的数目可以小至2个,大至几百个或更多。
该实施例的一种变化形式是合成具有发夹结构的200聚体,其具有与微阵列探针特征互补的5'25聚体突出端序列,从而双链DNA片段的两条链均由OLS提供。该方法无需用DNA聚合酶填充寡核苷酸,并且还容许在合成期间或之后使用MutS或T7内切核酸酶进行减少错误步骤,但其将使用现有化学连接到较大构建体中的每个片段的大小限制为不超过100个碱基对。这将限制最终组装产品的长度,或者增加为了组装较长长度的产品而要连接在一起的片段的数量。
微阵列上的DNA聚合
将寡核苷酸文库混合物加入到杂交室中的标准寻址微阵列中,并将混合物杂交以将给定组装体所需的所有寡核苷酸共同定位于微阵列上的每个限定特征。洗涤后,然后将DNA聚合酶(例如,5'至3'外切(-)聚合酶),dNTP,DNA连接酶和ATP加入杂交室中,以产生并共价锚定双链DNA,所述双链DNA对应于为每个微阵列特征限定的特定组装体的所有片段。在一些情况下,例如,如果完整发夹寡核苷酸文库与微阵列杂交,则可以省略DNA聚合步骤,但将双链体稳固锚定到特征探针的连接步骤对合成仍然是有益的。这种扩展产物的一个示例在图3中示意性地示出。
将反应混合物温育,然后洗涤以除去未结合的延伸寡核苷酸。在某些情况下,加入一些添加剂来增加特征与间隙基底区域之间的疏水-亲水边界对于洗涤步骤可能是有益的。
微阵列上的组装
然后将微阵列载玻片暴露于或“浸入”包含缓冲液、II型限制性内切核酸酶、DNA连接酶和ATP的溶液中。这种对缓冲试剂的暴露也可以通过在封闭室内盥洗和冲刷底物,或将底物浸入缓冲的酶溶液中来完成。由于微阵列特征和间隙基底之间的疏水-亲水边界,水性溶液将在包含DNA的亲水特征上形成小液滴,从而将每个由微阵列特征限定的组装反应隔离起来。所生成的室在图4中示意性地示出。
现在附接于微阵列探针的双链DNA片段被设计为在两端具有标准的IIs型限制酶位点(例如Bsa1),这些位点当被切割时,产生5'-末端突出端(“粘性末端”),每个突出端具有短的、在每个液滴内独特的序列(4-6个核苷酸),此序列将决定各片段连接在一起的顺序。IIs亚类的限制酶在偏离识别位点的位置切割核酸。这种性质使得寡核苷酸设计者能够利用对所有片段而言共同的限制酶来设计具有独特的突出端序列的片段序列。这些独特的突出端序列为长构建体的有序自组装创造了条件,使得每个组分以正确顺序和取向(由每个片段的突出端序列所决定)组装。据估计,半球形液滴中10个DNA片段的DNA浓度分别>50nM,这足以驱动互补“粘性末端”的杂交以便于连接。注意,如果5'-末端片段在其5'端含有第二个IIS型限制酶切割位点(例如FokI),则组装好的DNA构建体将保持附接于微阵列表面,允许额外的组装后洗涤步骤(如果必要)。然后可以通过用第二限制性内切核酸酶切割将组装好的构建体从基底释放,或者可以让其保留附接,以便随后在连接于表面的同时进行扩增。或者,可以利用可化学切割的接头来从基底释放构建体。然后使用PCR扩增释放出的组装好的构建体,扩增个别地进行或者以组装体组为单位进行,由组装好的构建体的5’末端与3’末端内的PCR引物结合位点所定义。以这种方式,可以从相同的复杂构建体池中独立地分离多组基因,每组基因组包含独特的特定途径或机制。
如果需要,可以在寡核苷酸合成步骤或在微阵列上组装之后,且在释放之前,在隔离的特征液滴内,用可识别并在错配位点切割的内切核酸酶(例如T7内切核酸酶)进行减少序列错误步骤。对于后述的方法,可以在受控湿度室(或使用外加的使蒸发最小化的试剂)加热微阵列以在隔离的液滴内形成异双链体,然后浸入含有T7内切核酸酶的溶液中以破坏所有含有错配和凸起(bulge)的分子。然后如上所述扩增和分离最终减少了错误的混合物。
为了帮助每个寡核苷酸特征的反应体积的有效隔离,可以将液滴浸入油或不与酶活性所需的水溶液混溶的另一种液体中。该油或隔离流体使得反应能够持续每个液滴内的大多数分子完成构建体组装所需的任何时间。或者,可通过气化挥发性隔离流体(例如短链氟化烃),并让其凝结到基底表面上和其上的液滴上,来添加不混溶溶液。一旦非水性边界层覆盖水性液滴,可以让额外的非水性流体流入室中以改善液滴的隔离。该隔离流体一旦到位,可使得液滴的温度能够发生实质变化,而不会混合液滴或液滴蒸发,从而优化反应速率。
为了控制反应速率和每个反应的持续时间,对不存在隔离流体的情况下的湿度和容纳载玻片或晶片的室的温度加以控制。测定的一项挑战是控制用于释放片段的限制性酶的相对反应速率以及试剂流过基底以产生隔离的液滴的流速。如果酶立即作用,则在实现液滴隔离之前许多片段可能已被洗掉。该酶反应可以通过温度和盐来控制。限制酶具有相当大的温度依赖性,在低于10℃的温度下酶活性严重降低(参见例如Fritz et al,Eur.J.BioChem,123,141-152(1982))。因此,通过将基底和溶液冷却至高于冰点少数几度,可以有效地关闭酶的活性。随后,一旦液滴被适当地隔离,通过载体流体,可以将基底温热至优化酶活性的温度。嗜热限制性酶,包括TaqII,在高达65℃仍具有活性。如果天然的嗜热酶不能提供足够的效率,则可以创建“热启动”,或者可能更恰当地,“温启动”核酸内切酶,来延迟片段的切割,直至达到起始温度。热启动聚合酶通过发现结合聚合酶活性位点的抗体而产生的(参见例如BioTechniques,16(6),1134-1137(1994))。在该实施方案中,通过在低于核酸酶的“启动”温度的温度的溶液中浸渍形成液滴,然后将基底加热(在精确的湿度控制下或在由两相表面乳液,例如油包水乳液的保护下)至足以除去保护基团或抗体的温度,通常为25℃至50℃,对于少数内切核酸酶甚至高达70℃,然后在优化的温度下进行酶促内切核酸酶反应,并在各自相应的优化温度进行任何随后的聚合酶和连接反应。更一般地,可以利用具有不同最佳操作温度的不同酶来将反应序列分阶段,其中每个反应依次在比在先反应更高的温度下发生。
控制酶切割切割的另一种机制是去除溶液中酶活性所需的二价阳离子(通常是镁)。这些二价离子应该可能通过引入盐来添加,所述盐呈离子载体流体的形式,所述离子载体流体与所述液滴的水溶液不混溶。如果必需的盐首先溶解在隔离流体中,则当载体流体在液滴包封后与水溶液达到平衡时,载体流体将它的一些离子转移到装载有酶的液滴。
实施例2
起始材料
标准微阵列载玻片:微阵列载玻片上的每个特征(例如~4,000个特征)各自包含~50聚体探针,所述探针具有5'25聚体的独特序列,用以寻址和捕获组装所需的每个AOM寡核苷酸(参见下文),以及3'25聚体的支架区。该实施例假定每个特征具有~4×10-17摩尔的探针。
50聚体衔接子寡核苷酸混合物(Adaptor Oligonucleotide Mixture,AOM)的通用储液:通过标准384孔合成(IDT)合成AOM寡聚物,并混合成混合物,其中每个AO的5'-25聚体序列与~4,000个标准微阵列寻址序列之一互补,所述寻址序列具有独特的3'-25聚体配偶序列,该配偶序列在约4,000个寡核苷酸的组中也是独特的,将会用作每个限定的组装体(见下文)所需的所有OLS寡核苷酸的捕获及DNA聚合酶引发位点。
寡核苷酸文库合成(OLS):为一批4,000个1.5Kbp组装体(4,000个组装体×10个寡核苷酸/组装体×6个特征/寡核苷酸=240,000)合成一个244K~200聚体OLS(具有150个核苷酸有用序列),其中给定组装体的所有寡核苷酸具有共同的5'25聚体序列,该序列与微阵列探针特征互补。对于OLS,可以假定10%全长产率,这将提供约2.5×10-17摩尔的每种寡核苷酸。每个寡核苷酸还将在所得的dsDNA的5'和3'末端处包含IIs型限制性内切核酸酶位点,所述位点当被切割时将驱动~150碱基对片段使用DNA连接酶组装。图5示意性地显示了通过衔接子寡核苷酸锚定到微阵列上的OLS寡核苷酸。
微阵列DNA聚合
将OLS/AOM混合物预杂交到OLS。然后将该OLS/AOM混合物加入标准微阵列杂交室中并杂交,以将给定组装所需的全部寡核苷酸共同定位到微阵列上的每个限定的特征。洗涤后,然后将DNA聚合酶(例如,5'至3'外切(-)聚合酶)、dNTP、DNA连接酶和ATP加入杂交室中以产生并共价锚定双链DNA,所述双链DNA对应于为每个微阵列特征定义的特定组装的所有片段。注意,如果完整的发夹OLS(见上文)与微阵列杂交,则可以省略DNA聚合步骤。图6示意性地示出了通过其末端索引子序列与微阵列杂交的双链OLS寡核苷酸。
将反应混合物温育,然后洗涤以除去未结合的延伸探针。洗涤步骤可能需要添加一些添加剂以增加特征和间隙区域之间的疏水-亲水边界。
微阵列上组装
然后将微阵列载玻片“浸入”包含缓冲液、II型限制性内切核酸酶、DNA连接酶和ATP的溶液中。由于微阵列特征和间隙基质之间的疏水-亲水边界,水性溶液将在包含DNA的亲水特征上形成小液滴,从而隔离由微阵列特征限定的每个组装反应,如上所述。
与上述“浸渍”相比更有效的一个实施方案涉及将微阵列暴露于流动池内的酶,其中在精确控制的过程中让各试剂顺序地流过基底的表面。就所需的试剂的体积而言,该方法的效率高得多。
现在附接于微阵列探针的dsDNA片段在两端具有标准的IIs型限制位点(例如Bsa1位点),这些位点当被切割时,产生具有独特序列的5'-末端突出端(“粘性末端”),这些序列将决定各片段连接在一起的顺序。Rs亚类的限制酶在偏离识别位点的位置切割核酸。这种性质使得寡核苷酸设计者能够利用对所有片段而言共同的限制酶来设计具有独特的突出端序列的片段序列。这些独特的突出端序列为长构建体的有序自组装创造了条件,使得每个组分以正确顺序和取向组装。据估计,半球形液滴中10个DNA片段的DNA浓度分别>50nM,这足以驱动互补“粘性末端”的杂交以便于连接。注意,如果5'-末端片段在其5'端含有第二个IIs型限制位点(例如FokI),则组装好的DNA构建体将保持附接于微阵列表面,允许额外的组装后洗涤步骤(如果必要)。然后可以通过用第二限制性内切核酸酶切割来释放组装好的构建体。或者,组装好的构建体缺少第二切割位点,可以利用溶液相中的引物在其附接于阵列的同时将其原位扩增。然后可以使用PCR扩增组装好的构建体,扩增个别地进行或者以组装体组为单位进行,由组装好的构建体的5’末端与3’末端内的PCR引物结合位点所定义。
如果需要,可以在OLS步骤或在微阵列上组装之后,且在释放之前,在隔离的特征液滴内用T7内切核酸酶进行减少错误步骤。已知T7内切核酸酶在富含锰的缓冲液的存在下优先切割由于错配而产生的凸起。对于该减少错误方法,在湿度室中加热微阵列以在隔离的液滴内形成异双链体,然后将其暴露于含有T7内切核酸酶的溶液,以破坏所有含有错配和凸起的分子。然后如上所述扩增最终减少了错误的混合物。
实施例3
这个实施例,如图8所示,显示了使用单链寡核苷酸的方法。在该实施例中,使用可切割接头能够实现单链组装技术。制备含有单个可切割接头,例如可光切割接头的单链寡核苷酸的文库。5'端包含将结合到阵列的末端索引子。寡核苷酸通过末端索引子结合到微阵列上。因为不需要像在其它方法中那样合成双链发夹,所以末端索引子可以更长,允许更严格的洗涤而不需要连接。
在杂交和洗涤后,通过浸渍或其它方式将最终组装所需的连接缓冲系统置于单个特征上。将载玻片暴露于适当波长的UV光(例如,在之前例示的接头的情况下约340-370nm)—可以进行修饰以改变波长),并且从表面切割下寡核苷酸,在被切割的寡核苷酸上留下5'-磷酸。
然后,具有相同末端索引子的各个单链寡核苷酸可以在同一液滴中组装在一起成为更大的构建体,而不需要进一步添加试剂。如图所示,一种组装方法是重叠寡核苷酸的连接,而在寡核苷酸与寡核苷酸之间不存在任何间隙。
示例性实施方案
本文提供一种方法,包括:(a)获得多组寡核苷酸的混合物,其中每组内的寡核苷酸各自包含末端索引子序列,并且可以组装以产生合成子;和(b)将该寡核苷酸混合物与阵列杂交,从而将不同组的寡核苷酸彼此在空间上分离。在任何实施方案中,每组的寡核苷酸可以通过聚合酶链式组装或有序连接来组装。
在任何实施方案中,所述混合物可以包含至少50个、至少100个、至少500个、至少1,000个、至少5,000个、至少10,000个、或至少50,000个或更多个寡核苷酸。
在任何实施方案中,混合物可以包含至少5组,至少10组,至少50组,至少100组,至少500组,至少1,000组,或至少5,000组或更多组寡核苷酸。
在任何实施方案中,每组可以包含至少5个,至少10个,至少50个或至少100个或更多(例如3至50个,例如4至30个)的寡核苷酸。
在任何实施方案中,末端索引子序列的长度可以在10-50个核苷酸的范围内。
在任何实施方案中,寡核苷酸可以是单链寡核苷酸。
在任何实施方案中,寡核苷酸可以含有简并碱基,包括如IUPAC核苷酸代码所定义的N,Y,R,S,W,K,M,B,D,H和V。
在任何实施方案中,寡核苷酸可以是双链寡核苷酸。
在任何实施方案中,寡核苷酸可以是单链的,并且包含3'发夹,该3'发夹可以延伸以产生双链延伸产物。
在任何实施方案中,所述方法可以进一步包括使所述阵列与包含聚合酶和核苷酸的溶液接触,从而延伸所述发夹并为每个被所述寡核苷酸结合的特征产生一组双链延伸产物。
在任何实施方案中,寡核苷酸可以直接与固定在阵列上的寡核苷酸杂交。
或者,寡核苷酸可以通过衔接子与固定在阵列上的寡核苷酸杂交。
在任何实施方案中,所述方法可以包括使所述阵列与包含聚合酶和核苷酸(和任选地,连接酶和ATP)的溶液接触,从而延伸衔接子,并为每个被寡核苷酸结合的特征产生一组双链扩展产物。
在任何实施方案中,所述方法还可包括:(c)使所述阵列与溶液接触,从而为每个被寡核苷酸结合的特征产生包含一个或多个特征的分立液滴。
在该实施方案中,该方法可以进一步包括在液滴上放置不可混溶的液体,从而为每个被寡核苷酸结合的特征产生由液滴限定的分立的反应室。
在该实施方案中,所述方法可以进一步包括在这样的条件下温育阵列:所述条件使得合成子在每个反应室中被组装。
在该实施方案中,液滴可以包含双链寡核苷酸或双链延伸产物,并且溶液包含IIs型限制性内切核酸酶、DNA连接酶和ATP。
在该实施方案中,通过IIs型限制性内切核酸酶消化双链寡核苷酸或双链延伸产物的产物可以通过分立的反应室中的DNA连接酶以限定的顺序彼此连接,从而产生合成子。
在一些实施方案中,寡核苷酸是包含交错的可光切割或可化学切割的联接的双链寡核苷酸,并且其中所述方法包括使用光或化学处理来切割交错的可切割联接,以产生可依次彼此连接的片段。
在一些实施方案中,液滴包含双链寡核苷酸或双链延伸产物,并且溶液包含IIs型限制性内切核酸酶、DNA连接酶、ATP、核酸外切酶、聚合酶和核苷酸。
在一些实施方案中,寡核苷酸是单链寡核苷酸,并且所述方法包括:从寡核苷酸切割末端索引子序列以从寡核苷酸释放出组装序列;和通过聚合酶链式组装或通过连接反应(ligation)而从组装序列组装合成子。
在一些实施方案中,切割可包括切割可光切割的联接。
在任何实施方案中,该方法可以进一步包括从阵列中分离合成子。该实施方案可以包括使用限制酶从阵列切割合成子。
在任何实施方案中,所述方法可以进一步包括使用与合成子的末端杂交的引物通过PCR扩增合成子。
在任何实施方案中,分立的液滴中的连接产物可以是编码序列。
在一些实施方案中,所有双链延伸产物,除了其中一个之外,均在两端具有相同的IIs型限制酶的识别位点。
在任何实施方案中,合成子的长度可以为至少500bp,至少1kb,或至少2kb bp。
在任何实施方案中,可以在步骤(c)之后使用识别错配并在错配处切割的内切核酸酶(例如T7内切核酸酶)除去异双链体。在任何实施方案中,通过IIs型限制酶消化产生的片段的长度可以在50bp至200bp的范围内。
在任何实施方案中,所述不同组在与索引子序列互补的寡核苷酸的阵列上空间上分离。
在任何实施方案中,每个液滴可以包含IIs型限制性内切核酸酶、连接酶和双链连接产物。
在任何实施方案中,阵列可以包含至少100个不同的液滴,其中每个液滴包含不同的双链连接产物。
还提供了包含多组寡核苷酸的组合物,其中每组内的寡核苷酸包含末端索引子序列,并且可以组装以产生合成子。
在一些组合物中,寡核苷酸,在其双链形式中,可被IIs型限制酶消化以产生能够通过聚合酶链式组装或有序连接而组装的片段。
在任何实施方案中,混合物可以包含至少50个,至少100个,至少500个,至少1,000个,至少5,000个,至少10,000个或至少50,000个或更多个寡核苷酸。
在任何实施方案中,混合物可以包含至少5组,至少10组,至少50组,至少100组,至少500组,至少1,000组或至少5,000组或更多组寡核苷酸。
在任何实施方案中,每组可以包含至少5个,至少10个,至少50个或至少100个或更多(例如3至50个,例如4至30个)寡核苷酸。
在任何实施方案中,末端索引子序列的长度可以在10-50个核苷酸的范围内。
在任何实施方案中,组合物可以包含:第一组式A-X的合成寡核苷酸,其中A是对第一组中所有寡核苷酸而言为共同的末端索引子序列,并且X在第一组的各寡核苷酸中是不同的;其中第一组中的寡核苷酸在其双链形式中可被切割(使用IIs型限制性酶或化学/光刺激),以产生能够以限定的顺序组装(例如彼此连接)的片段;和第二组式B-Y的合成寡核苷酸,其中B对于第二组中的所有寡核苷酸而言是共同的,并且不同于A;并且其中Y在第二组中的各寡核苷酸中不同;其中第二组中的寡核苷酸在其双链形式中可被切割(使用IIs型限制性酶或化学/光刺激),以产生能够以限定的顺序组装(例如彼此连接)的片段。
在一些实施方案中,组合物可包含多组寡核苷酸,其中每组内的寡核苷酸包含:(i)末端索引子序列和(ii)组装序列,其中所述末端索引子序列和组装序列由可光切割或可化学切割的接头所分开,并且每组寡核苷酸的各组装序列可以被组装以产生合成子。
在一些实施方案中,每个组的各组装序列包含重叠互补序列(overlapping complementary sequences),所述重叠互补序列在末端索引子序列被切割后可以彼此直接连接。寡核苷酸的这种配置示意性地示于图9,其中重叠互补序列(“组装序列”)显示为杂交到一起形成双链体,末端索引子序列是尾部,可切割接头显示为那些序列之间的黑点。如上所述,终端索引子序列与阵列的特征杂交,如图10所示。
在一些实施方案中,每个组的各组装序列包含重叠互补序列,所述重叠互补序列可以在末端索引子序列切割后通过聚合酶链式组装而组装。
还提供了一种装置,其包括:平面支持物、在平面支持物的表面上的多个空间上独立(spatially distinct)的液滴、和覆盖液滴的不可混溶的液体,其中所述装置包括多个由所述液滴限定的反应室,每个反应室包含一个不同的合成子。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种构建Hi‑C高通量测序文库的方法与制造工艺
- 桑葚病原菌高通量鉴定及种属分类方法及其应用与制造工艺
- 基于高通量测序技术检测乳腺癌/卵巢癌易感基因的多重PCR特异性引物、试剂盒及方法与制造工艺
- 基于高通量测序检测人EGFR基因变异的质控方法及试剂盒与制造工艺
- 基于高通量测序技术的小麦病原微生物检测方法及其应用与制造工艺
- 一种基于二代高通量测序技术的地中海贫血症的基因检测试剂盒的制造方法与工艺
- 一种基于集群的高通量数据分析方法与制造工艺
- 高通量双折射干涉成像光谱仪装置及其成像方法与制造工艺
- 高通量测序检测人循环肿瘤DNA EGFR基因的捕获探针及试剂盒的制造方法与工艺
- 一种高通量测序检测无创亲子鉴定的方法与制造工艺