用于减少病原体诱导的柑橘青果病的组合物和方法与流程
柑橘黄龙病(HLB),也称为“柑橘青果病”,可能是最具毁灭性的柑橘疾病。其遍布于全世界大多数产柑橘的国家,其中在重度影响区域产生大量经济损失。可疑的HLB致病因子为需要复杂营养的限制在韧皮部的韧皮部杆菌(Candidatus Liberibacter)属细菌。三种不同的细菌物种与柑橘中的HLB有关:存在于除非洲外的所有受HLB影响国家的韧皮部杆菌属亚洲种(CaLas),目前限制在非洲的韧皮部杆菌属非洲种和当前限制在巴西和中国的韧皮部杆菌属美洲种。病原体传播通过昆虫媒介亚洲柑橘木虱,Diaphorina citri Kuwayama或非洲柑橘木虱,Trioza erytrea Del Guercio,通过菟丝子(菟丝子属物种(Cuscuta sp.))和通过用患病接穗嫁接发生。
在受HLB影响的柑橘植物中观察的典型叶症状为老叶的不均匀斑污斑纹和一系列萎黄图案,常常类似缺锌症状。然后跟随这些的是在疾病晚期细枝顶梢枯死、果实产量减少、过早落果、活力减少和树衰退。筛管元件堵塞和韧皮部坏死引起的运输作用流(tanlocation stream)堵塞似乎是疾病过程的主要因素。
HLB影响所有已知的柑橘物种和柑橘亲属,几乎没有已知的抗性。当前的管理策略为除去受感染的树、通过使用杀虫剂尝试消除昆虫媒介和施加营养。目前尚不存在已知的治愈。全世界当局一致认为HLB正在破坏全球柑橘产业。
佛罗里达州、加利福尼亚州和美国之外每年几十亿美元柑橘产业受到木虱-CaLas媒介-疾病病原系统严重威胁。目前,对于该疾病尚无治愈,并且一旦感染树即被例行处死。此外,无已知的有关柑橘品种对柑橘青果病有抗性。
植物感染病原体通常导致一系列防御反应,例如过敏反应、产生活性氧物类、细胞壁强化(cell wall fortification)、合成发病机制相关蛋白和产生植物抗毒素。
关于韧皮部杆菌属物种感染和疾病中宿主转录调控,微阵列技术已经揭示许多,尽管柑橘物种甚至品种、不同植物组织以及感染和疾病的不同阶段之间注意到可变性。然而,一些报道表明柑橘对韧皮部杆菌属物种的转录反应涉及植物防御相关反应基因(植物防御蛋白、组成型疾病抗性蛋白1、防御基因转录调控因子,等)上调、糖代谢和淀粉合成基因上调和光反应基因的上调或下调(由研究而定)(Albrecht和Bowman, Plant Sci 2012, 185-186:118-130; Katagiri等人, Molec Plant-Microbe Interactions 2010, 23:1531-36; Anderson等人, Funct Plant Biol, 2010;37:499-512; Bolton, Molec Plant-Microbe Interaction 2009;22:487-97; Kim等人, Phytopathology 2009;99:50-57; Martinelli等人, PLoS One 2012 7:e38039; Conrath, Plant Signaling和Behav 2006, 1:179-84; Jones和Dangl, Nature 2006;444:323-329; Mafra等人, BMC Genomics 2013;14:247)。然而,至今尚未阐明疾病与个体基因或基因家族表达之间的因果关系。
对于预防和治疗HLB,一些提议的策略包括预防韧皮部杆菌属物种感染、诱导对韧皮部杆菌属的耐受、防止韧皮部杆菌属通过木虱媒介传播和增强植物防御机制。
Masaoka等人的美国专利公开2013025995、Figueredo等人20130225456和Musson的美国专利号8,546,360,IV公开用作用于控制柑橘树中细菌感染,例如HLB的杀生物剂的化学组合物。
一些建议的方法靶向木虱媒介。Stelinski等人的美国专利公开20130266535公开释放水杨酸甲酯引诱剂诱使木虱HLB媒介远离柑橘作物。Woods等人的美国专利公开20130287727也公开使用木虱引诱剂用于引诱走、捕捉和/或消除木虱媒介。Rouseff等人的美国专利号8,372,443公开使用挥发性化合物(例如,二甲硫)用于逐退或杀死传播HLB的木虱媒介。Rodriguez Baixauli等人的美国专利公开20110119788公开在柑橘树中转基因表达和释放挥发物用于逐退或抵抗木虱媒介和HLB细菌。
已经提出了诱导树的防御反应机制。Blotsky等人的美国专利公开20140030228公开用于通过向树施用细菌(“引发”)生物学控制植物病原体例如韧皮部杆菌属的方法。Jacobsen等人的美国专利公开20100092442、20110318386、20120003197以及美国专利号8,524,222、8,246,965和8,025,875公开使用非致病细菌分离物诱导系统获得抗性(SAR)病原体感染,其包括水杨酸累积,诱导防御蛋白和释放ROS。
一些提出的方法采用转基因和重组技术增加对病原体的抗性或耐受。Mirkov等人的美国专利公开20130205443公开用于通过给予树或在树中转基因表达一种或多种抗微生物肽,例如植物防御素、几丁质酶等增强柑橘树中的病原体抗性的方法。
Zipfel等人的美国专利公开20100122376公开用于通过在树中转基因表达EF-Tu受体蛋白和增强宿主树对病原体EF-Tu延伸因子的反应(PAMP-触发的免疫和效应物-触发的免疫)增强柑橘树对植物细菌病原体的抗性的方法。
Gabriel等人的美国专利公开20090036307公开用于通过施用或表达潜在保护性噬菌体细菌外膜破坏蛋白(BOMBp)干扰柑橘树细菌感染的方法。
Messier的美国专利公开20130318652公开转基因表达植物防御蛋白,dirigent蛋白,用于赋予增强的对HLB感染和疾病症状的抗性。Kachroo等人的美国专利公开20080163390公开抑制脂肪酸去饱和酶用于通过增强信号传导中间体增强植物病原体抗性反应。
然而,迄今为止,植物病原体抗性(PR)蛋白在植物中的过表达尚未导致增强的抗性(Conrath等人, 2006),并且HLB感染和疾病的复杂性使通过直接施用或遗传修饰提高柑橘树对HLB传染病的抗性的努力挫败。
发明概述
本发明一些实施方案的一个方面提供当感染植物病原体时增加柑橘类植物的产率、生长速率、活力、生物量、果实品质或应激耐受力的方法,所述方法包括向柑橘类植物中引入包含特异性地减少植物的至少一种植物病原体抗性基因产物表达的核酸序列的分离核酸剂,从而在感染植物病原体时调节至少一种植物病原体抗性反应和增加柑橘类植物的产率、生长速率、活力、生物量、果实品质或应激耐受力。
本发明的一些实施方案的一个方面提供当感染韧皮部杆菌属物种时增加植物的产率、生长速率、活力、生物量、果实品质或应激耐受力的方法,所述方法包括向植物中引入包含特异性地减少植物的至少一种植物病原体抗性基因产物表达的核酸序列的分离核酸剂,从而在感染韧皮部杆菌属物种时调节至少一种植物病原体抗性反应和增加植物的产率、生长速率、活力、生物量、果实品质或应激耐受力。
根据本发明的一些实施方案,所述植物病原体为韧皮部杆菌属物种。
根据本发明的一些实施方案,所述植物为柑橘类植物或茄属植物。
根据本发明的一些实施方案,所述植物为柑橘类植物。
根据本发明的一些实施方案,所述方法进一步包括在引入之后监测感染植物中的感染症状。
根据本发明的一些实施方案,所述韧皮部杆菌属物种选自韧皮部杆菌亚洲种、韧皮部杆菌非洲种、韧皮部杆菌美洲种和Candidatus Liberibacter psyllaurous。
根据本发明的一些实施方案,所述病原体为韧皮部杆菌属亚洲种(CaLas)。
根据本发明的一些实施方案,当感染时植物患黄龙病(HLB或柑橘青果病)。
根据本发明的一些实施方案,植物病原体抗性反应选自水杨酸水平变化、茉莉酸水平变化、赤霉酸水平变化、植物生长素水平变化、细胞分裂素水平变化、乙烯水平变化、ABA植物激素水平变化、植物激素相关基因上调、胼胝质的生物合成、沉积和降解、活性氧物类产生、功能性FLS2/BAK1复合体形成、蛋白激酶通路激活、韧皮部堵塞、淀粉积聚、韧皮薄壁组织细胞中淀粉积聚、聚合物筛形成、碳水化合物代谢变化、形成层活性畸变、蔗糖积聚和类胡萝卜素合成。
根据本发明的一些实施方案,产率、生长速率、活力、生物量、果实品质或应激耐受力的增加为选自水摄入增加、植物高度增加、植物花数目增加、淀粉积聚减少和疾病征兆指数(Disease Sign Index)减小的参数变化。
根据本发明的一些实施方案,所述参数的变化在选自感染后2-3周、感染后3-4周、感染后5-7周、感染后1-2月、感染后2-4月、感染后4-6月、感染后5-8月和感染后5-12月的时间点测量。
根据本发明的一些实施方案,病原体抗性反应选自活性氧物类产生、胼胝质生物合成和沉积、韧皮部堵塞和碳水化合物代谢变化。
根据本发明的一些实施方案,植物病原体抗性基因产物选自在植物感染所述植物病原体后具有上调的表达的植物基因产物。
根据本发明的一些实施方案,植物病原体抗性基因产物选自表IV的多核苷酸序列。
根据本发明的一些实施方案,植物病原体抗性基因产物选自与表II的任何多核苷酸序列具有至少60%同一性的植物基因产物。
根据本发明的一些实施方案,植物病原体抗性基因产物选自表V的多核苷酸序列。
根据本发明的一些实施方案,植物病原体抗性基因产物选自SEQ ID NOs: 204-265和489-516或其同系物。
根据本发明的一些实施方案,植物病原体抗性基因产物选自SEQ ID NOs. 1-203和其同系物。
根据本发明的一些实施方案,植物病原体抗性基因产物选自与表III中的任何多核苷酸序列具有至少60%同一性的植物基因产物。
根据本发明的一些实施方案,植物病原体抗性基因产物选自ADP-葡萄糖焦磷酸化酶大亚基(AGPase)基因产物、葡萄糖-6-磷酸/磷酸转运体(GPT)基因产物、胼胝质合酶基因产物和Myb转录调控因子(MYB)基因产物。
根据本发明的一些实施方案,所述核酸序列包括选自SEQ ID NOs. 528、530、532和536的核酸序列。
根据本发明的一些实施方案,植物病原体抗性基因选自SEQ ID NOs: 623-714或其同系物。
根据本发明的一些实施方案,所述引入经由喷雾、撒粉、浸泡、注射、应用气溶胶、粒子轰击、灌溉或经由施加正压或负压实现。
根据本发明的一些实施方案,所述植物为果树。
根据本发明的一些实施方案,所述果树为柑橘树。
根据本发明的一些实施方案,分离核酸剂进一步包含细胞渗透剂。
根据本发明的一些实施方案,所述引入在检测到植物感染病原体的症状之后。
本发明一些实施方案的一个方面提供包含特异性减少选自与表II的任何多核苷酸序列具有至少60%同一性的植物基因产物的至少一种植物病原体抗性基因产物的表达的核酸序列的分离核酸剂。
根据本发明的一些实施方案,分离核酸剂为dsRNA。
根据本发明的一些实施方案,dsRNA选自siRNA、shRNA和miRNA。
根据本发明的一些实施方案,所述核酸序列大于15个碱基对长。
根据本发明的一些实施方案,所述核酸序列为19-25个碱基对长。
根据本发明的一些实施方案,所述核酸序列为30-100个碱基对长。
根据本发明的一些实施方案,所述核酸序列为100-500个碱基对长。
根据本发明的一些实施方案,植物病原体抗性基因产物选自在植物感染所述植物病原体之后具有上调的表达的植物基因产物。
根据本发明的一些实施方案,植物病原体抗性基因为黄龙病相关植物病原体抗性基因。
根据本发明的一些实施方案,分离核酸剂包含选自表IV和IV(a)的多核苷酸序列的核酸序列。
根据本发明的一些实施方案,提供包含编码本发明分离核酸剂的核酸序列的核酸构建体。
根据本发明的一些实施方案,核酸构建体进一步包含在植物细胞中有活性的调控元件。
根据本发明的一些实施方案,核酸构建体包括含有病毒基因组或其部分的病毒沉默载体。
根据本发明的一些实施方案,核酸构建体、病毒基因组或其部分足以引起病毒诱导的基因沉默。
本发明一些实施方案的一些方面提供包含本发明核酸构建体的细菌宿主细胞。
根据本发明的一些实施方案,所述细菌细胞为农杆菌(Agrobacterium)。
本发明的一些实施方案的一个方面提供包含含有特异性减少至少一种植物病原体抗性基因产物表达的核酸序列的至少一种外源分离核酸剂的柑橘类植物。
本发明的一些实施方案的一个方面提供包含含有特异性减少选自与表II的任何多核苷酸序列具有至少60%同一性的植物基因产物的至少一种植物病原体抗性基因产物的表达的核酸序列的至少一种外源分离核酸剂的植物。
根据本发明的一些实施方案,所述植物选自树、灌木、矮树丛、幼苗、嫩枝(scion)、根茎、接枝的植物、芽、接穗(budwood)、根和嫁接株。
根据本发明的一些实施方案,所述植物为柑橘类或柑橘类相关植物。
根据本发明的一些实施方案,所述植物为处于感染CaLas风险中的植物。
本发明的一些实施方案提供本发明植物的细胞。
本发明一些实施方案的一个方面提供包含含有特异性减少植物中至少一种植物病原体抗性基因产物表达的核酸序列的分离核酸剂和选自肥料、抗生素、杀生物剂、杀虫剂、驱虫剂、除草剂、植物激素的植物有益化合物的农用化学品组合物。
根据本发明的一些实施方案,所述农用化学品组合物包含本发明的分离核酸剂或本发明的核酸构建体。
根据本发明的一些实施方案,本发明的农用化学品组合物、分离核酸剂或核酸构建体被配制为选自气溶胶、粉尘、干悬浮剂、可乳化的悬浮剂、颗粒、微型胶囊、丸剂、可溶性粉剂、可湿性粉剂、液体和水可分散颗粒的制剂。
附图的几个视图的简述
本文仅以举例的方式参考附图描述本发明的一些实施方案。现在详细地具体参考附图,强调所示细节为举例,用于说明性讨论本发明的实施方案的目的。就此而言,与附图一起采用的描述使得如何可以实践本发明的实施方案对本领域技术人员显而易见。
在附图中:
图1显示在感染后19和24天(dpi)使用农杆菌转化TRV VIGS沉默PDS (八氢番茄红素脱饱和酶)基因对三个番茄品种的一般表型的作用。EV-空载体。记录所选品种中叶的渐进光漂白;
图2为显示番茄叶中PDS基因表达的检测的图,表明PDS沉默与叶颜色表型(绿色v白色)之间的关联。TRV EV为空载体对照;
图3为沿80天的时间进程描绘感染C. Liberibacter solanacearum (Lso)的番茄中的疾病的病因学的图解;
图4为显示感染的Tiny Tom番茄植物(右)与未感染对照(左)之间高度差异的照片;
图5为显示感染的Tiny Tom番茄植物(右)与未感染对照(左)之间花数目差异的照片;
图6为显示PCR检测Lso 16S DNA的结果的琼脂糖凝胶的照片,在木虱饲养的感染植物(19、20、23和24)植物中而非未感染(N1、N2)植物中所述Lso 16S DNA的结果对应于预期大小;
图7为显示使用cDNA PCR检测Lso 16S的结果的琼脂糖凝胶的照片,所述Lso 16S对应于疾病表型(强带对应于植物中疾病症状的严重性);
图8为验证内含用于所选靶基因沉默的序列的农杆菌克隆以及空pTRV1和对照(MCS-多克隆位点-TRV2 w/o附加序列)克隆的插入的特性(identity)和完整性的琼脂糖凝胶的照片;
图9为显示不同靶基因的Ct (循环阈值)和沉默率的图,表明沉默率(转录物相对于EV对照的倍数减少)与基础表达水平(如以Ct表述的)成反比;
图10为显示通过VIGS暴露于沉默的植物中小RNA丰度和分布的表;
图11为描绘组成疾病严重性指数的表型参数的照片:DSI 0-正常,健康植物;1-轻度发育迟缓,微量卷曲;2-一些发育迟缓,明显卷曲,叶的僵硬和有弹性;3-显著的发育迟缓,卷曲和增厚的叶,中脉僵硬和有弹性,一些变紫;和4-严重发育迟缓,极其僵硬和增厚,略发紫的和濒死的叶,完全缺乏生长和果实;
图12描绘用于用HLB (韧皮部杆菌属物种)感染柑橘树/植物的嫁接程序;
图13为验证HLB-感染树(泳道73、101、105、112和171)中韧皮部杆菌属16S DNA的存在情况(参见“+”阳性对照)的PCR产物的琼脂糖凝胶的照片;
图14为显示响应HLB感染柑橘中PP2基因表达上调的图(使用相对于柑橘18S基因归一化转录物的△Ct计算归一化的表达);
图15为显示响应HLB感染柑橘中AGPase基因表达上调的图(使用相对于柑橘18S基因归一化转录物的△Ct计算归一化的表达);
图16为显示响应HLB感染柑橘中GPT基因表达上调的图(使用相对于柑橘18S基因归一化转录物的△Ct计算归一化的表达);
图17为显示响应HLB感染柑橘中α淀粉酶基因表达上调的图(使用相对于柑橘18S基因归一化转录物的△Ct计算归一化的表达);
图18为显示响应HLB感染柑橘中氧化还原酶基因表达上调的图(使用相对于柑橘18S基因归一化转录物的△Ct计算归一化的表达);
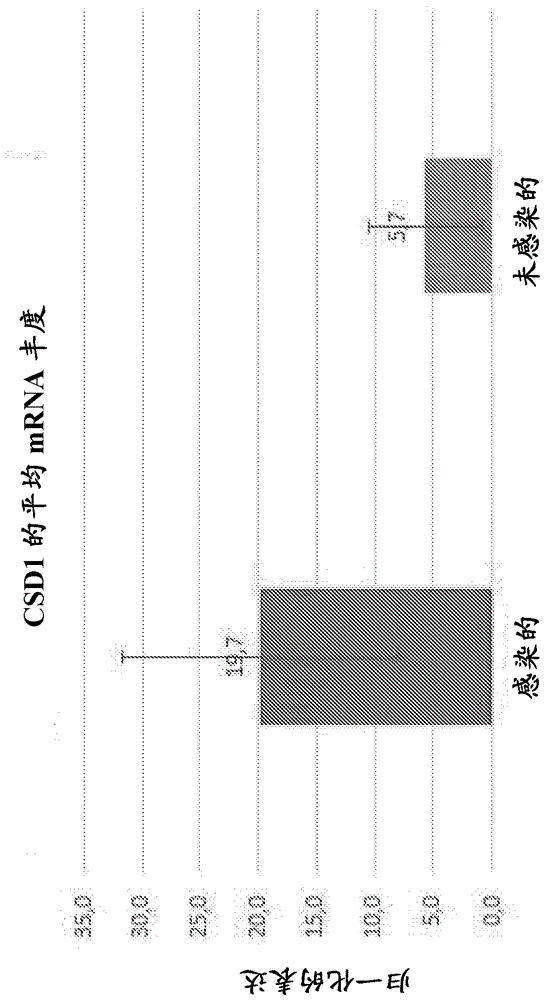
图19为显示响应HLB感染柑橘中CSD1基因表达上调的图(使用相对于柑橘18S基因归一化转录物的△Ct计算归一化的表达);
图20为显示HLB感染柑橘树(红色柱,HLB阳性)中MYB基因表达上调的图,如在嫁接(感染)后1、3和6个月时通过信号放大所测定的;
图21为显示HLB感染柑橘树(红色柱,HLB阳性)中锌转运蛋白5基因表达上调的图,如在嫁接(感染)后1、4和6个月时通过信号放大所测定的;
图22为显示HLB感染柑橘树(红色柱,HLB阳性)中PP2基因表达上调的图,如在嫁接(感染)后1、4和6个月时通过信号放大所测定的;
图23为显示HLB感染柑橘树(红色柱,HLB阳性)中超氧化物歧化酶基因表达上调的图,如在嫁接(感染)后1、4和6个月时通过信号放大所测定的;
图24为显示HLB感染柑橘树(红色柱,HLB阳性)中AGPase基因表达上调的图,如在嫁接(感染)后1、3和6个月时通过信号放大所测定的;
图25为说明嫁接(感染)后6个月时HLB感染柑橘树(红色柱,HLB阳性)的叶中淀粉积聚增加的图;
图26为说明HLB感染柑橘树(红色柱,HLB阳性)的叶中改变的淀粉积聚动力学的图,其在08:00、14:00和20:00时测量,对8:00时健康叶的淀粉含量标准化;
图27显示图26中所示淀粉积聚动力学结果的线性最佳拟合的统计分析;
图28为显示通过VIGS农业输注沉默GPT对番茄植物中GPT表达的作用的图,作为Lso感染两周后的相对表达测量(红色柱为感染植物);
图29为显示通过VIGS农业输注沉默脂氧合酶D (LoxD)对番茄植物中LoxD表达的作用的图,作为Lso感染两周后的相对表达测量(红色柱为感染植物);
图30为显示通过VIGS农业输注沉默Myb转录调控因子(MYB)对番茄植物中MYB表达的作用的图,作为Lso感染两周后的相对表达测量(红色柱为感染植物);
图31为显示通过VIGS农业输注沉默AGPase对番茄植物中AGPase表达的作用的图,作为Lso感染两周后的相对表达测量(红色柱为感染植物);
图32为显示与空载体(EV)和未处理的对照植物相比,Lso感染(红色柱为感染植物) 2和3周后候选基因Myb、LoxD、CalS、PP2、AGPase和GPT的基因沉默(通过VIGS农业输注)对感染的番茄植物的表型(DSI)的作用的一系列图;
图33为显示与空载体(EV)和未处理的对照植物相比,Lso感染(红色柱为感染植物) 2和3周后候选基因Myb、CalS、PP2、AGPase和GPT的基因沉默(通过VIGS农业输注)对感染的番茄植物的表型(花数目)的作用的一系列图;
图34为显示与空载体(EV)和未处理的对照植物相比,Lso感染(红色柱为感染植物) 5周后候选基因Myb、CalS、PP2、AGPase和GPT的基因沉默(通过VIGS农业输注)对感染的番茄植物的表型(水摄入)的作用的图。
本发明的具体实施方案的描述
本发明在其一些实施方案中涉及用于增强病原体-感染植物的健康的方法,并且,更特别地,但不排他地,涉及使用RNA干扰调节植物病原体抗性反应基因表达的方法。本发明公开用于在病原体易感植物中用siRNA沉默特定植物病原体抗性反应基因、减少宿主植物受感染时植物病原体抗性反应的负面影响和增强健康的组合物。特别地,本发明提供用于增强韧皮部杆菌属物种感染,特别地,柑橘类植物和树木中韧皮部杆菌属物种感染,如黄龙病之后宿主植物健康以及果实产率和品质的组合物和方法。
详细解释本公开内容的至少一个实施方案前,应理解本公开内容在其应用中不必定限制于下列描述中列出的或通过实施例例示的细节。本公开内容能够有其它实施方案或能够以不同方式实践或实施。同样,应理解本文所采用的短语和术语是为了说明的目的,不应被认为是限制。
应理解的是本申请中所公开的任何序列识别号码(SEQ ID NO)可指DNA序列或RNA序列,取决于提及SEQ ID NO的上下文,即使该SEQ ID NO仅以DNA序列格式或RNA序列格式表述。例如,SEQ ID NO: 527以DNA序列格式表述(例如,对于胸腺嘧啶叙述为T),但其可指α淀粉酶核酸序列对应的DNA序列,或所示RNA序列对应的RNA分子(例如,对于尿嘧啶叙述为U)的RNA序列。无论如何,预想具有带有任何取代的所公开序列的DNA和RNA分子二者。
植物免疫应答提供对抗各种植物病原生物体的保护,包括细菌、真菌、线虫、病毒、柔膜细菌(支原体、螺原体)、原生动物、显花植物、立克次氏体和类病毒、昆虫以及寄生植物。植物对病原体损害或侵入的先天免疫应答的双等级系统(微生物/病原体相关分子模式- (PAMP或MAMP)触发的免疫,或PTI,和效应物触发的免疫,或ETI)可分为以下特征阶段:在阶段1,植物通过跨膜模式识别受体(PRRs,例如受体样激酶,RLKs)检测MAMPs和/或PAMPs,触发PTI。植物对病原体损害的初始反应由很多一定程度重叠的信号传导级联(水杨酸信号传导是关键的)介导,包括分子、形态和生理变化。在几秒至几分钟内发生的早期变化包括跨质膜的离子流、植物抗毒素合成、氧化爆发、丝裂原活化蛋白(MAP)激酶活化和蛋白质磷酸化,随后为在PTI的第一个小时内大量转录重编程。稍后的变化包括发病机制-相关蛋白合成、胼胝质沉积(充当感染位点的物理障碍)和气孔关闭。
在阶段2,有毒病原体通过向宿主细胞中部署效应物以逃避或抑制PTI反应从而响应基于PRR的防御。这些继而激活阶段3,在该阶段胞内核苷酸结合结构域富含亮氨酸的重复(LRR)蛋白介导的ETI导致生长抑制,并常常伴随过敏反应。
过敏反应涉及在病原体侵入位点程序性细胞死亡的形式。过敏反应特征在于细胞质收缩、染色质凝聚、线粒体溶胀、空泡形成和叶绿体破裂。过敏反应潜在的分子事件包括光合作用下调、活性氧物类、反应性一氧化氮中间体以及防御激素水杨酸和茉莉酸产生和积聚增加、MAPK级联活化、胞内钙水平变化和转录重编程,然而,幅度和加速度比PTI阶段中更大。
病原体感染在植物中还产生一种类型的全身反应,所述全身反应远离感染位点,“引发”其它植物器官和组织的病原体损害(“priming” other plant organs and tissues for pathogen insult)。全身获得性反应(SAR)通过调动发病机制相关蛋白、信号传导和合成途径使未受影响的组织为接触病原体做准备,允许在病原体损害未受影响组织的情况下迅速和增强的反应,而在经济上避免开始全面性反应,直至真正被挑战时。介导SAR的全身信号尚未完全阐明,但已经证实水杨酸为重要的信号传导中间体。
响应病原体损害,PTI、ETI、过敏反应和SAR的结果常常为显著的能源再分配和生长抑制、隔离受影响区域以及,最终细胞死亡和受影响区域坏死。P-蛋白质积聚和胼胝质形成起作用关闭病原体感染组织的脉管系统中的筛管元件,阻断病原体和病原体效应物扩散,导致水、代谢物和激素转运的双向中断。
因此,尽管植物病原体反应起作用以有效隔离受影响的组织和限制病原体繁殖,但植物病原体防御涉及显著的能量消耗、代谢和形态重组,最后不利于植物活力、健康、生长和产量(即,果实、种子等)产生。尤为重要的是常见的植物病原体再感染,例如通过重复接触有效传播病原生物体的承载病原体的昆虫载体,和植物病原体反应的反复激活、植物资源枯竭和随后的宿主植物活力丧失。
RNA干扰(dsRNA和siRNA)策略已经显示在广泛的多个物种,包括植物中有效沉默基因表达。
RNA干扰(RNAi)以序列特异性的方式抑制基因表达,以至少两个步骤发生:第一步将较长dsRAN切割成较短的21-25个核苷酸长的dsRNAs,称作“小干扰RNAs”或siRNAs。在第二步中,较小的siRNAs然后介导靶相应的mRNA分子的降解。该RNAi效应可通过向细胞内的靶序列引入较长的双链RNA (dsRNA)或较短的小干扰RNA (siRNA)实现。
RNAi已经在植物害虫管理中成功展示。植物具有先天的RNA干扰能力,与动物RNAi相似但不相同,高度有效防止病毒病原体扩散。同样,由于大多数昆虫对通过dsRNA的RNAi基因沉默敏感,害虫特异性dsRNA在转基因植物中的表达,以及直接将dsRNA施用到害虫可提供保护免于植物害虫伤害和损伤。向转基因植物中引入dsRNA可对靶病原体高度特异。实际上,通过dsRNA基因沉默已经证明对植物害虫控制和植物病毒控制有效,例如,Arciello等人的美国专利公开号20110150839公开在植物宿主中转基因表达编码病原体GPCR受体特异性dsRNA的构建体,其用于增强植物对植物病原生物体攻击的抗性。
其中,在表达病毒特异性RNA转录物的转基因植物中已经证明对马铃薯Y病毒、黄瓜和烟草花叶病毒、番茄斑萎病毒、菜豆金黄花叶病毒、香蕉苞片花叶病毒和水稻东格鲁杆状病毒的抗性。在大麦中真菌特异性dsRNA的转基因表达有效赋予对大麦白粉病小麦白粉病Blumeria graminis的抗性。
已经发现直接施用dsRNA在植物中也有效,例如当直接递送至叶细胞时,来自烟草花叶病毒组、马铃薯Y病毒组(potyvirus)和苜蓿花叶病毒组的病毒特异性双链RNA (dsRNA)有效抑制植物感染。用于将dsRNA引入种子、新芽、植物细胞培养物和成年植物的所有组织和器官中的方法为本领域所熟知。
本发明人建议在柑橘或其它韧皮部杆菌属物种-易感宿主植物中通过使用RNAi基因沉默内源的病原体抗性反应基因调节植物病原体抗性反应基因表达减少植物病原体抗性反应对植物健康、生长、产率和果实品质的有害作用。本发明人已经鉴定了靶病原体抗性反应相关基因并设计用于RNAi沉默的核酸剂,当提供给植物时,所述核酸剂改善病原体感染之后植物的健康、活力、产率、果实品质和其它性状。
因此,本发明的方面的一些实施方案提供当感染植物病原体时增加柑橘类植物的产率、生长速率、活力、生物量、应激耐受力或果实品质的方法,所述方法包括向柑橘类植物中引入包含特异性减少植物的至少一种植物病原体抗性基因产物的表达的核酸序列的分离核酸剂,从而在感染植物病原体时调节至少一种植物病原体抗性反应和增加柑橘类植物的产率、生长速率、活力、生物量、果实品质或应激耐受力。
在本发明的又一个实施方案中,提供当感染韧皮部杆菌属细菌时增加植物的产率、生长速率、活力、生物量、应激耐受力或果实品质的方法,所述方法包括向植物中引入包含特异性减少植物的至少一种植物病原体抗性基因产物的表达的核酸序列的分离的核酸剂,从而在感染韧皮部杆菌属细菌时调节至少一种植物病原体抗性反应和增加植物的产率、生长速率、活力、生物量、果实品质或应激耐受力。
如本文所使用的术语“植物”包括整个植物、植物的祖先和子代以及植物的一部分(包括种子、芽、茎、根(包括块茎))和分离的植物细胞、组织和器官。植物可为任何形式,包括悬浮培养物、胚、分生区、愈伤组织、叶、配子体、孢子体、花粉和小孢子。将会理解的是,植物或其种子可为转基因植物。
如本文所使用的短语“植物细胞”指从分解的植物细胞组织或植物细胞培养物衍生和分离的植物细胞。短语“植物细胞”也可指“原位”植物细胞,例如,未从组织或植物器官分离的植物组织的细胞。
如本文所使用的短语“植物细胞培养物”指任何类型的天然(天然存在的)植物细胞、植物细胞系和遗传修饰的植物细胞,其未经组装形成完整的植物,以致植物的至少一个生物学结构不存在。任选,本公开内容的实施方案的植物细胞培养物可包括特定类型的植物细胞或多种不同类型的植物细胞。应指出的是任选以特定类型的植物细胞为特征的植物培养物可最初衍生自多个不同类型的这种植物细胞。在本公开内容的某些实施方案中,植物细胞为无性产生的植物细胞。在其它方面,本公开内容的植物细胞为非光合植物细胞。
本发明的一些实施方案设想对韧皮部杆菌属物种感染敏感的任何有商业或科学价值的植物。在本公开内容的方法中特别有用的植物包括,但不限于:
来自芸香科家族的植物,例如所有柑橘类物种和亚种,包括甜橙商业品种(脐橙(Citrus sinensis Osbeck (L.)))、克莱门氏小柑橘(clementines) (C. reticulata)、青柠(C. aurantifolia)、柠檬(C. limon)、酸橙(C. aurantium)、杂交种和亲缘植物(Citranges、Citrumelos、Citrandarins)、Balsamocitrus dawei、C. maxima、C. jambhiri、Clausena indica、C. lansium、Triphasia trifolia、Swinglea glutinosa、Micromellum tephrocarpa、三角橘属(Merope)物种、Eremolemon、酒饼簕属(Atalantia)物种、乌柑(Severiniabuxifolia)、指橘属(Microcitrus)物种、金橘属(Fortunella)物种、Calodendrum capense、九里香属(Murraya)物种、枳壳(Poncirus trifoliate);
茄属家族的植物例如烟草(烟草属(Nicotiana)物种)、番茄(Lycopersicon esculentum)、马铃薯(Solanum tuberosum)、辣椒(Capsicum annuum)、灯笼果(Physalis peruviana)、番茄树或树番茄(tamarillo)(Solanum betaceum);
来自蔷薇科家族的植物例如梨树(西洋梨(Pyrus communis));
来自伞形科(Apiaceae)家族的植物例如胡萝卜(野胡萝卜(Daucus carota));
来自旋花科家族的植物例如菟丝子(菟丝子属(Cuscuta)物种);
来自夹竹桃科家族的植物例如:长春花(Catharanthus roseus)。
根据一些实施方案,本发明方法使用的植物为作物。
根据一个具体的实施方案,所述植物选自柑橘类植物,包括,但不限于所有的柑橘类物种和亚种,包括甜橙商业品种(脐橙)、克莱门氏小柑橘(C. reticulata)、青柠(C. aurantifolia)、柠檬(C. limon)、酸橙(C. aurantium)、杂交种和亲缘植物(Citranges、Citrumelos、Citrandarins)、Balsamocitrus dawei、C. maxima、C. jambhiri、Clausena indica、C. lansium、Triphasia trifolia、Swinglea glutinosa、Micromellum tephrocarpa、三角橘属物种(Merope spp)、Eremolemon;酒饼簕属物种、乌柑;指橘属物种、金橘属物种、Calodendrum capense、九里香属物种和枳壳(Poncirus trifoliate)。在一些实施方案中所述柑橘类植物为橙、柠檬、青柠、葡萄柚、克莱门氏小柑橘、柑橘或柚子树。柑橘树可为种子生长的树或嫁接的树,其嫁接到不同的柑橘根茎上。
如本文所使用的,短语“植物病原体(plant pathogen或phytopathogen)”指能够在植物细胞或植物内增殖的包含核酸的剂,病原体通过破坏植物的正常功能和/或生长,通常通过侵入植物细胞,和利用植物细胞营养素、代谢产物和/或能量代谢用于病原体繁殖在植物中引起疾病。植物病原生物体包括病原性病毒、细菌、真菌、卵菌、子囊菌、担子菌、线虫、柔膜细菌(支原体、螺原体)、原生动物、显花植物、立克次氏体和类病毒、昆虫和寄生植物。
植物病原体可为胞内或胞外病原体。下表I包含在标注的宿主植物中导致或促进标注的疾病的示例性植物病原体的非穷举名单,对其的反应顺从于通过本发明组合物和方法的调节。
根据本发明的一个实施方案,所述病原体为导致或促进黄龙病的细菌,例如韧皮部杆菌属亚洲种、韧皮部杆菌属非洲种、韧皮部杆菌属美洲种等。根据本发明的另一个实施方案,所述病原体为细菌,在番茄中导致或促进疾病,例如斑马片病(Candidatus Liberibacter solanacearum (Lso))、木虱泛黄(Candidatus Liberibacter psyllaurous)等。
如本文所使用的,术语“植物疾病”或“病原体感染”定义为直接或间接由接触植物病原剂引起的植物的生理学、形态学、繁殖健康、经济价值、活力、生物量、果实品质、应激耐受力、对感染和/或侵袭的抗性的不期需变化。根据本发明的一个实施方案,所述不期需变化包括,但不限于患病的或病原体感染的植物的生物量和/或产率。根据本发明的另一个实施方案,产率的变化包括,但不限于果实产率、果实品质、种子产率、花产率、作物产率等的变化。在一些实施方案中,宿主植物为柑橘树或矮树丛并且所述植物疾病或病原体感染为韧皮部杆菌属感染,特别地,韧皮部杆菌属亚洲种感染。在一些实施方案中,韧皮部杆菌属感染在宿主植物中引起HLB疾病。
HLB疾病由易感宿主植物(例如柑橘类植物)感染韧皮部杆菌属病原体,例如,但不限于韧皮部杆菌属亚洲种引起,特征在于老叶的不均匀斑污斑纹、萎黄图案、细枝顶梢枯死、果实产量减少、过早落果,最后树衰退,这最可能是因为筛管元件堵塞和同韧皮部坏死引起的运输作用流堵塞。因此,在本发明一些方面的一些实施方案中,向易感植物(例如柑橘树)中引入本发明的分离核酸剂导致在感染韧皮部杆菌属物种之后,与相同的未处理植物和树相比,韧皮部杆菌属感染之后处理的植物和树中叶斑纹减少和萎黄图案较少、细枝顶梢枯死减少、果实产量提高、防止过早落果、活力增加和延迟或防止衰退。
根据本发明的一些实施方案,与病原体感染之后具有该至少一种植物病原体抗性反应基因产物正常表达的相似或相同植物相比,减少植物中至少一种植物病原体抗性反应基因产物的表达增加病原体感染之后植物的产率、生长速率、活力、生物量或应激耐受力中的至少一个。
如本文所使用的,短语“应激耐受力”指对生物应激的耐受力和对非生物应激的耐受力二者。如本文所使用的短语“非生物应激”指非生物剂引起的对植物代谢、生长、生存力和/或繁殖的任何有害作用。非生物应激可通过任何欠佳环境生长条件诱导,例如,缺水或干旱、泛滥、冰冻、低或高温、强风、重金属毒性、乏氧生活、高或低营养素水平(例如营养素缺乏)、高或低盐水平(例如,盐度)、大气污染、高或低光强(例如光不足)或UV照射。非生物应激可为短期作用(例如急性作用,例如持续约1周)或者可为持久的(例如慢性作用,例如持续例如10天或更久)。本公开内容考虑其中存在单一非生物应激条件的情况或者其中发生两种或更多种非生物应激的情况。
如本文所使用的短语“非生物应激耐受力”指植物忍耐非生物应激而不显示实质生理学或物理损伤(例如植物的代谢、生长、生存力和/或繁殖变化)的能力。
根据一些实施方案,减少病原体感染植物中至少一种植物病原体抗性反应基因产物的表达增加作物产量。作物产量可通过生物量、活力或产率测量,并且可用于计算氮使用效率和肥料使用效率。如本文所使用的,短语“氮使用效率(NUE)”指每单位氮肥输入的作物产量的量度。肥料使用效率(FUE)为NUE的量度。植物的氮使用效率通常为摄入、扩散、吸收、积累、(在植物内)再定位和使用植物所吸收的氮中至少一个改变的结果。提高的作物产量、活力、产率、NUE或FUE为相对于相同或相似物种和发育阶段的并且在相同或相似条件下生长的未减少至少一种植物病原体抗性基因产物表达(即,缺乏本发明的核酸剂)的病原体感染或患病植物。
如本文所使用的,术语/短语“生物量”、“植物的生物量”或“植物生物量”指在生长季节从植物产生的组织的量(例如,以风干组织的克数测量)。植物生物量的增加可为整株植物或其一部分,例如地上(例如可收获的)部分、营养生物量(vegetative biomass)、根和/或种子或其内含物(例如,油、淀粉等)。
如本文所使用的术语/短语“活力”、“植物的活力”或“植物活力”指在给定时间内由植物所产生的组织的量(例如,按重量测量)。增加的活力可决定或影响植物产率或每一生长时间或生长面积的植物产率。另外,早期活力(例如种子和/或幼苗)导致改善的田地站立(field stand)。
如本文所使用的术语/短语“产率”、“植物的产率”或“植物产率”指每一植物或每一生长季节产生的组织或器官的量(例如,按重量或尺寸测定)或数量(例如,数目)。增加的植物产率可影响在某一生长面积和/或生长时间可从植物获得的经济效益。
根据一个实施方案,产率通过纤维素含量、油含量、淀粉含量等测量。
根据另一个实施方案,产率通过油含量测量。
根据另一个实施方案,产率通过蛋白质含量测量。
根据另一个实施方案,产率通过每一植物或其部分(例如,核、豆)的种子数目、种子重量、花数目或花重量、果实数目或果实重量测量。
植物产率可受各种参数影响,包括,但不限于,植物生物量、植物活力、植物生长速率、种子产率、种子或谷粒数量、种子或谷粒质量、油得率、收获的器官(例如,植物的种子或营养部分)中的油、淀粉和/或蛋白质含量、每一圆锥花序的花发育、花(例如小花)数目(例如表述为饱满种子数目与原来的圆锥花序数目的比率)、收获指数、每一面积生长的植物数目、每一植物和每一面积收获的器官的数目和尺寸、每一生长面积的植物数目(例如密度)、田地中收获的器官数目、总叶面积、碳同化和碳分配(例如植物内碳的分布/分配)、耐阴性、倒伏抗性、可收获的器官(例如种子、花)数目、每一豆荚的种子、每一种子的重量、每一植物的花和改良的结构(例如增加茎直径、厚度或改善物理性质(例如弹性))。
根据本发明方面的一些实施方案,通过向植物中引入核酸剂增加果实品质和产率。果实产率可根据收获指数(见上文)测量,其表述为每一植物或每一生长面积的果实数目和/或尺寸,和/或根据果实品质测量——果实品质可包括,但不限于糖含量、果实外观、贮藏寿命和/或果实的运输适合性、果实易于贮藏、商业价值增加、果实重量、果汁重量、果汁重量/果实重量、皮重量、TSS-可溶固体总量(Brix)、种子质量、对称性、干重、TA-可滴定酸度、MI-成熟指数、CI-颜色指数、果皮颜色、营养制品性质、维生素C—抗坏血酸—含量、橙皮苷含量、总黄酮含量等。
在田地中改善的植物NUE转变为收获相似的产量而利用较少的肥料,或通过实施相同水平的肥料获得增加的产率。因此,改善NUE或FUE对田地中的植物产率具有直接效果。
如本文所使用的“生物应激”指由于其它活生物体,例如细菌、病毒、真菌、寄生虫、有益和有害昆虫、杂草和种植的或天然的植物对植物造成的损伤而发生的应激。应理解的是,在一些实施方案中,根据本发明一些方法的一些方面改善或增加感染植物病原体的或患病的植物的活力或生长速率,同时减少至少一种植物病原体抗性反应基因的表达,有助于植物的总体健康和稳健性,从而赋予改善的对生物以及非生物应激的耐受力。这样的生物应激可为,例如,感染与引入分离核酸剂前感染或患病植物所感染的相同的病原体或感染不同植物病原体的结果。
在本发明的一些实施方案中,向植物中引入本发明的分离核酸剂,和调节至少一种植物病原体抗性反应导致:改善的非生物应激耐受力(例如,缺水或干旱、热、冷、非最佳营养素或盐水平、非最佳光水平的耐受力)或生物应激(例如,拥挤、化感作用或创伤)耐受力;改良的初级代谢产物(例如,脂肪酸、油、氨基酸、蛋白质、糖或碳水化合物)组成;改良的次级代谢产物(例如,生物碱类、萜类化合物、聚酮化合物、非核糖体肽和混合生物合成源的次级代谢产物)组成;改良的痕量元素(例如,铁、锌)、类胡萝卜素(例如,β-胡萝卜素、番茄红素、叶黄素、玉米黄素或其它类胡萝卜素和黄叶素)或维生素(例如,生育酚类)组成;改善的产率(例如,在非应激条件下改善的产率或在生物或非生物应激下改善的产率);改善的使用氮或其它营养素的能力;改良的农学特征(例如,延迟成熟、延迟老化、早熟或晚熟、改善的耐荫性、改善的对根或茎倒伏的抗性、改善的对树干“绿色折断(green snap)”的抗性、修饰的光周期反应);改良的生长或繁殖性质;改善的收获、贮存或加工质量(例如,贮存期间改善的对害虫的抗性,改善的果实收获、果实贮存或果实加工质量(例如,贮存期间改善的对害虫的抗性,改善的对破损的抗性,改善的对消费者的吸引力));或这些性状的任何组合。
在本发明的一些实施方案中,相对于未用核酸剂处理的感染植物,当感染韧皮部杆菌属病原体时,向植物中引入本发明的分离核酸剂,和调整至少一种植物病原体抗性反应导致受处理植物的高度、水摄入、花数目、淀粉积聚和疾病征兆指数变化。在一些实施方案中,参数增加,例如花数目、高度和水摄入,表明受处理植物响应韧皮部杆菌属病原体感染改善的表型。在其它实施方案中,参数例如淀粉积聚和疾病征兆指数(DSI)在接受本发明分离核酸剂进入植物中并经受至少一种植物病原体抗性反应的调节的植物中降低,表明受处理植物响应韧皮部杆菌属病原体感染改善的表型。
如本文所使用的术语“改善”或“增加”指与感染相同病原体或具有相同疾病并且不具有本公开内容的减少的至少一种植物病原体抗性基因产物表达的相同或相似植物(即,缺乏核酸剂的植物)相比,植物的NUE、应激耐受力、生长速率、产率、生物量、果实品质、高度、花数目、水摄入或活力至少约2 %、至少约3 %、至少约4 %、至少约5 %、至少约10 %、至少约15 %、至少约20 %、至少约25 %、至少约30 %、至少约35 %、至少约40 %、至少约45 %、至少约50 %、至少约60 %、至少约70 %、至少约80 %、至少约90 %或更大的增加。
如本文所使用的,术语“减少”指与感染相同病原体或具有相同疾病并且不具有本公开内容的减少的至少一种植物病原体抗性基因产物表达的相同或相似植物(即,缺乏核酸剂的植物)相比,植物的疾病征兆例如DSI、淀粉积聚等至少约2 %、至少约3 %、至少约4 %、至少约5 %、至少约10 %、至少约15 %、至少约20 %、至少约25 %、至少约30 %、至少约35 %、至少约40 %、至少约45 %、至少约50 %、至少约60 %、至少约70 %、至少约80 %、至少约90 %或更大的减少。
在一些实施方案中,相对于未用核酸剂处理的感染植物,当感染韧皮部杆菌属病原体时受处理植物的高度、水摄入、花数目、淀粉积聚和疾病征兆指数变化在感染后2-3周、感染后3-4周、感染后5-7周、感染后1-2月、感染后2-4月、感染后4-6月、感染后5-8月和感染后5-12月或更久的时间点测量。
根据本发明的一些实施方案,植物参数在引入核酸剂之后在受处理的植物中监测。在一些实施方案中,监测植物病原体抗性反应的参数,例如,植物病原体抗性反应基因的表达,和/或这样的植物病原体抗性反应基因的表达的生理学或代谢症状。在其它实施方案中,替代监测植物病原体抗性反应基因表达的参数,或除了监测植物病原体抗性反应基因表达的参数之外,可监测植物的应激耐受力、生长速率、产率、生物量、果实品质或植物的活力的参数,并且可与来自缺乏本发明核酸剂的植物的相似参数比较。在一些实施方案中,监测(基因表达和/或植物应激耐受力、生长速率等的)植物参数可用于确定植物的处理方案,例如,额外引入本发明的核酸剂,用其它处理方式(例如杀虫剂、抗生素、植物激素等)增强处理,或以便确定果实收获时机或灌溉次数。用于在植物的田地或作物监测的植物的选择可为随机或系统的(例如,可在处理之前预先选择哨兵植物(sentinel plants))。
如本文所使用的,短语“植物病原体抗性反应”涉及植物对病原体攻击、损伤或感染的反应的任何方面,包括,但不限于微生物/病原体相关分子模式(PAMP或MAMP)触发的免疫或PTI,和效应物触发的免疫或ETI,包括有关的信号传导级联、分子、形态和生理变化例如跨质膜离子流的变化、植物抗毒素合成、ROS产生、丝裂原活化蛋白(MAP)激酶活化和蛋白质磷酸化,发病机制相关蛋白合成、胼胝质沉积、气孔关闭、生长抑制和过敏反应。过敏反应包括,但不限于,细胞质收缩,染色质凝聚,线粒体溶胀,由于光合作用下调引起的损伤位点(以及远程的,在系统获得性反应中的)空泡形成和叶绿体破坏,活性氧物类、反应性一氧化氮中间体以及防御激素水杨酸和茉莉酸产生和积聚增加,MAPK级联活化,胞内钙水平变化和转录重编程,以及筛管元件被胼胝质形成和P蛋白积聚而阻塞。
如本文所使用的,短语“植物病原体抗性反应基因”定义为其表达与植物中响应病原体攻击、损伤或感染发生的变化直接或间接相关的植物基因。植物病原体抗性反应基因可为其表达响应病原体攻击、损伤或感染改变(即上调或下调)的植物基因。术语“基因”广泛用于指与生物学功能相关的核酸的任何区段。因此,基因包括编码序列和/或其表达所需的调控序列。例如,基因指表达mRNA或功能RNA,或编码特定蛋白的核酸片段,并且其包含调控序列。基因也包括,例如,形成其它蛋白的识别序列的,非表达的DNA区段。基因可从多种源获得,包括从目的源克隆或从已知或预测的序列信息合成,并且可包括经设计而具有期需参数的序列。
植物病原体抗性基因包括,但不限于用于信号传导级联中间体例如MAPK、茉莉酸、水杨酸和脂肪酸,与ROS产生、碳水化合物和能量代谢相关的酶和蛋白质、叶绿体和光合作用相关基因产物、糖聚合物生物合成和降解、糖转运和输出、挥发性激素生物合成和降解的基因,碳水化合物转运基因、“R”基因等。在一些实施方案中,植物病原体反应包括,但不限于水杨酸水平变化、茉莉酸水平变化、赤霉酸水平变化、植物生长素水平变化、细胞分裂素水平变化、乙烯水平变化、ABA植物激素水平变化、植物激素相关基因上调、胼胝质的生物合成、沉积和降解、活性氧物类产生、功能FLS2/BAK1复合体形成、蛋白激酶途径活化、韧皮部堵塞、淀粉积聚、韧皮薄壁组织细胞中淀粉积聚、聚合物筛形成、碳水化合物代谢变化、形成层活性畸变、蔗糖积聚和类胡萝卜素合成。
如本文所使用的,短语“植物病原体抗性反应基因产物”指植物病原体抗性反应基因表达的产物,包括,但不限于植物病原体抗性反应基因的RNA转录物和植物病原体抗性反应基因的序列编码的肽或多肽。
在本发明的一些实施方案中,调节至少一种植物病原体抗性反应通过减少植物病原体抗性反应基因的表达达到。因此,在一些实施方案中,至少一种植物病原体抗性反应基因为其表达与植物病原体抗性反应相关增加的植物基因。主要通过患病和健康植物的表达谱,已经鉴定了响应病原体攻击、损伤或感染而上调的许多植物病原体抗性反应基因。例如,Kitagiri等人的美国专利公开20080172765公开其表达响应病原体感染改变,增加或降低,的植物基因。
在一个实施方案中,所述至少一种植物病原体抗性反应基因选自ADP-葡萄糖焦磷酸化酶大亚基(AGPase)基因产物、葡萄糖-6-磷酸/磷酸转运体(GPT)基因产物、胼胝质合酶基因产物和Myb转录调控因子(MYB)基因产物。
表II提供与植物病原体反应相关的植物基因(拟南芥同系物)的部分列表,其可为通过引入本发明核酸剂减少表达的靶。
表II 植物病原体抗性基因-拟南芥同系物(拟南芥基因符号)
因此,在一些实施方案中,分离核酸剂包含特异性减少与表II的任何序列具有至少60%序列同一性的植物病原体抗性基因产物的核酸序列。在一些实施方案中,植物病原体基因产物与表II的序列60-75%同一、70-85%同一、80-90%同一、90-95%同一或100%同一。
在一些实施方案中,靶向的基因产物包括,但不限于与表III中的任何序列具有至少60%同一性的多核苷酸序列。在一些实施方案中,植物病原体基因产物与表III的序列60-75%同一、70-85%同一、80-90%同一、90-95%同一或100%同一。
表III植物病原体抗性基因简表-拟南芥同系物
因此,本发明的一些实施方案提供包含特异性减少至少一种植物病原体抗性基因产物的表达的核酸序列的分离核酸剂。
在一些实施方案中,分离核酸剂包含特异性减少与表II的任何序列具有至少60%序列同一性的植物病原体抗性基因产物的核酸序列。
黄龙病主要是柑橘和柑橘相关植物和树的疾病。因此,在一些实施方案中,本发明的分离核酸指向柑橘特异性基因产物的下调。
表IV提供与柑橘类植物病原体反应有关的柑橘类植物多核苷酸序列的部分列表,其可为通过引入本发明核酸剂减少表达的靶。表IV(a)提供减少基因表达的候选靶的进一步的列表,基于特定基因的功能—斜体序列为柑橘病原体植物反应-相关序列,而粗体序列为糖代谢相关基因。
表IV 柑橘靶序列(GenBank登录号)
表IV(a)
在一些实施方案中,本发明的核酸剂指向表IV和IV(a)序列的任何一个或多个子集。表V提供与柑橘类植物病原体反应有关的柑橘类植物多核苷酸序列的示例性子集,其也是通过引入核酸剂和本发明方法减少表达的合适的靶。
表V-柑橘靶序列的简表(GenBank登录号)
在一些实施方案中,分离核酸剂包含特异性减少表IV和IV(a)的序列的任何植物病原体抗性基因产物的核酸序列。在其它实施方案中,分离核酸剂包含特异性减少表V的序列的任何植物病原体抗性基因产物的核酸序列。
在一些实施方案中,分离核酸剂包含特异性减少选自AGPas基因、GPT基因、胼胝质合酶基因、脂氧合酶D基因、Myb基因和PP2-B-15基因的基因的基因产物的核酸序列。在一些实施方案中,AGPase基因产物由SEQ ID NO: 527或其部分编码,GPT基因产物由SEQ ID NO: 529或其部分编码,胼胝质合酶基因产物由SEQ ID NO: 531或其部分编码,脂氧合酶D基因产物由SEQ ID NO: 533或其部分编码,Myb基因产物由SEQ ID NO: 535或其部分编码,PP2基因产物由SEQ ID NO: 537或其部分编码。
在一些实施方案中,分离核酸剂包含含有与AGPas基因、GPT基因、胼胝质合酶基因、脂氧合酶D基因、Myb基因中任一的基因产物的部分核酸序列互补的核酸序列的核酸序列,其特异性减少相应基因的基因产物。在一些实施方案中,靶向AGPas基因的核酸序列包含SEQ ID NO: 528或其部分,靶向GPT基因的核酸序列包含SEQ ID NO: 530或其部分,靶向胼胝质合酶基因的核酸序列包含SEQ ID NO: 532或其部分,靶向脂氧合酶D基因的核酸序列包含SEQ ID NO: 534或其部分,靶向Myb基因的核酸序列包含SEQ ID NO: 536或其部分,靶向PP2基因的核酸序列包含SEQ ID NO: 538或其部分。
在本发明的方面的一些实施方案中,所述核酸剂为双链RNA (dsRNA)。如本文所使用的术语“dsRNA”指通过碱基配对维持在一起的两条反向平行的多核糖核酸。两条链可为相同长度或不同长度,只要两条链之间存在足够的序列同源性使得双链结构以完整长度上至少80%、90%、95 %或100 %的互补性形成。根据本发明的一个实施方案,dsRNA分子无突出。根据本发明的另一个实施方案,dsRNA分子包含突出。根据其它实施方案,链对齐以致在链的末端存在1、2或3个碱基不对齐(即,对于其在相对链中不存在互补碱基),以致于当链退火时在双链体的一个或两个末端发生1、2或3个残基的突出。
将会注意的是,dsRNA可依据编码靶基因转录物的DNA的核酸序列定义,并且应理解与基因的编码序列对应的dsRNA序列包含基因的编码序列的RNA补体,或转录为RNA的基因的其它序列。
因此,在一些实施方案中,分离核酸剂包含与表II或表III的任何序列具有至少60%序列同一性的核酸序列互补的核酸序列。在一些实施方案中,所述核酸序列与表II或III的序列60-75%同一、70-85%同一、80-90%同一、90-95%同一或100%同一。
在其中植物或树为柑橘或柑橘相关植物或树的其它实施方案中,分离核酸剂包含与表IV和IV(a)的任何多核苷酸序列互补的核酸序列。在又其它的实施方案中,植物为柑橘或柑橘相关植物或树并且分离核酸剂包含与表V的任何多核苷酸序列互补的核酸序列。
抑制性RNA序列可与靶基因转录物的部分超过90%同一,或甚至100%同一。或者,RNA的双链体区域可功能上定义为能够与靶基因转录物的部分在严格条件下(例如,400 mM NaCl, 40 mM PIPES pH 6.4, 1 mM EDTA, 60℃杂交12-16小时,接着洗涤)杂交的核苷酸序列。与靶基因转录物互补的双链核苷酸序列的长度可为至少约18、19、21、25、50、100、200、300、400、491、500或更多碱基。在本发明的一些方面的一些实施方案中,对于柑橘类物种,例如但不限于甜橙:Citrus sinensis,柠檬:Citrus limon和酸橙:Citrusaurantium,双链核苷酸序列的长度大约为约18-约510核苷酸长。
如本文所使用的术语“相对应”意指与全部或部分参考多核苷酸序列同源的多核苷酸序列。相反,术语“互补”在本文中用于指互补序列与全部或部分参考多核苷酸序列同源。例如,核苷酸序列“TATAC”与参考序列“TATAC”相对应,与参考序列“GTATA”互补。
本教导涉及不同长度的dsRNA,较短版本即x小于或等于50 bp (例如,17-50),称为siRNA或miRNA。51-600的较长的dsRNA分子在本文中称作dsRNA,其可进一步加工为siRNA分子。根据一些实施方案中,dsRNA的核酸序列大于15个碱基对长。根据又其它的实施方案中,dsRNA的核酸序列19-25个碱基对长,30-100个碱基对长,100-250个碱基对长或100-500个碱基对长。根据又其它的实施方案,dsRNA 300-600个碱基对长,350-500个碱基对长或400-450个碱基对长。在一些实施方案中,dsRNA 400个碱基对长。
术语“siRNA”指诱导RNA干扰(RNAi)途径的小抑制性RNA双链体(一般在17-30个碱基对之间,但也可更长,例如,31-50 bp)。通常,siRNA作为21mers化学合成,具有中心的19 bp双链体区域和在末端的对称的2-碱基3’-突出,尽管近来已经描述与相同位置的21mers相比,化学合成的25-30碱基长的RNA双链体可具有高达100倍的效能增加。在触发RNAi中使用较长RNAs获得的观察到增加的效能理论上是由于用底物(27mer)代替产物(21mer)提供Dicer并且这提高siRNA双链体进入RISC的比率或效率。
已经发现3'-突出的位置影响siRNA的效能,在反义链上具有3'-突出的不对称双链体一般比在有义链上具有3'-突出的那些更有效(Rose等人, 2005)。这可归因于装载入RISC的不对称链,因为当靶向反义转录物时观察到相反的效率模式。
可连接双链干扰RNA (例如,siRNA)的链以形成发夹或茎-环结构(例如,shRNA)。因此,如所提及的,本发明一些实施方案的RNA沉默剂也可为短发夹RNA (shRNA)。
如本文所使用的,术语“shRNA”指具有茎-环结构的RNA剂,包含第一个和第二个互补序列区域,区域的互补性程度和定向足以使得区域之间发生碱基配对,第一个和第二个区域通过环区域连接,环由于环区域内核苷酸(或核苷酸类似物)之间缺乏碱基配对引起。环中的核苷酸数目为3-23或5-15或7-13或4-9或9-11之间并包括其的数目。环中的一些核苷酸可涉及与环中其它核苷酸的碱基对相互作用。可用于形成环的寡核苷酸序列的实例包括5'-UUCAAGAGA-3' (Brummelkamp, T. R.等人 (2002) Science 296: 550, SEQ ID NO: 517)和5'-UUUGUGUAG-3' (Castanotto, D.等人 (2002) RNA 8:1454, SEQ ID NO: 518)。本领域技术人员将会认识到所得的单链寡核苷酸形成包含能够与RNAi机器相互作用的双链区域的茎-环或发夹结构。
如本文所使用的,短语“微RNA (在本文中也可互换地称为“miRNA”或“miR”)或其前体”指充当转录后调控因子的微RNA (miRNA)。通常,miRNA分子为可装载入RISC复合体中并且指导另一个RNA分子的切割的约20-22个核苷酸长的RNA分子,其中其它RNA分子包含与miRNA分子的核苷酸序列基本上互补的核苷酸序列。
通常,miRNA分子从“前miRNA”或如本文所使用的前miRNA分子的前体通过任何植物细胞中存在的蛋白,例如DCL蛋白,加工,并装载到RISC复合体上,在复合体上其可指导靶RNA分子的切割。
前微RNA分子通常从pri-微RNA分子(初期转录物)加工。前微RNA两侧的单链RNA段对于将pri-miRNA加工成前-miRNA很重要。切割位点似乎是由距茎-ssRNA连接的距离决定(Han等人 2006, Cell 125, 887-901, 887-901)。
如本文所使用的,“前miRNA”分子为约100-约200核苷酸的RNA分子,优选约100-约130个核苷酸,其可采取包含不完美的双链RNA茎和单链RNA环(也称为“发夹”)的二级结构并且在双链RNA茎中进一步包含miRNA的核苷酸序列(及其互补序列)。根据一个具体的实施方案,miRNA及其补体位于距miRNA双链RNA茎的游离末端约10-约20个核苷酸处。单链环区域的长度和序列不是关键性的,并且可变化相当大,例如30-50个核苷酸长。miRNA与其补体之间的互补性不一定完美,可耐受1-3个未配对核苷酸的凸起。RNA分子采取的二级结构可通过本领域常规的计算机算法例如mFOLD预测。通过DCL活性释放并装载到RISC复合体上的来自前miRNA的双链RNA茎的特定链由5′末端的互补性程度决定,借此在其5′末端很少参与所切割的dsRNA茎的不同链的核苷酸之间的氢键的链装载到RISC复合体上并且将会决定靶RNA分子降解的序列特异性。然而,如果经验性地来自特定的合成前miRNA分子的miRNA分子无功能(因为“错误的”链装载到RISC复合体上),其立刻将会明显,该问题可通过交换前miRNA分子的dsRNA茎的各个链上的miRNA分子和其补体的位置解决。如本领域所已知的,涉及两个氢键的A和U之间的键,或涉及两个氢键的G和U之间的键不如涉及三个氢键的G和C之间强。
天然存在的miRNA分子可包含在其天然存在的前miRNA分子中,但也可通过将从这样的现存前miRNA分子正常加工的miRNA分子的核苷酸序列换成另一个目的miRNA的核苷酸序列将其引入现存前miRNA分子支架中。前miRNA的支架也可为完全合成的。同样,合成的miRNA分子可包含在现存前miRNA分子支架或合成的前miRNA支架中,和从现存前miRNA分子支架或合成的前miRNA支架加工。由于其被正确加工为期需微RNA的效率,相对于其它可优选一些前miRNA支架,特别是当作为其中除了前微RNA之外初级转录物中掺入其它DNA区域,例如非翻译前导序列或转录终止和多腺苷酸化区域的嵌合基因表达时。
在一些实施方案中,核酸剂为发夹RNA (hpRNA)干扰或包含内含子的发夹RNA (ihpRNA)干扰构建体。用于在植物中使用发夹RNA载体基因沉默的方法为本领域所熟知,并且被认为有效抑制植物中的基因表达。参见,例如,Waterhouse和Helliwell (2003) Nat. Rev. Genet. 4:29-38和Yan等人, PLoS one (2012) 7:e38186.
对于hpRNA沉默,表达盒设计为表达自身杂交以形成包含单链环区域和碱基配对茎的发夹结构的RNA分子。碱基配对的茎区域包含与编码抑制其表达的基因的内源信使RNA的全部或部分相对应的有义序列,和与有义序列完全或部分互补的反义序列。因此,该分子的碱基配对的茎区域一般决定用于沉默的RNA干扰的特异性。认为hpRNA分子有效抑制和沉默基因表达,并且其诱导的RNA干扰可被以后的植物世代遗传。用于使用hpRNA干扰抑制或沉默基因表达的方法在例如,Waterhouse等人的美国专利公开号2010058490中描述。Panstruga等人 (2003) Mol. Biol. Rep. 30:135-150描述了对于hpRNA构建体在体内沉默基因表达的有效性的瞬时测定。
对于ihpRNA,沉默分子具有与对于hpRNA相同的一般结构,但RNA分子额外包含能够在表达ihpRNA的细胞中被剪接的内含子。内含子的使用使剪接之后发夹RNA分子中的环尺寸减到最小,这增加干扰效率。
根据本教导,dsRNA分子可天然存在或合成。
dsRNA可为长或短dsRNA分子的混合物,例如,dsRNA、siRNA、siRNA+dsRNA、siRNA+miRNA、hpRNA或其组合。根据一个具体的实施方案,dsRNA为siRNA (100 %)。
dsRNA分子设计用于特异性靶向目的靶基因。将会理解的是dsRNA可用于下调一个或多个靶基因。如果靶向许多靶基因,使用包含用于靶向许多靶基因的多种RNA分子的异源组合物。或者所述多种dsRNA分子单独应用于种子(但不作为单个组合物)。根据一个具体的实施方案,对于单个靶使用许多不同的dsRNA分子,其可单独或同时(即,共制剂)应用。
根据本发明的一个实施方案,靶基因是植物内源的。这样的基因的下调通常对赋予植物改善的农业、园艺学、营养性状(“改善”或“增加”在本文中进一步定义)很重要。
如本文所使用,“内源”指表达(mRNA或蛋白)在植物中发生的基因。通常,内源基因在植物中天然表达或源于植物。因此,植物可为野生型植物。然而,植物也可为遗传修饰的植物(转基因的)。
靶基因的下调对于赋予改善的生物量、活力、产率、果实品质、非生物和/或生物应激耐受力中一种或至少一种(例如,两种或更多种)或改善的氮使用效率可为重要的。
在一些实施方案中,通过本发明的方法和核酸剂下调的靶基因为在植物感染植物病原体,例如植物感染的植物病原体(例如韧皮部杆菌属物种)之后其表达上调的植物病原体抗性基因产物。
示例性的靶基因包括,但不限于,信号传导级联中间体例如MAPK、茉莉酸、水杨酸和脂肪酸、ROS产生相关的酶和蛋白、碳水化合物和能量代谢、叶绿体和光合作用相关基因产物等、糖聚合物生物合成和降解、糖转运和输出、挥发性激素生物合成和降解、碳水化合物转运的基因、‘R’基因,可沉默其表达以改善植物在感染植物病原体时的产率、生长速率、活力、生物量、果实品质或应激耐受力。可经受本教导的调节的靶基因的其它实例在本文中描述。
在一些实施方案中,靶基因包括,但不限于病原体抗性反应的基因,例如水杨酸水平变化、茉莉酸水平变化、赤霉酸水平变化、植物生长素水平变化、细胞分裂素水平变化、乙烯水平变化、ABA植物激素水平变化、植物激素相关基因上调、胼胝质的生物合成、沉积和降解、活性氧物类产生、功能性FLS2/BAK1复合体形成、蛋白激酶通路激活、韧皮部堵塞、淀粉积聚、韧皮薄壁组织细胞中淀粉积聚、聚合物筛形成、碳水化合物代谢变化、形成层活性畸变、蔗糖积聚和类胡萝卜素合成。
靶基因可包含转录为编码多肽的mRNA的核酸序列。
或者,靶基因可为非编码基因例如miRNA或siRNA。
例如,为了沉默目的mRNA的表达,可如下选择合成适合本发明一些实施方案使用的dsRNA的合成。首先,扫描包含3' UTR和5' UTR的mRNA序列。
其次,使用任何序列比对软件,例如从NCBI服务器(wwwdotncbidotnlmdotnihdotgov/BLAST/)可得的BLAST软件比较mRNA序列与适当的基因组数据库。过滤出mRNA序列中与其它编码序列呈现出明显同源性的推定区域。
选择有资格的靶序列作为dsRNA合成的模板。优选的序列为与基因组中的其它基因具有小同源性的那些,以减少“脱靶”作用。
应理解的是本发明一些实施方案的RNA沉默剂不一定限于仅包含RNA的那些分子,而是进一步包含化学修饰的核苷酸和非核苷酸。
dsRNA可使用本领域已知的任何方法合成,包括酶促合成或固相合成。这些在具有或不具如上所解释的修饰的短多核苷酸序列的情况下尤其有用。用于执行固相合成的设备和试剂从,例如Applied Biosystems,市售可得。也可采用用于这样的合成的任何其它方法;寡核苷酸的实际合成在本领域技术人员的能力内,并且可经由如例如Sambrook, J.和Russell, D. W. (2001), "Molecular Cloning: A Laboratory Manual (分子克隆:实验室手册)"; Ausubel, R. M.等人, eds. (1994, 1989), "Current Protocols in Molecular Biology (分子生物学通用方案)," I-III卷, John Wiley & Sons, Baltimore, Maryland; Perbal, B. (1988), "A Practical Guide to Molecular Cloning (分子克隆实践指南)," John Wiley & Sons, New York; 和Gait, M. J., ed. (1984), "Oligonucleotide Synthesis (寡核苷酸合成)"中所详述的已建立的方法学利用固相化学,例如氰乙基亚磷酰胺接着脱保护、脱盐和通过,例如自动三苯甲基或HPLC纯化完成。
根据一个具体的实施方案,核酸剂以缺乏用于驱动dsRNA (外源)重组表达的异源启动子的配置提供给植物,致使本发明核酸分子为裸分子。核酸剂可仍包含可影响其稳定性和生物利用度的修饰(例如,PNA)。
术语“重组表达”指从核酸构建体的表达。
如本文所使用的,“缺乏用于驱动dsRNA表达的异源启动子”意指该分子不包含转录dsRNA的顺式作用调控序列(例如,异源的)。如本文所使用的术语“异源的”指外源的、天然植物细胞中非天然发生(例如通过位置整合,或在细胞内非天然存在)。
核酸剂可进一步包含在含有额外的调控元件的核酸构建体中。因此,本发明的方面的一些实施方案提供包含含有特异性减少至少一种植物病原体抗性基因产物表达的核酸序列的分离核酸剂的核酸构建体。
对于从体内转基因或表达盒转录,可使用调控区域(例如,启动子、增强子、沉默子、前导序列、内含子和多腺苷酸化)调节RNA链(或链们)的转录。因此,在一个实施方案中,提供包含核酸剂的核酸构建体。所述核酸构建体可具有构建为促进本发明RNA分子转录的多核苷酸序列与在宿主细胞中有功能的一个或多个启动子序列操作性连接。多核苷酸序列可置于在宿主基因组中天然存在的内源启动子控制下。处于操作性连接的启动子序列的控制下的本发明核苷酸序列可进一步两侧为有利影响其转录和/或所得转录物的稳定性的额外序列。这样的序列一般位于启动子上游和/或表达构建体的3'末端的下游。术语“操作性连接”,如参考调控序列和结构核苷酸序列使用的,意指调控序列导致连接的结构核苷酸序列的可调型表达。“调控序列”或“控制元件”指位于结构核苷酸序列的上游、内部或下游的并且影响转录时序和水平或量、RNA加工或稳定性,或相关的结构核苷酸序列的翻译的核苷酸序列。调控序列可包括启动子、翻译前导序列、内含子、增强子、茎环结构、阻遏物结合序列、终止序列、暂停序列、多腺苷酸化识别序列等。在一些实施方案中,所述宿主为植物,并且启动子和其它调控元件在植物中有活性。
核酸剂可以以多种方式递送至植物。如所提及的,核酸可通过注射、应用气溶胶、撒粉、在干悬浮剂中、在可乳化的悬浮剂中、作为颗粒、在微型胶囊中、在丸剂中、作为可溶性粉末、与损伤剂一起、轰击、通过喷枪喷雾、添加植物激素、添加至基于琼脂的发芽平台、添加湿润剂、添加多糖例如海藻酸钠或壳聚糖、添加转染试剂引入植物中。在一些非限制性的实施方案中,核酸剂配制为用于通过灌溉或施加正压或负压施用。在其它非限制性实施方案中,核酸剂配制为用于与植物营养补充剂一起施用,例如,脲-三嗪酮补充剂,例如市售可得的脲-三嗪酮N (N-SURE®, Tessenderlo-Kerley, Pheonix,AZ)。与这样的脲-三嗪酮补充剂一起给予核酸适于在所有植物中叶和土壤施用二者,特别是对于商业蔬菜和水果作物。核酸剂可作为核酸提供给植物,无额外的剂(例如转染剂)或胶囊化或其它配制,或,任选地,与额外的剂一起配制,例如用于增强摄入或靶基因产物的有效下调。
在一些具体的实施方案中,核酸剂通过注射入植物或树引入植物中。适于将核酸或核酸剂注射入植物或树的方法在,例如,Michael Kuhns的Utah State University Cooperative Extension’s informational paper (NR/FF/020)中描述,包括树干植入(参见例如,Acecaps ™和Medicaps ™)、加压和无压力树干注射(参见,例如,Arborjet Tree IV ™和Wedgle ™, Tree Tech ™和Rainbow Tree Care ™)、土壤注射和树干基部喷雾。
在其它实施方案中,核酸剂使用病毒诱导的基因沉默引入植物中。病毒诱导的基因沉默(VIGS)提供吸引人的转基因技术替代,因为其允许无植物转化调查基因功能(Ruiz等人, 1998; Burch-Smith等人, 2004)。候选基因的部分片段插入病毒载体中以产生重组病毒。用该重组病毒(例如,经由农杆菌)转染植物导致产生病毒相关的小干扰RNA (siRNAs) (Baulcombe, 2004),其可介导相关内源基因转录物的降解,导致接种植物中候选基因表达的沉默(Brigneti等人, 2004; Burch-Smith等人, 2004)。对内源基因表达的沉默作用通常可在病毒接种后1-2周测定。VIGS已经成为最广泛使用的确实重要的反向遗传学工具之一,特别是对于非模型植物。在一些实施方案中,使用VIGS在模型感染和/或田野条件下筛选用于特异性减少植物病原体抗性基因产物表达的候选核酸序列。
VIGS可用于沉默或减少候选植物病原体相关基因的表达。使用病毒载体沉默内源植物基因可涉及克隆入病毒基因组而不显著折衷病毒复制和移动,与内源植物基因共享一定百分比的同一性或互补性的核苷酸片段。关于VIGS系统的原理和详细方案已有描述(Dinesh-Kumar,等人, (2003) Methods in Mol. Biol. 236:287-94; Lu,等人, (2003) Methods 30:296-303)。已经修饰几种不同的RNA和DNA植物病毒以用作基因表达的载体。这些RNA病毒,例如TMV (烟草花叶病毒)、PVX (马铃薯病毒X)和TRV (烟草脆裂病毒),可用于沉默许多不同的靶基因(Angell,等人, (1999) 植物 J. 20:357-62; Kumagai,等人, (1995) PNAS 92:1679-83; MacFarlane,等人, (2000) Virology 267:29-35)。其它合适的用于VIG构建的病毒包括,但不限于柑橘衰退病毒(CTV)、苹果潜伏球形病毒(ALSV)、大麦条斑花叶病毒(BSMV)、卫星烟草花叶病毒(STMV)和黄花茅属潜伏性漂白病毒(ALBV)。尽管DNA病毒,限于双生病毒科,尚未广泛用作表达载体,但番茄金黄花叶病毒(TGMV)和卷心菜曲叶病毒(CaLCuV)已经用于产生沉默载体并沉默番茄和拟南芥中的转基因和天然基因二者(Peele,等人, (2001) Plant J. 27:357-66; Turnage,等人, (2001) Plant J. 107:14)。如本领域技术人员所知的,每一病毒/宿主组合应对于产生有效沉默载体最佳化。在本文提供的实例中,病毒基因组作为二分病毒提供。然而,应理解可使用其它最佳化的载体并且包含在申请人的技术的范围内。例如,沉默载体可包括复制原点(在植物细胞中复制所需的基因)和与一个或多个靶基因相似的一个或多个核苷酸序列。载体可也包含病毒移动所需的那些基因。在二分病毒例如双生病毒的情况下,A和B组分可在同一沉默载体中携带。或者,如在TRV的情况下,植物可用在分离的载体上的两个组分转化。在一个实例中,显示双生病毒的A基因组组分(自主复制)对VIGS足够,B组分同样(WO 01/94694和美国专利申请出版号2002/0148005,二者通过引用结合到本文中)。这些参考表明A基因组(AL1、AL2和/或AL3)或B基因组(BR1和/或BL1)可用作沉默载体。美国专利号6,759,571以及美国专利申请出版号2004/0019930和20110016584中公开了其它沉默载体,所述专利和专利申请二者均通过引用结合到本文中。WO 01/94694 (通过引用结合到本文中)公开可插入核苷酸序列的双生病毒基因组的位置。例如,与至少靶基因的片段相似的核苷酸序列可替换对于当前的基因沉默目的非必需的任何编码或非编码区域,可插入病毒序列外的载体,或可插入内源病毒基因的正下游,以致病毒基因和核苷酸序列共转录。例如,核苷酸序列可插入病毒基因组的共有区域,然而优选核苷酸序列不插入或替换病毒DNA复制所需的Ori序列或两侧序列。与靶基因相似的核苷酸序列的大小可取决于在病毒基因组内插入或替换的位点。
因此,在一些实施方案中,包含特异性减少至少一种植物病原体抗性基因产物表达的核酸的核酸剂包含在VIGS病毒诱导的基因沉默载体构建体中。在一些实施方案中,VIGS载体构建体进一步包含在适当的细菌宿主中,例如,农杆菌。在又进一步的实施方案中,向植物给予或提供本发明核酸剂包括将包含核酸剂的VIGS载体引入宿主植物中。
表达包括异源DNA序列转录为mRNA。确保在真核生物中表达的调控元件为本领域技术人员所熟知。在真核细胞的情况下,其包含确保转录终止和转录物稳定的polyA信号。通常使用的polyA信号包括来自CaMV的35S RNA的polyA信号和来自农杆菌的nos基因的polyA信号。其它调控元件可包括转录和/或翻译的;增强子、内含子和其它为本领域技术人员所已知的。
可使用本领域技术人员所已知的任何接种或转化方法。用于VIGS构建体的递送方法包括但不限于,机械注射体外转录的RNA或感染植物的提取物、农杆菌(Agro)-接种、通过用金刚砂和质粒DNA温和磨损叶表面接种(“质粒接种”)和微粒轰击。机械注射耗时但可在某些宿主例如拟南芥中可增加沉默效率(Ratcliff,等人, (2001) Plant J. 25:237-45)。Agro-接种最普遍并且对于DNA和RNA病毒二者均已开发(Schob,等人, (1997) Mol. Gen. Genet. 256:581-85)。Agro-接种对于大规模生产应用更可行并且耗时较少。已经开发了烟草、番茄和大麦VIGS载体并且使用Agro-接种显示广泛的沉默。特别地,对于许多研究者,TRV-衍生的VIGS载体/Agro-接种正在成为优势组合。Uhde,等人, (2005) Arch. Virol. 150:327-340中描述了通过用金刚砂和质粒DNA温和磨损叶表面接种。质粒DNA-包覆的钨或金微米大小颗粒的微粒轰击对于基于DNA病毒的VIGS载体极其有用(Muangsan,等人, (2004) Plant J. 38:1004-14)。Ryu,等人, (WO 2005/103267)描述通过在农杆菌(Agrodrench)悬浮液中浸湿植物的根经由农杆菌接种的VIGS方法。
因此,根据本发明的一些实施方案,提供包含至少一种含有特异性减少选自与表II或表III的任何多核苷酸序列具有至少60%同一性的至少一种植物病原体抗性基因产物表达的核酸的外源分离核酸剂的植物。植物可为树、灌木、矮树丛、幼苗、种子、嫩枝(scion)、根茎、接枝的植物、芽、接穗(budwood)、根或嫁接株中的任何一种。在一些具体的实施方案中,植物为选自甜橙商业品种(脐橙(Citrus sinensis Osbeck (L.)))、克莱门氏小柑橘(clementines) (C. reticulata)、青柠(C. aurantifolia)、柠檬(C. limon)、酸橙(C. aurantium)、杂交种和亲缘植物(Citranges、Citrumelos、Citrandarins)、Balsamocitrus dawei、C. maxima、C. jambhiri、Clausena indica、C. lansium、Triphasia trifolia、Swinglea glutinosa、Micromellum tephrocarpa、三角橘属(Merope)物种、Eremolemon、酒饼簕属(Atalantia)物种、乌柑(Severiniabuxifolia)、指橘属(Microcitrus)物种、金橘属(Fortunella)物种、Calodendrum capense、九里香属(Murraya)物种、枳壳(Poncirus trifoliate)的柑橘或柑橘样植物。在一些实施方案中,其中植物为柑橘或柑橘相关植物,所述至少一种外源分离核酸剂包含特异性减少选自表IV的多核苷酸序列的至少一种植物病原体抗性基因产物表达的核酸。在一些实施方案中提供包含至少一种外源分离核酸剂的植物细胞。所述细胞可为植物任何器官或组织的细胞。
应理解的是一些非柑橘类植物也可为韧皮部杆菌属物种的宿主,例如茄属,例如,番茄和马铃薯。已知番茄在野外和受控的实验室条件二者中均沾染韧皮部杆菌属感染。适合与本发明的组合物和方法一起使用的番茄序列的非限制性列表在表VI中提供:
表VI 一些番茄植物病原体反应基因序列[SEQ ID NO.和基因识别(gi)号]
分离核酸可在农用化学品组合物中提供。因此,根据一些实施方案,提供包含特异性减少植物中至少一种植物病原体抗性基因产生表达的分离核酸序列的农用化学品组合物。如本文所使用的,短语“农用化学品组合物”定义为用于农用化学品用途的组合物,并且,如进一步定义的,农用化学品组合物包含至少一种农用化学品活性物质。因此,除了分离核酸序列,本发明的农用化学品组合物可包含额外的植物-有益的或农用化学品活性化合物。示例性的植物-有益的或农用化学品活性化合物包括,但不限于肥料、抗生素、杀生物剂、杀虫剂、驱虫剂、除草剂、植物激素、杀菌剂例如铜等。在一些具体的实施方案中,农用化学品组合物包含植物激素。如本文所使用的,术语“植物激素”用于指植物产生的正常影响植物发育的至少一个方面,包括但不限于,生长、种子发育、开花和根生长的信号传导分子。本领域技术人员将会容易地理解术语植物激素和什么实体落在该术语的范围下。例如,植物激素包括但不限于,脱落酸(ABA)或其衍生物、赤霉素(GA)、植物生长素(IAA)、乙烯、细胞分裂素(CK)、油菜类固醇(BR)、茉莉酸(JA)、水杨酸(SA)、独脚金内素(SL)。在选择的实施方案中,本发明的融合蛋白包含结合脱落酸(ABA)、赤霉素(GA)、植物生长素(IAA)和/或茉莉酸(JA)的植物激素结合结构域。
进一步地,所述农用化学品组合物可任选包含有利于最佳分散、雾化、沉积、叶润湿、分布、延迟被土壤生物及其分泌物降解(例如,通过加入杀菌剂例如铜)、植物保留和/或摄入农用化学品组合物的一种或多种添加剂。作为一个非限制实例,这样的添加剂为稀释剂、溶剂、佐剂、表面活性剂、润湿剂、铺展剂、油类、粘着剂、增稠剂、渗透剂、缓冲剂、酸化剂、抗沉降剂、抗冷冻剂、光保护剂、消泡剂、杀生物剂和/或漂移控制剂。
本发明的核酸剂、组合物和农用化学品组合物适合农用化学品用途。如本文所使用的,“农用化学品用途”不仅包括如上所定义的适合和/或意在用于田野生长作物(例如,农业)的农用化学品组合物的用途,还包括用于温室生长作物(例如,园艺/花卉栽培)或水培培养系统的农用化学品组合物的用途,或在公共或私人绿地(例如私家园林、公园、运动场地)中的用途,用于保护植物或植物的部分,包括但不限于鳞茎、块茎、果实和种子(例如,免于有害生物、疾病或害虫),用于控制,优选促进或增加植物的生长,和/或用于提升植物或收获的植物部分(例如,其果实、花、种子等)的产率。
如本文所使用的,“农用化学品活性物质”意指可用于如上所定义的农用化学品用途的任何活性物质或要素。这样的农用化学品活性物质的实例对于技术人员将会是清楚的,并且可例如包括作为杀虫剂(例如,接触杀虫剂或内吸杀虫剂,包括家用杀虫剂)、杀螨剂(acaricides, miticides)、除莠剂(例如,接触除莠剂或内吸除莠剂,包括家用除莠剂)、杀真菌剂(例如接触杀真菌剂或内吸杀真菌剂,包括家用杀真菌剂)、杀线虫剂(例如,接触杀线虫剂或内吸杀线虫剂,包括杀线虫剂)和其它杀虫剂(例如杀鸟剂、杀螺剂、杀鱼剂)或杀生物剂(例如,用于杀死细菌、藻类或螺类的剂)有活性的化合物,以及肥料、生长调节剂例如植物激素、微量营养素、安全剂、信息素、驱虫剂、饵(例如,昆虫饵或螺饵)和/或用于调节(即,增加、降低、抑制、增强和/后触发)靶植物(例如,待保护的植物或待控制的植物)的基因表达(和/或其它生物学或生物化学过程)的活性要素。农用化学品活性物质包括化学品,但也包括核酸、肽、多肽、蛋白质(包括抗原结合蛋白)和微生物。这样的农用化学品活性物质的实例对技术人员将会清楚;并且例如包括,但不限于:二酰胺类:氯虫苯甲酰胺、氰虫酰胺、氟虫双酰胺;特窗酸和特特拉姆酸衍生物:螺螨酯、螺虫乙酯、螺甲螨酯(spiromisifen);弦音器官调节剂:吡蚜酮、氟啶虫酰胺;烟碱乙酰胆碱受体激动剂:氟啶虫胺腈、flupyradifurone;螺环菌胺、草甘膦、百草枯(paraquat)、异丙甲草胺、乙草胺、甲基磺草酮、2,4-D、阿特拉津(atrazine)、草铵膦,草硫膦、恶唑禾草灵、二甲戊灵、毒莠定、氟乐灵、溴苯腈、炔草酸,氟草烟(fluoroxypyr)、烟嘧磺隆、苄嘧磺隆、咪草烟(imazetapyr)、麦草畏,吡虫啉、噻虫嗪、氟虫腈、毒死蜱、溴氰菊酯、λ-三氯氟氰菊酯(cyhalotrin)、硫丹、甲胺磷、呋喃丹、噻虫胺、氯氰菊酯、阿维菌素、吡氟酰草胺、多杀菌素、茚虫威、联苯菊酯、七氟菊酯、嘧菌酯、噻虫嗪、戊唑醇、代森锰锌、氰霜唑、氟啶胺、唑菌胺酯,氟环唑、百菌清、铜杀真菌剂、肟菌酯、丙硫菌唑、苯醚甲环唑、多菌灵、丙环唑、托布津、硫磺、啶酰菌胺和其它已知的农用化学品或其任何适当组合。基于本文的公开内容其它合适的农用化学品对技术人员将会清楚,并且可例如为任何市售可得的农用化学品,例如包括Herbicide Resistance Action Committee (除草剂抗性行动委员会)、Fungicide Resistance Action Committee (杀真菌剂抗性行动委员会)和Insecticide Resistance Action Committee (杀虫剂抗性行动委员会)的任何网站中列出的每一化合物,以及Phillips McDougall, AgriService November 2007 V4.0, Products Section--2006 Market, Product Index pp. 10-20中列出的那些。农用化学品活性物质可以以不同的形式存在,包括但不限于,作为晶体、作为微晶、作为纳米晶体、作为共结晶、作为粉尘、作为颗粒、作为粉末、作为片剂、作为凝胶、作为可溶浓缩物、作为乳液、作为乳化浓缩物、作为悬浮液、作为悬浮液浓缩物、作为悬乳剂、作为分散剂、作为分散浓缩物、作为微胶囊悬浮液或作为本领域技术人员清楚的任何其它形式或类型的农用化学品制剂。农用化学品活性物质不仅包括即用型的活性物质或要素,还包括非活性形式的前体,其可由外部因素激活。作为非限制性的实例,前体可通过虫害时植物伤口引起的pH变化,真菌攻击导致的酶促作用,或通过温度变化或湿度变化激活。
本文的农用化学品组合物可为液体、半固体或固体形式,并且例如作为气溶胶、流动性粉剂、可湿性粉剂、可湿性颗粒、可乳化浓缩物、悬浮浓缩物、微乳、胶囊悬浮液、干燥微胶囊、片剂或凝胶,或悬浮、分散、乳化或另外引进合适的液体介质(例如水或另一种合适的水性、有机或油介质)中维持用于储存或应用。任选地,所述组合物进一步包含适合用在本文组合物中的一种或多种进一步的组分,例如但不限于,稀释剂、溶剂、佐剂、表面活性剂、润湿剂、铺展剂、油类、粘着剂、增稠剂、渗透剂、缓冲剂、酸化剂、抗沉降剂、抗冷冻剂、光保护剂、消泡剂、杀生物剂和/或漂移控制剂等。
根据本发明的一些方面,还提供用于制造农用化学品组合物的方法,所述方法包括:(i) 选择至少一个,优选多个,特异性减少植物中至少一种植物病原体抗性基因产物表达的核酸序列(例如dsRNA),和(ii) 在具有额外的物质,例如农用化学品活性物质的化合物,或化合物的组合中配制核酸剂,和任选(iii) 加入可适用于这样的组合物,优选农用化学品组合物的进一步的组分。在一些实施方案中,所述化合物包含在载体中。
本发明的方法包括本文的组合物向植物或植物部分的至少一种施用。
若需要,使用前将组合物溶解、悬浮和/或稀释在适当溶液中。向植物或植物部分的施用使用任何合适或期需的用于施用农用化学品组合物的手工或机械技术进行,包括但不限于喷雾、刷、敷裹、滴、浸渍、包覆、扩散、作为小滴、雾或气溶胶施用。如本文所使用的,“当感染植物病原体时增加植物的产率、生长速率、活力、生物量、果实品质或应激耐受力”为保护植物免于植物病原体感染(如前文所定义的)所引起的损伤或产率降低。因此,除了对植物病原体反应的作用,本文的组合物还可具有杀虫或抗菌或杀虫活性,帮助对抗植物病原性生物引起的损伤,并因此防止产率损失。
在一些实施方案中,本发明的dsRNA或组合物将会通过注射提供给植物。
组合物中dsRNA的示例性浓度包括,但不限于,0.01-0.3 µg/µl、0.01-0.15 µg/µl、0.04-0.15 µg/µl、0.1-100 µg/µl; 0.1-50 µg/µl、0.1-10 µg/µl、0.1-5 µg/µl、0.1-1 µg/µl、0.1-0.5 µg/µl、0.15-0.5 µg/µl、0.1-0.3 µg/µl、0.01-0.1 µg/µl、0.01-0.05 µg/µl、0.02-0.04 µg/µl、0.001-0.02 µg/µl。根据进一步的实施方案,处理溶液中dsRNA的浓度包括,但不限于,0.01-0.3 ng/µl、0.01-0.15 ng/µl、0.04-0.15 ng/µl、0.1-100 ng/µl; 0.1-50 ng/µl、0.1-10 ng/µl、0.1-5 ng/µl、0.1-1 ng/µl、0.1-0.5 ng/µl、0.15-0.5 ng/µl、0.1-0.3 ng/µl、0.01-0.1 ng/µl、0.01-0.05 ng/µl、0.02-0.04 ng/µl、0.001-0.02 ng/µl。根据一个具体的实施方案,处理溶液中dsRNA的浓度为0.1-1 µg/µl。根据一些实施方案,核酸剂以有效减少或抑制至少一种植物病原体抗性基因产物表达的量提供。如本文所使用的“抑制性量”或“有效量”指足以将靶基因下调(减少其表达)至少20 %、30 %、40 %、50 %,或更多,约60 %、70 %、80 %、90 %或更多甚至100 %的dsRNA的量。
根据本发明的一些实施方案,dsRNA的浓度以有效量提供给植物,以质量/kg植物测量。这样的有效量包括,但不限于,0.001-0.003 mg/kg、0.005-0.015 mg/kg、0.01-0.15 mg/kg、0.1-100 mg/kg; 0.1-50 mg/kg、0.1-10 mg/kg、0.1-5 mg/kg、0.1-1 mg/kg、0.1-0.5 mg/kg、0.15-0.5 mg/kg、0.1-0.3 mg/kg、0.01-0.1 mg/kg、0.01-0.05 mg/kg、0.02-0.04 mg/kg、0.001-0.02 mg/kg、0.001-0.003 g/kg、0.005-0.015 g/kg、0.01-0.15 g/kg、0.1-100 g/kg; 0.1-50 g/kg、0.1-10 g/kg、0.1-5 g/kg、0.1-1 g/kg、0.1-0.5 g/kg、0.15-0.5 g/kg、0.1-0.3 g/kg、0.01-0.1 g/kg、0.01-0.05 g/kg、0.02-0.04 g/kg、0.001-0.02 g/kg植物。根据一个具体的实施方案,提供给植物的dsRNA的有效量为0.0001-10000 mg/kg植物。在另一个实施方案中,有效量为1-1000 mg/kg 植物。
本发明的试剂可包装在包含核酸剂(例如dsRNA)、用于引入核酸剂的说明书、进入植物中的构建体或组合物和任选农用化学品活性剂的试剂盒中。
若需要,本发明的一些实施方案的组合物可以以包装或分配装置呈现,其可包含含有活性成分的一个或多个剂量形式。包装可,例如,包含金属或塑料箔,例如泡罩包装。包装或分配装置可伴随用于引入植物中的说明书。
根据一个示例性的实施方案,核酸剂或组合物和添加剂包含在分开的容器中。
如本文所使用的术语“约”指±10 %。
术语“包含(comprises,comprising)”、“包括(includes,including)”、“具有”及其词形变化意指“包括但不限于”。
术语“由其组成”意指“包括并且限于”。
术语“基本上由其组成”意指组合物、方法或结构可包括额外的成分、步骤和/或部分,但仅在额外的成分、步骤和/或部分不实质上改变所要求组合物、方法或结构的基本和新型特征时。
如本文所使用的,单数形式“一个”、“一种”和“所述”包括复数提及,除非上下文另有清楚规定。例如,术语“一种化合物”或“至少一种化合物”可包括多个化合物,包括其混合物。
在本申请各处,本发明的不同实施方案可以以范围格式呈现。应理解的是范围格式的描述仅是为了方便和简洁,不应解释为对本发明范围的固定限制。相应地,范围的描述应认为是具有具体公开的所有可能的亚范围以及该范围内的个体数值。例如,范围的描述例如1-6应认为具有具体公开的亚范围例如1-3、1-4、1-5、2-4、2-6、3-6等,以及该范围内的个体数字,例如,1、2、3、4、5和6。这适用于任何范围宽度。
每当本文中标明数字范围时,其意指包括所标明范围内的任何引用数字(分数或整数)。短语第一个标明数字和第二个标明数字“之间的范围(ranging/ranges between)”和从第一个标明的数字“到”第二个标明的数字“变动(ranging/ranges from)”在本文中可互换使用,并且意指包括第一个或第二个标明的数字和期间的所有分数和整数。
如本文所使用的术语“方法”指用于完成给定任务的方式、手段、技术和程序,包括但不限于,化学、药理学、生物学、生物化学和医药领域的从业者已知的或从已知方式、手段、技术和程序容易地开发的那些方式、手段、技术和程序。
应理解为了清楚起见在分离的实施方案的语境中描述的本发明的某些特征也可在单个实施方案中组合提供。相反,为简洁起见在单个实施方案的语境中描述的本发明的不同特征也可分离地或以任何适当的亚组合或在本发明任何其它描述的实施方案中适当地提供。在不同实施方案的语境中描述的某些特征不应认为是那些实施方案的基本特征,除非该实施方案无那些元素无效。
如上文所描绘的和如下面的权利要求部分所要求的本发明的不同实施方案和方面在下列实施例中找到实验支持。
实施例
现在参考下列实施例,与上面的说明书一起,以非限制性方式说明本发明。
一般而言,本文所使用的命名和本发明中采用的实验室程序包括分子、生物化学、微生物学和重组DNA技术。这样的技术在文献中透彻解释。参见,例如,"Molecular Cloning: A laboratory Manual (分子克隆:实验室手册)" Sambrook等人, (1989); "Current Protocols in Molecular Biology (分子生物学通用方案)" Volumes I-III Ausubel, R. M., ed. (1994); Ausubel等人, "Current Protocols in Molecular Biology (分子生物学通用方案)", John Wiley和Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning (分子克隆实践指南)", John Wiley & Sons, New York (1988); Watson等人, "Recombinant DNA (重组DNA)", Scientific American Books, New York; Birren等人 (eds) "Genome Analysis: A Laboratory Manual Series (基因组分析:实验室手册系列)", 1-4卷, Cold Spring Harbor Laboratory Press, New York (1998);美国专利号4,666,828、4,683,202、4,801,531、5,192,659和5,272,057中列出的方法学; "Cell Biology: A Laboratory Handbook (细胞生物学:实验室手册)", I-III卷 Cellis, J. E., ed. (1994); Freshney, Wiley-Liss的"Culture of Animal Cells - A Manual of Basic Technique (动物细胞培养-基础技术手册)", N. Y. (1994), 第三版; "Current Protocols in Immunology (免疫学通用方案)" I-III卷 Coligan J. E., ed. (1994); Stites等人 (eds), "Basic and Clinical Immunology (基础和临床免疫学)" (第8版), Appleton & Lange, Norwalk, CT (1994); Mishell和Shiigi (eds), "Selected Methods in Cellular Immunology (细胞免疫学中选择的方法)", W. H. Freeman和Co., New York (1980); 可用的免疫测定在专利和科学文献中广泛描述,参见,例如,美国专利号3,791,932、3,839,153、3,850,752、3,850,578、3,853,987、3,867,517、3,879,262、3,901,654、3,935,074、3,984,533、3,996,345、4,034,074、4,098,876、4,879,219、5,011,771和5,281,521; "Oligonucleotide Synthesis (寡核苷酸合成)" Gait, M. J., ed. (1984); “Nucleic Acid Hybridization (核酸杂交)" Hames, B. D., 和Higgins S. J., eds. (1985); " Transcription and Translation (转录和翻译)" Hames, B. D., 和Higgins S. J., eds. (1984); "Animal Cell Culture (动物细胞培养)" Freshney, R. I., ed. (1986); "Immobilized Cells and Enzymes (固定化细胞和酶)" IRL Press, (1986); "A Practical Guide to Molecular Cloning (分子克隆实践指南)" Perbal, B., (1984)和"Methods in Enzymology (酶学中的方法)" 1-317卷, Academic Press; "PCR Protocols: A Guide To Methods And Applications (PCR方案:方法和应用指南)", Academic Press, San Diego, CA (1990); Marshak等人, "Strategies for Protein Purification and Characterization - A Laboratory Course Manual (蛋白纯化和表征策略-实验室课程手册)" CSHL Press (1996); 其所有通过引用结合,如同在本文中完整阐述。其它一般参考在该文档各处提供。相信其中的程序为本领域所熟知并为了方便读者而提供。其中所包含的所有信息通过引用结合到本文中。
一般材料和实验方案
基因靶选择
靶植物抗性反应基因根据报道的微阵列和RNAseq实验选择,例如,表II、IV和IV(a)。靶向来自不同功能类别的基因,例如:水杨酸水平变化、茉莉酸水平变化、赤霉酸水平变化、植物生长素水平变化、细胞分裂素水平变化、乙烯水平变化、ABA植物激素水平变化、植物激素相关基因上调、胼胝质的生物合成、沉积和降解、活性氧物类产生、功能性FLS2/BAK1复合体形成、蛋白激酶通路激活、韧皮部堵塞、淀粉积聚、韧皮薄壁组织细胞中淀粉积聚、聚合物筛形成、碳水化合物代谢变化、形成层活性畸变、蔗糖积聚和类胡萝卜素合成。靶向的具体序列根据在线可用的siRNA分析选择,例如http://www(dot)med(dot)nagoya-u(dot)ac(dot)jp/neurogenetics/i_Score/i_score(dot)html。所选序列综合排序并用作体外反转录反应的模板。
例如,选择基因和序列例如表III中的那些及其同系物用于靶向并如下描述产生靶向其的dsRNA。
生物测定
番茄植物对经由木虱B. cockerelli的C. Liberibacter psyllaurous感染敏感。因此,番茄植物组成用于评估组合物和方法增强HLB-感染植物的健康的功效的模型物种。
通过撒粉、喷雾、灌溉、注射或其它向植物递送dsRNA的有效方法将如上文描述产生的包含所选的与植物病原体抗性反应有关的靶番茄基因的序列的dsRNA引入未感染的番茄植物。示例性的来自番茄的靶基因在表VI中详述。
dsRNA在番茄植物组织和器官中的存在情况通过PCR、凝胶电泳斑点印迹或其它典型的检测技术监测,并选择有效的递送方法。定期监测dsRNA的持久性和完整性。
进行RNA提取和cDNA合成。来自每一重复处理的cDNA然后用于通过使用qRT-PCR测量基因表达水平来评估RNAi的量和完整性。反应一式三份进行,并与内参比较以比较RNAi水平。检验基因水平降低的番茄植物进一步生长并用HLB实验性地感染。
对照和含有dsRNA的番茄植物二者均通过与感染木虱接触或向番茄根茎上嫁接感染嫩枝用C. Liberibacter psyllaurous (也称为“Lso”)感染。韧皮部杆菌属感染通过肉眼检测特征性黄化、斑纹、斑点、缩叶、僵硬、弹性、变紫、生长受阻、生长、结果等鉴定并通过韧皮部杆菌属特异性标志的PCR验证。
对照和处理番茄植物的健康根据果实品质、落果和肉眼检测而测定。还监测dsRNA、靶基因的表达和韧皮部杆菌属感染的严重性,以便评估与未处理或假处理对照相比,靶基因表达的下调程度、疾病的严重性与处理植物的健康之间的关联。
本发明人考虑向番茄植物中引入靶向番茄植物病原体抗性反应基因的dsRNA将会通过减弱植物对感染的反应的严重性和预防或减轻植物病原体抗性反应对感染植物的其它有害作用增强其在韧皮部杆菌属(例如Lso)感染之后的健康和果实品质。
其下调证明有效增强健康和果实品质的候选病原体抗性反应基因可用作在其它HLB易感植物物种,例如柑橘中dsRNA沉默研究的有效靶。
实施例I-筛查番茄品种与木虱黄(Lso)疾病和与烟草脆裂病毒(Tobacco Rattle Virus,TRV)介导的病毒诱导的基因沉默的相容性
为了选择适于建模HBL疾病的番茄品种,和通过基因沉默对其的减弱,使用番茄脆裂病毒(TRV)载体和农杆菌转化,通过病毒诱导的基因沉默(VIGS)靶向八氢番茄红素脱饱和酶(PDS)基因的表达。选择显示光漂白和强烈、均一的基因沉默的植物作为经由木虱饲养感染的候选。
品种
选择具有多种不同特征的番茄品种,包括自由授粉-早熟品种(Gold Nugget、Yellow Pear、Early Cascade)、自由授粉-晚熟品种(Manitoba、Prudens Purple、Red Zebra)、杂种-早熟品种(Juliet、Tiny Tim)和杂种-晚熟品种(Big Beef和Celebrity)。
基因沉默
种子在水饱和的发芽土壤混合物中在发芽锥中发芽,掩盖锥以遮挡光并在23-26℃孵育48-72小时,然后转移至16/8光/暗周期。幼苗通常在5周后出现。幼苗然后生长至四真叶阶段(发芽后大约3周)。
包含构建体pTRV1、pTRV2-空载体(无PDS序列)和pTRV2-PDS的农杆菌在LB培养基+抗生素中生长过夜,沉淀并重悬在接种培养基(10 mM MES, 10 mM MgCl, 250 uM乙酰丁香酮)中,测量OD600。pTRV2-PDS包含番茄八氢番茄红素脱饱和酶序列SEQ ID NO: 520。SEQ ID NO: 519为完整的番茄PDS序列。临通过喷雾接种渗入植物之前1:1混合农杆菌培养物。TRV为二分病毒并且,正因如此,使用两种不同的根癌农杆菌用于VIGS —一种携带pTRV1,其编码复制和移动病毒功能,而另一种,pTRV2含有用于VIGS的植物内源序列和衣壳蛋白。用两种菌株的混合物接种番茄幼苗导致基因沉默。
生长至四真叶阶段的幼苗用转化的农杆菌接种,并生长另外的20天,观察光漂白(其表明PDS沉默)的出现。为了监测接种植物中靶mRNA的水平,在从均质化植物材料样品提取的RNA上进行定量PCR分析,接着使用反转录酶合成cDNA拷贝。
经由木虱用Lso感染植物
为了将植物暴露于Lso细菌病原体,用纱袋覆盖检验植物的下部叶,纱袋的一个末端在叶上闭合,木虱从其它开口引入袋中(例如,每一处理15只成年木虱),并将袋拉闭合以防止木虱迁移。检验和匹配的对照植物(无木虱)恢复至正常光周期72小时,以便允许木虱以叶为食。在72小时,移除处理的叶(和相应的对照植物叶)并丢弃袋。
核酸提取
使用十六烷基三甲基溴化铵(CTAB)缓冲液提取DNA。使用TRI®试剂提取和用DNA酶处理以去除DNA单独提取RNA。
结果
三个品种与VIGS沉默高度相容(图1) – Tiny Tim、Microtom和Manitoba。在这些品种中通过感染木虱饲养沉默导致100%漂白,表明在检验植物中100%的沉默率。此外,如通过TRV空载体(EV)的有害作用所判断的,仅TRV的作用最不明显。
所有剩余的检查品种由于下列原因之一认为不相容:1. TRV感染导致植物的严重生长受阻,2. 光漂白以低比率出现,3. 光漂白非常弱并且斑驳。
挑选叶并处理以测定PDS基因沉默是否对光漂白表型是专有的。分析绿色和白色两种叶。图2中的结果表明白色叶表型(PDS白色)与有效沉默完全相关。
在显示令人满意的基因沉默的三个品种中,仅一个与经由感染木虱饲养的Lso感染相容。Tiny Tim感染导致疾病症状快速进展。感染后3周内,感染植物明显区别于未感染植物。图3描绘沿80天时程的疾病病因学。图4和5分别描绘感染和未感染植物之间在植物高度和花数目方面的不同。
木虱饲养番茄植物实际感染Lso细菌病原体的存在情况使用两种核酸提取方案的任一通过PCR确认,其中一种方案提取DNA,另一种提取RNA。使用下列引物测定来自感染和对照植物的样品的Lso 16s核糖体序列(SEQ ID NO: 521)的存在情况:
OA2 (也称为CP_P97) GCGCTTATTTTTTAATAGGAGCGGCA (SEQ ID NO: 522)
O12C (也称为CP_P98) GCCTCGCGACTTCGCAACCCAT (SEQ ID NO: 523)。
PCR的内部控制通过测量番茄肌动蛋白序列的存在情况提供。使用的番茄肌动蛋白引物为:
ACTIN-LIKE7_F Actin2 qRT F (也称为CP_P23): TTGCTGACCGTATGAGCAAG (SEQ ID NO: 525)
ACTINLIKE7_R Actin2 qRT R (也称为CP_P24) GGACAATGGATGGACCAGAC (SEQ ID NO: 526)。番茄肌动蛋白扩增子(SEQ ID NO: 524)为291碱基长。
从经由木虱饲养感染的植物收获的组织在感染6周后显示清楚的疾病征兆。未感染植物(“模拟”处理,其中相似地应用空“纱袋”,然后剪去叶柄)显示无疾病征兆(图6,泳道N1和N2)。Lso 16S的预期大小所对应的PCR产物的存在仅在通过木虱饲养感染的植物中检测到(图6,泳道19、22、23和24)。
当cDNA用作Lso检测的模板时,检测与疾病征兆的严重性一致(图7)。强带(泳道1、2、3、4、5 (微弱)101、105、11、12、14和15)与具有较强疾病征兆的植物相对应。下方的带为番茄肌动蛋白(管家基因)对照。
实施例II:使用病毒诱导的基因沉默(VIGS)基因沉默内源番茄基因
一旦鉴定适合基因沉默和Lso感染二者的番茄品种,并且确认感染细菌病原体,就进行候选基因的实际基因沉默。
使用1 ml无针注射器,将如上所述从种子生长的Tiny Tim番茄植物用含有如上所述的TRV质粒的农杆菌细菌培养物农业-渗透。基因沉默的靶包括在柑橘中在HLB感染中差别表达的那些所对应的基因:
表VII-番茄中的基因沉默靶
连接和转化入大肠杆菌细胞中后,进行菌落PCR和测序以验证每一克隆的性质和完整性(图8)。在图8中,不同大小的扩增序列与靶的预期长度对应。MCS (多克隆位点,相当于空载体EV)用作背景对照。pTRV1 (具有TRV基因组其余部分的质粒)未产生扩增。
农业-渗透后,将植物保持在22℃+/- 1额外的22天,然后收获植物组织。与实施例I中所描述的程序类似地提取RNA并测量每一基因的mRNA水平。
结果:
图9中说明了番茄植物基因的不同程度的沉默。有趣地,沉默率(与空载体对照相比转录物水平降低的倍数)与基础表达水平[在qPCR中使用的归一化基因(肌动蛋白)的Ct (循环阈值—PCR产物变得可检测的循环数目)值差异(△)]成反比(图9)。
沉默番茄植物的小RNA深度测序
定位与基因沉默有关的小RNA以鉴定高丰度小RNA种类,并定位小RNA沿基因的分布。
使用MirVana小RNA试剂盒按照制造商的方案从沉默和对照(EV)植物提取RNA,并制备代表小RNA片段(200碱基或更少)群的文库。将RNA测序,丢弃小于18碱基的读数,通过与植物基因沉默靶比对,或通过不与基因组比对定量和与番茄成熟或茎和环miRNA数据库比较而定量样品中的siRNA。
图10为概述小RNA对每一沉默基因的定位的表,这显示在每一沉默的基因中小RNA专有地定位到沉默基因。跨靶基因序列的读数丰度的分析显示对于每一测定基因在“沉默区域”外未检测到显著的读数丰度。
实施例III-在番茄中Lso感染引起的差别基因表达
分析番茄植物对Lso感染的转录反应,以便鉴定用于通过基因沉默预防或减轻疾病症状的潜在靶。在发展清楚的症状前一周,即当感染和未感染植物之间开始出现明确差异时,产生表达谱,以试图鉴定可能对疾病症状关键的基因。
疾病征兆指数
番茄植物中Lso疾病严重性通过与标准化疾病征兆图(参见图11)盲法比较根据表型视觉评估。观察的参数包括生长受阻、缩叶、叶的僵硬和有弹性、出现紫色/略发紫的颜色、生长和结果。“0”DSI为健康植物,而DSI“4”认为是严重患病的植物。
为了制备表达谱,同时使110棵Tiny Tim番茄植物发芽。15天后,其中55棵经由感染木虱饲养感染,如上文所描述的。其余植物定义为对照,对于其,与感染植物类似地剪断叶柄。在感染之后的每一周,从5棵感染植物和5棵对照植物获取双份叶样品,持续8周。每一植物仅取样一次以防止取样本身(损伤)引起的基因表达改变。根据DSI (疾病征兆指数)监测所有植物的疾病征兆(图11)。
从在取样1周后呈现DSI水平为1的植物获取的样品定义为症状发生之前的样品。定义了三个这样的样品,相应地匹配三棵对照植物。用Trizol (根据上述方案)提取RNA并通过凝胶电泳以及测量230nm/260nm和260nm/280nm吸光度比率(包括-至少2)验证高质量。为了验证Lso感染,使用从这些提取物制备的cDNA作为用于Lso检测PCR方案的模板,如上所描述的。
结果
所有三棵感染植物均对Lso感染阳性,而对照为阴性(结果未示出)。样品使用番茄基因芯片(2.0,Affymetrix)进行微阵列分析。根据上述准则鉴定候选基因,并选择用于作为沉默靶进一步调查。
实施例IV:柑橘树中的实验HLB疾病
为了建立用于在“实验室”控制环境中实验的疾病模型,并且为了使感染同步发生,经由嫁接将HLB引入树中。嫁接的树也可用作研究随时间差别基因表达的模板。
嫁接程序
当前,每一实验由30-50棵感染植物和相等数目的嫁接对照组成。感染树大约6个月龄,并且属于嫁接到‘Swingle’根茎顶部的品种‘sweet orange Valencia’。
感染通过将来自从不同源的两个接穗嫁接到树的茎上进行。嫁接材料(接穗)的源来自已经鉴定为高度症状树的感染树。“嫁接对照”树为自我嫁接的,即接穗从树上取下并再次嫁接到同一树上,以便排除嫁接中涉及的损伤引起的基因差别表达(图12)。
使用改良的“嵌芽接(chip budding graft)”方案,其中通常从一棵植物获取芽并插入另一棵上。由于此处嫁接的目的仅是为了连接脉管组织,并不是为了无性繁殖,待使用的嫩枝切口不需要任何芽。
示例性的嫁接方案:
1. 用解剖刀制造一个45o角穿过根茎(来自健康柑橘属物种的年幼的非木质化茎)四分之一距离的切口。第一个切口上方四厘米,制造第二个向下和向内的切口,直至其遇到第一个切口以创建小凹口并移除树皮块;
2. 用解剖刀以根-顶的方向,以与根茎的块切口相同的大小,切割一块接穗,HLB感染柑橘属物种的茎。该接穗应具有与根茎的茎切口相同的口径;
3. 将感染HLB的茎切段(接穗)插入健康植物茎(根茎)的切口中,再次确保两个茎呈相同的脉管流向(根-顶);
4. 用塑料条尽可能紧地缠绕该区域;
5. 四十天后取下塑料条,如果感染的茎死亡,很可能细菌未能传播至健康组织中,因此丢弃该树;
6 如果嫁接成功(感染茎仍然活着),两个月后,可通过PCR反应检验(从嫁接上方的叶样品)嫁接植物以评估感染的成功;
7. 监测生长效果,症状应从4个月开始出现;
对照组:
为了产生对照植物,使用上述相同程序,但仅用健康植物(未感染接穗)进行。
通过常规PCR检测HLB
为了评估嫁接的柑橘类植物感染黄龙病(HLB)的成功率和为了确认对照植物无这些细菌,可通过常规PCR检测HLB特异性的DNA。
与上文对于番茄所描述的DNA提取方案相似地从柑橘提取DNA。
为了检测柑橘类植物中韧皮部杆菌亚洲种、韧皮部杆菌非洲种和韧皮部杆菌美洲种的存在或不存在情况,使用细菌特异性引物进行双重PCR,例如,其靶向韧皮部杆菌亚洲种和韧皮部杆菌非洲种的β-操纵子核糖体蛋白基因和韧皮部杆菌美洲种的16S rDNA。
用于PCR检测HLB感染的示例性引物:
韧皮部杆菌美洲种:
GB1-正向引物:AAGTCGAGCGAGTACGCAAGTACT (SEQ ID NO: 715)
GB3-反向引物:CCAACTTAATGATGGCAAATATAG (SEQ ID NO: 716)
韧皮部杆菌亚洲种和韧皮部杆菌非洲种:
A2-正向引物:TATAAGGTTGACCTTTCGAGTTT (SEQ ID NO: 717)
J5-反向引物:ACAAAAGCAGAAATAGCACGAACAA (SEQ ID NO: 718)
额外的引物:
CaLas PGK_RT_L3正向 CAATCGTGGGAGGCTCTAAG (SEQ ID NO:719)
CaLas PGK_RT_R3反向 CCATGCCCTGTGCTACTAA (SEQ ID NO:720)
柑橘18S正向 GCTTAGGCCAAGGAAGTTTG (SEQ ID NO:589)
柑橘18S反向 TCTATCCCCATCACGATGAA (SEQ ID NO: 590)
图13显示在琼脂糖凝胶上分离的来自感染和对照树的样品的PCR产物(示出两块凝胶)。较低的带为肌动蛋白扩增子(阳性对照)。较高的带为韧皮部杆菌属16S,样品树感染HLB的证据。“+”为阳性对照(韧皮部杆菌属DNA),“-”为阴性对照(未感染的树)。树73、101、105、112和117很显然为HLB感染阳性的。
实施例V- HLB感染-敏感参数-植物高度
幼龄柑橘树对HLB感染最显著的症状反应之一为垂直生长发育迟缓。该参数的定量测量的建立对评估处理结果的能力很重要。将树修剪为50 cm,然后测量8个月。8个月期间对感染树和未感染对照树二者的小心测量显示高度差异在感染后大约5个月时出现,并在接连的月中始终持续增加:
实施例VI- HLB中的差别基因表达
响应HLB上调(在感染和未感染的树之间差别表达)的基因和仅在敏感植株中响应感染上调而在耐受植株中不(或较小程度)上调的基因为有吸引力的沉默靶。一个实例为胼胝质合酶,其造成韧皮部中胼胝质沉积。因此,选择其调节依附于上述标准的胼胝质合酶基因用于基因表达分析。比较感染和未感染植物群组(二者均来自实验组(例如嫁接实验)和来自从商业柑橘林收集的田野样品)之间目的基因的mRNA丰度。
对于每一测量,取样10个感染和10个未感染样品。根据上述方案提取RNA并相应合成cDNA。使用SYBR® Green (Life Technologies, Carlsbad CA)方案检测PCR产物比较mRNA水平。mRNA水平使用差别Ct (循环阈值)计算(参见上文)计算。18S基因用作归一化转录物。
对于PP-2 (韧皮部-特异性凝集素PP2样蛋白) (图14)、AGPase (ADP-葡萄糖焦磷酸化酶大亚基) (图15)、GPT (葡萄糖-6-磷酸转运体蛋白) (图16)、推定的α-淀粉酶蛋白(图17)、氧化还原酶(图18)和细胞溶质铜/锌超氧化物歧化酶(CDS1) (图19)检测的平均相对mRNA丰度水平表明与未感染的对照树相比感染树中强烈的上调。用于测量的引物集合在下面描绘。
实施例VII-通过信号放大精细分析差别基因表达
与核酸序列的分子扩增(如在PCR中)不同,信号放大提供用于测量沿HLB感染周期的基因表达的灵敏工具,因为其不限于如在PCR中的倍数变化。监测和比较了来自三个不同时间点的八个不同基因的表达动力学。
对于三个时间点的每一,一式三份取样十棵树。五棵树通过PCR (如上所述)验证感染,三棵为经验证无细菌的嫁接对照。(例外为时间点“感染后1个月”,对于该时间点验证感染太早,因为HLB细菌仅可在嫁接8-20月后检测到)。
用于信号放大(Quantigene 2.0®, Affymetrix, Inc, Santa Clara, CA)的样品制备通常如下:向每一样品中加入含有4 μl蛋白酶K的400 μL均质溶液。每一样品在25 Hz均质化,每周期15分钟,总共3个周期,65℃孵育30分钟,离心以沉淀碎片。然后将每一匀浆转移至新管,再沉积以澄清化,等分至杂交板并根据制造商的方案处理。
通过信号放大分析的基因包括GPT (NCBI参考序列:XM_006449009.1, SEQ ID NO: 721)、α淀粉酶(NCBI参考序列:XM_006473264.1, SEQ ID NO: 722)、PP2 (NCBI参考序列:XM_006472910.1, SEQ ID NO: 723)、AGPase NCBI参考序列:XM_006423259.1, SEQ ID NO: 724)、锌转运蛋白 (NCBI参考序列:XM_006448556.1, SEQ ID NO: 725)、MYB转录调控因子(NCBI参考序列:XM_006429779.1, SEQ ID NO: 726)、CDR1 (NCBI参考序列:XM_006437293.1, SEQ ID NO: 727)、Cu/Zn超氧化物歧化酶(GenBank: AJ000045.1, SEQ ID NO: 577)、延伸因子1 HKG (Gene ID: 102578002, SEQ ID NO: 729)和肌动蛋白样HKG (NCBI参考序列: XM_006492793.1, SEQ ID NO: 730)。
结果
基因表达对肌动蛋白归一化。伴随信号放大的基因表达结果表明尽管某些基因,例如超氧化物歧化酶(图23)、PP2 (图22)、锌转运蛋白(图21)和MYB (图20)仅在感染后期(4和6月)差别表达,但其它基因(例如,AGPase,图24)在疾病的早期阶段差别表达,该信息可用于理解对疾病的转录响应和计划用dsRNA治疗的方案。
实施例VIII-HLB感染和未感染柑橘类植物中淀粉积聚动力学分析
淀粉是植物中主要的和最丰富的贮存多糖,并且是以不可溶的颗粒形式在叶绿体中暂时沉积的主要的光合作用产物。其在质体内合成,但其功能取决于具体的质体类型和衍生其的植物组织。淀粉合成可受昼长、夜间温度和一天的时间影响。通常,光照期间合成的所有淀粉在夜间降解,提供整个植物中代谢所需的糖。一般而言,淀粉生物合成从ADP-葡萄糖的形成开始,然后葡萄糖部分转移到受体上,通常短链麦芽寡糖,整个过程(其中许多酶参与)结束时,它们建立最终的淀粉颗粒结构。
与HLB感染有关的主要症状为叶和叶柄中大块淀粉积累。HLB影响的树在光合细胞以及韧皮部元件和叶及叶柄的脉管薄壁组织中具有广泛积聚的淀粉。相反,HLB影响的树的根耗尽淀粉,而对照树的根包含大量淀粉沉积物。然而,响应营养缺乏和病毒感染也观察到淀粉积聚。
通过微阵列分析调查宿主反应表明HLB感染上调淀粉生物合成酶:包括ADP-葡萄糖焦磷酸化酶、淀粉合酶、颗粒结合淀粉合酶和淀粉脱支酶在内的三个关键淀粉生物合成基因,这很可能有助于HLB影响的叶中淀粉积聚。
淀粉含量测定
植物组织淀粉含量的简单测量涉及增溶淀粉、将其定量转化为葡萄糖并测定葡萄糖。植物组织必须最初就迅速冷冻以停滞代谢,然后萃取以去除游离葡萄糖。淀粉通过加热增溶,然后通过加入葡聚糖水解酶消化为葡萄糖。酶法测定葡萄糖。也可使用基于碘的方案,然而,其倾向于不太灵敏和不太准确,而酶法测定更适合具有广范围淀粉含量的组织。
简言之,淀粉测量如下进行:
淀粉萃取:
收获叶组织,急骤冷冻,研磨(例如,在研钵和研杵中),称重并用乙醇萃取。淀粉用乙醇沉淀和洗涤,干燥并复溶于水中。然后通过高压灭菌使淀粉胶化,然后用α-淀粉酶和淀粉葡萄糖苷酶消化。
消化的淀粉样品的葡萄糖含量通过己糖激酶测定[葡萄糖(HK)测定, Sigma, St Louis, MO]测量。葡萄糖在己糖激酶催化的反应中被腺苷三磷酸(ATP)磷酸化。葡萄糖-6-磷酸(G6P)然后在氧化型烟酰胺腺嘌呤二核苷(NAD)存在下在葡萄糖-6-磷酸脱氢酶(G6PDH)催化的反应中氧化为6-磷酸葡萄糖酸。在该氧化期间,等摩尔量的NAD还原为NADH。随之发生的340 nm处吸光度的增加与葡萄糖浓度成正比。
结果:
图25显示在单个时间点,感染6个月后,对于柑橘树,与未感染的对照叶(HLB-)相比,感染叶(HLB+)的淀粉含量(克淀粉/克鲜重)大大增加。
图26显示感染和健康未感染对照树中淀粉积聚的动力学。在8:00 AM, 14:00和20:00时计算来自感染和对照树的叶的相对淀粉含量[归一化至对照叶的淀粉含量-即,8:00 AM时对照叶的淀粉含量 = 1]。尽管对照植物在白天积累淀粉(统计显著正斜率),但感染植物更大的淀粉含量显示在白天无统计显著的变化(图27)。
实施例IX- 通过基因沉默缓和Lso疾病征兆
基因沉默对LSO感染番茄植物中的疾病征兆的作用可,例如,根据叶的淀粉含量的差异定量测量,或使用表型评分半定量测量,相关的分子数据指示基因沉默和LSO的存在情况。
植物
Tiny Tim番茄植物如上所述发芽。在6-9天时具有两片或更多真叶的植物从实验中排除。
VIGS渗入
发芽后6-9天时,VIGS渗入使用1 ml无针注射器在子叶底侧进行,如上文所述。
290棵植物分为下列组:
20棵未处理的对照
50棵空载体(EV)
40棵PDS (光漂白沉默对照)
对于GPT沉默、AGPase沉默、PP2沉默、CalS沉默、LoxD沉默和MYB沉默,每一30棵。
为了最佳的基因沉默将植物保持在22℃。20天后,所有PDS植物(100%)显示实质上的光漂白,提示对于所有的处理组稳健的基因沉默。
恰好两周后,按照下列分组如先前所描述的进行Lso感染:10棵植物NO VIGS感染,10棵植物NO VIGS不感染,30棵植物EV感染,20棵植物EV不感染,20棵植物PDS感染,20棵植物PDS不感染,每一单个的基因沉默处理的20棵植物感染,每一单个的基因沉默处理的10棵植物不感染。
分析和取样:
感染之后,每周观察植物,持续四周。在感染后2和4周时从所有植物取样。
每周以“双盲”程序测量DSI (疾病征兆指数)指数。
RNA从感染后4周的样品提取,转化为cDNA并进行Lso检测方案,因为在该时间之前所有感染植物均可通过PCR检测。94%的植物确认感染。依据表型和分子(基因表达)分析二者排除鉴定为未感染的植物。
结果
在理想情况下,候选HLB相关基因随感染上调。尽管已经观察到VIGS在天真(naïve)植物中一定程度抑制基因表达,但VIGS和细菌感染的组合恢复基础表达水平,以致如果基因上调造成疾病症状,所述疾病症状将会在处理时缓解。
图28-31显示GPT (图28)、LoxD (图29)、Myb (图30)和AGPase (图31)的有效基因沉默(作为Lso感染后两周时的相对表达测量)的实例。所有的实例显示响应感染的基因表达增加(红色条),以及在VIGS基因表达沉默处理的植物中基因表达减少,至少至未感染、未处理的健康植物的水平。
疾病征兆指数
图32显示Lso感染后2和3周时记录的,按照疾病征兆指数的半定量参数表述的,感染和基因沉默对植物表型的作用。(注意低DSI为优秀表型)。
DSI表型参数的观察表明一些候选基因的沉默与表型之间良好的关联。在2周时,当与未处理和空载体处理植物(EV)比较时,几乎所有植物具有显著减小的DSI。感染后3周时,基因沉默与低DSI之间持续关联。
花数目
可提供Lso感染中植物的相对健康的指示的另一个表型参数为观察到的花数目。当与未处理和空载体植物(EV)比较时,基因沉默的植物的花数目显示一些优势(图33),所有基因沉默的感染植物在感染后2和3周时具有比感染的空载体对照更大的花数目。具体而言,AGPase和GPT的沉默在感染后2周时有效提高花数目,MYB和PP2的沉默在感染后3周时有效。在感染后2周时,与未感染植物相比,在感染植物中2个基因群组(以橘色框标出)具有更多的花。
水摄入
水摄入是指示植物相对健康的又一个显著的表型参数。感染植物倾向于比其未感染的副本吸取更少的水(参见图34,“未处理”和“EV”)。通过填充至顶部标记(例如,250 ml)和在后来的任何给定时间测量水体积减少,水摄入在以体积增量(例如,25 ml增量)标记的种植盆中容易地测量。
图34显示感染后5周时候选基因的基因沉默对感染植物中水摄入的作用。未处理或空载体处理植物与基因沉默植物之间的比较表明伴随一些候选靶(例如GPT和MYB)的沉默水摄入显著提高,以及对于一些其它的正趋势。
总之,结果表明一些候选基因靶的基因沉默可明显影响番茄植物响应Lso感染的表型。沉默不同基因的差别效果表明,当有效时,基因沉默可单独地并且在Lso感染的不同阶段影响参数。
尽管本发明已经结合其具体的实施方案进行描述,但显然本领域技术人员将会想到许多替代、修饰和变更。因此,其意在包含落入所附权利要求的精神和广阔范围内的所有这样的替代、修饰和变更。
本说明书中提及的所有出版物、专利和专利申请通过引用到说明书中以其整体结合到本文中,达到如同每一单个出版物、专利或专利申请具体和单独地标明通过引用结合到本文中相同的程度。另外,本申请中任何参考的引用和标识不应解释为承认这样的参考可作为本发明的现有技术。就节标题使用的程度来,其不应解释为必然限制。
- 还没有人留言评论。精彩留言会获得点赞!