用于操控糖蛋白的聚糖含量水平的方法与流程
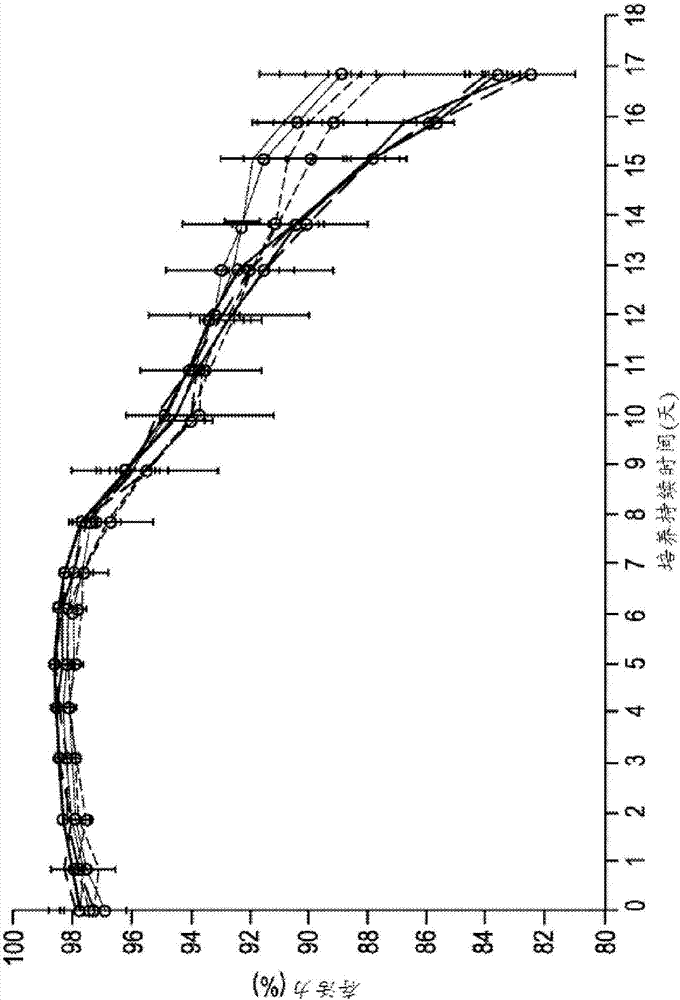
发明背景在由高等真核生物表达的蛋白质上进行包括甲基化、硫酸化、磷酸化、脂质添加和糖基化在内的多种翻译后修饰。糖基化包括糖部分共价附接至特定氨基酸,且为重组蛋白质最常见且最重要的翻译后修饰之一。蛋白质糖基化在包括蛋白质折叠和质量控制、分子运输和分类以及细胞表面受体相互作用在内的多种功能中起作用。已知许多分泌性蛋白质、膜蛋白和靶向泡囊或某些细胞内细胞器的蛋白质都进行糖基化。虽然糖基化可以有许多形式,但n连接的糖基化是最常见的。n连接的糖基化涉及使寡糖加至在蛋白质中的某些识别序列(例如asn-x-ser/thr)中发现的天冬酰胺残基上。n连接的糖蛋白含有由甘露糖、半乳糖、n-乙酰葡糖胺和神经氨酸构成的标准分支结构。重组表达的治疗性抗体的fc结构域的n连接的糖基化是一种关键的翻译后修饰。典型的治疗性抗体具有复杂的糖型,该糖型具有其中三甘露糖基核心在每个分支上由n-乙酰半乳糖胺(glcnac)、半乳糖和n-乙酰神经氨酸(neu5ac)残基封端的岩藻糖基化双触角聚糖。其它糖型可以是非岩藻糖基化型,半乳糖基化型,唾液酸化型,具有末端或等分glcnac,具有高量甘露糖(5-9个残基)等等。糖基化会影响重组蛋白药物的治疗功效。众所周知fc糖基化的变异会影响fc介导的效应功能。例如半乳糖基化和唾液酸化等一些糖型是降低免疫原性所需要的,而例如非岩藻糖基化、二分glcnac残基和高量甘露糖聚糖等其它糖型增强抗体依赖性细胞毒性(adcc)活性。糖基化对决定治疗性抗体的结构和功能来说是重要的。一旦被引入治疗应用后,其决定着结合能力,并常常决定抗体的识别和加工。在半乳糖基化和岩藻糖基化的情况下,其分别决定其影响的补体依赖性细胞毒性(cdc)活性和adcc功能。β-半乳糖基化水平与更“成熟”的糖型有关。添加半乳糖为在分泌前在高尔基体中发生的糖基化的最后阶段之一。唾液酸化需要末端半乳糖,唾液酸化可能是一些蛋白质的糖基化中的最后一步。半乳糖还用作半乳糖结合蛋白的配体,且为与碳水化合物水平有关的多种抗原反应的基础。还展示了半乳糖影响溶液中蛋白质的构形。(furukawa和sato,(1999)biochimicaetbiophysicaacta(bba),1473(1),第54-86页和houde等人,(2010)molecularandcellularproteomics,9(8),第1716-1728页。岩藻糖基化还作为在分泌前蛋白质成熟的一部分在高尔基体中进行。如果蛋白质进行岩藻糖基化,那么其典型地在糖基化通路中的半乳糖基化前发生。然而,岩藻糖基化并非进行半乳糖基化所必需的(hossler等人,(2009)_glycobiology,19(9),第936-949页)。糖基化对治疗性糖蛋白的生物活性、药物动力学、免疫原性、溶解性和体内清除的影响已经使得糖基化的监测和控制成为生物制药的关键参数。因此,操控治疗性蛋白质的聚糖含量水平的方法将是有益的。在制药行业中需要操控和控制重组治疗性糖蛋白的聚糖含量水平,且实现此同时不显著影响细胞生长、存活力和生产率的方法将是适用的。本发明提供了一种通过调节细胞培养基中铜和锰的水平和ph值来操控重组蛋白质上的岩藻糖基化聚糖含量的方法。发明概要本发明提供了一种操控重组蛋白质上的岩藻糖基化聚糖含量的方法,所述方法包括将生物反应器用表达所述重组蛋白质的宿主细胞接种,在无血清的化学成分确定的细胞培养基中培养宿主细胞;其中细胞培养基包括10至100ppb铜和50至1000nm锰,ph7.0;收获由宿主细胞产生的重组蛋白质,其中与在相同细胞培养基中在较低ph下获得的非岩藻糖基化聚糖水平相比,所述重组蛋白质上的非岩藻糖基化聚糖水平有所增加。在一个实施方案中,所述方法进一步包括增加重组蛋白质上的β-半乳糖基化水平。在一个实施方案中,铜浓度为100ppb。在一个实施方案中,锰浓度为1000nm。在一个实施方案中,对岩藻糖基化聚糖含量进行操作以影响重组蛋白质的效应功能。在一个实施方案中,所述方法进一步包括温度变动。在一相关实施方案中,温度变动是从36℃至31℃。在另一相关实施方案中,温度变动是在生长期与生产期之间进行转变时发生。在又一相关实施方案中,温度变动是在生产期期间发生。在一个实施方案中,将表达重组蛋白质的宿主细胞以分批培养、补料分批培养、灌注培养或其组合进行培养。在一相关实施方案中,培养为灌注培养。在另一相关实施方案中,灌注包含连续灌注。在另一相关实施方案中,灌注速率是恒定的。在另一相关实施方案中,灌注以每天小于或等于1.0工作体积的速率进行。在又一相关中,灌注通过交替切向流来实现。在一个实施方案中,生物反应器具有至少500l的容量。在一个实施方案中,生物反应器具有至少500l至2000l的容量。在一个实施方案中,生物反应器具有至少1000l至2000l的容量。在一个实施方案中,对生物反应器用至少0.5×106个细胞/毫升进行接种。在一个实施方案中,无血清的化学成分确定的细胞培养基为灌注细胞培养基。在一个实施方案中,宿主细胞为哺乳动物细胞。在一个实施方案中,宿主细胞为中国仓鼠卵巢(cho)细胞。在一个实施方案中,重组蛋白质为糖蛋白。在一个实施方案中,重组蛋白质选自人抗体、人源化抗体、嵌合抗体、重组融合蛋白或细胞因子。在一个实施方案中,由宿主细胞产生的重组蛋白质被纯化和配制成药学上可接受的制剂。在一个实施方案中,为一种由本发明的方法产生的重组蛋白质。在一相关实施方案中,因此纯化重组蛋白质。在又一相关实施方案中,重组蛋白质被配制成药学上可接受的制剂。图示简单说明图1积分活细胞密度(106个细胞天/毫升)ph6.8550mn2+10cu2+(具有+的灰虚线)ph6.8550mn2+100cu2+(具有+的灰线)ph6.851000mn2+10cu2+(具有空心圆的灰虚线)ph6.8550mn2+100cu2+(具有空心圆的灰线)ph7.050mn2+10cu2+(具有+的黑虚线)ph7.050mn2+100cu2+(具有+的黑线)ph7.01000mn2+10cu2+(具有空心圆的黑虚线)ph7.050mn2+100cu2+(具有空心圆的黑线)ph值似乎是影响细胞生长的唯一因素。锰和铜的浓度似乎对细胞生长没有影响。图2存活力(%)ph6.8550mn2+10cu2+(具有+的灰虚线)ph6.8550mn2+100cu2+(具有+的灰线)ph6.851000mn2+10cu2+(具有空心圆的灰虚线)ph6.8550mn2+100cu2+(具有空心圆的灰线)ph7.050mn2+10cu2+(具有+的黑虚线)ph7.050mn2+100cu2+(具有+的黑线)ph7.01000mn2+10cu2+(具有空心圆的黑虚线)ph7.050mn2+100cu2+(具有空心圆的黑线)到第17天,在ph6.85下的培养物与在ph7.0下的培养物相比最终存活力更高。然而,最终存活力超过80%,无论ph值为多少。在测试范围内的铜和锰浓度对存活力没有影响。fig.3经红细胞压积调整的滴度(g/l)ph6.8550mn2+10cu2+(具有+的灰虚线)ph6.8550mn2+100cu2+(具有+的灰线)ph6.851000mn2+10cu2+(具有空心圆的灰虚线)ph6.8550mn2+100cu2+(具有空心圆的灰线)ph7.050mn2+10cu2+(具有+的黑虚线)ph7.050mn2+100cu2+(具有+的黑线)ph7.01000mn2+10cu2+(具有空心圆的黑虚线)ph7.050mn2+100cu2+(具有空心圆的黑线)ph值似乎对经红细胞压积调整的滴度没有统计学上的影响,同样,铜和锰的浓度对此细胞系和过程没有影响。图4活细胞密度(105个细胞天/毫升)ph6.8550mn10cu(具有+的灰虚线)ph6.8550mn100cu(具有+的灰线)ph6.851000mn10cu(具有空心圆的灰虚线)ph6.8550mn2+100cu2+(具有空心圆的灰线)ph7.050mn2+10cu2+(具有+的黑虚线)ph7.050mn2+100cu2+(具有+的黑线)ph7.01000mn2+10cu2+(具有空心圆的黑虚线)ph7.050mn2+100cu2+(具有空心圆的黑线)在ph6.85下操作的反应器比ph7.0下生长的反应器多生长至每毫升几乎106个细胞的细胞密度。在针对此细胞系和过程的此实验中,铜和锰的浓度对细胞生长没有统计学上显著的影响。ph值为影响细胞生长的唯一因素。图5:使用jmp统计软件产生的β-半乳糖基化(调整的r2=0.95)预测剖析图。该剖析图说明由于操控ph值和锰浓度而引起的β-半乳糖基化改变的方向和量值。剖析图中的项目表示统计模型中在去除统计学上不显著的那些项目后剩余的项目。锰的添加对β-半乳糖基化水平具有显著影响;锰的浓度越大,β-半乳糖基化的百分比越大。ph值也对β-半乳糖基化具有统计学上显著的影响,当ph值增加时,β-半乳糖基化也增加,但未达到添加锰时所观测到的程度。图6:使用jmp统计软件产生的非岩藻糖基化(调整的r2=0.92)预测剖析图。该剖析图说明由于操控ph值、锰和铜浓度而引起的非岩藻糖基化改变的方向和量值。剖析图中的项目表示统计模型中在去除统计学上不显著的那些项目后剩余的项目。铜、锰和ph值都对非岩藻糖基化水平具有统计学上显著的影响。增加铜和锰的水平以及增加ph值都引起非岩藻糖基化增加。图7在基础非岩藻糖基化(4%)、6%非岩藻糖基化和8%非岩藻糖基化下的adcc相对细胞毒性。图8在基础β-半乳糖基化(2.7%)、25%β-半乳糖基化和50%β-半乳糖基化下的以cdc衡量的剂量反应。发明详述改变细胞培养基中的锰的浓度会影响重组抗体的β-半乳糖基化程度。锰在调节半乳糖基转移酶的活性中充当辅因子。半乳糖基转移酶介导的反应采用udp-半乳糖作为糖底物并采用锰作为辅因子。半乳糖基化水平的改变可以由udp-半乳糖可用性的改变或酶活性的改变(例如通过改变锰辅因子的浓度)或两者引起。类似地,岩藻糖基化可以通过改变gdp-岩藻糖的水平,通过干扰岩藻糖基转移酶的活性,或通过改变gdp-岩藻糖转运机制来减轻。然而,尚未报导金属离子在任一这些机制中起直接作用。如本文中所描述,发现增加锰和铜的水平通过显著增加非岩藻糖基化聚糖水平而影响重组蛋白质的岩藻糖基化聚糖含量。另外,发现ph值在决定糖基化模式中也起到重要的作用。已知igg1抗体上n连接的糖基化的类型和程度影响fc介导的效应功能。举例来说,非岩藻糖基化水平通过增加对fcγ受体的结合亲和力而有力地增强抗体依赖性的细胞介导的细胞毒性(adcc),而半乳糖基化水平会影响补体依赖性的细胞毒性(cdc)活性。此使得了解和控制治疗性蛋白质的糖基化的性质和水平是关键的。如本文中所描述,非岩藻糖基化和半乳糖基化的增强对adcc和cdc效应功能具有很大影响。提供了一种方法,所述方法通过操控ph值和细胞培养基中锰(mn2+)和铜(cu2+)的浓度,改善对重组蛋白质上的非岩藻糖基化聚糖水平的控制。在不影响细胞培养性能下增加非岩藻糖基化和β-半乳糖基化聚糖水平。本发明提供了一种操控重组蛋白质上的岩藻糖基化聚糖含量的方法,所述方法包括将生物反应器用表达所述重组蛋白质的宿主细胞接种,在无血清的化学成分确定的细胞培养基中培养宿主细胞;其中细胞培养基包括10至100ppb铜和50至1000nm锰,ph7.0;收获由宿主细胞生产的重组蛋白质,其中与在相同细胞培养基中在较低ph值下获得的非岩藻糖基化聚糖水平相比,重组蛋白质上的非岩藻糖基化聚糖水平有所增加。在一个实施方案中,所述方法进一步包括增加重组蛋白质上的β-半乳糖基化水平。在一个实施方案中,铜的浓度为10ppb。在一个实施方案中,锰浓度为1000nm。在一个实施方案中,对岩藻糖基化聚糖含量进行操控以影响重组蛋白质的效应功能。在一个实施方案中,所述方法进一步包括温度变动。在一相关实施方案中,温度变动是从36℃至31℃。在另一相关实施方案中,温度变动是发生在生长期与生产期之间进行转变时。在又一相关实施方案中,温度变动是发生在生产期期间。在一个实施方案中,将表达重组蛋白质的宿主细胞以分批培养、补料分批培养、灌注培养或其组合进行培养。在一相关实施方案中,培养为灌注培养。在另一相关实施方案中,灌注包含连续灌注。在另一相关实施方案中,灌注速率是恒定的。在另一相关实施方案中,灌注以每天小于或等于1.0工作体积的速率进行。在又一相关实施方案中,灌注通过交替切向流来实现。在一个实施方案中,生物反应器具有至少500l的容量。在一个实施方案中,生物反应器具有至少500l至2000l的容量。在一个实施方案中,生物反应器具有至少1000l至2000l的容量。在一个实施方案中,对生物反应器用至少0.5×106个细胞/毫升进行接种。在一个实施方案中,无血清的化学成分确定的细胞培养基为灌注细胞培养基。在一个实施方案中,宿主细胞为哺乳动物细胞。在一个实施方案中,宿主细胞为中国仓鼠卵巢(cho)细胞。在一个实施方案中,重组蛋白质为糖蛋白。在一个实施方案中,重组蛋白质选自人抗体、人源化抗体、嵌合抗体、重组融合蛋白或细胞因子。在一个实施方案中,由宿主细胞产生的重组蛋白质被纯化和配制成药学上可接受的制剂。在一个实施方案中,为一种由本发明的方法产生的重组蛋白质。在一相关实施方案中,因此纯化重组蛋白质。在又一相关实施方案中,重组蛋白质被配制成药学上可接受的制剂。细胞培养“细胞培养”或“培养”意指细胞在多细胞生物体或组织外的生长和繁殖。本领域中已知适合于哺乳动物细胞的培养条件。参见例如animalcellculture:apracticalapproach,d.rickwood等人,oxforduniversitypress,newyork(1992)。哺乳动物细胞可以悬浮培养或在附接于固体底物的同时培养。如本文所用,术语“细胞培养基”(又称“培养基”、“细胞培养基”、“组织培养基”)是指用于例如动物或哺乳动物细胞等细胞生长且一般提供至少一种或更多种来自以下的组分的任何营养液:能源(通常呈碳水化合物形式,例如葡萄糖);所有必需氨基酸中的一种或多种,和一般二十种碱性氨基酸加半胱氨酸;维生素和/或典型地需要低浓度的其它有机化合物;脂质或游离脂肪酸;以及微量元素,例如无机化合物或典型地需要极低浓度,通常在微摩尔浓度范围内的天然存在的元素。营养液可以任选地补充有其它组分以使细胞的生长最佳,例如激素和其它生长因子,例如胰岛素、铁转递蛋白、表皮生长因子、血清等等;盐,例如钙、镁和磷酸盐,以及缓冲液,例如hepes;核苷和碱基,例如腺苷、胸苷、次黄嘌呤;以及蛋白质和组织水解产物,例如水解动物蛋白(胨或胨混合物,其可以从动物副产品、纯化明胶或植物物质获得);抗生素,例如庆大霉素(gentamycin);细胞保护剂或表面活性剂、聚胺,例如腐胺、亚精胺或精胺(参见例如wipo公布no.wo2008/154014)以及丙酮酸盐(参见例如美国专利no.8053238),取决于待培养的细胞的需要和/或所需细胞培养参数。非离子型表面活性剂也可以添加到细胞培养基中。非离子型表面活性剂的实例包括(但不限于)聚乙烯醇、聚乙二醇以及非离子型嵌段共聚物表面活性剂。还包括烷基聚(氧化乙烯)、聚(氧化乙烯)与聚(氧化丙烯)的共聚物(eo-po嵌段共聚物)、聚(乙烯基吡咯烷酮)、烷基多聚葡糖苷(例如蔗糖单硬脂酸酯、月桂基二葡糖苷或脱水山梨糖醇单月桂酸酯、辛基葡糖苷以及癸基麦芽糖苷)、脂肪族醇(十六烷醇或油醇)或椰子酰胺(椰子酰胺mea、椰子酰胺dea以及椰子酰胺tea)。还包括基于环氧乙烷和环氧丙烷的嵌段共聚物,还称为聚氧化丙烯-聚氧化乙烯嵌段共聚物。这些分子为具有侧接聚氧化乙烯(聚(氧化乙烯))的两条亲水性链的聚氧化丙烯(聚(氧化丙烯))的中心疏水链的非离子型三嵌段共聚物。其中特别关注具有70个聚氧化丙烯单元和各30个单元的聚氧化乙烯链的共聚物。在一优选实施方案中,嵌段共聚物为泊洛沙姆(poloxamer)188(平均分子量为8.4kd的cas#90003-11-6,basfchemical,washington,nj),其以例如f68、p-188、f68和188等各种商标名称出售。此类非离子型表面活性剂可以依多达5g/l或更多的浓度添加,并可以用于在atf灌注条件下维持细胞存活力达更长培养持续时间。本发明提供了一种含有10至100ppb铜和50至1000nm锰的细胞培养基。在一个实施方案中,细胞培养基含有100ppb锰。在另一实施方案中,细胞培养基含有1000nm锰。在另一实施方案中,细胞培养基含有100ppb锰和1000nm锰。可用于本发明的铜盐和锰盐包括(但不限于)五水合硫酸铜和单水合硫酸锰。包括铜和锰在内的细胞培养基组分可以完全磨成粉末培养基制剂;部分碾磨,并且需要时将液体补充剂添加至细胞培养基中;或细胞培养基组分可以呈完全液体形式添加至细胞培养物中。细胞培养基包括典型地用于任何细胞培养方法和/或因用于任何细胞培养方法而众所周知的细胞培养基,所述细胞培养方法为例如(但不限于)细胞的分批培养、延长分批培养、补料分批培养和/或灌注培养或连续培养。“基础”(或分批)细胞培养基是指典型地用于开始细胞培养并足够完全支持细胞培养的细胞培养基。“生长”细胞培养基是指在指数生长时期(“生长期”)期间典型地用于细胞培养并足够完全支持此时期期间的细胞培养的细胞培养基。生长细胞培养基还可以含有赋予对并入宿主细胞系中的选择性标记物的抗性或历经所述标记物而存活的选择试剂。此类选择试剂包括(但不限于)遗传霉素(g4118)、新霉素(neomycin)、潮霉素b(hygromycinb)、嘌呤霉素(puromycin)、零霉素(zeocin)、甲硫氨酸磺基肟、甲氨蝶呤(methotrexate)、无谷氨酰胺的细胞培养基、缺乏甘氨酸、次黄嘌呤和胸苷的细胞培养基或单独胸苷。“生产”细胞培养基是指当指数生长结束且蛋白质生产取而代之时在转变和生产期期间典型地用于细胞培养并在这些时期期间足够完全维持所需细胞密度、存活力和/或产物滴度的细胞培养基。“灌注”细胞培养基是指典型地用于通过灌注或连续培养法而维持的细胞培养物中并足够完全支持此过程期间的细胞培养的细胞培养基。灌注细胞培养基制剂可以被富集或比基础细胞培养基制剂更浓缩,从而适应用于去除用过的培养基的方法。在生长期与生产期期间都可以使用灌注细胞培养基。细胞培养物可以补充含有例如营养素和氨基酸等的在培养物生产期过程期间消耗的组分的浓缩补料培养基。浓缩细胞培养基可以含有维持细胞培养所必需的一些或所有营养素;具体地说,浓缩培养基可以含有被鉴别为或已知在细胞培养生产期过程期间消耗的营养素。浓缩培养基可以基于几乎任何细胞培养基制剂。此类浓缩补料培养基可以含有例如正常量的约2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、12倍、14倍、16倍、20倍、25倍、30倍、40倍、50倍、75倍、100倍、200倍、400倍、600倍、800倍或甚至1000倍的细胞培养基的一些或所有组分。在某些实施方案中,细胞培养基可以无血清和/或无动物来源的产物或成分。在某些实施方案中,细胞培养基可以是化学成分确定的,其中已知所有化学组分。如开业医生所了解,在适于所培养的具体细胞并可以由本领域技术人员在不进行过度实验下确定的培养基中培养动物或哺乳动物细胞。可以利用市售培养基并包括(但不限于)伊斯科夫氏改良的杜尔贝科氏培养基(iscove′smodifieddulbecco′smedium)、rpmi1640和最低基础培养基-α(mem-α)、杜尔贝科氏改良的伊格尔氏培养基(dulbecco′smodificationofeagle′smedium,dmem)、dme/f12、αmem、具有厄尔bss的厄尔基础培养基(basalmediumeaglewithearle′sbss)、具有谷氨酰胺的高葡萄糖dmem、无谷氨酰胺的高葡萄糖dmem、无谷氨酰胺的低葡萄糖dmem、具有谷氨酰胺的dmem:f121:1、gmem(格拉斯哥氏mem(glasgow′smem))、具有谷氨酰胺的gmem、格雷斯完全昆虫培养基(grace′scompleteinsectmedium)、无fbs的格雷斯昆虫培养基、具有谷氨酰胺的ham′sf-10、具有谷氨酰胺的ham′sf-12、具有hepes和谷氨酰胺的imdm、具有hepes且无谷氨酰胺的imdm、ip41昆虫培养基、无谷氨酰胺或酚红的15(leibovitz)(2x)、无谷氨酰胺的15(leibovitz)、麦考伊氏改良培养基(mccoy′s5amodifiedmedium)、培养基199、无谷氨酰胺或酚红的伊格尔氏mem(2x)、具有谷氨酰胺的伊格尔氏mem-厄尔bss、无谷氨酰胺的伊格尔氏mem-厄尔bss、无谷氨酰胺的伊格尔氏mem-汉克斯bss、具有谷氨酰胺的nctc-109、具有谷氨酰胺的黎克特cm培养基(richter′scmmedium)、具有hepes、谷氨酰胺和/或青霉素-链霉素的rpmi1640、具有谷氨酰胺的rpmi1640、无谷氨酰胺的rpmi1640、施奈德昆虫培养基(schneider′sinsectmedium)或本领域技术人员已知的针对具体细胞类型而配制的任何其它培养基。可以根据需要或需要时且如本领域的技术人员使用常规技能所知和实施,向上述示例性培养基添加适当浓度或量的补充组分或成分,包括任选的组分。细胞培养物还可以补充可能难以配制或在细胞培养中快速消耗的具体营养素的独立浓缩补料。此类营养素可以为氨基酸,例如酪氨酸、半胱氨酸和/或胱氨酸(参见例如wipo公布no.2012/145682)。举例来说,浓缩酪氨酸溶液可以独立地补料至在含有酪氨酸的细胞培养基中生长的细胞培养物中。酪氨酸和胱氨酸的浓缩溶液也可以独立地补料至在缺乏酪氨酸、胱氨酸和/或半胱氨酸的细胞培养基中生长的细胞培养物。独立补料可以在生产期前或生产期开始时开始。独立补料可以在与浓缩补料培养基相同或不同的日子伴随着补料分批至细胞培养基。还可以在与灌注培养基相同或不同的日子灌注独立的补料。可以采用方法连续补料哺乳动物细胞培养物,例如未采用反馈控制的细胞培养物(参见wipo公布no.wo2013/040444)。培养基处理可以使用方法或装置处理细胞培养基以在添加至生物反应器和/或细胞培养物前将培养基杀菌或消毒。可以使用高温短时灭菌法(htst)处理细胞培养基(参见例如美国专利no.7,420,183)。还可以使用uv与过滤组合,处理细胞培养基(参见例如wipo公布wo2008/157247;wo2012/115874;wo2013/063298和wo2013/138159)。细胞培养基可以经受纳米过滤(参见例如liu等人(2000)biotechnol.prog.16:425-434)。细胞培养基可以用例如溶剂、清洁剂、补骨脂素或β-丙内酯等使病毒失活的化学物质处理。细胞用于本发明的细胞系(又称为“宿主细胞”)进行基因工程化,以表达商业或科学关注的多肽。细胞系典型地来源于由可以维持培养无限时间的原始培养物产生的谱系。细胞可以含有例如经由转化、转染、感染或注射引入的表达载体(构筑体),例如质粒等等,所述表达载体具有编码在培养方法中表达和生产的蛋白质的编码序列或其部分。此类表达载体含有插入编码序列转录和翻译所必需的元件。本领域技术人员众所周知并实施的方法可以用于构筑含有编码所生产的蛋白质和多肽的序列以及适当转录和翻译控制元件的表达载体。这些方法包括体外重组dna技术、合成技术和体内基因重组。此类技术描述于j.sambrook等人,2012,molecularcloning,alaboratorymanual,第4版coldspringharborpress,plainview,n.y.或任何先前版本;f.m.ausubel等人,2013,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,n.y或任何先前版本;kaufman,r.j.,largescalemammaliancellculture,1990,都以引用的方式并入本文中以达成任何目的。动物细胞、哺乳动物细胞、培养细胞、动物或哺乳动物宿主细胞、宿主细胞、重组细胞、重组宿主细胞等等都是可以根据本发明的方法培养的细胞的术语。此类细胞典型地为获自或来源于哺乳动物的细胞系并能够在放于含有适当营养素和/或其它因子(例如本文中描述的因子)的培养基中进行单层培养或悬浮培养时生长和存活。典型地选择可以表达和分泌蛋白质,或可以在分子层面上进行工程化以表达和分泌大量具体蛋白质、更尤其是相关糖蛋白至培养基中的细胞。应了解,由宿主细胞生产的蛋白质可以是宿主细胞内源性的或与其同源。或者,蛋白质为与宿主细胞异源的,即外来的,举例来说,人类蛋白质由中国仓鼠卵巢(cho)宿主细胞生产和分泌。另外,哺乳动物蛋白质,即原始获自或来源于哺乳动物生物体的蛋白质,通过本发明的方法获得,并可以被细胞分泌至培养基中。本发明的方法可以用于培养多种细胞。在一个实施方案中,培养细胞为真核细胞,例如植物和/或动物细胞。细胞可以为哺乳动物细胞、鱼类细胞、昆虫细胞、两栖动物细胞或鸟类细胞。适于培养生长的多种哺乳动物细胞系可得自美国典型菌种保藏中心(manassas,va.)和其它存放机构以及商业供应商。可以用于本发明的方法中的细胞包括(但不限于)mk2.7细胞、per-c6细胞、中国仓鼠卵巢细胞(cho),例如cho-k1(atccccl-61)、dg44(chasin等人,1986,som.cellmolec.genet.,12:555-556;kolkekar等人,1997,biochemistry,36:10901-10909;以及wo01/92337a2)、二氢叶酸还原酶阴性cho细胞(cho/-dhfr,urlaub和chasin,1980,proc.natl.acad.sci.usa,77:4216)以及dp12.cho细胞(美国专利no.5,721,121);猴肾细胞(cv1,atccccl-70);由sv40转化的猴肾cv1细胞(cos细胞、cos-7,atcccrl-1651);hek293细胞和sp2/0细胞、5l8杂交瘤细胞、多蒂细胞(daudicell)、el4细胞、海拉细胞(helacell)、hl-60细胞、k562细胞、朱卡特细胞(jurkatcell)、thp-1细胞、sp2/0细胞、初级上皮细胞(例如角化细胞、子宫颈上皮细胞、支气管上皮细胞、气管上皮细胞、肾上皮细胞和视网膜上皮细胞)和确立的细胞系和其品系(例如人类胚肾细胞(例如293细胞或被亚克隆用于悬浮培养生长的293细胞,graham等人,1977,j.gen.virol.,36:59);幼仓鼠肾细胞(bhk,atccccl-10);小鼠足细胞(tm4,mather,1980,riol.reprod.,23:243-251);人类子宫颈癌细胞(hela,atccccl-2);犬肾细胞(mdck,atccccl-34);人类肺细胞(w138,atccccl-75);人类肝细胞瘤细胞(hep-g2,hb8065);小鼠乳腺肿瘤细胞(mmt060562,atccccl-51);水牛大鼠肝细胞(brl3a,atcccrl-1442);tri细胞(mather,1982,annalsnyacad.sci.,383:44-68);mcr5细胞;fs4细胞;per-c6视网膜细胞、mdbk(nbl-1)细胞、911细胞、crfk细胞、mdck细胞、bewo细胞、张氏细胞(changcell)、底特律(detroit)562细胞、海拉229细胞、海拉s3细胞、hep-2细胞、kb细胞、ls180细胞、ls174t细胞、nci-h-548细胞、rpmi2650细胞、sw-13细胞、t24细胞、wi-28va13、2ra细胞、wish细胞、bs-c-i细胞、llc-mk2细胞、克隆m-3细胞、1-10细胞、rag细胞、tcmk-1细胞、y-1细胞、llc-pk1细胞、pk(15)细胞、gh1细胞、gh3细胞、l2细胞、llc-rc256细胞、mh1c1细胞、xc细胞、mdok细胞、vsw细胞以及th-i、b1细胞或其衍生物)、来自任何组织或器官的成纤维细胞(包括(但不限于)心脏、肝脏、肾、结肠、肠、食管、胃、神经组织(脑、脊髓)、肺、血管组织(动脉、静脉、毛细管)、淋巴组织(淋巴腺、腺状物、扁桃腺、骨髓和血液)、脾和成纤维细胞和成纤维细胞样细胞系(例如trg-2细胞、imr-33细胞、don细胞、ghk-21细胞、瓜氨酸血症细胞、登普西细胞(dempseycell)、底特律551细胞、底特律510细胞、底特律525细胞、底特律529细胞、底特律532细胞、底特律539细胞、底特律548细胞、底特律573细胞、hel299细胞、imr-90细胞、mrc-5细胞、wi-38细胞、wi-26细胞、micl1细胞、cv-1细胞、cos-1细胞、cos-3细胞、cos-7细胞、非洲绿猴肾细胞(vero-76、atcccrl-1587;vero、atccccl-81);dbs-frhl-2细胞、balb/3t3细胞、f9细胞、sv-t2细胞、m-msv-balb/3t3细胞、k-balb细胞、blo-11细胞、nor-10细胞、c3h/ioti/2细胞、hsdm1c3细胞、kln205细胞、mccoy细胞、小鼠l细胞、品系2071(小鼠l)细胞、l-m品系(小鼠l)细胞、l-mtk(小鼠l)细胞、nctc克隆2472和2555、scc-psa1细胞、swiss/3t3细胞、赤麂(indianmuntac)细胞、sirc细胞、cii细胞以及延森细胞(jensencell)或其衍生物)或本领域技术人员已知的任何其它细胞类型。细胞可以适于贴壁培养、单层培养或悬浮培养、转染和蛋白质(例如抗体)的表达。细胞可以用于分批培养、补料分批培养和灌注或连续培养法。细胞培养类型为了理解,但不限于,熟练开业医生应了解用于蛋白质生产的细胞培养和培养操作可以包括三个通用类型;即,分批或延长分批培养、补料分批培养、灌注培养或其组合。在分批培养中,细胞初始在培养基中培养且不去除、替换或补充此培养基,即,在培养操作期间或在培养操作结束前细胞不“加入”新鲜培养基。在培养操作结束时收获所需产物。在补料分批培养中,通过在操作期间将培养基补充新鲜培养基一次或多次(或连续)来增加培养操作时间,即在培养期期间细胞用新培养基(“补料培养基”)“补料”。补料分批培养可以包括各种补料方案和次数,例如每天、每隔一天、每两天等等,每天超过一次或每天少于一次等等。此外,补料分批培养物可以用补料培养基连续补料。接着可以在培养/生产操作结束时收获所需产物。有时称为连续培养的灌注培养为其中细胞培养物接收新鲜灌注培养基且其中在操作期间从生物反应器去除用过的培养基的培养。新鲜培养基灌注至细胞培养物且去除用过的培养基可以是连续、逐步、间歇的或任何或所有这些的组合。灌注速率可以在每天少于一个工作容积至每天多个工作容积的范围内。术语“灌注流速”为在给定时间内从生物反应器通过(添加和去除)的培养基的量,典型地表示为工作容积的一部分或多个。灌注流速可以在细胞培养操作持续时间内变化。“工作容积”是指用于细胞培养的生物反应器容积的量。在一个实施方案中,灌注流速小于或等于每天一个工作容积。灌注补料培养基可以经配制以最大化灌注营养素浓度,从而使灌注速率减至最少。优选地,细胞保持在培养物中,且所去除的用过的培养基基本上无细胞或具有比培养物显著少的细胞。由细胞培养物表达的重组蛋白质也可以保持在培养物中供随后收获,或与用过的培养基一起去除。灌注可以通过包括离心、沉降或过滤在内的许多方式实现,参见例如voisard等人,(2003),biotechnologyandbioengineering82:751-65。在一个实施方案中,使用过滤法。过滤器包括膜式过滤器、陶瓷过滤器和金属过滤器,且可以为任何形状,包括螺旋缠绕式或管状或呈薄片形式。一个或多个过滤器可以一起或独立地连接至生物反应器、与生物反应器呈流体连通,串联或并联。中空纤维过滤器可以用于哺乳动物细胞灌注培养中以保留细胞和/或重组蛋白质。当包括细胞培养基、细胞(全细胞和溶解细胞)、可溶性的所表达的重组蛋白质、宿主细胞蛋白质、废产物等在内的细胞培养物被引入过滤器时,取决于孔径或分子量截止(mwco),中空纤维材料可以将某些细胞培养物组分保留在腔侧(内部),且基于中空纤维材料的孔径或分子量截止,允许某些组分通过过滤器(透过物)。所保留的物质(保留物)返回至生物反应器。将新鲜的灌注细胞培养基添加至生物反应器,并以预定时间间隔或连续从过滤器取出透过物,以维持所需或恒定生物反应器容积。透过物可以丢弃,存储在贮槽、袋子或手提包中,或直接转移至另一个单元操作,例如过滤、絮凝、离心和/或其它下游的纯化方法等等。用于微过滤器的中空纤维典型地具有在0.1μm至5-10μm范围内的孔径或500kda或更大的分子量截止,且可以用于允许蛋白质通过透过物。超滤中空纤维典型地具有在0.01μm至0.1μm的孔径范围或300kda或更小的分子量截止,且可以用于保留保留物中的所需蛋白质并将其返回至生物反应器。此可以用于例如浓缩重组蛋白质产物以供收获。此类过滤器可以购得,例如xamplerufp-750-e-4ma、xamplerufp-30-e-4ma(gehealthcare,pittsburg,pa)和midikrostcmodulest02-e030-10、t02-050-10、t02-e750-05、t02-m10u-06(spectrumlaboratories,inc,dominguez,ca)。可以通过抽吸系统,将细胞培养物从生物反应器抽出并抽入过滤器中,所述抽吸系统使细胞培养物通过中空纤维的腔侧。细胞抽吸系统的实例包括蠕动泵、双隔膜泵、低剪切泵(泵,zurich,switzerland)和交替切向流系统(atftm,refinetechnology,pinebrook,nj,参见例如美国专利no.6,544,424;furey(2002)gen.eng.news.22(7),62-63)。透过物可以通过利用蠕动泵从过滤器抽出。在一优选实施方案中,灌注通过交替切向流系统的使用来实现。细胞培养方法细胞培养可以在用于重组蛋白质的小规模至大规模生产的条件下使用常用于动物或哺乳动物细胞培养的培养容器和/或培养设备进行。如本领域技术人员所了解,在实验室工作台规模上,典型地使用组织培养皿、t形烧瓶和旋转瓶。对于更大规模的培养,可以使用例如(但不限于)发酵罐型槽培养装置、气升型培养装置、流化床生物反应器、中空纤维生物反应器、滚瓶培养、搅拌槽式生物反应器系统、填充床型培养装置以及一次性使用的袋子,或本领域技术人员已知的任何其它适合的装置。微载体可以用于滚瓶或搅拌槽式生物反应器系统。系统可以呈分批、补料分批或灌注/连续模式操作。另外,培养设备或系统可以装备有其它设备,如使用过滤器、重力、离心力等的细胞分离器。重组蛋白质的生产可以在多期培养方法中进行。在多期方法中,细胞在两个或更多个不同时期中培养。举例来说,细胞可以首先在一个或多个生长期中在最大化细胞增殖和存活力的环境条件下培养,接着转变至在最大化蛋白质生产的条件下的生产期。在哺乳动物细胞生产重组蛋白质的商业方法中,通常存在多个,例如至少约2个、3个、4个、5个、6个、7个、8个、9个、10个或更多个在最终生产培养前发生在不同培养容器中的生长期(n-x至n-1)。生长期和生产期可以在一个或多个转变期前或间隔一个或多个转变期。生产期可以大规模进行。术语细胞培养物的“生长期”是指指数细胞生长时期(即对数期),其中细胞一般快速分裂。细胞维持在生长期达约一天或约两天或约三天或约四天或超过四天的时间。细胞维持在生长期的持续时间将基于例如细胞类型和/或细胞生长速率和/或培养条件变化。术语“转变期”是指生长期与生产期之间的时间段。一般来说,转变期为培养条件可以进行控制以支持从生长期变动至生产期的时间。可以控制的各种细胞培养参数包括(但不限于)以下中的一者或多者:温度、ph值、渗透压度、维生素、氨基酸、糖、胨、铵、盐等等。术语细胞培养的“生产期”是指细胞生长平稳的时间段。对数细胞生长典型地在此时期前或期间结束,且蛋白质生产取而代之。补料分批和灌注细胞培养方法补充细胞培养基或提供新鲜培养基,以便在此阶段实现和维持所需细胞密度、存活力和产物滴度。生产期可以大规模进行。大规模细胞培养可以维持在至少约100升、500升、1000升、2000升、3000升、5000升、7000升、8000升、10,000升、15,000升、20,000升的容积中。在本发明的一实施方案中,生产期在500l、1000l和/或2000l生物反应器中进行。典型地,在最终生产培养前的细胞培养经历两个先前时期,种子和接种体培养。种子培养期(n-x)小规模进行,其中细胞数目迅速扩增。在接种体培养期(n-1),细胞进一步扩增,以产生用于生产生物反应器的接种体,例如至少0.5×106个细胞/毫升的接种体。种子和n-1培养可以通过任何培养法,典型地分批细胞培养来产生。n-1细胞密度≥0.5×105个细胞/毫升是生产生物反应器接种典型的细胞密度。较高的n-1细胞密度可以减少或甚至消除生产生物反应器中为达到所需细胞密度所需的时间。一种实现较高n-1细胞密度的优选方法为使用交替切向流过滤进行灌注培养。借助于灌注法,使用交替切向流过滤生长的n-1细胞培养物可以提供任何所需密度,例如密度>90×106个细胞/毫升或更多的细胞。n-1细胞培养物可以用于产生单剂接种培养物,或可以用作滚动种子储备培养物,维持其接种多个生产生物反应器。接种密度可以对所产生的重组蛋白质的水平具有积极影响。产物水平趋向于随着接种密度增加而增加。滴度的改善不仅与较高接种密度相联,而且可能受放入生产中的细胞的代谢和细胞周期状态影响。在本发明之一个实施方案中,通过用至少0.5×106个细胞/毫升对生物反应器进行接种来建立细胞培养物。术语“细胞密度”是指在给定的培养基容积中细胞的数目。“活细胞密度”是指如通过标准存活力分析法(例如锥虫蓝染料排除法)来测定,给定的培养基容积中活细胞的数目。术语“红细胞压积”(pcv)又称为“红细胞压积百分比”(%pcv),为细胞占据的容积与细胞培养物的总容积的比率,表示为百分比(参见stettler等人,(2006)biotechnolbioeng.dec20:95(6):1228-33)。红细胞压积为细胞密度和细胞直径的函数;红细胞压积的增加可能由细胞密度或细胞直径或两者的增加而引起。红细胞压积为细胞培养物中固体含量的量度。细胞培养控制适于本发明方法的细胞培养条件为典型地用于和已知用于细胞的分批、补料分批或灌注(连续)培养或那些方法的任何组合的条件,其中关注ph值、溶解氧(o2)和二氧化碳(co2)、搅动和湿度以及温度。在重组蛋白质生产期间,需要具有一种控制系统,其中细胞生长所需时间或生长至所需密度,然后细胞的生理状态转换至生长限制或抑制的高生产状态,其中细胞使用能量和底物产生重组蛋白质,有利于细胞密度增加。对于工业规模的细胞培养和生物治疗剂的制造,非常需要在生产期期间能够限制或抑制细胞生长并能够维持细胞处于生长限制或抑制的状态。此类方法包括例如单独或组合的温度变动、使用蛋白质生产的化学诱导物、营养限制或饥饿和细胞周期抑制剂。用于限制或抑制生长的一种此类机制是在细胞培养期间变动温度。温度变动可以发生在细胞培养期间的任何时间。生长期可以发生在比生产期更高的温度下。细胞培养可以在约35℃至约38℃的第一温度设定点下操作,然后温度变动至约29℃至约37℃,任选地约30℃至约36℃或约30℃至约34℃的第二温度设定点。在一个实施方案中,温度变动可以发生在生长期与生产期之间的转变期间。在另一实施方案中,温度变动可以发生在生产期期间。转换温度设定点可以人工进行,或可以通过利用生物反应器控制系统自动进行。温度设定点可以在预定时间或响应于一个或多个细胞培养参数,例如细胞密度、滴度或一种或多种培养基组分的浓度来转换。一种此类方法使用整合至生物反应器控制系统中的在线生物质监测工具,在达到所需细胞密度时触发温度设定点改变。举例来说,可以使用基于电容的生物质探针在线估计细胞密度,且来自在线测量的数据可以用于触发生物反应器温度的变动。此类基于电容的探针包括fogale电容传感器(dn12-200)(nimes,france)。可以独立于温度变动,或与温度变动同时、在温度变动前或在温度变动后,添加蛋白质生产的化学诱导物,例如咖啡因、丁酸盐和/或六亚甲基双乙酰胺(hmba)。如果在温度变动后添加诱导物,那么诱导物可以在温度变动后一小时至五天,任选地在温度变动后一天至两天添加。接着细胞培养可以维持数天或甚至数周,同时细胞生产所需蛋白质。维持细胞处于所需生理状态下的另一种方法是通过将细胞培养物暴露于低l-天冬酰胺条件来诱发细胞生长抑制(参见例如wipo公布no.wo2013/006479)。可以通过含有有限浓度的l-天冬酰胺的培养基并维持细胞培养物中低浓度的l-天冬酰胺来实现和维持细胞生长抑制。维持l-天冬酰胺的浓度在5mm或更小下可以用于维持细胞处于生长抑制状态。细胞周期抑制剂也可用于诱发细胞生长抑制,细胞周期抑制剂是已知或怀疑调控细胞周期进展和转录、dna修复、分化、衰老和细胞凋亡的相关过程的化合物。与循环机制相互作用的细胞周期抑制剂,例如细胞周期蛋白依赖性激酶(cdk),如与来自其它通路(例如akt、mtor和直接或间接影响细胞周期的其它通路)的蛋白质相互作用的那些分子般适用。收获和纯化所表达的重组蛋白质可以分泌至培养基中,从培养基中可以回收和/或收集重组蛋白质。接着重组蛋白质可以进行一个或多个加工步骤,包括收获、纯化、内毒素和/或病毒失活/过滤和/或超滤/渗滤。可以在收获的透过物中捕捉所表达的重组蛋白质。可以使用本领域中已知和/或可以从商业供应商获得的方法和市售产品,从收获的透过物纯化或部分纯化蛋白质。此类方法包括絮凝;离心;沉淀;过滤法,例如深度过滤;色谱法,包括亲和色谱法、空间排阻色谱法、离子交换色谱法、混合模式阴离子交换色谱法、疏水相互作用色谱法和羟磷灰石色谱法,可用方法之一。纯化的蛋白质接着可以加以“配制”,意指缓冲液更换、杀菌、散装包装和/或加上包装,以用于最终用户。本领域中已知适用于药物组合物的制剂并包括以下中描述的制剂:remington′spharmaceuticalsciences,第18版1995,mackpublishingcompany,easton,pa。过程分析技术过程分析技术和方法可以用来监测和评估在细胞培养和纯化过程期间所取的样品,以定量和/或定性地监测重组蛋白质和生产过程的特征。此实时或在线信息可以用于监测和/或控制产品和生产参数,例如滴度、细胞密度;产品质量属性,例如翻译后修饰;产品或过程可变性,例如杂质等等,以根据需要及时作出决定和修改方法。可以监测上游细胞培养过程或下游纯化过程的每个步骤,以提供有关具体产品质量属性(pqa)的量的信息并在预设目标和范围下控制此pqa。可以间歇性,在所需频率下,或连续地取样。可以实时或接近实时分析样品,或存储以供随后分析。此信息可以用于在上游和下游过程期间作出改变。可以使用质谱分析法、液相色谱法与uv和/或质谱分析检测和毛细管电泳等,检测产品质量属性。这些方法适合于如所指定的产品质量属性的水平所确定,在与例如补料、温度、过程持续时间等人工或自动过程调整下进行连续监测。可以使用呈尺寸排除模式操作且与esi-ms联合的聚羟乙基天冬酰胺柱,检测例如氨基酸加工和糖基化等翻译后修饰的存在的完整质量分析(brady等人,(2008)jamsocmassspectro,19:502-509)。通过使用激光散射检测器和uv吸光度,监测每种洗脱份的标准化ls/uv比来实时监测来自离子交换色谱法的洗脱物,参见美国专利公布no.us2013-0303732。多属性方法使用单一液相色谱法/质谱分析法(lc/ms),使用各种数据库和搜索平台搜索和表征串联ms数据,例如sequest(thescrippsresearchinstitute,lajolla,ca)、x!tandem(theglobalproteomemachineorganization)或mascot(matrixscience,boston,ma)。样品可以在高ph值下变性,或为维持二硫化物同种型并保护琥珀酰亚胺变异体,在低ph值下变性。接着将样品还原并烷基化,接着用胰蛋白酶消化。接着将样品注射至ms(例如qexactivetmhybridquadrupole-orbitrap质谱仪,thermofischerscientific,waltham,ma)并使用pinpoint软件(thermofischerscientific)进行分析。可以鉴别、定量和监测的属性包括异构化、脱氨基、二硫化物还原、宿主细胞蛋白质污染、突变、错误并入、羟基赖氨酸、硫醚、未糖基化重链、c端酰胺化、剩余蛋白a,表征聚糖并提供分子身份。每种监测属性的质量准确度可以设定为少于预测质量的5ppm。通过ms2片段化和正交表征法(例如对于糖基化为hilic-ms)来证实肽/属性的鉴别。当与理论同位素分布相比时,实验同位素分布必须具有超过0.95的点积分数。为每种属性设定保留时间窗,且考虑每种属性的所有可检测电荷状态进行定量。界定将检测属性改变的标准。举例来说,可以通过确定脱氨基值(脱去氨基的肽除以脱去氨基的肽与未修饰的亲本肽的总和乘以100)来监测脱氨基。通过将每种特定聚糖相对于所有可检测聚糖的总和进行比较来监测。蛋白质如本文所用,“肽”、“多肽”和“蛋白质”通篇可互换使用,且是指包含两个或更多个由肽键彼此接合的氨基酸残基的分子。肽、多肽和蛋白质也包括修饰,包括(但不限于)产生糖蛋白的糖基化、脂质附接、硫酸化、谷氨酸残基的γ-羧化、羟基化和adp-核糖基化。如本文所用,术语“糖蛋白”是指具有至少一个包括甘露糖残基的寡糖侧链的肽和蛋白质。糖蛋白可以与所用的宿主细胞同源,或可以与宿主细胞异源,即外来的,举例来说,由中国仓鼠卵巢(cho)宿主细胞产生的人类糖蛋白。此类糖蛋白一般称为“重组糖蛋白”。在某些实施方案中,由宿主细胞表达的糖蛋白直接分泌至培养基中。在科学或商业上会关注蛋白质,包括基于蛋白质的药物。蛋白质尤其包括抗体和融合蛋白。肽、多肽和蛋白质可以通过重组动物细胞系,使用细胞培养方法产生,并可以称为“重组肽”、“重组多肽”、“重组蛋白质”、“重组糖蛋白”。所表达的重组蛋白质可以在细胞内生产或分泌至培养基中,从培养基中可以回收和/或收集重组蛋白质。可以有利由本发明的方法产生的哺乳动物蛋白质的非限制性实例包括氨基酸序列与以下蛋白质之一的全部或一部分一致或基本上类似的蛋白质:肿瘤坏死因子(tnf)、flt3配体(wo94/28391)、促红细胞生成素、促血小板生成素、降钙素、il-2、促血管生成素-2(maisonpierre等人(1997),science277(5322):55-60)、nf-κb受体活化剂的配体(rankl,wo01/36637)、肿瘤坏死因子(tnf)相关的细胞凋亡诱发配体(trail,wo97/01633)、胸腺基质衍生的淋巴细胞生成素、粒细胞群落刺激因子、粒细胞-巨噬细胞群落刺激因子(gm-csf,澳大利亚专利no.588819)、肥大细胞生长因子、干细胞生长因子(美国专利no.6,204,363)、表皮生长因子、角化细胞生长因子、巨有核细胞生长与发育因子、rantes、人类纤维蛋白酶原样2蛋白质(fgl2;ncbi寄存编号nm_00682;rüegg和pytela(1995),gene160:257-62)生长激素、胰岛素、促胰岛素、胰岛素样生长因子、甲状旁腺激素、干扰素(包括α-干扰素、γ-干扰素和复合干扰素)(美国专利no.4,695,623和4,897471)、神经生长因子、脑衍生神经营养因子、突触结合蛋白样蛋白质(slp1-5)、神经营养蛋白-3、胰高血糖素、白细胞介素、群落刺激因子、淋巴细胞毒素-β、白血病抑制因子和制癌蛋白-m。可以根据本发明的方法产生的蛋白质的描述可见于例如humancytokines:handbookforbasicandclinicalresearch,所有卷(aggarwal和gutterman编辑,blackwellsciences,cambridge,ma,1998);growthfactors:apracticalapproach(mckay和leigh编辑,oxforduniversitypressinc.,newyork,1993);和thecytokinehandbook,第1卷和第2卷(thompson和lotze编辑,academicpress,sandiego,ca,2003)。另外,本发明的方法可用于产生包含任何上述蛋白质的受体的氨基酸序列全部或一部分的蛋白质、此类受体或任何上述蛋白质的拮抗剂和/或基本上类似于此类受体或拮抗剂的蛋白质。这些受体和拮抗剂包括:肿瘤坏死因子受体的两种形式(tnfr,称为p55和p75,美国专利no.5,395,760和美国专利no.5,610,279)、白细胞介素-1(il-1)受体(i型和ii型;欧洲专利no.0460846、美国专利no.4,968,607和美国专利no.5,767,064)、il-1受体拮抗剂(美国专利no.6,337,072)、il-1拮抗剂或抑制剂(美国专利no.5,981,713、6,096,728和5,075,222)、il-2受体、il-4受体(欧洲专利no.0367566和美国专利no.5,856,296)、il-15受体、il-17受体、il-18受体、fc受体、粒细胞-巨噬细胞群落刺激因子受体、粒细胞群落刺激因子、制癌蛋白-m和白血病抑制因子的受体、nf-κb受体活化剂(rank,wo01/36637和美国专利no.6,271,349)、骨保护素(美国专利no.6,015,938)、trail受体(包括trail受体1、2、3和4)以及包含死亡结构域的受体,例如fas或细胞凋亡诱发受体(air)。可以使用本发明产生的其它蛋白质包括包含分化抗原的氨基酸序列全部或一部分的蛋白质(称为cd蛋白质)或其配体或基本上类似于这些中任一者的蛋白质。此类抗原在leukocytetypingvi(proceedingsofthevithinternationalworkshopandconference,kishimoto,kikutani等人编辑,kobe,japan,1996)中公开。类似cd蛋白质在随后研讨会中公开。此类抗原的实例包括cd22、cd27、cd30、cd39、cd40和其配体(cd27配体、cd30配体等等)。若干cd抗原为tnf受体家族的成员,tnf受体家族还包括41bb和ox40。配体与41bb配体和ox40配体也一样常为tnf家族的成员。还可以使用本发明产生酶活性蛋白质或其配体。实例包括包含以下蛋白质之一的全部或一部分的蛋白质或其配体或基本上类似于这些之一的蛋白质:解聚素和金属蛋白酶结构域家族成员,包括tnf-α转变酶、各种激酶、葡糖脑苷脂酶、过氧化物歧化酶、组织纤溶酶原活化剂、因子viii、因子ix、阿朴脂蛋白e、阿朴脂蛋白a-i、球蛋白、il-2拮抗剂、α-1抗胰蛋白酶、任何上述酶的配体和许多其它酶和其配体。除非另作说明,否则术语“抗体”包括提及任何同种型或子类的糖基化与非糖基化免疫球蛋白,或与完整抗体竞争特异性结合的其抗原结合区,包括人、人源化、嵌合、多特异性、单克隆、多克隆和寡聚体或其抗原结合片段。还包括具有如下抗原结合片段或区域的蛋白:fab、fab’、f(ab’)2、fv、双功能抗体、fd、dab、最大功能抗体(maxibody)、单链抗体分子、互补决定区(cdr)片段、scfv、双功能抗体、三功能抗体、四功能抗体和含有足够赋予标靶多肽特异性抗原结合的免疫球蛋白的至少一部分的多肽。术语“抗体”包括(但不限于)通过重组方式制备、表达、产生或分离的抗体,例如从经转染以表达抗体的宿主细胞分离的抗体。抗体的实例包括(但不限于)识别包括(但不限于)上述蛋白质的任一蛋白质或蛋白质组合和/或以下抗原的抗体:cd2、cd3、cd4、cd8、cd11a、cd14、cd18、cd19、cd20、cd22、cd23、cd25、cd27l、cd32、cd33、cd40、cd44、cd52、cd80(b7.1)、cd86(b7.2)、cd147、il-1α、il-1β、il-2、il-3、il-7、il-4、il-5、il-8、il-10、il-12、il-12p35亚单位、il-13、il-21、il-23、il-23p19亚单位、il-12/il-23共享的p40亚单位、il-2受体、il-4受体、il-6受体、il-13受体、il-17受体、il-18受体亚单位、fgl2、pdgf-β和其类似物(参见美国专利no.5,272,064和5,149,792)、b7rp-1、b7rp-2、vegf、tgf、tgf-β2、tgf-β1、c-fms、egf受体(参见美国专利no.6,235,883)、cgrp受体、vegf受体、肝细胞生长因子、前蛋白转化酶枯草杆菌蛋白酶/科星第9型(proproteinconvertasesubtilisin/kexintype9,pcsk9)、fgf21、骨保护素配体、干扰素γ、egfrviii、b淋巴细胞刺激物(blys,又称为baff、thank、tall-1和ztnf4;参见do和chen-kiang(2002),cytokinegrowthfactorrev.13(1):19-25)、st2、c5补体、ige、肿瘤抗原ca125、肿瘤抗原muc1、pem抗原、lcg(其为与肺癌相关表达的基因产物)、her-2、her-3、肿瘤相关的糖蛋白tag-72、sk-1抗原、以高水平存在于结肠癌和/或胰腺癌患者的血清中的肿瘤相关表位、在乳房、结肠、鳞状上皮细胞、前列腺、胰腺、肺和/或肾癌细胞和/或黑素瘤、神经胶质瘤或神经母细胞瘤细胞上表达的癌症相关表位或蛋白质、肿瘤的坏死中心、整合素α4β7、整合素vla-4、b2整合素、tslp、ifnγ、trail受体1、2、3和4、rank、rank配体、tnf-α、粘着分子vap-1、上皮细胞粘着分子(epcam)、细胞间粘着分子-3(icam-3)、促血管生成素1(ang1)、促血管生成素2(ang2)、白细胞整合素粘附素、血小板糖蛋白gpiib/iiia、心肌肌球蛋白重链、甲状旁腺激素、rnapc2(其为因子viia-组织因子的抑制剂)、mhci、癌胚抗原(cea)、α-甲胎蛋白(afp)、肿瘤坏死因子(tnf)、ctla-4(其为细胞毒性t淋巴细胞相关抗原)、程序性细胞死亡1(pd-1)、程序性细胞死亡配体1(pdl-1)、程序性细胞死亡配体2(pdl-2)、淋巴细胞活化基因-3(lag-3)、t细胞免疫球蛋白结构域和粘蛋白结构域3(tim3)、fc-γ-1受体、hla-dr10β、hla-dr抗原、硬骨素、l-选择蛋白、呼吸道合胞病毒、人类免疫缺陷性病毒(hiv)、乙型肝炎病毒(hbv)、变异链球菌(streptococcusmutans)和金黄色葡萄球菌(staphlycoccusaureus)。可以使用本发明方法产生的已知抗体的特定实例包括(但不限于)阿达木单抗(adalimumab)、阿利若单抗(alirocumab)、贝伐单抗(bevacizumab)、英利昔单抗(infliximab)、阿昔单抗(abciximab)、阿伦单抗(alemtuzumab)、巴匹珠单抗(bapineuzumab)、巴利昔单抗(basiliximab)、贝利木单抗(belimumab)、布雷奴单抗(briakinumab)、布若达单抗(brodalumab)、卡那奴单抗(canakinumab)、赛妥珠单抗(certolizumabpegol)、西妥昔单抗(cetuximab)、克土木单抗(conatumumab)、地诺单抗(denosumab)、杜皮利单抗(dupililumab)、依库丽单抗(eculizumab)、吉妥单抗(gemtuzumab)、古赛单抗(guselkumab)、奥唑米星(ozogamicin)、戈利木单抗(golimumab)、依吐单抗(ibritumomab)、依珠单抗(ixekizumab)、伊匹单抗(ipilimumab)、替克西坦(tiuxetan)、拉贝珠单抗(labetuzumab)、乐珠单抗(lebrikizumab)、马帕木单抗(mapatumumab)、马瑞木单抗(mavrilimumab)、马妥珠单抗(matuzumab)、美泊利单抗(mepolizumab)、莫维珠单抗(motavizumab)、莫罗单抗-cd3(muromonab-cd3)、尼鲁单抗(nivolumab)、那他珠单抗(natalizumab)、尼妥珠单抗(nimotuzumab)、奥法木单抗(ofatumumab)、奥玛珠单抗(omalizumab)、奥戈伏单抗(oregovomab)、帕利珠单抗(palivizumab)、帕尼单抗(panitumumab)、派吐单抗(pemtumomab)、帕妥株单抗(pertuzumab)、派姆单抗(pembrolizumab)、兰尼单抗(ranibizumab)、利妥昔单抗(rituximab)、洛索珠单抗(romosozumab)、罗维珠单抗(rovelizumab)、瑞吐珠单抗(rilotumumab)、替珠单抗(tildrakizumab)、托珠单抗(tocilizumab)、托西莫单抗(tositumomab)、曲努单抗(tralokinumab)、曲妥珠单抗(trastuzumab)、曲米木单抗(tremelimumab)、优特克单抗(ustekinumab)、维里单抗(vedolizomab)、扎鲁木单抗(zalutumumab)和扎木单抗(zanolimumab)。本发明还可以用于产生包含例如任何上述蛋白质的重组融合蛋白。举例来说,可以使用本发明的方法产生包含上述蛋白质之一加多聚化结构域(例如亮氨酸拉链、卷曲螺旋、免疫球蛋白的fc部分或基本上类似的蛋白质)的重组融合蛋白。参见例如wo94/10308;lovejoy等人(1993),science259:1288-1293;harbury等人(1993),science262:1401-05;harbury等人(1994),nature371:80-83;等人(1999),structure7:255-64。此类重组融合蛋白中特别包括的是其中受体的一部分与抗体的fc部分融合的蛋白质,例如依那西普(etanercept)(ap75tnfr:fc)和贝拉西普(belatacept)(ctla4:fc)。嵌合蛋白和多肽以及任何上述蛋白质和多肽的片段或部分或突变体、变异体或类似物也包括在可以通过本发明的方法产生的适合蛋白质、多肽和肽中。此包括曲巴那尼(trebananib),一种促血管生成素(ang)1和2中和肽体。还包括选择性发挥作用且引导人类免疫系统针对肿瘤细胞的双特异性t细胞接合器(bite)。此类bite中特别包括靶向cd19的抗体,例如博纳吐单抗(blinatumomab)。其它分子包括阿柏西普(aflibercept)。虽然本申请中所用的术语是本领域内的标准术语,但本文中提供了某些术语的定义以保证权利要求书含义的清楚和明确。单位、前缀以及符号可以呈其si公认形式表示。本文中叙述的数值范围包括界定范围的数目,且包括并支持所界定范围内的每个整数。除非另有指示,否则本文中描述的方法和技术一般根据本领域中众所周知且如本说明书通篇所引用和论述的各种通用和更特定参考文献中所述的常规方法进行。参见例如sambrook等人molecularcloning:alaboratorymanual,第3版,coldspringharborlaboratorypress,coldspringharbor,n.y.(2001)和ausubel等人,currentprotocolsinmolecularbiology,greenepublishingassociates(1992),以及harlow和laneantibodies:alaboratorymanualcoldspringharborlaboratorypress,coldspringharbor,n.y.(1990)。本申请中引用的所有文献或文献的部分,包括(但不限于)专利、专利申请、文章、书和论文,都以引用的方式明确并入本文中。在本发明的一实施方案中描述的内容可以与本发明的其它实施方案组合。本发明在范围上不受本文中描述的特定实施方案限制,所述实施方案仅仅意图说明本发明的个别方面,且功能等效的方法和组分在本发明的范围内。实际上,除本文中所示和所述外,本领域技术人员根据上述描述和附图将变得显而易见本发明的各种修改。此类修改意图在随附权利要求书范围内。实施例细胞培养在第0天,将表达重组抗tnfα抗体的cho细胞于1500ml工作容积的无血清的化学成分确定的基础培养基中以9.0×106个活细胞/毫升接种至3l生物反应器(applikon,fostercity,ca)。将培养物维持在36℃下,do在30mmhg下,在400rpm下搅动。细胞培养以分批模式开始,且在第3天,使用装备有30kdanfwcgertp中空纤维滤筒(gehealthcare,pittsburg,pa)的atf-2tm交替切向流过滤系统(refinetechnologies,hanover,nj)开始灌注。培养基是无血清的化学成分确定的灌注培养基,其包括如表1中所述的单水合硫酸锰和五水合硫酸铜以及ph值。实验一式两份进行。表1phmn2+(nm)cu2+(ppb)6.8550106.85501006.851000106.8510001007.050107.0501007.01000107.01000100在细胞培养操作期间,灌注速率从0.3工作容积/天逐渐增加至1.0工作容积/天。当天,温度变动至31℃,且在第17天收获培养物。葡萄糖维持在4-8g/l之间。每天取样以评定培养物。使用rapidlab1260血液气体分析器(siemens,malvern,pa)测量ph值和co2(pco2)和o2(po2)的分压;使用novaflex(novabiomedical,waltham,ma)测量葡萄糖和乳酸盐的浓度。通过型号2020渗透压力计(advancedinstruments,norwood,ma)测定渗透压度。使用applikonadi1010控制器控制温度、ph值、溶解氧和搅动。在第7天、第10天、第13天、第15天和第17天,从生物反应器去除50ml培养物样品,用于分析产物质量。将样品在室温下在3000rpm下离心30分钟(beckmancoulter,indianapolis,in)并通过0.2μm筒状顶过滤器(corning,fisherscientific,pittsburgh,pa)过滤上层清液。接着将无细胞的上层清液冷冻在-20℃下,直至解冻和蛋白a纯化,接着分析产物质量。在17天生产结束后,从生物反应器去除剩余培养物。通过在4℃下在3000rpm下离心30分钟来分离细胞与上层清液,且使用0.2μm聚醚砜(pes)筒式过滤器将条件培养基无菌过滤至nalgene瓶(fisherscientific,pittsburgh,pa)中,接着通过蛋白质进行纯化,并如上所述,测试中和洗脱物。活细胞密度和细胞存活力通过vi-cell(beckmancoulter,brea,ca)测定。积分活细胞密度(ivcd)被计算为在整个生产时间长度期间累积活细胞密度。使用蛋白a(lifetechnologies,grandisland,ny)测量滴度。在上层清液中测定滴度,然后针对细胞所占据的容积进行调整,以便其代表实际上存在于给定容积的细胞培养流体中的细胞。因为红细胞压积被表示为总容积的百分比,所以经pcv调整的滴度始终低于上层清液中的滴度。通过亲水性相互作用液相色谱法(hilic)分析不同的n-聚糖物质并呈现为组合聚糖的总峰面积的百分比。通过蛋白a收集和纯化含有抗体的样品。纯化的样品用pngase-f处理并在37℃下培育2小时以释放n连接的聚糖。在80℃下将酶促释放的聚糖用2-氨基苯甲酸(2-aa)标记75分钟。接着用glycocleans滤筒去除过量2-aa标记。将样品蒸发过夜并用水复原所得的干燥小球,以用于随后使用uplc(waterscorporation,milford,ma)进行hilic分析。在高有机条件下将聚糖注射并结合于柱并用增加梯度的水性甲酸铵缓冲液洗脱。使用荧光检测来监测聚糖洗脱并计算主要和次要聚糖物质的相对百分比。β-半乳糖基化水平包括a1g1f、a2g1f、a2g2f和类似的非岩藻糖基化形式。非岩藻糖基化形式包括a1go、a2go、a1g1、a2g1和a2g2。还测定甘露糖5和甘露糖7。此实验被设计成能界定每个主要因子(铜、锰和ph值)的影响和双向相互作用。实验是界定主要影响和双向相互作用的三因子双层(23)全因子设计,且不包括中心点。该研究意图使用1.25的信噪比,提供大约0.8的功率值。使用jmp统计软件和预测剖析图(sasinstitute,inc.,cary,nc)产生剖析特征。结果灌注培养基中铜和锰的浓度不影响细胞培养性能或生产率。虽然ph值不影响细胞生长或生产率,但ph6.85使最终存活力减少大约10%(p<0.001),图1-4。高甘露糖聚糖ph值是显著影响高甘露糖水平的唯一因子。当ph值增加时,高甘露糖的水平也增加,参见表2。β-半乳糖基化锰的添加增强β-半乳糖基化。锰的浓度越大,β-半乳糖基化的百分比越大。ph值也对β-半乳糖基化具有统计学上显著的影响。ph值增加,β-半乳糖基化也增加,但增加程度低于添加锰时的增加,参见图5。铜对β-半乳糖基化的影响不显著。非岩藻糖基化铜、锰和ph值都对非岩藻糖基化水平具有统计学上显著的影响。铜和锰的浓度越大,且ph值越高,非岩藻糖基化水平越高,参见图6。所有关键聚糖都受ph值显著影响。β-半乳糖基化受锰浓度的增加显著影响。如通过统计模型测定,锰水平增加至其最高水平会引起β-半乳糖基化增加达超过基线(在相同ph值下铜和锰的最低水平)大约14%。非岩藻糖基化显著受铜与锰浓度的增加影响。增加铜和锰的水平增强非岩藻糖基化水平超过基线值大约1.3%。虽然高浓度铜和锰的添加未影响细胞培养性能,但其对产物质量有影响。参见表2和3。表2.来自第17天收获的结果表3.作为模型的一部分的项目的模型拟合(r2)和统计显著性(p值)的概述。名称“较高”是指其中ph值或其它因子较高,然后不同类型糖基化上升的情况。糖基化会影响重组蛋白药物的治疗功效。众所周知fc糖基化的变异会影响fc介导的效应功能。非岩藻糖基化和高甘露糖聚糖会增强抗体依赖性的细胞毒性(adcc)活性。为用于adcc分析法中,使用补料分批培养分开产生非岩藻糖基化和岩藻糖基化的重组抗tnfα抗体物质。在添加的岩藻糖基转移酶抑制剂的帮助下,制造非岩藻糖基化抗体。所得重组抗体大约85%非岩藻糖基化。非岩藻糖基化抗体物质接着与完全岩藻糖基化的抗体物质混合,以产生最终抗体混合物中特定水平的非岩藻糖基化。接着使用抗体物质测量在各种水平非岩藻糖基化下的adcc活性水平,以确定adcc反应的敏感性。在基于细胞的分析法中,使用稳定表达横跨膜tnfα的tnfα转变酶(tace)抗性形式的chom7细胞作为标靶细胞,来评估抗体混合物的adcc活性。经人cd16(fcγriiia-158v)稳定转染的nk92-m1细胞用作效应细胞。简单地说,将标靶细胞用增加浓度(0.143ng/ml至40ng/ml)的抗体调理,接着与nk92-m1/cd16效应细胞共同培育。在adcc介导的标靶细胞溶解后,胞内酶腺苷酸激酶释放至细胞培养基。使用toxilighttm生物分析试剂盒(lonza,allendale,nj)测量释放的腺苷酸激酶的量。pro(moleculardevices,sunnyvale,ca)将进行4参数数据分析并与剂量-反应数据进行约束模型曲线拟合。通过将测试样品反应与针对参考标准获得的反应比较,确定测试样品活性,并报导为相对细胞毒性百分比。为用于补体依赖性的细胞毒性(cdc)分析法,从用色谱法富集的重组抗tnfα抗体洗脱份获得β-半乳糖基化物质。富集的抗体用来制备具有特定水平β-半乳糖基化的溶液。接着测量在各种水平β-半乳糖基化下的cdc活性水平以确定cdc反应的敏感性。在功能性的基于细胞的分析中评估由抗体引起的cdc活性程度。将chom7细胞预先与20μm钙黄绿素-am(sigma,st.louis,mo)一起培育。钙黄绿素-am进入细胞并由非特异性酯酶裂解,变得发荧光并被捕捉在完整细胞膜内。负载钙黄绿素的标靶细胞与不同剂量浓度的抗体(1.563ng/ml至200ng/ml)一起培育,接着添加补体(2.5%最终浓度)用于第二次培育。在补体培育后,去除上层清液并使用微盘式读数器(envision,perkinelmer,waltham,ma)测量荧光。荧光强度与细胞溶解的量成正比。pro(moleculardevices,sunnyvale,ca)将用于进行4参数数据分析并与剂量-反应数据进行约束模型曲线拟合。通过将测试样品反应与针对参考标准获得的反应比较,确定测试样品活性,并报导为相对细胞毒性百分比。仅仅使非岩藻糖基化水平增加2%就对adcc活性具有实际影响(图7)。cdc活性还清楚地受β-半乳糖基化水平的增加影响,不过反应不太敏感(图8)。adcc和cdc效应功能可能是治疗性蛋白质的临床活性的关键因子,且实现特定聚糖的所需目标值对于达到所需临床终点来说是关键的。非岩藻糖基化微小改变对糖蛋白的adcc活性可能具有巨大的影响。通过改变铜和锰,可以控制负责这些效应功能并管理产物质量的聚糖水平。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 泡沫稳定型大豆蛋白及其糖接枝技术结合酸性加热制备方法
- 一种溴己新药物中间体n-甲基-n-邻硝基苄基环己胺的合成方法
- 一种高性能的人尿液α1酸性糖蛋白检测试剂盒的制作方法
- 改造核糖体结合位点提高基因工程菌株生产重组人骨形态发生蛋白2产量的方法
- 一种树脂再生提高柱效纯化乌司他丁的方法及提高乌司他丁稳定性的药物组合物的制作方法
- 一种亲和层析纯化乌司他丁的方法及提高乌司他丁稳定性的药物组合物的制作方法
- 一种亲和层析纯化乌司他丁的方法及提高乌司他丁复溶性的药物组合物的制作方法
- 一种吸附柱层析纯化乌司他丁的方法及提高乌司他丁稳定性的药物组合物的制作方法
- 一种树脂再生提高柱效纯化乌司他丁的方法及提高乌司他丁复溶性的药物组合物的制作方法
- 一种吸附柱层析纯化乌司他丁的方法及提高乌司他丁复溶性的药物组合物的制作方法