一种具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物及其制备方法和应用与流程
本发明涉及具有抗肿瘤活性的化合物,具体涉及从中药红花中提取的得到的具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物新化合物及其在预防和治疗肿瘤疾病和炎症疾病中的用途,属医药技术领域。
背景技术:
红花为菊科植物红花Carthamus tinctorius L.的干燥花,始载于《开宝本草》,主产于新疆、河南、浙江、云南等地,味辛性苦,归心、肝经,具有活血通经、散瘀止痛的功效,作为传统活血化瘀中药治疗中风、冠心病和心绞痛已有2500多年的历史。红花水提物制成的红花注射液收载于卫生部药品标准中药成方制剂二十册中,临床上广泛用于心血管疾病的治疗。目前已从红花中分离得到200多种化合物,包括醌式查尔酮苷类、黄酮类、生物碱类、有机酸类和甾体类等,而醌式查尔酮苷类是红花水提物的主要成分,如羟基红花黄色素A(HSYA)、红花黄色素A、safflomin C和脱水红花黄色素B(AHSYB)。现代药理研究发现,红花及其活性成分具有抗凝血、抗氧化、抗炎、保肝、降压等活性。
本发明继续对红花化学成分系统深入研究,对水部位中的醌式查尔酮苷类化合物进行系统分离,研究开发其新的活性结构。
技术实现要素:
发明目的:本发明的目的是在现有技术的基础之上,对红花化学成分系统深入研究,对水部位中的醌式查尔酮苷类化合物进行系统分离,研究开发出新的活性结构,并通过药理实验筛选其在防治肿瘤疾病、炎症疾病和抗血栓疾病中的新用途。
技术方案:为了实现以上目的,本发明采取的技术方案为:
具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物,其特征在于,其结构式如式Ⅰ所示:
具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物的制备方法,包括以下步骤:
(1)取红花,加乙醇提取得到乙醇提取液,合并提取液,浓缩,得乙醇浸膏;
(2)取步骤(1)制得的乙醇浸膏,依次用石油醚、乙酸乙酯和水进行萃取,萃取后浓缩,分别得到石油醚、乙酸乙酯和水的萃取物;
(3)取步骤(2)得到的水的萃取物,上大孔吸附树脂柱,先用水洗脱,然后分别用体积浓度为5~95%的乙醇洗脱,收集体积浓度为30%的乙醇洗脱液,浓缩,得大孔吸附树脂洗脱物;
(4)取步骤(3)得到的大孔吸附树脂洗脱物上LH-20凝胶柱层析,洗脱液为H2O-MeOH(体积比为从100∶0到0∶100),得到30个流分;
(5)取步骤(4)LH-20凝胶柱洗脱物,上pre-HPLC色谱进行分离,得到式Ⅰ所示的醌式查尔酮与黄酮醇结合物。
作为优选方案,以上具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物的制备方法,步骤(1)的提取方法为渗漉法,超声提取法,浸泡法或回流法。
作为优选方案,以上所述的具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物的制备方法,步骤(5)pre-HPLC色谱分离的分离条件:XBridgeTMC18OBDTM柱(150×30mm,5μm),流动相为0.1%甲酸水(A)和甲醇(B),采用梯度洗脱程序:0-5min,16%-19%B;5-15min,19%B;15-20min,19%-44%B;20-30min,44%B;30-32min,44%-100%B。流速为15mL/min;柱温为室温(25℃)。
本发明所述的具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物在制备抗炎药物中的应用。
作为另一优选方案,本发明所述的具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物在制备抗血栓性疾病中的应用。
作为另一优选方案,本发明所述的具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物在制备抗肿瘤药物中的应用。所述的肿瘤为肺癌、胃癌、结肠癌、宫颈癌、乳腺癌、肝癌或肾癌。
本发明所述的具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物,将醌式查尔酮与黄酮醇结合物化合物和药学上可接受的载体制备成片剂、胶囊剂、注射剂、粉针剂、颗粒剂、微囊、丸剂、软膏剂或透皮控释贴剂剂型的药物。
将本发明提供的醌式查尔酮与黄酮醇结合物制成片剂时,把醌式查尔酮与黄酮醇结合物和乳糖或玉米淀粉,需要时加入润滑剂硬脂酸镁,混合均匀,整粒,然后压片制成片剂。
本发明提供的醌式查尔酮与黄酮醇结合物制成胶囊剂时把醌式查尔酮与黄酮醇结合物和载体乳糖或玉米淀粉混合均匀,整粒,然后装胶囊制成胶囊剂。
本发明提供的醌式查尔酮与黄酮醇结合物制成颗粒剂时,把醌式查尔酮与黄酮醇结合物和稀释剂乳糖或玉米淀粉、混合均匀,整粒,干燥,制成颗粒剂。
本发明提供的醌式查尔酮与黄酮醇结合物制成粉针剂、注射液时加入载体按药学常规方法制备得到。
本发明提供的醌式查尔酮与黄酮醇结合物制成脂肪乳剂、软膏剂或透皮控释贴剂等剂型时加入载体按药学常规方法制备得到。
有益效果:本发明提供的具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物和现有技术相比具有以下优点:
本发明通过对红花化学成分进行系统深入研究,经过波谱和质谱数据分析表明从红花中分离得到醌式查尔酮与黄酮醇结合物,式Ⅰ化合物为首次从自然界中分离得到的醌式查尔酮和黄酮的二聚体为新骨架结构化合物。且经过抗炎和抗肿瘤活性研究表明,本发明提供的醌式查尔酮与黄酮醇结合物具有很好的抗炎活性,并且能抑制DNA拓扑异构酶I,对多种肿瘤均具有很强的抗肿瘤活性,且经过毒性实验研究表明,本发明提供的具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物毒性较低,可开发成新的抗肿瘤药物或抗炎药物,具有重要的应用价值。
本发明提供的制备方法,工艺设计合理,可操作性强,制备得到的醌式查尔酮与黄酮醇结合物纯度高。
附图说明
图1为醌式查尔酮与黄酮醇结合物式Ⅰ的结构示意图;
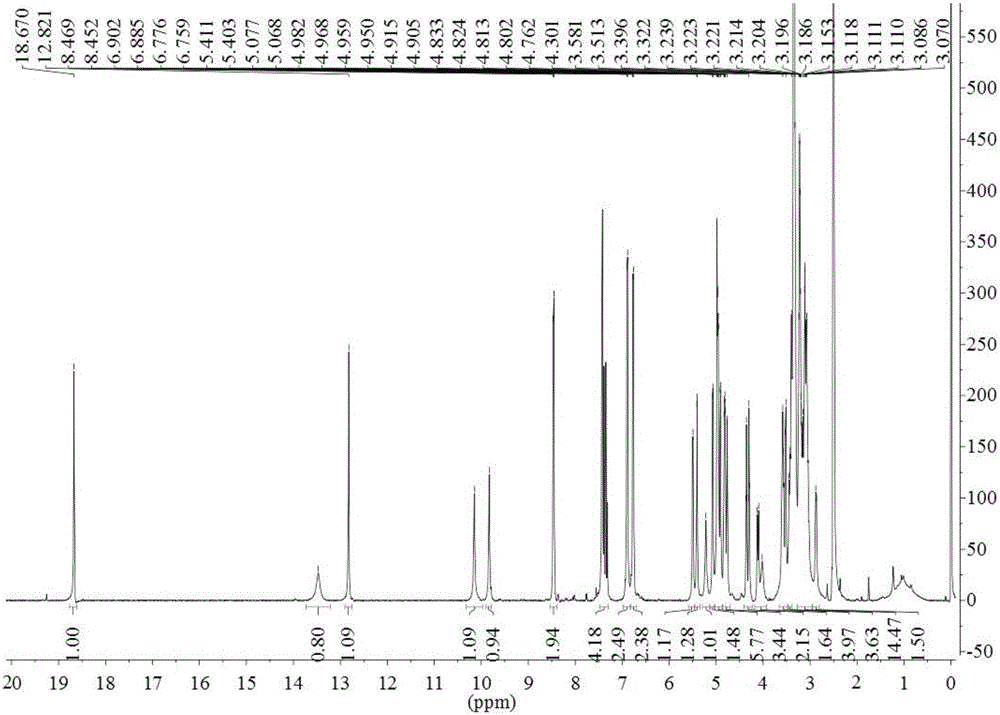
图2为醌式查尔酮与黄酮醇结合物式Ⅰ的1H-NMR图;
图3为醌式查尔酮与黄酮醇结合物式Ⅰ的的13C NMR图;
具体实施方式
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的具体的物料配比、工艺条件及其结果仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
实施例1醌式查尔酮与黄酮醇结合物的制备
具有抗肿瘤活性和抗炎活性的醌式查尔酮与黄酮醇结合物的制备方法,包括以下步骤:
(1)取红花15kg,依次加入体积浓度为95%和70%的乙醇渗漉提取至无色,得到乙醇提取液,合并提取液,浓缩,得乙醇浸膏1950g;
(2)取步骤(1)制得的乙醇浸膏,分散在水中,依次用石油醚和乙酸乙酯进行萃取,萃取后浓缩,分别得到石油醚、乙酸乙酯和水的萃取物;
(3)取步骤(2)得到的水的萃取物,上D101大孔吸附树脂柱,先用水洗脱,然后分别用体积浓度为5~95%的乙醇洗脱,收集体积浓度为30%的乙醇洗脱液,浓缩,得大孔吸附树脂洗脱物;
(4)取步骤(3)得到的大孔吸附树脂洗脱物上LH-20凝胶柱层析,洗脱液为H2O-MeOH(体积比为从100∶0到0∶100),得到30个流分;
(5)取步骤(4)LH-20凝胶柱洗脱流分第9流分和第3流分,上pre-HPLC色谱进行分离,pre-HPLC色谱分离的分离条件:XBridgeTMC18OBDTM柱(150×30mm,5μm),流动相为0.1%甲酸水(A)和甲醇(B),采用梯度洗脱程序:0-5min,16%-19%B;5-15min,19%B;15-20min,19%-44%B;20-30min,44%B;30-32min,44%-100%B。流速为15mL/min;柱温为室温(25℃)。
得到式Ⅰ所示的醌式查尔酮与黄酮醇结合物,结构式如图1。
式Ⅰ所示:
式Ⅰ的结构解析:黄色粉末,[α]D20:+363.6(c 0.1,MeOH)。高分辨质谱(HR-ESI-MS:m/z=1087.2563[M-H]-1,calcd.1087.2572)表明其分子式为C49H51O28。红外光谱在3434cm-1处的强吸收显示它有羟基存在,在1651cm-1处也出现羰基的特征吸收,同时在1539和1401cm-1处也出现芳环的特征吸收。紫外光谱显示228、271、342和402nm有最大吸收,说明分子中存在高度共轭体系。1H-NMR(图2)显示一套反式双键H信号δ7.40(1H,d,J=16.0Hz)和7.33(1H,d,J=16.0Hz),一套AA′BB′系统δ7.43(2H,d,J=8.5Hz)和6.77(2H,d,J=8.5Hz),一个酚羟基H信号δ9.83(1H,s),以及一个特征性的低场H信号δ18.67(1H,s),由此证明分子中可能含有醌式查尔酮的骨架。在1H-NMR中还有一套AA′BB′系统δ8.46(2H,d,J=8.5Hz)和6.89(2H,d,J=8.5Hz),以及三个酚羟基H信号δ13.47(1H,br s)、12.82(1H,s)和10.15(1H,s)。此外还有一个亚甲基氢信号δ4.11(1H,d,J=14.5Hz)和3.32(1H,d,J=14.5Hz),三个糖端基氢信号δ5.50(1H,d,J=7.2Hz)、4.98(1H,d,J=7.5Hz)和3.52(1H,d,J=9.5Hz),以及一些脂肪族H信号δ2.88-5.50ppm。
13C-NMR(图3)显示有49个碳原子,结合HSQC谱可判定有四个亚甲基碳,25个次甲基碳,以及20个季碳信号。其中,归属出三套吡喃葡萄糖碳信号。另外,此化合物的碳谱数据与羟基红花黄色素A和6-羟基山柰酚-3,6-二-O-β-D-葡萄糖苷比较发现,区别在于化合物1缺少一个碳苷葡萄糖基并存在一个亚甲基(δ17.1)信号。结合氢谱的数据,推测此化合物是由醌式查尔酮苷和黄酮苷组成的二聚体。
在HMBC光谱上,两个不等价亚甲基H信号δ4.11和3.32与δ103.3(C-6)、107.2(C-8′)、149.3(C-7′)、157.5(C-9′)、184.6(C-1)和188.9(C-5)相关,表明醌环的C-6位(A环)与苯环的C-8′位(C环)通过亚甲基相连。在MS/MS谱图结果显示式Ⅰ化合物经麦氏重排裂解成两个特征碎片m/z 625.14([M-H-C22H22O11]-)和461.11([M-H-C27H30O17]-),再次证明C-6/CH2/C-8′的桥连存在。通过酸水解和柱前衍生化,3′位和6′位的葡萄糖经HPLC分析确定为D构型。另外,酚羟基δ18.67和δ184.6(C-1)、177.8(C-7)、121.6(C-8)、106.9(C-2)和103.3(C-6)HMBC相关,表明化合物1的醌式查尔酮苷部分在DMSO-d6中呈现1-烯醇-3,7-二酮和7-烯醇-1,3-二酮两种互变异构体共存状态。根据在溶液中醌式查尔酮碳苷优势构型的规律,式Ⅰ化合物的优势构型应为为1-烯醇-3,7-二酮。
式Ⅰ化合物的ECD上λmax(nm)(Δε)值为212(-21.80)、245(+9.45)、268(-30.53)和415(+16.61)。此化合物在270nm附近为负cotton效应,由此确定此化合物在C-4位的绝对构型为S。
实施例2抑制LPS诱导的HUVEC细胞炎症反应的活性筛选
血瘀证的本质是微循环障碍或血液流变性异常。随着细胞、分子生物学研究的深入,炎症反应与血瘀证关系密切,一系列的炎症细胞和炎症因子参与血瘀证的疾病过程。故本实验采用LPS诱导HUVEC建立体外细胞炎症反应模型评价醌式查尔酮与黄酮醇结合物的抗炎活性。
1、实验材料
1.1仪器
SERIES II WATER JAVKET型CO2孵育箱(美国Thermo公司);1300SERIES A2型生物安全柜(美国Thermo公司);BWS-10型水浴锅(昆山一恒仪器有限公司);TOMY SX-500高压蒸汽灭菌锅(日本Queensland公司);EPED超纯水系统(南京易普易达科技发展有限公司);CKX31SF型倒置显微镜(OLYMPUS公司);Allegra X-12R通用台式离心机(美国BECKMAN公司);6孔培养板(美国Costar公司);WGL-230B型电热鼓风干燥箱(天津市泰斯特仪器有限公司);qPCR仪(美国Applied Biosystem公司);超微量核酸蛋白检测仪(日本Queensland公司)。
1.2细胞及试剂
HUVEC细胞购自南京凯基生物科技发展有限公司;高糖DEME培养基和胎牛血清(FBS)购自美国Gibco公司;脂多糖(LPS)购自于美国Sigma-Aldrich公司;TRIzol试剂购自美国Invitrogen公司;PrimeScriptTMRT reagent kit购自中国大连TaKaRa公司。
2、实验方法
2.1细胞培养
HUVEC细胞培养于含10%的胎牛血清、100mg·mL-1青霉素、100mg·mL-1链霉素的DMEM培养基中,置于37℃、5%二氧化碳培养箱中。2~3d更换培养液,3~4d传代一次。2.2细胞处理及分组
将HUVEC细胞按1×105个·mL-1接种于六孔板,每孔满体积2mL。实验分为3组:空白组,不加入LPS和药物;模型组,加入LPS,终浓度10μg·mL-1,不加药物;给药组:依次加入以上式Ⅰ化合物,使式Ⅰ-1化合物浓度为0.8μmol·L-1、式Ⅰ-2化合物浓度为4μmol·L-1、式Ⅰ-3化合物浓度为20μmol·L-1、式Ⅰ-4化合物浓度为100μmol·L-1药物。连续给药2天后收集细胞,用于提取总RNA。
2.3RNA提取
于6孔板每个孔各加入500μLRNAzol,准备1.5mL子弹头,标记好记号,用刮刀将细胞HUVEC仔细的刮下并且转移到1.5mL的EP管中;加入500μL DEPC H2O,混悬15s;离心(13200rpm,10min,4℃);取上清1000μL到新的EP管中,离心(13200rpm,30min,4℃);观察RNA形态,倾倒出上层液体,每个EP管中加入500μL 70%乙醇,离心(13200rpm,10min,4℃);重复1次,倒置,晾干后,各加入20μL 55℃ DEPC H2O,-80℃保存;Nano drop测定RNA含量(A260/280的范围在1.8-2.0)。
2.4转cDNA
TaKaRa试剂盒:PrimeScriptTMRT reagent Kit with gDNA Eraser
1)基因组DNA去除反应
2)逆转录反应
Store at 4℃;
3)Nano drop测定cDNA含量(A260/280的范围在1.6-1.8)。
2.6.1.2.5 qRT-PCR SYBR Green试剂盒(QIAGEN)
1)qPCR反应体系配制
2)qPCR反应程序设置
取对数生长期HUVEC,加入一定浓度药物作用,利用RNAzol一步法提取总RNA,1μg的总RNA以10μL体系进行逆转录,制备cDNA并反转录PCR。使用引物如下:
3、实验结果
表1式Ⅰ醌式查尔酮苷化合物抑制LPS诱导的HUVEC细胞炎症因子表达结果
与空白组相比,#P<0.05,##P<0.01,与模型组相比,*P<0.05,**P<0.01.
由以上表1实验结果表明,式Ⅰ醌式查尔酮与黄酮醇结合物显著上调抗炎因子IL-10的基因表达作用,且式Ⅰ醌式查尔酮与黄酮醇结合物可选择性抑制IL-1和IL-6的mRNA表达;式Ⅰ醌式查尔酮与黄酮醇结合物仅在高剂量浓度下对TNF-α的基因表达具有显著抑制作用,进一步表明,醌式查尔酮与黄酮醇结合物具有特异性的抗炎活性,有开发成为新一代抗炎药的潜力。
实施例3抑制DNA拓扑异构酶I的活性筛选
DNA拓扑异构酶(Topoisomerase)是一种重要的核酶,参与DNA复制、转录、重组、基因调节及细胞有丝分裂等重要生命活动,可通过催化DNA链的断裂和结合控制其拓扑结构。肿瘤细胞中,Topo I含量及活性远高于正常体细胞,抑制Topo I-DNA可裂解复合物解离,就能选择性抑制肿瘤细胞的快速增殖,进而杀死肿瘤细胞[8]。Topo I由此成为公认的抗癌药作用靶点。故本实验采用体外抑制DNATopo I的模型评价醌式查尔酮与黄酮醇结合物的抗肿瘤活性。
1、实验材料
1.1仪器
凝胶成像仪(上海培清科技有限公司),电泳仪(北京市六一仪器厂),金属浴(杭州博日科技有限公司)。
1.2药物及试剂
DNA Topo I、ρBR322DNA、Agarose Regular、6×Loading Buffer、Tris-Borate-EDTA Buffer(TBE)powder均购自宝生物(大连)有限公司;10-羟基喜树碱(OPT)和十二烷基硫酸钠购自上海阿拉丁生化科技公司;Super green I购自北京泛博生物化学有限公司。实施例1制备得到的式Ⅰ醌式查尔酮与黄酮醇结合物。
2、实验方法
该测试采用20μL反应体系,包括10×Topo I缓冲液(350mM Tris-HCl pH 8.0,720mM KCI,50mM MgCl2,50mM DTT,50mM spermidine)、0.1%BSA、0.5μg小牛胸腺ρBR322DNA、1U Topo I、待测化合物的DMSO溶液,阳性药为10-羟基喜树碱(OPT)。置于37℃金属浴中反应30min,加入5μL反应终止液1.5%十二烷基硫酸钠(SDS)终止反应。1μL产物与2μL 6×loading buffer混合上样,1%琼脂糖凝胶、TBE缓冲液、90V电压,电泳60min。Sybr green I染色30min,凝胶成像仪观察结果,拍照记录。酶活力单位定义:能在37℃ 30min松驰0.5μg负超螺旋ρBR322DNA所需的Topo I酶量,为1个单位(U)。
3、实验结果
式Ⅰ化合物在500μM时对Topo I有抑制作用,结果表明醌式查尔酮与黄酮醇结合物具有较好的抗肿瘤活性。
实施例4体外抗肿瘤实验
本发明使用改良MTT法对本发明实施例1制备得到的式Ⅰ醌式查尔酮与黄酮醇结合物进行体外抗肿瘤细胞实验:将肺癌、胃癌、结肠癌、宫颈癌、乳腺癌、肝癌或肾癌用胰酶进行消化、计数、制成浓度为5×104个/ml的细胞悬液。将96孔板中每孔加入100μl细胞悬液(每孔5×103个细胞),然后置于37℃,5%CO2培养箱中培养24小时;用非完全培养基稀释式Ⅰ醌式查尔酮苷化合物至所需的不同梯度浓度,每孔加入100μL相应的含药培养基,同时设立阴性对照组,溶媒对照组和阳性对照组,再将96孔板置于37℃,5%CO2培养箱中培养72小时。然后每孔加入20μLMTT(5mg/ml),继续培养4小时,终止培养,弃去培养基,每孔加入150μLDMSO溶解,摇床10分钟轻轻混匀。在λ=4570nm、620nm两波长下用酶标仪检测每孔的吸光度即OD值,以各复孔的平均值作为该组细胞的OD值,计算各药物的抑制率。
实验结果显示本发明实施例1制备得到的式Ⅰ醌式查尔酮与黄酮醇结合物,对肺癌、胃癌、结肠癌、宫颈癌、乳腺癌、肝癌或肾癌均具有较强的抑制作用,在10μg/ml剂量下,对肺癌、胃癌、结肠癌、宫颈癌、乳腺癌、肝癌或肾癌抑制率均大于50%。
以上实施方式只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人了解本发明内容并加以实施,并不能以此限制本发明的保护范围,凡根据本发明精神实质所做的等效变化或修饰,都应涵盖在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!