一种促进厌氧消化器启动及加速丙酸转化为甲烷的方法与流程
本发明属于发酵工程领域,具体涉及一种促进厌氧消化器启动及加速丙酸转化为甲烷的方法。
背景技术:
厌氧消化体系中,乙酸、丙酸、丁酸等有机酸的积累常导致厌氧消化系统酸化,有机负荷降低甚至整个系统崩溃。然而,作为有机废弃物厌氧转化的重要中间代谢产物,乙酸、丙酸、丁酸却难以降解。短链脂肪酸(如乙、丙和丁酸)是沼气发酵过程中的重要中间代谢产物,其代谢转化是控制沼气发酵过程的重要环节。但在标准状况下,这些脂肪酸的厌氧氧化反应是一个吸热反应(吉布斯自由能ΔG>0),不能自发发生。在没有其它电子受体条件下,短链脂肪酸的降解需要通过脂肪酸氧化菌与产甲烷古菌偶联,通过互营代谢作用才能完成。微生物互营代谢是有机质降解产甲烷过程中的限速步骤,参与这步代谢的互营菌营养条件苛刻、获取的能量低、生长缓慢,极大的限制了脂肪酸的代谢。此外,在互营代谢过程中,脂肪酸氧化菌与产甲烷古菌之间必须建立良好的物质、能量传递,才能实现互营代谢的顺利进行。
丙酸的降解需要更多的能量和更低的氢分压,因此比其他短链脂肪酸更难降解。因此,控制丙酸的正常代谢也是维持沼气发酵过程正常进行的关键问题。
技术实现要素:
针对现有技术的缺点,本发明的目的在于提供一种促进厌氧消化器启动及加速丙酸转化为甲烷的方法,该方法包括如下步骤:
(1)复合菌的制备:
1)以右旋糖酐废水厌氧消化器出水为原始接种物,以丙酸钠作为碳源,进行接种培养至培养物中丙酸降解率达到50-80%,甲烷含量为30-50%;
2)将步骤1)所得物转移到新鲜培养基培养,并按每ml步骤1)培养液,加入如下细菌:
3)将步骤2)所得物进行密封培养,即得所述快速解除丙酸积累的复合菌;
(2)配制新鲜培养基,加入终浓度为3000mg/L的丙酸钠,接种10%步骤(1)所得复合菌,40℃静置培养至丙酸降解率达到50-80%,甲烷含量为30-50%;
(3)将步骤(2)所述培养物转移至新鲜培养基,以质量百分比1-20%的比例加入固型载体,所述固型载体包括内径为6-15mm的生物环、粒径为50-250μm的空心玻璃微珠、粒径为1-5mm的活性炭、直径为5-12mm的实心PV球、体积密度为0.1-0.2g/cm3的活性炭毡中的一种;
(4)将步骤(3)所得物密封并静置培养,直至丙酸降解率达70-100%,即为完成丙酸厌氧消化系统的启动过程;丙酸厌氧消化系统启动完成后继续添加1-30g/L的丙酸钠,40℃静置培养,即为丙酸厌氧消化系统启动后运行过程。
在步骤1)接种时,接种量为1-20%,培养条件为于25-55℃、pH=6.0-9.0下密封培养。
优选的,丙酸钠的添加量为1500-10000mg/L。
所述培养基,按每升培养基计,包括1g NH4Cl,1g酵母粉,1g胰蛋白胨,0.5g半胱氨酸盐酸盐,50ml大量元素溶液,10ml微量元素溶液,10ml维生素141,10mg刃天青;所述大量元素每升包括6g KH2PO4,12g NaCl,2g MgCl2·6H2O,1.6g CaCl2·2H2O;所述微量元素溶液每升包括12.8g氨基三乙酸,1.35g FeCl3·6H2O,0.1g MnCl2·4H2O,0.1g CoCl2·6H2O,0.1g ZnCl2,0.025g CuCl2·2H2O,0.01g H3BO3,0.024g Na2MoO4·2H2O,1g NaCl,0.12g NiCl2·6H2O,0.026g Na2SeO3·5H2O。
步骤3)中培养条件为:培养温度为25-55℃,pH为6.0-9.0。
优选的,所述固型载体为粒径为1-5mm的活性炭或粒径为50-250μm的空心玻璃微珠。更优选的,所述固型载体为粒径为1-5mm的活性炭。
本发明的有益效果:
1、本发明可大幅提高丙酸的降解率和大幅缩短丙酸完全降解所需的时间;
2、本发明对丙酸代谢转化甲烷的运行效率具有显著的促进作用;
3、本发明可有效促进厌氧消化系统中H2的转运代谢,使系统维持在较低的氢分压状态,使得厌氧消化系统更加稳定,抗逆行更强,大幅度提升运行负荷。
附图说明
图1为本发明复合菌对丙酸的水解能力图;
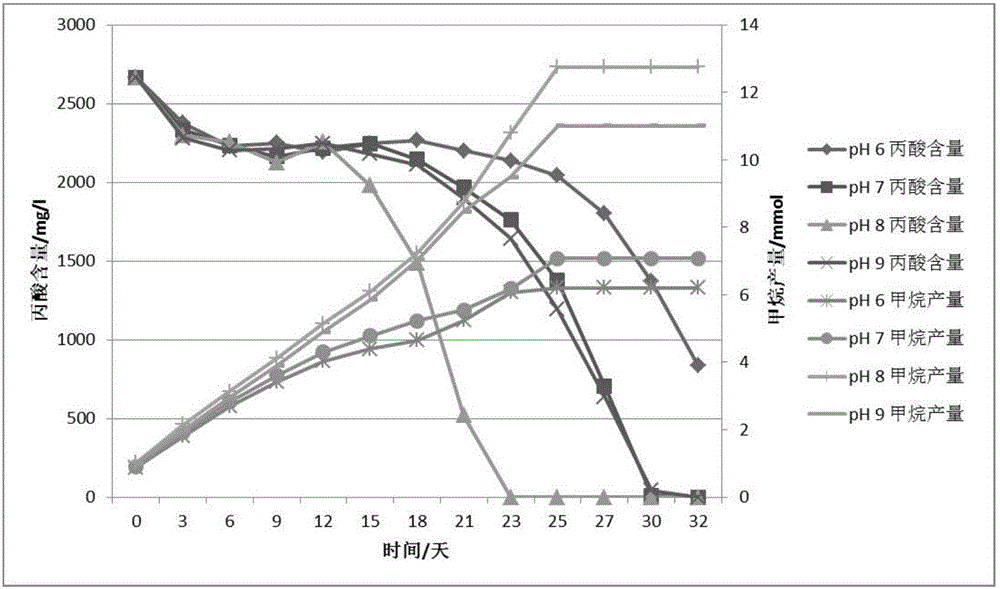
图2为复合菌群对pH的适应能力图;
图3为复合菌群对丙酸钠的代谢能力图;
图4和图5为空心玻璃微珠对丙酸互营氧化的影响;
图6为固型载体促进丙酸厌氧消化系统快速启动的效果图;
图7为固型载体加速丙酸厌氧消化系统丙酸转化产甲烷的效果图;
图8为不同固型载体含量对丙酸互营代谢的影响结果图,其中,A、B表示丙酸互营代谢启动阶段(1ST)的丙酸降解率和产甲烷情况,C、D表示丙酸互营代谢运行阶段(2ST)的丙酸降解率和产甲烷情况;
图9为本发明固型载体对厌氧消化系统中氢分压及运行负荷的影响结果图。
具体实施方式
下面通过实施例对本发明进行具体描述,有必要在此指出的是以下实施例只是用于对本发明进行进一步的说明,不能理解为对本发明保护范围的限制,该领域的技术熟练人员根据上述发明内容所做出的一些非本质的改进和调整,仍属于本发明的保护范围。
下述实施例中所用的BCTY培养基的配方为:按每升培养基计,由1g NH4Cl,1g酵母粉,1g胰蛋白胨,0.5g半胱氨酸盐酸盐,50ml大量元素溶液,10ml微量元素溶液,10ml维生素141,10mg刃天青;所述大量元素每升包括6g KH2PO4,12g NaCl,2g MgCl2·6H2O,1.6g CaCl2·2H2O;所述微量元素溶液每升包括12.8g氨基三乙酸,1.35g FeCl3·6H2O,0.1g MnCl2·4H2O,0.1g CoCl2·6H2O,0.1g ZnCl2,0.025g CuCl2·2H2O,0.01g H3BO3,0.024g Na2MoO4·2H2O,1g NaCl,0.12g NiCl2·6H2O,0.026g Na2SeO3·5H2O组成。
实施例1
配制厌氧的BCTY培养液,加入终浓度为3000mg/L的丙酸钠,分装150ml于250ml厌氧瓶中,接种10%(V/V)右旋糖酐废水厌氧消化器出水,密封,40℃静止培养。待丙酸降解率达到80%,甲烷含量为50%左右,按照以下三种方案添加功能菌株(个细胞/ml培养液):
方案一:Pelotomaculum schinkii 2.5×107,Pelotomaculum propionicicum 1×107,Syntrophobacter wolinii 1×106,Methanospirillum hungatei 4×106,Methanoculleuspalmolei 5×106,Methanoculleus bourgensis 5×106,Methanosarcina barkeri 5×106,Methanosarcina mazei 1×107。
方案二:Pelotomaculum schinkii 4×107,Pelotomaculum propionicicum 1.5×107,Syntrophobacter wolinii 3×106,Methanospirillum hungatei 1.4×107,Methanoculleuspalmolei 1×107,Methanoculleus bourgensis 1×107,Methanosarcina barkeri 1.5×107,Methanosarcina mazei 2×107。
方案三:Pelotomaculum schinkii 5×107,Pelotomaculum propionicicum 2.5×107,Syntrophobacter wolinii 3×106,Methanospirillum hungatei 1.4×107,Methanoculleuspalmolei 1.4×107,Methanoculleus bourgensis 1.4×107,Methanosarcina barkeri 2.5×107,Methanosarcina mazei 3×107;
密封,40℃静止培养,监测丙酸降浓度和甲烷产量,结果见图1。
实施例2复合菌群对pH的适应能力
配制厌氧的BCTY培养液,加入终浓度为3000mg/L的丙酸钠,分装150ml于250ml厌氧瓶中,接种20%(V/V)右旋糖酐废水厌氧消化器出水,密封,20℃静止培养。待丙酸降解率达到70%,甲烷含量为40%左右,按照以下方案添加功能菌株(个细胞/ml培养液):Pelotomaculum schinkii 5×107,Pelotomaculumpropionicicum 2.5×107,Syntrophobacter wolinii 3×106,Methanospirillum hungatei 1.4×107,Methanoculleuspalmolei 1.4×107,Methanoculleus bourgensis 1.4×107,Methanosarcina barkeri 2.5×107,Methanosarcina mazei 3×107。
密封,20℃静止培养,获得水解丙酸产甲烷复合菌群。将获得的菌群分别接种于pH 6.0,pH 7.0,pH 8.0,pH 9.0的新鲜BCTY培养基中,接种量20%(V/V),丙酸终浓度为3000mg/L,监测丙酸浓度和甲烷产量,结果见图2。
实施例3复合菌群对丙酸钠的代谢能力
配制厌氧的BCTY培养液,加入终浓度为10000mg/L的丙酸钠,分装150ml于250ml厌氧瓶中,接种1%(V/V)右旋糖酐废水厌氧消化器出水,密封,55℃静止培养。待丙酸降解率达到50%,甲烷含量为30%左右,按照以下方案添加功能菌株(个细胞/ml培养液):Pelotomaculum schinkii 5×107,Pelotomaculumpropionicicum 2.5×107,Syntrophobacter wolinii 3×106,Methanospirillum hungatei 1.4×107,Methanoculleuspalmolei 1.4×107,Methanoculleus bourgensis 1.4×107,Methanosarcina barkeri 2.5×107,Methanosarcina mazei 3×107。
密封,55℃静止培养,获得水解丙酸产甲烷复合菌群。将获得的菌群接种于pH 7.0的新鲜BCTY培养基中,接种量1%(V/V),丙酸终浓度分别为1g/L,3g/L,5g/L,7g/L,10g/L,15g/L,20g/L,30g/L,密封,40℃静止培养,监测培养液中的丙酸相对含量,结果见图3。
丙酸相对含量=监测时发酵液中的丙酸浓度(mg/L)/培养液中的初始丙酸浓度(mg/L)×100%。
实施例4
配制厌氧的BCTY培养液,加入终浓度为3000g/L的丙酸钠,分装300ml于550ml厌氧瓶中,厌氧瓶内加入10%(W/V)固型载体玻璃砂,对照组不加固型载体,121℃灭菌30min,接种10%(V/V)实施例2所得复合菌,10%NaHCO3调pH至7.0-8.5,密封,40℃静止培养。检测丙酸浓度和甲烷产量,添加固型载体玻璃砂后,丙酸完全降解的时间缩短16天,降解速率提高62%,与此同时,甲烷产量从52%提高到67%,甲烷产量提高28.8%(图4和图5)。
实施例5
配制厌氧的BCTY培养液,加入终浓度为3000mg/L的丙酸钠,分装300ml于600ml厌氧瓶中,厌氧瓶内加入10%(W/V)固型载体空心玻璃微珠CL、空心玻璃微珠N60、生物磁环、活性炭毡、活性炭,对照组不加固型载体,121℃灭菌30min,接种10%(V/V)实施例2所得复合菌,以10%NaHCO3调pH至7.0-8.5,密封,40℃静止培养,连续监测丙酸浓度和甲烷产量。
如图6所示,本发明所述固型载体能显著的促进丙酸互营代谢过程。活性炭具有显著加速丙酸互营代谢启动的作用,在该组条件下,仅用17天即达到了对丙酸的最大降解率(93.63%),是同期对照组丙酸降解率(25.43%)的3.8倍;空心玻璃微珠CL和空心玻璃微珠CL+N60组在第19天完成了丙酸的完全降解,是同期对照组丙酸降解率(43.8%)的2.28倍;反应进行到21天时,生物磁环、活性炭毡、和对照组的丙酸降解率分别为94.86%、88.09%和78.05%,两组固型载体均能有效加速丙酸互营氧化。其中,空心玻璃微珠CL的粒径范围为200-250μm(下同);空心玻璃微珠N60的粒径范围为50-60μm(下同)。
实施例6
在丙酸厌氧消化系统启动完成后,继续加入3000ppm丙酸钠。如图7所示,固型载体对丙酸代谢转化甲烷的运行效率具有显著的促进作用。
实施例7
配制厌氧的BCTY培养液,加入终浓度为3000mg/L的丙酸钠,分装50ml于120ml厌氧瓶中,厌氧瓶内分别加入0%、10%、20%、30%、40%(W/V)的固型载体空心玻璃微珠CL,121℃灭菌30min,接种10%(V/V)实施例2所得复合菌,10%NaHCO3调pH至7.0-8.0,密封,40℃,静止培养,连续监测丙酸浓度和甲烷产量,结果如图8所示,固型载体可加速丙酸的互营氧化产甲烷的速率,同时不同含量的固型载体对丙酸代谢速率的影响有一定差异。丙酸启动阶段CH4产率为C20>C30>C40,C10>CK,丙酸降解率为C20=C30=C40>C10>CK;丙酸互营代谢启动完成后,第二次加入3000mg/L的丙酸,则丙酸降解率C20>C10>C30>C40,甲烷产率C20>C10>C30>C40。其中,C10、C20、C30和C40分别代表添加量为10%(W/V)、20%(W/V)、30%(W/V)和40%(W/V)的固型载体空心玻璃微珠CL,CK代表不添加固型载体。
丙酸互营代谢过程极易受厌氧消化系统中氢分压影响,过高的氢分压极易造成厌氧消化系统中有机酸如乙酸、丙酸和丁酸的积累,从而导致系统酸化,运行效率降低,产气减少。如图9所示,当利用空心玻璃微珠CL(C20)作为固型载体时,本发明方法可有效促进厌氧消化系统中H2的转运代谢,使系统维持在较低的氢分压状态。因此,使得厌氧消化系统更加稳定,抗逆行更强,使其运行负荷大幅度提升。
- 还没有人留言评论。精彩留言会获得点赞!