一种固氮基因nifDK基因敲除的方法与流程
本发明属于生物技术领域,涉及一种固氮基因nifDK基因敲除的方法。
背景技术:
在基因敲除的实验过程中,通常采用融合PCR技术与抗性质粒连接后进行筛选,采用单一抗性质粒筛选会导致筛选效率低,不易找到重组子,最终实验失败。
技术实现要素:
为了解决构建慢生型大豆根瘤菌突变株的技术问题,本发明提供了一种固氮基因nifDK基因敲除的方法。
本发明的目的是通过以下技术方案实现的:
一种固氮基因nifDK基因敲除的方法,包括以下步骤:
一、PCR扩增慢生型大豆根瘤菌中的nifDK基因上下游片段,分别为nifDK-AB和nifDK-CD;
二、以nifDK-AB和nifDK-CD的PCR产物为模板进行融合PCR,PCR扩增nifDK-AD;
三、将nifDK-AD与载体pK18mobsacB相连,酶切验证,将nifDK-AD转入E.coli DH5α中;
四、将供体菌nifDK-AD、辅助菌pRK2013、受体菌HW-05三亲本杂交;
五、第一次同源重组:通过在KmR的平板上生长,在10%蔗糖平板不生长,第一次筛选重组子;
六、第二次同源重组:通过在KmR的平板上不生长,在10%蔗糖平板生长,第二次筛选重组子;
七、PCR验证,确定筛选的重组子已经插入到慢生型大豆根瘤菌的基因组中,而基因组中不含有野生株。
本发明采用融合PCR的方法,将融合片段与质粒pK18mobsacB连接,通过KmR抗性筛选和sacB在10%蔗糖的筛选压力迫使其发生双交换,在2次同源重组后,采用PCR法筛选突变株,提高了筛选成功率。
附图说明
图1是筛选重组子流程图;
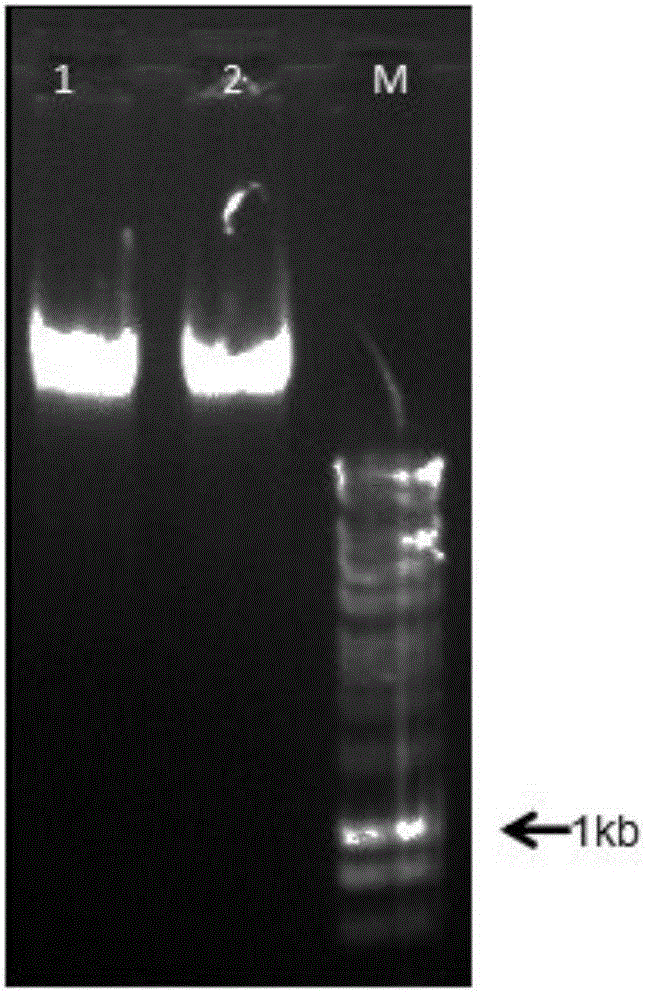
图2是基因组DNA提取结果,M:DNA Marker DL10000,1:HW-05基因组DNA,2:HH103基因组DNA;
图3是nifDK基因PCR扩增结果,M:DNA Marker DL10000,1:USDA110nifDK基因PCR扩增产物,2:HW-05nifDK基因PCR扩增产物;
图4是nifDK-AB片段PCR扩增结果,M:DNA Marker DL10000,1:nifDK-AB片段PCR扩增产物;
图5是nifDK-CD片段PCR扩增结果,M:DNA Marker DL10000,1-2:nifDK-CD片段PCR扩增产物;
图6是nifDK-AD片段PCR扩增结果,M:DNA Marker DL10000,1:nifDK-AD片段PCR扩增产物;
图7是nifDK-AD/pK18mobsacB转化后提取结果,M:DNA Marker DL10000,1:nifDK-AD/pK18mobsacB连接后转化提取结果;
图8是克隆酶切鉴定结果,M:DNA Marker DL10000,1:克隆EcoRⅠ和BamHⅠ双酶切产物;
图9是重组子筛选,M:DNA Marker DL10000,1-2:nifDK片段PCR扩增产物。
具体实施方式
下面结合附图对本发明的技术方案作进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。
以慢生型大豆根瘤菌HW-05为例,本发明提供的固氮基因nifDK基因敲除的方法如下:
一、试验方法
1、HW-05的分离
选取个大且饱满的根瘤,用剪刀将其剪下(带部分根),将根瘤放在清水中浸泡4~5min,洗去杂质,再用95%乙醇浸泡5min后用0.1%的HgCl2表面灭菌5min,然后用无菌水冲洗10次。在无菌操作的情况下,将单个根瘤夹破后在YMA培养基上划线,在28℃的温箱中培养3~5d后,挑取少许菌体观察其形态、大小、透明度、粘稠度、颜色、光泽等特征与标准菌对比,将获得的菌体挑入培养基斜面上,继续培养观察,如果菌落无异常,再划线稀释反复分离,直到纯化为止。
2、HW-05中nifDK基因的克隆
以慢生型大豆根瘤菌HW-05的基因组DNA为模板,采用同源序列克隆法,设计nifDK基因的特异性引物,采用PCR方法扩增目的基因nifDK全长DNA反应后,回收PCR产物与pMD18-T Vector Kit进行连接并转化至E.coli DH5α。送与上海生物工程有限公司进行测序。
3、PCR扩增HW-05中的nifDK-AB片段
(1)PCR管中依次加入以下试剂,以nifDK-A(F)和nifDK-B(R)为引物扩增nifDK-AB片段,扩增体系见表1:
表1
(2)扩增反应参数见表2:
表2
(3)取5μl反应产物,加1μL6×loading buffer,1%琼脂糖凝胶电泳检测。
4、PCR扩增HW-05中的nifDK-CD片段
(1)PCR管中依次加入以下试剂,以nifDK-C(F)和nifDK-D(R)为引物扩增nifDK-CD片段,扩增体系见表3:
表3
(2)扩增反应参数见表4:
表4
(3)取5μl反应产物,加1μl 6×loading buffer,1%琼脂糖凝胶电泳检测。
5、nifDK-AB片段和nifDK-CD片段融合
(1)PCR管中依次加入以下试剂,以nifDK-A(F)和nifDK-D(R)为引物,nifDK-AB 1μl和nifDK-CD 1μl为模板扩增nifDK-AD片段,扩增体系见表5:
表5
(2)扩增反应参数见表6:
表6
(3)取5μL反应产物,加1μL6×loading buffer,1%琼脂糖凝胶电泳检测。
6、纯化产物与pK18mobsacB连接
将纯化的PCR产物nifDK-AD与载体pK18mobsacB在16℃连接过夜,反应体系如表7:
表7
7、酶切鉴定
限制性内切酶鉴定提取的质粒。根据pK18mobsacB载体酶切图谱,选用EcoRI和BamHI双酶切筛选阳性重组质粒,反应条件为37℃水浴4h。反应结束后分别取3μL酶切产物进行0.8%琼脂糖凝胶电泳检测,观察酶切结果,确定是否有外源片段以及插入片段大小是否正确,从而初步判断是否为重组克隆。
双酶切体系(20μl)见表8:
表8
8、nifDK-AD转入HW-05重组子筛选
通过两次同源重组,10%蔗糖和KmR筛选后进行PCR检测阳性克隆,在20μLPCR反应体系中,以1μL质粒DNA(经20倍稀释)为模板,加入相应的PCR反应成分,进行PCR扩增,电泳检测是否扩出特异性条带,以确定重组子。筛选重组子流程图如图1所示。
二、实验结果
1、HW-05总DNA提取
总DNA提取结果,根据总DNA提取方法获得基因组DNA,结果见图2。
2、PCR扩增HW-05中nifDK片段
结果见图3。
3、PCR扩增HW-05中nifDK-AB片段
PCR扩增nifDK-AB片段产物大小约在600bp处,与预期大小相符,结果见图4。
4、PCR扩增HW-05中nifDK-CD片段
PCR扩增nifDK-CD片段产物大小约在600bp处,与预期大小相符,结果见图5。
5、PCR扩增HW-05中nifDK-AD片段
将nifDK基因上游的AB片段和下游的CD片段进行融合PCR扩增,扩增得到约1200bp目的条带,结果见图6。
6、nifDK-AD片段连接于pK18mobsacB载体及鉴定
选择nifDK-AD片段和pK18mobsacB载体共有的EcoRⅠ和BamHⅠ两种内切酶,进行酶切连接后转化,提取质粒,在约为7kb出现条带,结果见图7。
选用EcoRⅠ和BamHⅠ酶切进行验证,出现两个条带分别约为1kb和6kb,结果见图8。
7、nifDK-AD转入HW-05重组子筛选
将nifDK-AD片段经三亲本杂交转入HW-05后,PCR扩增nifDK片段,条带约为1200bp的为重组子,结果见图9。
- 还没有人留言评论。精彩留言会获得点赞!
- 用CRISPR/Cas9技术易于筛选获得目的基因敲除细胞系的方法及产品与制造工艺
- 一种Candida amazonensis的FLP/FRT基因敲除方法与制造工艺
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 利用CRISPR/Cas9敲除人PD‑1基因构建靶向CD19CAR‑T细胞的方法与制造工艺
- 一种构建基因替代小鼠研究野生型和突变体非肌性肌球蛋白重链II功能的方法与制造工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 猪ApoE基因敲除打靶载体及其构建方法和应用与制造工艺
- 一种血小板减少症的斑马鱼模型的制造方法与工艺
- 基于CRISPR技术敲除FUT8基因的方法与制造工艺