西红花及西红花内生真菌GGPPS基因、基因克隆方法与应用与流程
本发明属于基因工程技术领域,尤其是涉及一种西红花及西红花内生真菌GGPPS基因、基因克隆方法与应用。
背景技术:
牻牛儿基牻牛儿基焦磷酸合成酶(Geranylgeranyl pyrophosphate synthase,GGPPS)是萜类、赤霉素、维生素E等化合物合成的关键酶。牻牛儿基牻牛儿基焦磷酸合成酶可催化15碳的法呢基焦磷酸(FPP)和5碳的异戊烯基焦磷酸(IPP)缩合生成20碳的牻牛儿基牻牛儿焦磷酸(GGPP),GGPP是萜类及其类胡萝卜素生物合成的关键前体物质,参见图1。目前,已从细菌、真菌、藻类和高等植物中均发现该基因的存在,参与不同化合物的生物合成。
中国专利CN 101475946A公布了一种丹参牻牛儿基牻牛儿基焦磷酸合成酶基因及其编码的蛋白质和应用,填补了从我国传统中药材丹参中分离克隆出牻牛儿基牻牛儿基焦磷酸合成酶基因的空白。该发明的牻牛儿基牻牛儿基焦磷酸合成酶基因可通过基因工程技术提高丹参中萜类活性成分丹参酮的含量,有助于丹参药材的品质改良,具有很好的应用前景。
中国专利CN 102174563 A公布了一种提高丹参酮含量的方法,用丹参1-脱氧木酮糖-5-磷酸合成酶(SmDXS)和丹参牻牛儿基牻牛儿基焦磷酸合成酶(SmGGPPS)基因构建成SmDXS和SmGGPPS基因的植物双价高效表达载体,遗传转化丹参叶片获得转SmDXS和SmGGPPS基因的丹参毛状根。
上述两篇专利研究的均是丹参中牻牛儿基牻牛儿基焦磷酸合成酶基因,并确认了其可以参与不同化合物的生物合成。而对于西红花中是否具有牻牛儿基牻牛儿基焦磷酸合成酶以及西红花中牻牛儿基牻牛儿基焦磷酸合成酶基因的功能验证目前专利文献中并没有发现。
技术实现要素:
本发明的目的就是为了克服上述现有技术存在的缺陷而提供西红花及西红花内生真菌GGPPS基因、基因克隆方法与应用。
本发明的目的可以通过以下技术方案来实现:
技术方案一:提供西红花内生真菌GGPPS基因、西红花内生真菌GGPPS基因编码的蛋白质及其应用。
西红花内生真菌牻牛儿基牻牛儿基焦磷酸合成酶基因序列,其是如下的基因(a)或基因(b):
基因(a):具有SEQ ID No.3所示的核苷酸序列的基因;
基因(b):由SEQ ID No.3所示的核苷酸序列经过替换、缺失或添加一个或多个碱基而得到的具有牻牛儿基牻牛儿基焦磷酸合成功能的基因。
对于基因(a)而言,从ATG起的795bp到874bp位置包含一个80bp内含子,该基因DNA序列具有SEQ ID No.3所示的核苷酸序列。该基因的cDNA全长序列具有SEQ ID No.1所示的核苷酸序列。
一种西红花内生真菌牻牛儿基牻牛儿基焦磷酸合成酶基因启动子,所述启动子选自以下任意一组并具有启动子功能的核苷酸序列:a、具有SEQ ID No.5所示的核苷酸序列;b、与SEQ ID No.5互补的核苷酸序列。
其中西红花内生真菌生物学名称为Cadophora luteo-olivacea.,其指定名称为3P1CQ1,目前保存在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:CGMCC NO.11606,保藏日期为:2015年11月24日;保藏地址:北京市朝阳区北辰西路1号院3号。
该西红花内生真菌的培养及保存条件为平板保存,培养基条件为:土豆200g,葡萄糖20g,磷酸二氢钾5g,无水硫酸镁1.46g,VB1:10mg,琼脂18g,加单蒸水至1L。
西红花内生真菌GGPPS基因编码的蛋白质,其是如下的蛋白质(a)或蛋白质(b):
蛋白质(a):具有SEQ ID NO.2所示的氨基酸序列的蛋白质;
蛋白质(b):由SEQ ID NO.2所示的氨基酸序列经过替换、缺失或添加一个或多个氨基酸而得到的具有牻牛儿基牻牛儿基焦磷酸合成功能的蛋白质。
西红花内生真菌GGPPS基因克隆方法如下:
首先根据CTAB法提取西红花内生真菌菌丝体基因组DNA,然后在NCBI GenBank中搜索同源属中已报道的GGPPS(Geranylgeranyl pyrophosphate synthase)基因序列,根据同源性设计引物Fg1:5'-AAATCAGTTCTGCGACCTGTTCC-3'和Rg1:5'-CGGTCTTGTTTCCAACCATTTC-3',经PCR扩增得到584bp的GGPPS基因保守片段。根据该584bp基因序列设计3′端和5′端RACE特异引物GSP 1:5'–ATCGCCTTGGGGTTCTTCAGC–3'、GSP2:5'–CGACCTGTTC CAGAGGGCGATTG–3'、GSP3:5'–GCCAGTCTGAATAACCCTCCTGTCTT–3'。运用RACE技术的同源性克隆方法,克隆出GGPPS基因3′端和5′端cDNA基因序列,经序列拼接得到了cDNA的全长序列,如SEQ ID No.1所示。设计ORF酶切引物fGGPPS:5'-GAAGATCTATGTTCCACAGCAACCGCTCAGCAC-3'和rGGPPS:5'-ATAAGAATGCGGC CGCTCA AACAGCCATCTTATCC-3',克隆GGPPS的cDNA和DNA序列,如SEQ ID No.1和SEQ ID No.3所示。生物信息学分析GGPPS基因序列及其编码的氨基酸序列,如SEQ ID No.2所示,初步鉴定该基因。
技术方案二:提供西红花GGPPS基因。
西红花牻牛儿基牻牛儿基焦磷酸合成酶基因,该基因DNA序列没有内含子,与SEQ ID No.1和SEQ ID No.3所述基因ORF序列相同。其cDNA开放阅读框序列具有SEQ ID No.4所示的核苷酸序列。
西红花GGPPS基因的克隆方法如下:
提取西红花柱头基因组DNA和RNA,用西红花内生真菌GGPPS基因的ORF引物fGGPPS:5'-GAAGATCTATGTTCCACAGCAACCGCTCAGCAC-3'和rGGPPS:5'-ATAAGAATGCGGCCGCTCA AACAGCCATCTTATCC-3',克隆西红花GGPPS基因。以西红花柱头的基因组DNA为模板进行PCR,克隆得到西红花GGPPS DNA序列,如SEQ ID No.4所示。用西红花柱头RNA进行反转录合成西红花柱头的RACE-ready cDNA,以西红花柱头的cDNA为模板进行PCR,克隆得到GGPPS的cDNA序列,如SEQ ID No.4所示,即西红花编码区cDNA序列和西红花GGPPS基因组DNA序列相同。
西红花与西红花内生真菌的GGPPS核酸序列比较,两者间序列高度相似,其中开放阅读框序列达到100%相同。
技术方案三:提供西红花内生真菌GGPPS基因的功能验证。
通过构建表达载体pTRC-CSEFggpps,导入携带pACCAR25△crtE质粒的宿主XL1-Blue细胞,经颜色遗传互补反应,证明该基因表达蛋白具有酶催化活性,可 催化GPP和IPP合成GGPP(C20)。
GGPPS原核表达体系的构建和GGPPS功能验证方法如下:
首先用质粒抽提试剂盒对pTRC-IPI和pMD18T-CSEFggpps进行质粒抽提,用BglⅡ、NotⅠ两个内切酶同时对pMD18T-CSEFggpps质粒和pTRC-IPI质粒完成双酶切。胶回收pTRC空载体(约3.7kb)和ggpps基因(约1239bp),用T4连接酶进行pTRC空载和ggpps基因的连接,转化XL1-Blue感受态细胞,从而获得了携带pTRC-CSEFggpps质粒的XL1-Blue工程菌。然后用质粒抽提试剂盒对携带pTRC-CSEFggpps质粒的XL1-Blue菌株进行质粒抽提,得到质粒pTRC-CSEFggpps。利用颜色互补(color complementation)原理,将携带西红花内生真菌ggpps基因的表达载体pTRC-CSEFggpps通过热激活转化到携带来自Erwinia herbicola上的一系列类胡萝卜途径相关基因(包括crtB、crtI、crtX、crtY、crtZ)的表达载体pACCAR25△crtE的XL1-Blue感受态细胞中,涂布到双抗LB平板,再通过筛选产黄色物质的阳性克隆,即获得了携带双质粒:载体pTRC-CSEFggpps和pACCAR25△crtE的XL1-Blue重组工程菌。大肠杆菌工程菌完成从crtE到crtX的酶代谢,形成玉米黄素(黄色物质),验证了GGPPS编码的蛋白具有典型GGPPS的酶催化功能。
西红花内生真菌牻牛儿基牻牛儿基焦磷酸合成酶基因或西红花牻牛儿基牻牛儿基焦磷酸合成酶基因在细菌、真菌、藻类和高等植物中通过基因工程的手段参与合成萜类化合物、赤霉素或维生素E,所述的萜类化合物包括类胡萝卜素。或,西红花内生真菌牻牛儿基牻牛儿基焦磷酸合成酶基因或西红花牻牛儿基牻牛儿基焦磷酸合成酶基因的核苷酸序列突变的应用。
本发明提供了西红花内生真菌以及西红花GGPPS的基因序列以及其编码的蛋白质,同时还提供了西红花内生真菌GGPPS基因的功能验证。通过构建表达载体pTRC-CSEFggpps,导入携带pACCAR25△crtE质粒的宿主XL1-Blue细胞,经颜色遗传互补反应,证明该基因表达蛋白具有酶催化活性,可催化GPP和IPP合成GGPP(C20)。
附图说明
图1为牻牛儿基牻牛儿焦磷酸合成及应用技术路线图;
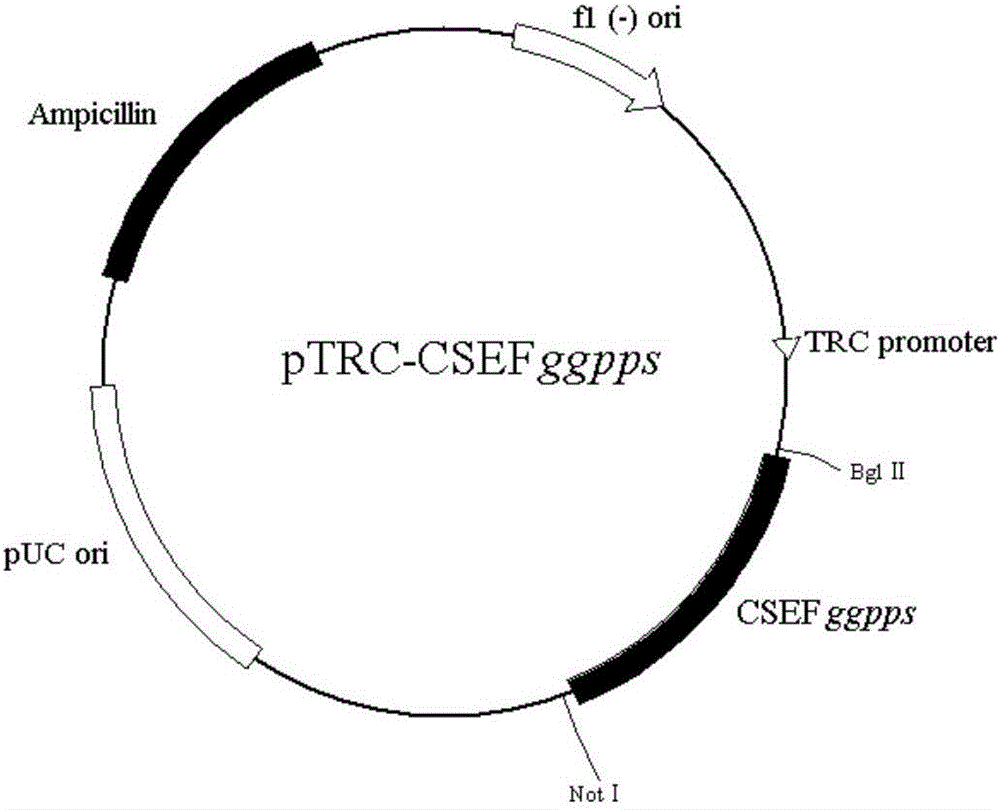
图2为GGPPS基因表达载体pTRC-CSEFggpps构建示意图;
图3为大肠杆菌XL1-Blue细胞中通过颜色互补验证GGPPS功能结果图。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。
实施例1西红花内生真菌总RNA的提取
西红花内生真菌生物学名称为Cadophora luteo-olivacea.,其指定名称为3P1CQ1,目前保存在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:CGMCC NO.11606,保藏日期为:2015年11月24日;保藏地址:北京市朝阳区北辰西路1号院3号。该西红花内生真菌的培养及保存条件为平板保存,培养基条件为:土豆200g,葡萄糖20g,磷酸二氢钾5g,无水硫酸镁1.46g,VB1:10mg,琼脂18g,加单蒸水至1L。
取适量西红花内生真菌菌丝体放入预冷的研钵中,倒入液氮,迅速研磨至粉末状,加入1ml RNAiso Plus,按上海生工的Total RNA提取试剂盒所提供方法进行裂解提取其总RNA。然后用琼脂糖凝胶电泳鉴定RNA质量。
实施例2西红花内生真菌GGPPS保守片段的克隆
用CTAB法提取西红花内生真菌菌丝体基因组DNA作为模板,用保守区域设计引物Fg1:5'-AAATCAGTTCTGCGACCTGTTCC-3'和Rg1:5'-CGGTCTTGTTTCCAACCATTTC-3'进行PCR扩增,扩增的反应体系如下:Template 1μL,引物Fg1(20μM)和Rg1(20μM)各0.5μL,Takara Premix Taq 25μL,ddH2O 22μL,PCR扩增条带经胶回收、连接和转化DH5α感受态细胞后送测序,得到GGPPS保守片段序列。
实施例3西红花内生真菌GGPPS基因3′端克隆
根据GGPPS保守片段序列设计3′RACE(rapid-amplification of cDNA ends,RACE)的特异引物GSP2:5'–CGACCTGTTC CAGAGGGCG ATTG–3'。然后用SMART RACE cDNA Amplification Kit(CLONTECH,USA)提供的实验方案经反转录合成3′-RACE cDNA和5′-RACE cDNA。3′-RACE的PCR反应体系:Template(3′-RACE cDNA)4μL,引物Long UP(4μM)1μL,引物Short UP(20μM)1μL,引物GSP2(20μM)1μL,10×Buffer 5μL,dNTP(2.5mM each)4μL,Taq DNA聚合酶25μL,ddH2O 9μL,PCR扩增条件:94℃预变性5min;94℃变性30s,72℃延伸3min,5个循环;94℃变性30s,70℃退火30s,72℃延伸2min,5个循环;94℃变性30s,68℃退火30s,72℃延伸2min,25个循环;最后72℃延 伸5min,4℃保温。PCR产物经连接到pMD 18-T Vector上,转化DH5α感受态细胞,挑选阳性克隆,经菌液PCR检测后送测序得3′端的基因序列。
实施例4西红花内生真菌GGPPS基因5′端克隆
根据GGPPS保守片段序列设计5′RACE的特异引物GSP1:5'–ATCGCCTTGGGGTTCTTCAGC–3',GSP3:5'–GCCAGTCTGAATAACCCTCCTGTCTT–3'。5′-RACE的第一轮PCR反应体系:Template(5′-RACE cDNA)0.5μL,引物Long UP(4μM)0.5μL,引物Short UP(20μM)0.5μL,引物GSP3(20μM)0.5μL,10×Buffer 2.5μL,dNTP(2.5mM each)2μL,Takara Premix Taq25μL,ddH2O 18.5μL,PCR扩增条件:94℃预变性5min;94℃变性30s,72℃延伸2min,5个循环;94℃变性30s,70℃退火30s,72℃延伸90s,5个循环;94℃变性30s,68℃退火30s,72℃延伸90s,25个循环;最后72℃延伸5min,4℃保温。第二轮PCR扩增:Template(第一轮PCR产物稀释20倍)1μL,引物LongUP(4μM)1μL,引物Short UP(20μM)1μL,引物GSP1(20μM)1μL,Takara Premix Taq 20μL,ddH20 26μL,PCR扩增条件为:94℃预变性5min;94℃变性30s,68℃退火30s,72℃延伸70s,5个循环;94℃变性30s,66℃退火30s,72℃延伸70s,5个循环;94℃变性30s,64℃退火30s,72℃延伸70s,30个循环;最后72℃延伸5min,4℃保温。PCR产物经连接到pMD 18-T Vector上,转化DH5α感受态细胞,挑选阳性克隆,经菌液PCR检测后送测序得5′端的基因序列。
实施例5西红花内生真菌GGPPS的cDNA克隆
根据克隆得到的3′端RACE和5′端RACE的cDNA基因序列,进行序列拼接得到cDNA全长序列信息,根据这条序列设计带酶切位点的两条引物fGGPPS:5'-GAAGATCTATGTTCCACAGCAACCGCTCAGCAC-3'和rGGPPS:5'-ATAAGAATGCGGCCGCTCA AACAGCCATCTTATCC-3',用高保真酶扩增ORF序列。PCR反应液组成:Template(cDNA)0.5μL,引物fGGPPS(10μM)0.75μL,引物rGGPPS(10μM)0.75μL,10×PCR Buffer 2.5μL,2mM dNTPs 2.5μL,25mM MgSO4 1.5μL,KOD-Plus-Neo酶0.5μL,ddH2O 16μL,PCR扩增程序用两步法PCR循环:94℃预变性5min;94℃变性15s,68℃退火延伸90s,35个循环;最后72℃延伸5min。扩增反应完成后,电泳回收纯化,进行末端加A反应。回收纯化PCR产物后的DNA作为模板,在微管中配制以下反应液:Template(回收纯 化后的DNA)10μL,10×PCR buffer 2μL,dATP 3μL,Taq DNA聚合酶0.25μL,ddH20 4.75μL,将配制好的反应液置于72℃反应30分钟(PCR仪上)。反应结束后,产物回收、连接,获得携带西红花内生真菌GGPPS基因的pMD-18T质粒,该质粒命名为pMD-18T-CSEFggpps,转化大肠杆菌后,获得了携带ggpps的pMD-18T-CSEF ggpps质粒重组子。测序后,与3′RACE和5′RACE的拼接结果结合,得西红花内生真菌GGPPS的的cDNA全长序列。该基因的cDNA全长为1888bp,具有1215bp(从423bp位置到1638bp位置)的开放阅读框,如SEQ ID No.1所示;编码404个氨基酸残基蛋白,如SEQ ID No.2所示。在NCBI数据库上进行核苷酸序列和蛋白质序列的BLAST,发现该基因在氨基酸水平上与其他物种中的GGPPS有较高的同源性,同时具有属于异戊二烯生物合成酶超家族(Isoprenoid Biosynthesis Superfamily)的结构域特征。
实施例6西红花内生真菌GGPPS的基因克隆
以西红花内生真菌的基因组DNA为模板,反应液配制如下:Template 0.5μL,引物fGGPPS(10μM)0.75μL,引物rGGPPS(10μM)0.75μL,10×PCR Buffer 2.5μL,2mM dNTPs 2.5μL,25mM MgSO4 1.5μL,KOD-Plus-Neo酶0.5μL,ddH2O16μL,扩增程序用的是两步法:94℃预变性5min;94℃变性15s,68℃退火延伸90s,35个循环;最后72℃延伸5min。扩增反应完成后,进行电泳、回收,进行加A反应。电泳完后,进行回收、连接、转化、测序,得到西红花内生真菌GGPPS的基因序列。该基因DNA序列长度为1295bp,与其cDNA序列相比较,从ATG开始算起的795bp位置到874bp位置多一个80bp内含子,如SEQ ID No.3所示。
实施例7西红花GGPPS的cDNA和基因组DNA克隆
提取西红花柱头基因组DNA和RNA,用西红花内生真菌GGPPS基因的引物fGGPPS、rGGPPS克隆西红花基因组DNA进行GGPPS基因全长。以西红花柱头的基因组DNA为模板,PCR反应液如下:
Template 2μL,引物fGGPPS(10μM)0.5μL,引物rGGPPS(10μM)0.5μL,10×PCR Buffer 2.5μL,dNTPs 4μL,LA Taq聚合酶0.25μL,ddH2O 15.25μL,扩增程序用的是两步法:94℃预变性5min;94℃变性15s,68℃退火延伸90s,35个循环;最后72℃延伸5min。扩增反应完成后,进行电泳、回收和加A反应。电泳完后,进行回收、连接、转化、测序。用西红花RNA反转录合成西红花柱头的 RACE-ready cDNA,以西红花柱头的cDNA为模板,PCR反应液如下:Template0.5μL,引物fGGPPS(20μM)0.5μL,引物rGGPPS(20μM)0.5μL,2×PCR Buffer for KOD FX 12.5μL,2mM dNTPs 5μL,KOD-FX聚合酶0.5μL,ddH2O 5.5μL,PCR扩增程序用两步法循环:94℃预变性5min;94℃变性15s,68℃退火延伸2min,45个循环;最后72℃延伸5min。扩增反应完成后,进行电泳、回收和加A反应。电泳完后,进行回收、连接、转化、测序。得到1215bp的西红花编码区cDNA序列和同样序列的基因组DNA序列,说明西红花GGPPS基因没有内含子结构,如SEQ ID No.4所示,该基因具有SEQ ID NO.1序列所示开放阅读框,编码SEQ ID NO.2所示的氨基酸序列。通过DNAMAN软件的序列比对,西红花与其内生真菌的GGPPS进行核酸序列的比较,发现两者间GGPPS核酸序列相似度很高,其中开放阅读框的cDNA序列相似度达到100%,如图1所示,说明内生真菌GGPPS与其宿主植物西红花的GGPPS可能是同源的。
实施例8西红花内生真菌GGPPS基因功能验证
1.GGPPS原核表达体系的构建:
首先用质粒抽提试剂盒对pTRC-IPI和pMD18T-CSEFggpps进行质粒抽提,用BglⅡ、NotⅠ这两个内切酶同时对pMD18T-CSEFggpps质粒和pTRC-IPI质粒完成双酶切。双酶切反应体系为:BglⅡ(10U/μL)0.5μL,NotⅠ(10U/μL)0.5μL,质粒20μL,10×H Buffer 5μL,0.1%BSA 5μL,ddH2O 19μL,37℃水浴3h。反应完成后加入适量的10×loading Buffer停止反应。电泳检测后,胶回收pTRC空载体(约3.7kb)和ggpps基因(约1239bp)。用T4连接酶进行pTRC空载和ggpps基因的连接反应,反应体系:10×T4DNA ligase buffer 2.5μL,CSEFggpps DNA10μL,pTRC空载体DNA11.5μL,T4DNA ligase 1μL,将反应液置于16℃过夜连接。取连接液转化XL1-Blue感受态细胞涂布平板后,挑单克隆,验证后即获得了携带pTRC-CSEFggpps质粒的XL1-Blue工程菌,如图2所示。
2.pTRC-CSEFggpps和pACCAR25△crtE双质粒的XL1-Blue重组工程菌的构建
首先用CaCl2重悬法制备携带pACCAR25△crtE质粒的XL1-Blue感受态细胞,然后用质粒抽提试剂盒对携带pTRC-CSEFggpps质粒的XL1-Blue菌株进行质粒抽提,得到质粒pTRC-CSEFggpps。取10μL的pTRC-CSEFggpps质粒DNA通过热激活转化200μL的携带pACCAR25△crtE的XL1-Blue感受态细胞,涂布含 Amp(50μg/mL)和Cm(25μg/mL)的双抗LB平板。37℃过夜倒置培养12h,筛选阳性克隆进行颜色互补验证,即获得了携带双质粒:载体pTRC-CSEFggpps和pACCAR25△crtE的XL1-Blue重组工程菌。
3.颜色反应遗传互补平板的制备
准备一个划分为五块区域的LB双抗平板(Amp 50μg/mL+Cm 25μg/mL),挑取不携带质粒的XLI-Blue细菌(培养在未加抗生素的LB平板)、携带pTRC-CSEFggpps质粒的XLI-Blue细菌(培养在含50mg/L Amp的LB平板)、携带pACCAR25△crtE质粒的XLI-Blue细菌(培养在含25mg/L Cm的LB平板)、携带pTRC+pACCAR25△crtE质粒的XLI-Blue细菌(培养在含50mg/L Amp和25mg/L Cm的LB平板)、携带pTRC-CSEFggpps+pACCAR25△crtE双质粒的单菌落(培养在含50mg/L Amp和25mg/L Cm的LB平板),在各自划分区域上点呈三角形的10个点,28℃倒置暗培养约2天,获得颜色反应遗传互补平板。在LB双抗平板上(如图3所示):XLI-Blue细菌,由于不带有抗性基因,所以不能生长;携带pTRC-CSEFggpps质粒的XLI-Blue细菌,含有Cm抗性基因,但没有Amp抗性基因,所以也不能生长;只携带pACCAR25△crtE质粒的XLI-Blue细菌,含有Amp抗性基因,但没有Cm抗性基因,所以也不能生长;携带pTRC和pACCAR25△crtE质粒的XLI-Blue细菌,含有Cm和Amp抗性基因,所以能生长,但没有GGPPS基因,不能合成玉米黄素,显示白色菌落;而携带pTRC-CSEFggpps和pACCAR25△crtE双质粒的重组工程菌,既能在LB双抗平板生长,又能合成玉米黄素,显示出橘黄色的菌落,表明了大肠杆菌工程菌可以完成从crtE到crtX的酶代谢,形成玉米黄素(黄色物质,图3中右边三角区域,由于突片为黑白图,在图中显示出黄色,但是其实际颜色为黄色),验证了该西红花内生真菌GGPPS编码的蛋白具有典型GGPPS的酶催化功能。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种参与丹参酮合成的2‑酮戊二酸依赖性双加氧酶基因克隆鉴定及应用的制造方法与工艺
- 汉坦病毒S基因克隆、表达、单克隆抗体的制备方法及其应用与制造工艺
- 斯氏副柔线虫半胱氨酸蛋白酶抑制剂Pj_CPI基因克隆、重组表达方法及应用与制造工艺
- 一种单链核酸分子、聚合酶活性测定方法及试剂盒与制造工艺
- 一种柞蚕血液DNA提取方法与制造工艺
- 一种检测CYP2C9基因多态性的ARMS引物的制造方法与工艺
- 与桃树矮化基因紧密连锁的SNP标记的应用的制造方法与工艺
- 一种新型基因克隆T‑载体及其构建方法和应用与制造工艺
- 一种青稞RPL11cDNA基因的反转录PCR方法及其PCR扩增和重组表达方法与制造工艺
- 一种植物单染色体的显微分离方法与制造工艺