一种提高核酸提取率的磁珠组合物及其应用的制作方法
本发明属于分子生物技术领域,具体涉及一种提高核酸提取率的磁珠组合物及其应用。
背景技术:
超顺磁性纳米磁珠是由Senyei A E在1978年首先研制出来的一种新型的功能性材料,发展至今,在细胞分选、蛋白质纯化、核酸提取、细菌检测、免疫分析等不同领域应用广泛。其中,在核酸提取领域,超顺磁性纳米磁珠实现了生物科学和纳米材料学的结合,是核酸提取纯化技术创新的一次重大突破。
超顺磁性纳米磁珠粒径位于纳米级范围,在磁场的存在下能够迅速聚集,离开磁场能够均匀分散,通过其表面活性基团的性质,在外磁场的作用下轻松实现与核酸的可逆性结合与分离。磁性微珠颗粒拥有比表面积大、沉降慢、磁响应快等传统核酸提取纯化方法无法比拟的优势,能够轻松实现自动化、操作简单、时间短、安全无毒、提取效率高等,使得磁珠法快速发展为一种简单高效的核酸提取、纯化及回收方法,能够快速地从全血、血浆、干血斑、口腔脱落上皮细胞、病原微生物、土壤、食品等中提取、纯化或回收核酸。
现有技术中磁珠法提取核酸的一般流程为:样本裂解、磁珠与核酸结合、杂质清洗和核酸洗脱四个步骤。其中,样本裂解常采用盐酸胍、蛋白酶K、异硫氰酸胍、碘化钠、碘化钾、曲拉通(Triton X-100),壬基酚聚氧乙烯醚(NP-40),吐温-20(Tween-20)等成分。但是,这些多成分的裂解液会影响磁珠溶液与核酸的结合效率,且后续清洗不彻底,会残留一些少量的杂质(如蛋白质、多糖、脂肪等),纯化效果不理想,同时,在提取痕量核酸的回收率时更是低于80%。
由此可见,现有技术还存在较大不足。
技术实现要素:
鉴于此,有必要针对上述的问题,提供一种能提高核酸提取率,尤其是痕量核酸的提取率的磁珠组合物,以及运用该组合物提取核酸的方法。
为实现上述目的,本发明采用如下技术方案:
一种用于核酸提取的磁珠组合物,包括下列浓度组份:
进一步的,所述组合物,包括下列浓度组份:
进一步的,所述纳米磁珠为超顺磁性纳米级双壳氧化硅羧基磁珠;所述磁珠结构由内至外依次为:聚苯乙烯核仁、第一层聚苯乙烯密封的磁铁圈、第二层聚苯乙烯密封的磁铁圈、包被羧基。
进一步的,所述磁珠直径大小为100-1000nm。
进一步的,所述磁珠的羧基密度2.5-5μM/mg。
进一步的,所述磁珠聚苯乙烯核仁体积小,质量小,沉降速度缓慢,悬浮时间长。
进一步的,所述磁珠组合物在核酸提取中的应用。
进一步的,将所述组合物应用于核酸提取;包括以下步骤:
(1)磁珠溶液的分装:将所述磁珠溶液分装到无核酸酶的离心管中;
(2)混样:将样本核酸溶液短暂离心后,转移至(1)所得装有磁珠溶液的离心管中,混匀,离心;
(3)吸弃上清液:将(2)所得混合液置于磁力架上静置,吸弃上清液;
(4)洗涤:向(3)所得磁珠中加入洗涤液洗涤,置于磁力架上静置,吸弃洗涤液,室温干燥;
(5)洗脱:向(4)所得磁珠中加入10mM Tris-HCl(pH 8.0),混匀,离心,置于磁力架上至溶液澄清,转移上清液即得。
进一步的,所述组合物应用于样本核酸定向提取,包括以下步骤:
(1)样本核酸溶液分装:分装核酸溶液至无核酸酶的离心管中;
(2)一次混样:向(1)所得核酸溶液管中加入所述磁珠溶液,混匀,离心;
(3)转移上清液:将(2)所得混合液置于磁力架上静置,转移上清液至无核酸酶的离心管中;
(4)二次混样:向(3)中所得的上清液管中加入所述磁珠溶液,混匀,离心;
(5)吸弃上清液:将(4)所得混合液静置于磁力架上静置,吸弃上清液;
(6)洗涤:向(5)所得磁珠中加入洗涤液洗涤,置于磁力架上静置,吸弃洗涤液,室温干燥;
(7)洗脱:向(6)所得磁珠中加入10mM Tris-HCl,混匀,离心,置于磁力架上至溶液澄清,转移上清液即得。
本发明有益效果:
本发明所提供的磁珠溶液,磁珠为超顺磁性纳米级双壳氧化硅羧基磁珠,该磁珠有两层磁铁圈,聚苯乙烯核仁体积小,磁珠质量小,没有磁场的作用时,沉降速度缓慢,悬浮时间长,在磁场的作用下,能够以普通磁珠磁响应性2倍速度迅速聚集,瞬时完成磁珠与溶液的彻底分离,提高磁珠提取核酸的效率,同时,磁珠表面充足的羧基基团最大限度地结合样本中的目标核酸分子,提高核酸提取的效率,尤其是痕量核酸的提取率,优势更为明显;本发明的组合物中磁珠直径大小为100-1000nm,羧基密度2.5-5μM/mg,较小的磁珠质量及充足的羧基集团能够使羧基磁珠在悬浮的状态最大限度地结合样本中的核酸分子,提高结合效率;同时,该磁珠在超声波、干燥、极限pH值环境下依然有很好的稳定性。
本发明所提供的磁珠溶液,还通过调控组分浓度,尤其是调控聚乙二醇8000和NaCl的浓度,改变所述磁珠溶液疏水及盐溶液环境,以实现提高磁珠与核酸之间的结合效率,提高核酸的提取率。含有所述浓度组分的磁珠溶液在上述聚乙二醇8000和NaCl的浓度环境下,聚乙二醇8000能够消除核酸表面的水化层,使带负电荷的磷酸基团暴露出来,被NaCl提供的带正电的Na+中和,有效地屏蔽了磷酸基团之间的静电斥力,疏水作用增强,提高了核酸分子与磁珠表面的羧基集团结合能力;相反,调控组分的浓度使溶液在亲水及低盐环境下,核酸与磁珠表面的羧基集团发生解离,获得纯化的核酸样本。
本发明的磁珠溶液能够增强羧基磁珠与核酸的吸附效率,大大提高提取率,尤其是痕量核酸样本的提取,优势更为明显;同时,本发明提供的磁珠溶液不仅能维持溶液中核酸稳定性,使核酸与磁珠在不同条件下吸附与解吸附快速进行,提高核酸的提取效率,还缩短了操作时间,容易实现自动化。
附图说明
图1两种磁珠溶液提取的建库产物和纯化前建库产物电泳比较图;其中,M:Marker;1:测序建库产物纯化前;2:本发明磁珠组合物纯化;3:市售磁珠纯化。
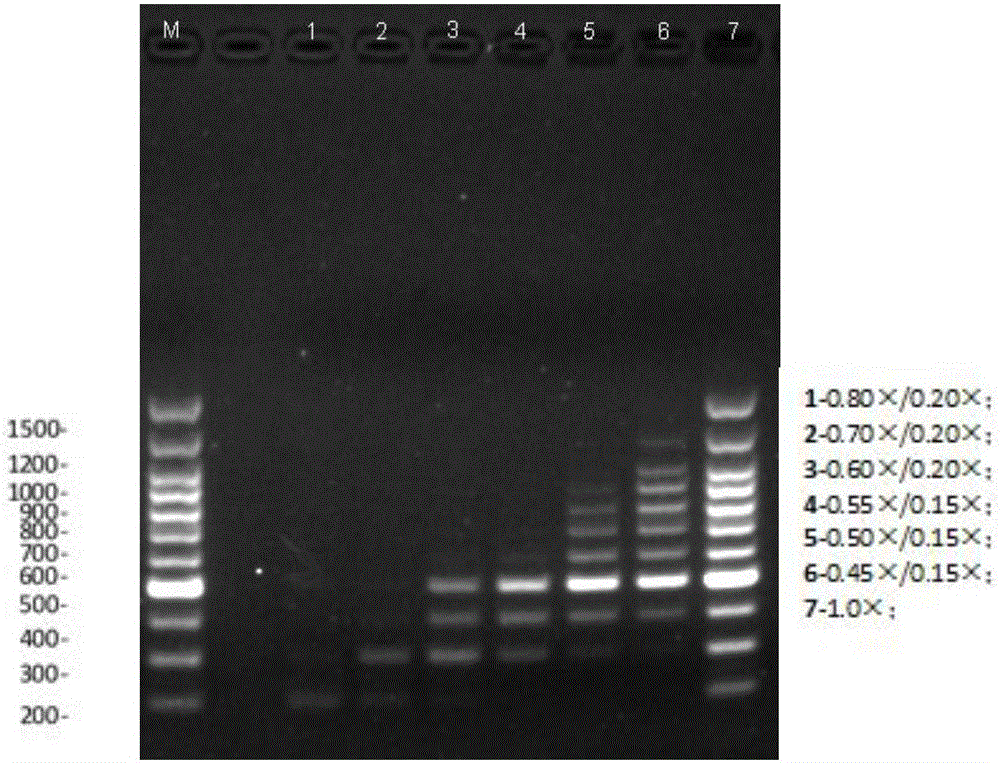
图2两种磁珠溶液定向提取Marker(200bp-700bp)条带电泳比较图。M:Marker;1-7为样本磁珠体积比:1:0.80×/0.2×;2:0.70×/0.2×;3:0.60×/0.2×;4:0.55×/0.15×;5:0.50×/0.15×;6:0.45×/0.15×;7:1.0×。
图3本发明磁珠组合物提取核酸的操作示意图。
图4本发明组合物中纳米磁珠的结构示意图。
图5本发明磁珠溶液和市售磁珠溶液沉降对比图(左:市售磁珠溶液;右:本发明磁珠溶液)。
具体实施方式
为了更好地说明本发明所解决的问题、所采用的技术方案和所达到的效果,现结合具体实施例和附图进一步阐述。需要说明的是,本发明内容包含但不限于以下实施例及其组合实施方式。
实施例1一种提高核酸提取率的磁珠组合物
组成成分及浓度:
1mg/ml磁珠、0.022mol/L聚乙二醇8000、2.2mol/L氯化钠、0.5mol/L乙二胺四乙酸溶液、10mol/L三羟甲基氨基甲烷溶液、超纯水余量。
配制方法:
根据配置总量和各组分浓度计算各组分用量;按计算结果备料,使用万分之一天平分别称取1.76g聚乙二醇8000,1.287g氯化钠,1.46g乙二胺四乙酸,0.012g三羟甲基氨基甲烷于50mL干净烧杯中,加入5mL超纯水后将烧杯置于55℃水浴上辅助溶解,待所有固体溶解溶液变澄清后,将烧杯内容物转移至10mL容量瓶,使用1mL移液器吸入干净的超纯水清洗烧杯内液体残留物,再次转移至容量瓶,重复两次。同时,取混匀200μl悬浮的50mg/mL磁珠母液加入10mL容量瓶中,超纯水定容至10mL。
实施例2一种提高核酸提取率的磁珠组合物
组成成分及浓度:
1mg/ml磁珠、0.024mol/L聚乙二醇8000、2.5mol/L氯化钠、0.5mol/L乙二胺四乙酸溶液、10mol/L三羟甲基氨基甲烷溶液、超纯水余量。
配制方法:
根据配置总量和各组分浓度计算各组分用量;按计算结果备料,使用万分之一天平分别称取1.92g聚乙二醇8000,1.5g氯化钠,1.46g乙二胺四乙酸,0.012g三羟甲基氨基甲烷于50mL干净烧杯中,加入5mL超纯水后将烧杯置于55℃水浴上辅助溶解,待所有固体溶解溶液变澄清后,将烧杯内容物转移至10mL容量瓶,使用1mL移液器吸入干净的超纯水清洗烧杯内液体残留物,再次转移至容量瓶,重复两次。同时,取混匀200μl悬浮的50mg/mL磁珠母液加入10mL容量瓶中,超纯水定容至10mL。
实施例3一种提高核酸提取率的磁珠组合物
组成成分及浓度:
1mg/ml磁珠、0.025mol/L聚乙二醇8000、2.5mol/L氯化钠、1mol/L乙二胺四乙酸溶液、15mol/L三羟甲基氨基甲烷溶液、超纯水余量。
配制方法:
根据配置总量和各组分浓度计算各组分用量;按计算结果备料,按计算结果备料,使用万分之一天平分别称取2g聚乙二醇8000,1.5g氯化钠,2.92g乙二胺四乙酸,0.018g三羟甲基氨基甲烷于50mL干净烧杯中,加入5mL超纯水后将烧杯置于55℃水浴上辅助溶解,待所有固体溶解溶液变澄清后,将烧杯内容物转移至10mL容量瓶,使用1mL移液器吸入干净的超纯水清洗烧杯内液体残留物,再次转移至容量瓶,重复两次。同时,取混匀200μl悬浮的50mg/mL磁珠母液加入10mL容量瓶中,超纯水定容至10mL。
实施例4测序建库产物中核酸提取
采用实施例1混合的磁珠溶液,运用本发明提供的提取方法对测序建库产物进行如下步骤地提取操作:
磁珠溶液的分装:将配制好的磁珠溶液分装到无核酸酶的1.5ml离心管中。所述磁珠溶液的用量根据需要提取核酸片段长度在30-100μl之间任选。
混样:将扩增完成的测序建库产物混匀,短暂离心,转移至上述装有磁珠溶液的无核酸酶1.5mL离心管中。涡旋混匀5s,瞬时离心5s。所述测序建库产物的用量根据用户需要在10~50μl之间任选。所述测序建库产物由酶混合物、特异引物、通用引物、核酸模板、无核酸酶水混匀,通过一步法建库所得。
吸弃液体:将上述离心管放置到八孔磁力架上,静置30s,用移液器在磁珠对侧吸弃上清。
洗涤:从八孔磁力架上取下1.5mL离心管,向每管加入150-200μl 70%体积浓度的乙醇溶液,重新放置到八孔磁力架上,静置30s,直接用移液器吸弃洗涤液。室温干燥2min。
洗脱:从八孔磁力架上取下1.5mL离心管,向每个1.5mL离心管中加入10mM Tris-HCl,涡旋混匀5s,瞬时离心5s。重新放置到八孔磁力架上,静置30s,直至溶液澄清,转移上清即可获得纯化后的核酸样品。所述洗脱缓冲液10mM Tris-HCl溶液的用量根据需要在20~100μl之间任选。
分别使用实施例1中配制的纳米磁珠溶液和市售磁珠提取液,按照上述实施例4的方法进行测序建库产物核酸提取,提取的样本量为12.5μl,洗脱体积为20μl,实验结果如表1所示。分别各取5μl提取好的核酸溶液和纯化前的建库产物溶液进行浓度测定,并进行1.5%琼脂糖凝胶电泳,结果如图1所示。
表1提取测序建库产物中核酸的浓度和纯度
在本发明的实施例4中,使用本发明建立的磁珠溶液及其提取方法,聚乙二醇8000为磁珠与核酸的结合创造了疏水环境,NaCl为磁珠与核酸的结合创造了高盐环境,大大增强了羧基磁珠与核酸分子之间的亲和力,提高核酸的提取率。将其实验结果与采用某市场上现有的磁珠提取试剂的试验结果进行比较,使用本发明磁珠溶液与市售的知名度较高的同类产品对比,结合表1和图1所示,提取本发明的磁珠溶液提取的测序建库产物核酸总量优于现有的磁珠核酸提取液。
实施例5痕量DNA提取
采用实施例2混合的磁珠溶液,运用本发明提供的提取方法对样本进行如下步骤地提取操作:
磁珠溶液的分装:将配制好的磁珠溶液分装到无核酸酶的1.5mL离心管中。所述磁珠溶液的用量在80-100μl之间任选。
混样:将待提取总量为2ng的50μl核酸样本短暂离心,转移至上述装有磁珠溶液的无核酸酶1.5mL离心管中。涡旋混匀5s,瞬时离心5s。
吸弃上清:将上述离心管放置到八孔磁力架上,静置30s,用移液器在磁珠对侧吸弃上清。
洗涤:从八孔磁力架上取下1.5mL离心管,向每管加入150-200μl 70%体积浓度的乙醇溶液,重新放置到八孔磁力架上,静置30s,直接用移液器吸弃洗涤液。室温干燥2min。
洗脱:从八孔磁力架上取下1.5mL离心管,向每个1.5mL离心管中加入10mM Tris-HCl,涡旋混匀5s,瞬时离心5s。重新放置到八孔磁力架上,静置30s,直至溶液澄清,转移上清即可获得纯化后的DNA样品。所述洗脱缓冲液10mM Tris溶液的用量根据需要在10~20μl之间任选。
分别使用实施例2中配制的纳米磁珠溶液,按照实施例5的方法进行样本DNA的提取,对照试剂选用市售磁珠溶液。提取的样本量为50μl,洗脱体积为20μl。实验结果如表2,使用本发明磁珠溶液与市售的知名度较高的同类产品对比,提取相同DNA含量的效率优于市售产品。
表2本发明磁珠溶液与市售磁珠溶液提取得DNA浓度和纯度
在本发明的实施例5中,使用本发明建立的磁珠溶液及其提取方法,磁珠溶液中双壳羧基磁珠质量小,沉降速度慢,悬浮时间长,能充分地结合溶液中的核酸分子,将其实验结果与采用市售磁珠溶液的试验结果进行比较,如表2所示,结果表明,本发明的磁珠溶液提取痕量核酸回收率优于市售磁珠溶液。
实施例6定向提取Marker中200~700bp DNA片段
采用实施例3混合的磁珠溶液,运用本发明提供的提取方法对Marker(100bp-1500bp)中200~700bp DNA片段进行如下步骤地提取操作:
DNA溶液分装:分装50μl DNA溶液至无核酸酶的1.5mL离心管中。
一次混样:向上述DNA溶液管中加入实施例1混合的磁珠溶液。涡旋混匀5s,瞬时离心5s。所述磁珠溶液体积为0.7~0.9倍DNA溶液体积。
转移上清:将上述离心管放置到八孔磁力架上,静置30s,用移液器在磁珠对侧转移上清至另一无核酸酶的离心管中。
二次混样:向上述所得的上清液管中再次加入实施例1混合的磁珠溶液。涡旋混匀5s,瞬时离心5s。所述磁珠溶液体积为0.15~0.2倍DNA溶液体积。
吸弃上清:将上述离心管放置到八孔磁力架上,静置30s,用移液器在磁珠对侧吸弃上清。
洗涤:从八孔磁力架上取下1.5mL离心管,向每管加入150-200μl 70%体积浓度的乙醇溶液,重新放置到八孔磁力架上,静置30s,直接用移液器吸弃洗涤液。室温干燥2min。
洗脱:从八孔磁力架上取下1.5mL离心管,向每个1.5mL离心管中加入10mM Tris-HCl,涡旋混匀5s,瞬时离心5s。重新放置到八孔磁力架上,静置30s,直至溶液澄清,转移上清即可获得纯化后的DNA样品。所述洗脱缓冲液10mM Tris-HCl溶液的用量根据需要在50~100μl之间任选。
分别使用实施例1中配制的纳米磁珠溶液,按照上述的方法进行Marker中200~700bp片段的提取。同样的操作步骤,不同的样本溶液与磁珠溶液的体积比时,与磁珠结合的核酸片段长度不同,利用此原理对不同长度的核酸片段进行定向提取。
表3定向提取不同DNA长度对应的样本溶液与磁珠溶液体积比
提取完成后,分别取5μl DNA溶液进行浓度测定,并进行1.5%琼脂糖凝胶电泳,结果如图2所示。
在本发明的实施例6中,使用本发明建立的磁珠溶液及其提取方法,通过调节磁珠溶液与样本体积比来改变溶液中的Na+浓度,影响羧基磁珠与核酸之间的亲和力,进而筛选不同片段大小的核酸分子。如图2所示电泳结果表明,本发明的磁珠溶液能够定向提取不同长度核酸提取物。
实施例7磁珠组合物中磁珠沉降性能验证
采用实施例1混合的磁珠溶液与市售磁珠溶液沉降性能进行对比,所述磁珠沉降性能验证,按照如下步骤操作:
磁珠溶液分装:分装本发明及市售磁珠溶液各800μl至无核酸酶的2mL离心管中。
涡旋混匀:将两管磁珠溶液分别涡旋混匀,向上置于离心管板上静置。
间隔拍照:每0min、1min、3min、5min、10min对两管磁珠溶液进行拍照,记录磁珠沉降情况。
在本发明的实施例7中,实验结果如图5,使用本发明建立的磁珠溶液,磁珠有两层磁铁圈,聚苯乙烯核仁体积小,磁珠质量小,没有磁场的作用时,沉降速度缓慢,悬浮时间长,使用本发明磁珠溶液与市售的知名度较高的同类产品对比,本发明磁珠溶液涡旋混匀后沉降缓慢,性能明显优于市售产品。
本发明所提供的磁珠溶液,通过调控组分浓度,主要是聚乙二醇8000和NaCl的浓度,改变所述磁珠溶液疏水及盐溶液环境,以实现提高磁珠与核酸之间的结合效率,提高核酸的提取率。含有所述含量组分的磁珠溶液处于疏水且高盐环境,核酸表面的水化层被消除,电荷层被破坏,使带负电荷的磷酸基团暴露出来,被NaCl提供的带正电的Na+中和,有效地屏蔽了磷酸基团之间的静电斥力,疏水作用增强,提高了核酸分子与磁珠表面的羧基集团结合能力;相反,调控组分的浓度使溶液在亲水及低盐环境下,核酸与磁珠表面的羧基集团发生解离,获得纯化的核酸样本。本发明的磁珠溶液能够增强羧基磁珠与核酸的吸附效率,大大提高提取率,尤其是痕量核酸样本的提取,优势更为明显;同时,本发明提供的磁珠溶液不仅能维持溶液中核酸稳定性,使核酸与磁珠在不同条件下吸附与解吸附快速进行,提高核酸的提取效率,还缩短了操作时间。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!