载药壳聚糖/海藻酸钠双重交联水凝胶及其制法和应用的制作方法
本发明属于生物医学工程材料领域,特别涉及一种具有结肠靶向的载药壳聚糖(CS)-海藻酸钠(SALG)双重交联水凝胶及其制备方法和应用。
背景技术:
一直以来医学界一直延用“能口服就不肌注,能肌注就不静滴”的药用原则,但人们为了高效率,动辄就进行输液治疗,输液治疗尽管作用强,见效快,但它的危害和不良反应也突出,不当的输液治疗将对患者的健康造成严重危害!主要有肺功能下降。长期输液将加重心脏和肾脏负担,输液过多往往伴随着大量抗生素的滥用,导致人体菌群失调抗病能力下降,免疫力降低以及细菌抗药性的增加。同样的口服药物也有很多危害,目前治疗疾病都需要联合用药,长疗程服药,药物副作用大,甚至有好多药物遇到酸性条件就会降解,降解的药物在胃中进行治疗,又会引起胃病,例如胃溃疡,接着又吃胃药,又会引发骨质疏松,于是又吃维他命D。这样就引起了连锁反应,药物虽然能治疗特定的症状,但又会引发其他的症状,当前常用药剂存在靶向性差、毒性大、药物易流失等问题,因此,为了克服以上的不足,生物粘附型结肠靶向给药系统的药物载体成为目前医学工程领域的研究热点。
张俐娜等公开了一种羧甲基壳聚糖和海藻酸钠共混微胶囊的制备方法及用途(CN200310111493.8),但其中负载药物的海藻酸钠/羧甲基壳聚糖微胶囊在结肠中药物释放速度快,释放的药物不能在结肠部位停留时间长,药物不能和人体有效接触治疗疾病,不能达到长效治疗的目的。
徐咏梅等公开了一种海藻酸钠/壳聚糖共混凝胶粒的制备方法(CN200610018351.0),但其中离子交联的海藻酸钠壳聚糖凝胶粒在肠液中容易出现缓释现象,而在结肠环境下羧酸钙不稳定会发生不同程度的崩解释药迅速且药物容易泄露流失,网络结构不紧凑,从而导致治疗效果不明显。
因此制备安全有效、pH敏感性好、生物相容性好、毒性低、药物泄露少、可在结肠部位药物停留时间长、缓释控释能力强,可进行结肠靶向性治疗目的的载药材料已经成为当前生物医学工程领域亟待解决的重要课题。
技术实现要素:
为了克服上述现有技术的缺点与不足,本发明的首要目的在于提供一种具有结肠靶向的载药壳聚糖/海藻酸钠双重交联水凝胶的制备方法。
本发明另一目的在于提供上述方法制备的具有结肠靶向的载药壳聚糖/海藻酸钠双重交联水凝胶。该水凝胶具有良好的缓释控释性能、溶胀性好、pH敏感特性、生物相容性、粘附性、以及载药后不失活、毒性低、药物泄露少、可在结肠部位药物停留时间长,可进行结肠靶向性治疗目的,且网络结构的紧密程度以及释放速率和粘附性可以通过调节交联度和壳聚糖的浓度来实现。
本发明的再一目的在于提供上述具有结肠靶向的载药壳聚糖/海藻酸钠双重交联水凝胶在制备缓释药物中的应用。
本发明的目的通过下述方案实现:
一种具有结肠靶向的载药壳聚糖/海藻酸钠双重交联水凝胶的制备方法,其包括以下步骤:
(1)将壳聚糖溶于水中,然后再加入0.5mol/L醋酸溶液,形成溶液1;
(2)将需要负载的药物溶于水中,形成溶液2;
(3)将溶液2加入到溶液1中,形成溶液3;
(4)将海藻酸钠溶于溶液3中,搅拌1~2h后,用碱调节溶液的pH为4~6,得到载有药物的壳聚糖/海藻酸钠水凝胶;
(5)将步骤(4)中得到的载有药物的壳聚糖/海藻酸钠水凝胶以1~3滴/s的速度逐滴加入到京尼平的水溶液中,然后机械搅拌3~5h,得到载有药物的壳聚糖/海藻酸钠-京尼平单重交联的凝胶微粒;
(6)将步骤(5)中得到的载有药物的壳聚糖/海藻酸钠-京尼平单重交联的凝胶微粒用34~37℃的水洗涤4~6次,然后倒入氯化钙的水溶液中,静置48h后得到载有药物的壳聚糖/海藻酸钠-京尼平-钙离子的双重交联的水凝胶;
(7)将步骤(6)中得到的载有药物的壳聚糖/海藻酸钠-京尼平-钙离子的双重交联的水凝胶用34~37℃的水洗涤4~6次后,真空干燥即得纯化后的载有药物的壳聚糖/海藻酸钠-钙离子-京尼平的双重交联的水凝胶。
所述的步骤(1)~(7)均在室温下进行。
步骤(1)中所述的壳聚糖的分子量优选为300000~600000。
步骤(1)中所用的壳聚糖与水的用量为将壳聚糖溶于水后得到的壳聚糖水溶液中壳聚糖的质量浓度为0.620%~1.56%;所用的醋酸溶液的量为醋酸溶液与水的体积比为1:30~1:50。
步骤(2)中所述的药物可为盐酸阿霉素、异烟肼、利福平中的至少一种;优选为盐酸阿霉素,此时步骤(2)~(7)均在避光条件下操作。
步骤(2)中所用的药物和水的量为每1mg的药物对应使用0.1~1mL的水
步骤(3)中所用的溶液1和溶液2的体积比为(20~30):(5~10)。
步骤(4)中所用的海藻酸钠的量为海藻酸钠与溶液3中壳聚糖的质量比为1:1~4:1。
步骤(4)中所用的碱可为0.05~0.2mol/L的NaOH水溶液,优选为0.1mol/L的NaOH水溶液。
步骤(4)中所述的搅拌优选为1h。
步骤(4)中所述的pH值优选为5。
步骤(5)中所述的京尼平水溶液的质量浓度为1~4%,优选为2%。
步骤(5)中所用的京尼平水溶液的用量为载有药物的壳聚糖/海藻酸钠水凝胶与京尼平的水溶液的体积比为(4~5):(10~20)。
步骤(5)中所述的搅拌优选为4h。
步骤(4)和(5)中所述的搅拌的速度均为200~700rpm。
步骤(6)中所述的氯化钙的水溶液的质量浓度为1~4%,优选为2%。
步骤(6)中所用的氯化钙的水溶液的用量为载有药物的壳聚糖/海藻酸钠-钙离子单重交联的凝胶微粒与氯化钙的水溶液的体积比为(4~5):(20~40)。
步骤(6)和步骤(7)中所述的洗涤均优选在36℃洗涤6次。
一种由上述方法制备得到的具有结肠靶向的载药壳聚糖/海藻酸钠双重交联水凝胶,其粒径为500~1000μm。
上述具有结肠靶向的载药壳聚糖/海藻酸钠双重交联水凝胶在制备缓释药物中的应用。
本发明的机理为:
本发明的水凝胶是先交联壳聚糖后交联海藻酸钠,药物包载在壳壳糖内,海藻酸钠包裹于外层,然后经过钙离子和京尼平双重交联,其中的羧基和氨基均被固定,形成互穿网络结构,这种结构不易在人们体液中降解流失,可通过改变其壳聚糖的浓度来改变其粘附性。在模拟胃和小肠内环境下,几乎不溶胀,在结肠的内环境下由于海藻酸钙结构的变化溶胀明显,溶胀效果说明药物包埋量和释放速率效果,溶胀性好释放能力强,溶胀性不好则相反,载药后可达到在胃液(pH<2)2小时释放少量药物,在小肠环境下(pH=6.5)4小时几乎不释放,而在结肠(pH=7.4)环境下释放药物较多,而且可以达到长时间的释放,这弥补了前面人们所做载药凝胶所体现的药物突释,药物泄露和材料容易降解流失等缺陷。可以达到结肠靶向定位长时间释放药物进行治疗,此种水凝胶相对于静脉注射治疗风险小,不会在胃中释放大量药物而是通过结肠靶向治疗。可通过调节壳聚糖/海藻酸钠的质量比和交联剂的浓度来实现调控网络紧密程度来提高药物缓释控释性能,制备出适合结肠靶向治疗的定位给药系统。
本发明相对于现有技术,具有如下的优点及有益效果:
本发明提供的具有结肠靶向的载药壳聚糖/海藻酸钠双重交联水凝胶的制备方法工艺简单、安全有效、符合环保要求,同时,海藻酸钠和壳聚糖中都有pH敏感的羧基和氨基基团,加上交联后的产物网络结构稳定同样具备pH敏感的特性,所以制备的载药壳聚糖/海藻酸钠水凝胶具备很强的pH敏感特性,在口服给药系统中具有长效的缓释控释性能,是一种良好的缓释药物。
本发明所制备的载药壳聚糖/海藻酸钠双重交联水凝胶当模拟人体内环境(pH<2)2小时释放的药物百分数较小,当模拟人体小肠内环境(pH=6.5)下4小时释放药物几乎不释放,当在模拟人体结肠内环境(pH=7.4)下85小时以上药物可达到长时间的释放且释放百分数可达到80%以上,使药物在结肠部位缓慢释放让药物与结肠有效接触达到靶向治疗的目的。
附图说明
图1为实施例5中载盐酸阿霉素的壳聚糖/海藻酸钠双重交联水凝胶在不同的pH值条件下在不同的时间下的药物释放率图。
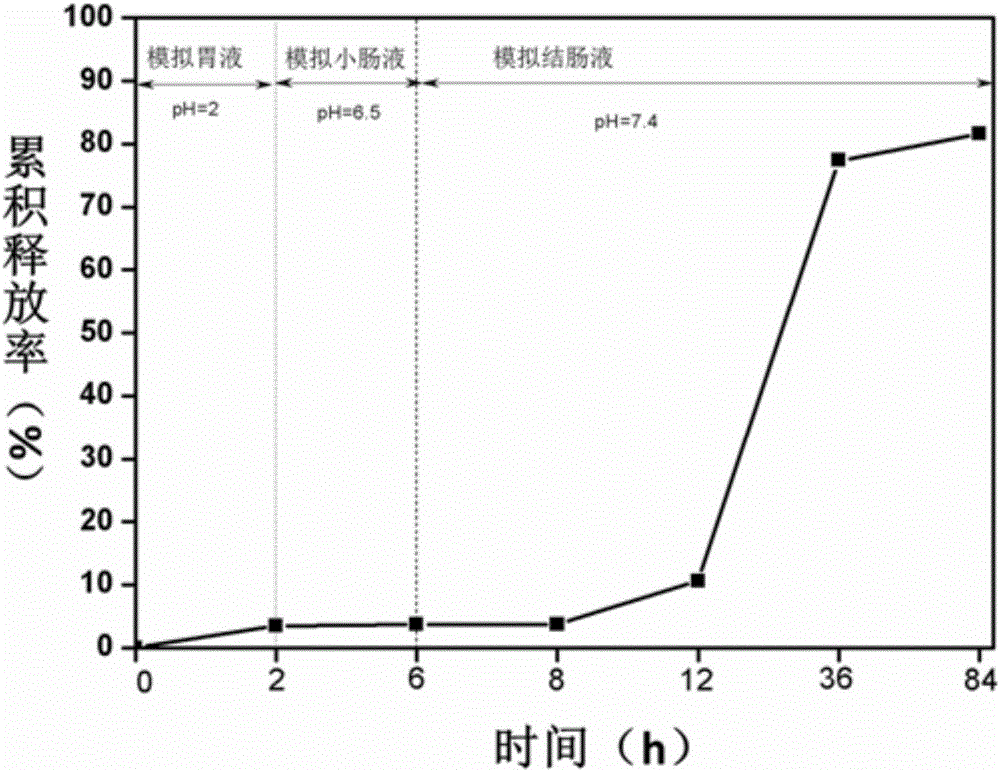
图2为实施例6中载盐酸阿霉素的壳聚糖/海藻酸钠双重交联水凝胶在不同的pH值及不同的时间下的药物累积释放率图。
图3为实施例7中壳聚糖/海藻酸钠双重交联水凝胶在不同的pH值条件下的溶胀效果图。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例中所用试剂如无特殊说明均可从市场常规购得。
实施例1:具有结肠靶向的载药(盐酸阿霉素)壳聚糖/海藻酸钠双重交联水凝胶的制备
(1)称取壳聚糖(其分子量为600000)0.312g,在室温下溶于20ml的去离子水中室温下机械搅拌,加入0.5ml醋酸搅拌溶解。
(2)称取盐酸阿霉素(大连美仑生物技术有限公司)0.01g溶于5ml去离子水中(避光下进行)。
(3)将(2)中的溶液加入(1)溶液中继续机械搅拌(将整体实验避光)。
(4)再称取0.417g的海藻酸钠溶解在步骤(3)得到的溶液中机械搅拌1h,用0.1M的NaOH调节pH值为5得到载有盐酸阿霉素的壳聚糖/海藻酸钠水凝胶,将载有盐酸阿霉素的壳聚糖/海藻酸钠水凝胶用10#的注射针头以1滴/s的速度滴入质量分数为2%的京尼平溶液中下机械搅拌4h,得到载有盐酸阿霉素的壳聚糖/海藻酸钠-京尼平子单重交联的共混凝胶,将其用34~37℃的水洗涤4~6次,然后倒入质量分数为2%的氯化钙中静置48h(室温及避光),得到载有盐酸阿霉素的壳聚糖/海藻酸钠-京尼平-钙离子的双重交联共混水凝胶,洗涤后真空干燥制得粒径分布在500~1000μm的载有盐酸阿霉素的壳聚糖/海藻酸钠-京尼平-钙离子双重交联的共混凝胶粒(以上步骤均在避光及室温下进行)。
载有盐酸阿霉素的水凝胶在模拟胃液pH<2的酸性介质中2h释放4%,在模拟人体小肠环境pH=6.5的酸性介质时释放2%,而在模拟人体结肠环境pH=7.4的碱性介质时释放21%,释放时间超过85个小时。
实施例2:具有结肠靶向的载药(盐酸阿霉素)壳聚糖/海藻酸钠双重交联水凝胶的制备
(1)称取壳聚糖(其分子量为600000)0.208g,在室温下溶于20ml的去离子水中室温下机械搅拌,加入0.5ml醋酸搅拌溶解。
(2)称取盐酸阿霉素(大连美仑生物技术有限公司)0.01g溶于5ml去离子水中(避光下进行)。
(3)将(2)中的溶液加入(1)溶液中继续机械搅拌(将整体实验避光)。
(4)再称取0.417g的海藻酸钠溶解在步骤(3)得到的溶液中机械搅拌1h,用0.1M的NaOH调节pH值为5得到载有盐酸阿霉素的壳聚糖/海藻酸钠水凝胶,将载有盐酸阿霉素的壳聚糖/海藻酸钠共混凝胶用10#的注射针头以1滴/s滴入质量分数为2%的京尼平溶液中(避光及室温)下机械搅拌4h得到载有盐酸阿霉素的壳聚糖/海藻酸钠-京尼平单重交联的共混凝胶,将其用34~37℃的水洗涤4~6次,然后倒入质量分数为2%的氯化钙中静置48h(室温及避光),得到载有盐酸阿霉素的壳聚糖/海藻酸钠-京尼平-氯化钙的双重交联共混水凝胶,洗涤后真空干燥制得粒径分布在500~1000μm的载有盐酸阿霉素的壳聚糖/海藻酸钠-京尼平-钙离子的双重交联的水凝胶(以上步骤均在避光及室温下进行)。
载有盐酸阿霉素的水凝胶在模拟胃液pH<2的酸性介质中2h释放4%,在模拟人体小肠环境pH=6.5的酸性介质时释放2%,而在模拟人体结肠环境pH=7.4的碱性介质时释放21%,释放时间超过85个小时。
实施例3:具有结肠靶向的载药(盐酸阿霉素)壳聚糖/海藻酸钠双重交联水凝胶的制备
(1)称取壳聚糖(其分子量为600000)0.156g,在室温下溶于20ml的去离子水中室温下机械搅拌,加入0.5ml醋酸搅拌溶解。
(2)称取盐酸阿霉素(大连美仑生物技术有限公司)0.01g溶于5ml去离子水中(避光下进行)。
(3)将(2)中的溶液加入(1)溶液中继续机械搅拌(将整体实验避光)。
(4)再称取0.469g的海藻酸钠溶解在步骤(3)得到的溶液中机械搅拌1h,用0.1M的NaOH调节pH值为5,得到载有盐酸阿霉素的壳聚糖/海藻酸钠水凝胶,将载有盐酸阿霉素的壳聚糖/海藻酸钠水凝胶用10#的注射针头1滴/s的速度滴入质量分数为2%的京尼平溶液中(避光及室温)下机械搅拌4h得到载有盐酸阿霉素的壳聚糖/海藻酸钠-京尼平单重交联的水凝胶,将其用34~37℃的水洗涤4~6次,然后倒入质量分数为2%的氯化钙中静置48h(室温及避光),得到载有盐酸阿霉素的壳聚糖/海藻酸钠-京尼平-钙离子的双重交联水凝胶,洗涤后真空干燥制得粒径分布在500~1000μm的载有盐酸阿霉素的壳聚糖/海藻酸钠-京尼平-钙离子的双重交联的共混凝胶粒(以上步骤均在避光及室温下进行)。
载有盐酸阿霉素的水凝胶在模拟胃液pH<2的酸性介质中2h释放5%,在模拟人体小肠环境pH=6.5的酸性介质时释放3%,而在模拟人体结肠环境pH=7.4的碱性介质时释放22%,释放时间超过85个小时。
实施例4:具有结肠靶向的载药(盐酸阿霉素)壳聚糖/海藻酸钠双重交联水凝胶的制备
(1)称取壳聚糖(其分子量为600000)0.125g,在室温下溶于20ml的去离子水中室温下机械搅拌,加入0.5ml醋酸搅拌溶解。
(2)称取盐酸阿霉素(大连美仑生物技术有限公司)0.01g溶于5ml去离子水中(避光下进行)。
(3)将(2)中的溶液加入(1)溶液中继续机械搅拌(将整体实验避光)。
(4)再称取0.5g的海藻酸钠溶解在步骤(3)得到的溶液中机械搅拌1h,用0.1M的NaOH调节pH值为5,得到载有盐酸阿霉素的壳聚糖/海藻酸钠水凝胶,将载有盐酸阿霉素的壳聚糖/海藻酸钠水凝胶用10#的注射针头逐滴滴入质量分数为2%的京尼平溶液中(避光及室温)下机械搅拌4h得到载有盐酸阿霉素的壳聚糖/海藻酸钠-京尼平单重交联的共混凝胶,将其用34~37℃的水洗涤4~6次,然后倒入质量分数为2%的氯化钙中静置48h(室温及避光),得到载有盐酸阿霉素的壳聚糖/海藻酸钠-京尼平-钙离子的双重交联水凝胶,洗涤后真空干燥制得粒径分布在500~1000μm的载有盐酸阿霉素的壳聚糖/海藻酸钠-京尼平-钙离子的双重交联的水凝胶(以上步骤均在避光及室温下进行)。
载有盐酸阿霉素的水凝胶在模拟胃液pH<2的酸性介质中2h释放8%,在模拟人体小肠环境pH=6.5的酸性介质时释放4%,而在模拟人体结肠环境pH=7.4的碱性介质时释放80%,释放时间超过85个小时。
实施例5:药物(盐酸阿霉素)的释放
标准曲线的制备:配置不同浓度梯度(0.5μg/mL、1μg/mL、2μg/mL、5μg/mL、10μg/mL、15μg/mL、20μg/mL、25μg/mL)的盐酸阿霉素溶液,在紫外吸光度为480nm处测其吸光度值,绘制标准曲线。
对实施案例4制备的载盐酸阿霉素的壳聚糖/海藻酸钠双重交联水凝胶采用紫外分光光度计(UV)的方法测定合成产物在不同pH值(pH值分别为2、6.5、7.4)下不同时间段的释药量进行测量。每个pH值设置三组样品进行试验,称取9组样品,每组样品称取50mg水凝胶,同时加入25ml的PBS,然后分别于0.5h、1.5h、2.5h、4.5h、6.5h、8.5h、11.5h、23.5h、47.5h、85.5h取上清液5ml,同时对应加入5ml PBS,一切都在模拟人体温度的摇床中且在避光下进行(37.2℃,100rpm),然后用紫外分光光度计测其在480nm处(因为盐酸阿霉素的特征峰在480nm处)的吸光度值,取平均值。然后根据标准曲线计算其释放质量,结果如图1所示,从图1中可以看出载有盐酸阿霉素的壳聚糖/海藻酸钠双重交联水凝胶在PBS(pH值为2、6.5、7.4)中持续释放85.5h,在结肠中(pH=7.4)累积释放率达到80%,说明载有盐酸阿霉素的壳聚糖/海藻酸钠双重交联水凝胶在结肠(pH=7.4)环境下释放药物较多,而且可以达到长时间的释放。
实施例6:载盐酸阿霉素的壳聚糖/海藻酸钠双重交联的水凝胶的模拟人体释放试验
对实施案例4制备得到的载盐酸阿霉素的壳聚糖/海藻酸钠双重交联的水凝胶采用紫外分光光度计(UV)的方法测定合成产物在不同pH值(pH分别为2、6.5、7.4)下不同时间段的释药量进行测量。首先称取3组水凝胶,做平行实验取平均值,将水凝胶浸泡于模拟胃液环境的pH值为2的PBS里,2个小时后取上清液再将凝胶捞出浸泡于模拟小肠溶液pH值为6.5的PBS里,4个小时后取上清液,将里面的凝胶捞出浸泡于模拟结肠溶液pH值为7.4的PBS里,累积释放84小时,一切都在模拟人体温度的摇床中且在避光下进行(37℃,100rpm),将取得的上清液用紫外分光光度计测其在480nm的吸光度,再根据标曲(同上)计算各个阶段释放率,结果如图2所示,从图2中可以看出在模拟胃液时药物释放了3.4%,在模拟小肠溶液时药物几乎不释放,而在模拟结肠溶液时,84小时时累积释放率达到了80%。说明载有盐酸阿霉素的壳聚糖/海藻酸钠双重交联的水凝胶在结肠环境下释放药物较多,且可以达到长时间的释放,能与结肠达到有效接触。
实施例7:壳聚糖/海藻酸钠双重交联的水凝胶的溶胀实验
对实施案例4中去除(2)步骤,其他实验步骤不变将制得未载药的壳聚糖/海藻酸钠水凝胶浸泡在不同pH值(pH值分别为2、6.5、7.4)的PBS里,每个pH值条件设置三组平行组,取平均值,分别在0h、0.2h、0.5h、1.0h、1.5h、2.5h、3.5h、4.5h、6h、7.5h、8.5h、20.5h、40.5h,测量水凝胶的质量,结果如图3所示,从图3中可以看出,在不同的pH值下水凝胶的溶胀程度不同,水凝胶在pH值为2时的溶胀最小,在pH值为6.5时溶胀很小,在pH值为7.4时溶胀最明显,几乎达到了开始称量值的三倍左右。在40.5h时达到最大溶胀。而溶胀程度大说明其包埋药物多,且溶胀程度越大其释放药物量也最大,从图3中可以看出本发明的水凝胶具有结肠靶向性。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!